miR-124-3p调控激素性股骨头坏死患者骨髓间充质干细胞成骨分化作用的研究*
2024-02-27杨增强郝飞虎原天祎周治衡崔泳
杨增强 郝飞虎 原天祎 周治衡 崔泳
激素性股骨头坏死(steroid-induced necrosis of femoral head, SINFH)是因为长期使用糖皮质激素及其衍生药物导致的严重骨科疾病。SINFH的主要病理学特点是骨细胞和骨髓的慢性持续性坏死,最终导致股骨头的破坏坍塌[1-3]。虽然药物治疗及核心减压对SINFH 有一定的效果[4],但早期的干预也只能减轻激素的副作用[5]。因此,寻找SINFH的发病机制和早期治疗的有效方法在骨科领域至关重要。
既往研究表明,SINFH 与骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)的成骨能力和成脂能力失衡有关[6]。骨髓间充质干细胞的分化方向受骨形态发生蛋白(bone morphogenetic proteins, BMPs)、Wnt 和Notch 等信号通路,Runx2、C/EBP 和PPARγ 等转录因子,非编码RNA,激素及线粒体等众多因素的调控,任何环节的异常都可能导致病理状态的发生[7]。
非编码RNA(noncoding RNA, ncRNAs)是一类调节基因表达的小分子RNA,可以调控基因的表达和转录[8-9],在SINFH 中发挥着重要作用[10-11]。CTNNB1 基因可以编码蛋白质β-连环蛋白(β-Catenin),参与调控细胞的增殖和凋亡,以及调节骨形成和骨吸收之间的平衡[12]。有研究发现,miR-322-5p、miR-124-3p、miR-125a-3p和CTNNB1的表达失衡与SINFH 有关[13]。同时,miR-124 对人类BMSC的生物学功能有一定的影响[14]。然而,miR-124-3p、CTNNB1在SINFH中的作用和分子机制仍不清楚。本研究主要探讨SINFH 中miR-124-3p 对BMSCs 的调控作用及其与CTNNB1 的相关性,明确miR-124-3p 对BMSCs 的调控作用,为SINFH的诊治提供依据。
1 材料与方法
1.1 主要仪器与试剂
细胞培养箱(美国Thermo Fisher 公司);超净工作台(苏州安泰科技有限公司);低温冷冻离心机(德国Sigma公司);Real-time检测仪(美国Thermo Fisher公司);研究级倒置显微镜(中国广州市明美科技有限公司);人骨髓间充质干细胞(中国武汉普诺赛生命科技有限公司);F12K培养基、FBS(美国Hyclone 公司);miR-124-3P NC、miR-124-3P mimic、 miR-124-3p inhibitor、 CTNNB1-3'UTR-WT、CTNNB1-3'UTR-MUT 载体(上海吉玛制药技术有限公司);DMEM、血清、胰酶(美国Gibco 公司);双荧光素酶报告基因检测试剂盒(美国Promega 公司);Trizol 试剂、Lipofectamine™ 3 000(美国Invitrogen 公司);SYBR Green PCR试剂盒(美国Thermo Fisher公司);逆转录试剂盒(美国Thermo Fisher 公司);抗CTNNB1 抗体(美国Abcam公司)。
1.2 一般资料
1.2.1 病例选择
选择在2020 年9 月到2022 年5 月就诊于新疆医科大学第五附属医院行髋关节置换术的患者,术中扩髓时收集骨髓组织。期间收集SINFH 患者病例20 例随机选择15 例作为实验组,收集股骨颈骨折(无SINFH)患者病例28例随机选择15例作为对照组。SINFH诊断定义为平均每日使用类固醇激素剂量16.6 mg 或最高每日剂量80 mg,至少1年[15],由磁共振图像确认。有慢性疾病、癌症或饮酒的患者被排除在外。本研究经新疆医科大学附属第五医院伦理委员会批准(XYDWFYLS-2019-06),所有方法均按照相关指南和规定进行,患者已知晓此研究并取得同意。
1.2.2 BMSCs来源
细胞培养在DMEM培养基中,其中含有10%胎牛血清细胞(fetal bovine serum, FBS)、100 U/mL青霉素和100 mg/mL链霉素。用甲泼尼龙(辉瑞,美国)处理细胞建立SINFH细胞模型,浓度为4 mg/106个细胞,每8 h 1次,共处理5次。培养在37℃、5% CO2的培养箱中,用于后续实验。
1.3 方法
1.3.1 qRT-PCR检测miR-322-5p、miR-124-3p、miR-125a-3p以及CTNNB1表达
收集实验组和对照组扩髓时的骨髓组织,采用Trizol法提取总RNA,纯化,逆转录获取互补cDNA。反应体系:SybrGreen qPCR Master Mix 10 μL,cDNA 模板1 μL,上下游引物各0.4 μL。反应条件:95℃预变性5 min;95℃变性30 s,95℃退火5 s,72℃延伸30 s。各引物及其序列如表1 所示。以U6 为内参,采用2-△△CT法计算miR-322-5p、miR-124-3p、miR-125a-3p及CTNNB1表达量。

表1 反应体系中各引物及其序列
1.3.2 Western Blot检测CTNNB1蛋白的表达水平
用冰冻的含蛋白酶抑制剂的放射性免疫沉淀试验(RIPA)裂解缓冲液从骨髓间充质干细胞中提取蛋白质。用10%SDS-PAGE 分离等量的蛋白质,然后转移到聚偏氟乙烯膜上。用脱脂干牛奶阻断后,用特异性一抗孵育膜。然后用酶标二抗孵育膜。以β-肌动蛋白作为内参蛋白,测定CTNNB1蛋白表达水平。
1.3.3 细胞转染及分组
分别用无血清培养基稀释miR-124-3p mimic、miR-124-3p mimic NC、miR-124-3p inhibitor(DNA含量为3 μg),根据Lipofectamine™ 3 000转染试剂说明书转染。依次分为BMSC 组、BMSC+miR124-3p+NC 组、BMSC+miR124-3p+inhibitor 组、BMSC+miR124-3p+mimics 组。转染48 h 后,收集细胞。
1.3.4 转染后各组细胞中miR-124-3p和CTNNB1的表达
取上述细胞接种于24孔板,各组设置3个复孔。待细胞贴壁后,提取RNA 进行q-RTPCR 检测,其反应体系、引物、条件同前。PCR扩增后,实时荧光定量PCR仪自动分析结果,采用2-△△CT法计算miR-124-3p 和CTNNB 的相对表达量。Western Blot操作同前。
1.3.5 分化能力评估
取转染分组后细胞接种于培养皿,使其汇合度为70% ~ 80%。分为两组,分别弃去原培养基,一组进行成骨诱导(osteoblasts induction, OI)分化,添加成骨诱导培养基(内含50 mM 抗坏血酸、100 nM 地塞米松、10 mM β‐磷酸甘油和15%胎牛血清),另一组进行成脂诱导(adipogenic induction, AI)分化,添加成脂诱导培养基(内含10 μg/mL 胰岛素,1 μM 地塞米松,0.5 mM IBMX 和0.1 mM吲哚美辛)。2 d换液一次,15 d后分别进行茜素红染色和油红O染色,显微镜下观察拍照。
1.3.6 miR-124-3p与CTNNB1的靶向验证
利用生物信息学数据库Starbase 预测miR-124-3p 与CTNNB1的结合位点。转染前一天,将细胞接种于24孔板内,使其汇合度为70% ~ 80%。按照试剂盒说明书步骤提取质粒,然后将miR-124-3p mimics和提取的质粒共转染进BMSCs。具体组别为CTNNB1-3'UTR-WT+NC、CTNNB1-3'UTR-WT+hsa-miR-124-3p mimic、CTNNB1-3'UTR-MUT+hsa-miR-124-3p mimic,48 h后,依据双荧光素酶报告基因检测试剂盒(Promega)使用说明检测海肾荧光素酶(RL)和萤火虫荧光素酶(FL)的强度。
1.4 统计学方法
采用SPSS 25.0软件进行统计学分析。所有数据均以均数±标准差表示,组间差异采用t检验,两两比较采用LSDt检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者BMSCs 中miR-322-5p、miR-124-3p、miR-125a-3p及CTNNB1表达
qRT-PCR实验结果显示,实验组BMSCs中miR-124-3p的表达量低于对照组,miR-125a-3p 和CTNNB1 的表达量高于对照组(P<0.001),miR-322-5p的表达量未见明显差异,见图1。

图1 qRT-PCR实验结果:A. miR-124-3p表达水平;B. miR-322-5p表达水平;C. miR-125a-3p表达水平;D. CTNNB1表达水平
2.2 Western Blot检测CTNNB1蛋白的表达水平
Western Blot结果显示,实验组CTNNB1蛋白表达水平高于对照组(P<0.05),差异具有统计学意义,结果见图2。
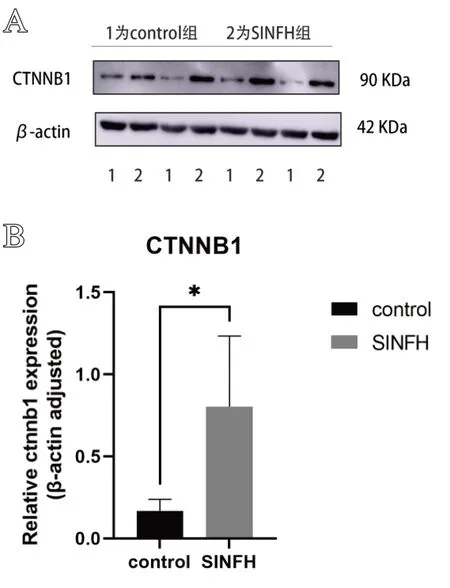
图2 CTNNB1 蛋白Western Blot 检测结果:A. CTNNB1 蛋白电泳条带;B. CTNNB1相对表达水平
2.3 转染后各组miR-124-3p和CTNNB1表达比较
转染miR-124-3p mimics组miR-124-3p表达量高于BMSC组和BMSC+miR124-3p+NC 组(P<0.001),而CTNNB1表达量低于BMSC组和BMSC+miR124-3p+NC组(P<0.001);转染miR-124-3p inhibitor 组miR-124-3p 表达量低于BMSC组和BMSC+miR124-3p+NC 组(P<0.001),CTNNB1表达量高于BMSC 组和BMSC+miR124-3p+NC 组(P<0.001),见图3。
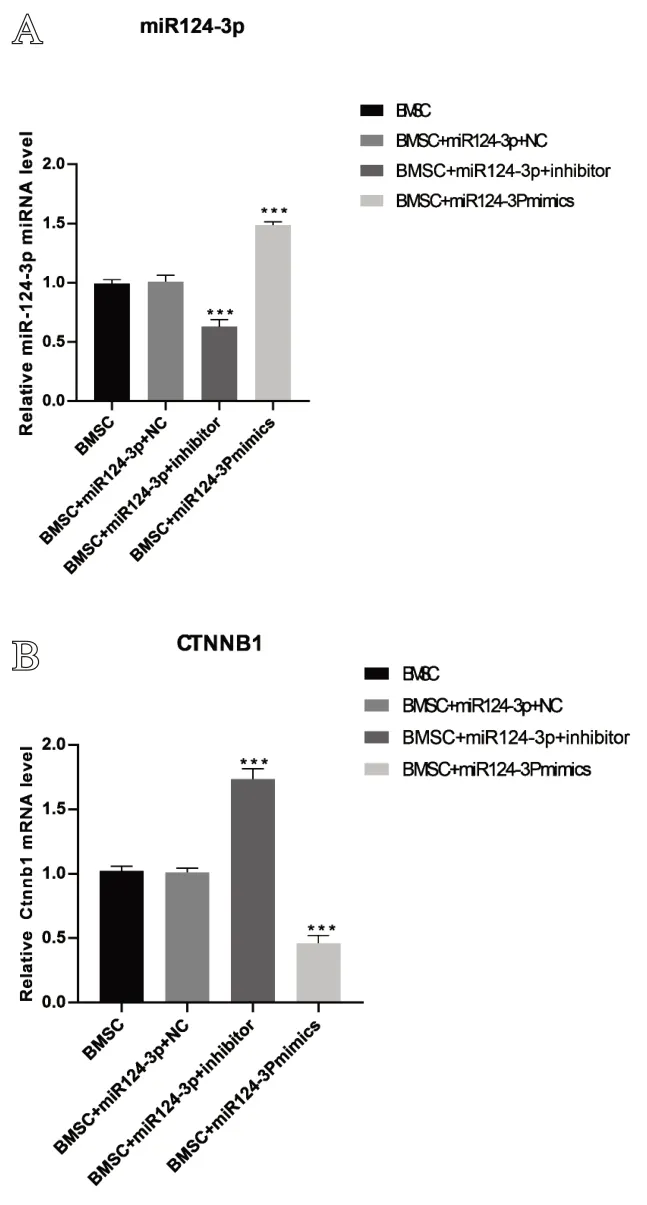
图3 转染后各组miR-124-3p 和CTNNB1 表达量:A. 转染后miR-124-3p的表水平;B. 转染后CTNNB1的表达水平
2.4 转染后CTNNB1蛋白的表达水平
Western Blot 结果显示,BMSC 组和转染miR-124-3p+NC组CTNNB1蛋白表达水平没有差异。转染miR-124-3p+inhibitor 组和BMSC 组相比,CTNNB1 蛋白表达水平较高(P<0.001)。转染miR-124-3pmimics 组和BMSC 组相比,CTNNB1蛋白表达水平较低(P<0.001)。结果见图4。

图4 转染后CTNNB1 蛋白Western Blot 检测结果:A. CTNNB1 蛋白电泳条带;B. 各组CTNNB1表达水平
2.5 分化能力评估
2.5.1 成骨分化结果
BMSCs成骨诱导15 d后进行茜素红染色,结果显示各组有红色钙结节形成,提示成功诱导BMSCs向成骨细胞分化,结果见图5。
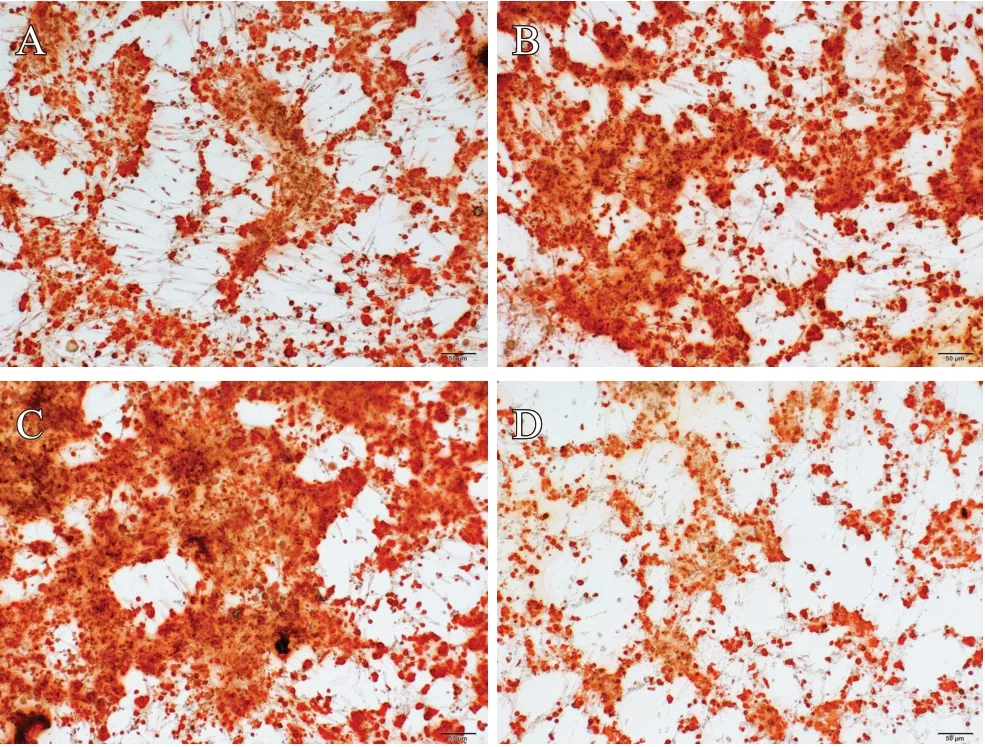
图5 成骨诱导分化结果:A. BMSCs+OI组;B. BMSCs+OI+NC组;C. BMSCs+OI+miR-124-3p+mimic组;D. BMSCs+OI+inhibitor组
2.5.2 成脂诱导结果
BMSCs 成脂诱导15 d 后进行油红O 染色,结果显示,各组有脂滴形成,提示成功诱导BMSCs 向脂肪细胞分化,结果见图6。

图6 成脂诱导结果:A. BMSCs+AI 组;B. BMSCs+AI+NC 组;C. BMSCs+AI+miR-124-3p mimic 组;D. BMSCs+AI+miR-124-3p inhibitor组
2.5.3 成骨和成脂诱导数据分析结果
在对成骨诱导实验结果进行分析后发现,与BMSCs+OI组和BMSCs+OI+NC 组相比,BMSCs+OI+miR-124-3p mimic组染色区域扩大(P<0.01);BMSCs+OI+miR-124-3p inhibitor 组染色区域减小(P<0.01),这提示BMSCs+OI+miR-124-3p mimic组钙沉积多于其他组,过表达miR-124-3p可以促进BMSCs 的成骨分化;抑制miR-124-3p 表达则结果相反,结果见图7。
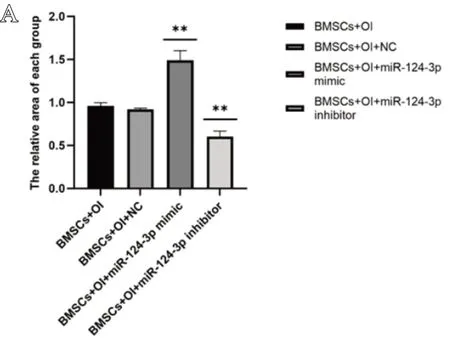
图7 染色区域相对面积:A. 成骨诱导茜素红染色区域相对面积; B. 成脂诱导油红O染色区域相对面积
在对成脂诱导实验结果进行分析后发现,与BMSCs+AI 组和BMSCs+AI+NC 相比, BMSCs+AI+miR-124-3p mimic 组染色区域减少(P<0.01),BMSCs+AI+miR-124-3p inhibitor 组染色区域扩大(P<0.01),这提示BMSCs+AI+miR-124-3p inhibitor 组脂滴形成增多,而BMSCs+AI+miR-124-3p mimic 组脂滴形成较少,过表达miR-124-3p 可抑制BMSCs 的成脂分化;抑制miR-124-3p 表达则结果相反,结果见图7。
2.6 miR-124-3p与CTNNB1的靶向验证结果
Starbase 数据库中检索发现,CTNNB1-3'UTR 含有miR-124-3p的结合位点。实验结果显示与对照组相比,转染miR-124-3p mimic 的野生型CTNNB1 荧光素酶报告质粒相对活性下降(P<0.01)。而CTNNB1-MUT 组与对照组荧光素酶活性相比,两者活性相当,差异无统计学意义(P>0.05)。说明CTNNB1-WT 与miR-124-3p 存在靶向关系,结果见图8。
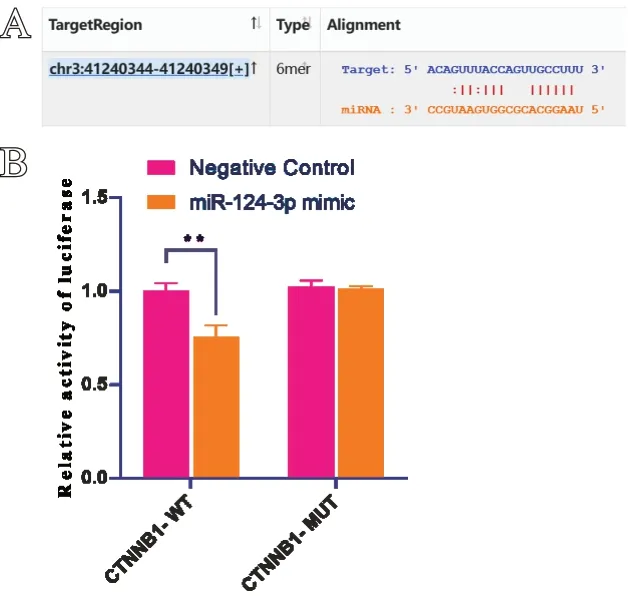
图8 CTNNB1 与miR-124-3p 的结合位点和双荧光素酶实验结果:A. CTNNB1与miR-124-3p的结合位点;B. 双荧光素酶实验结果
3 讨论
激素性股骨头坏死(SINFH)是激素的副作用导致的髋关节退行性病变。截至目前,其潜在的发病机制仍然不清楚,这限制了人们对激素性股骨头坏死的诊断和治疗,虽然早期可以通过髓内减压和移植骨瓣等手段缓解病情[16-17],但远期的效果并不理想,给医生和患者带了很大困扰。
MiRNA作为一类高度保守的内源性非编码单链RNA,在调节基因表达中起着重要作用[18]。大量的研究表明,miRNAs 参与调控脂质和骨代谢[19-20],从而影响SINFH 的发生发展过程。在本研究中,笔者证实miR-124-3p和miR-125a-3p在实验组和对照组中差异表达,且实验组miR-124-3p 表达量低于对照组,miR-125a-3p 表达量高于对照组。miR-124-3p作为一种基因调控因子,对细胞的增殖、凋亡和分化起着很重要的作用,miR-124-3p可以与STAT3结合抑制鼻咽癌细胞的增殖和转移[21]。同时miR-124-3p可以调控血管平滑肌细胞、心肌细胞和神经元细胞的增殖和凋亡[22-24],过表达miR-124-3p 可以增强细胞活性,减缓细胞凋亡。有学者在对绵羊基质血管组分(stromal vascular fraction, SVF)分化研究中发现,过表达miR-124-3p 可以减弱SVF 成脂作用,抑制miR-124-3p 表达则结果相反[25]。这与本研究结果吻合,本研究中过表达miR-124-3p促进了BMSCs 的成骨作用,减弱了BMSCs 的成脂作用。过量激素诱导骨髓间充质干细胞可造成骨标志物Alpl、Bglap 和Runx2 的降低,但过表达miR-124-3p 可以逆转骨髓间充质干细胞的生理活动,促进Alpl、Bglap和Runx2等成骨标志物的表达[26]。
CTNNB1编码β-catenin蛋白,钙粘蛋白黏附复合物的组成部分,调节细胞-细胞黏附和典型Wnt信号通路中的基因表达,典型的Wnt/β-catenin信号通路是祖细胞增殖和分化的重要调节因子,是各种人类疾病发病机制的核心,包括那些影响骨骼发育和肿瘤进展的疾病。在维持关键的生物稳态方面受到高度调控。CTNNB1的异常积累与大多数癌症有关。研究发现,抑制CTNNB1可抑制肾癌细胞的增殖、迁移和侵袭,并诱导细胞凋亡。过表达CTNNB1可以促进肾透明细胞癌细胞的增殖、迁移和侵袭,抑制细胞凋亡[27]。CTNNB1 变异与儿童硬化性骨发育不良和肾上腺皮质腺瘤[28]、痉挛性双瘫痪和视觉缺陷的神经发育障碍[29]以及子宫内膜异位症细胞增殖和侵袭[30]紧密相关。大量研究证实,Wnt信号通路可以调节骨骼和骨量发育,激活Wnt/β-catenin 信号通路可以促进BMSCs 的成骨分化[31-33]。β-catenin 是Wnt 信号通路的组成部分,并且是该信号通路的核心蛋白,其活性和含量对BMSCs的成骨分化具有重要作用[34]。本研究中双荧光素酶实验结果显示,miR-124-3p与CTNNB1 有潜在的结合位点,提示miR-124-3p 可能在Wnt信号通路中发挥一定作用,然而miR-124-3p/CTNNB1发挥的功能、发挥功能的途径及下游的靶基因仍需进一步的研究。
在本研究中,笔者对激素诱导的股骨头坏死患者骨髓组织进行了研究,发现在SINFH患者体内miR-124-3p的表达量下降,CTNNB1的表达量升高;进一步实验证实过表达miR-124-3p 可以促进BMSCs 的成骨分化;同时miR-124-3p和CTNNB1有靶向结合关系。为激素性股骨头坏死的研究提供了一个新思路,做出了一定的补充。
总而言之,本研究表明,miR-124-3p在SINFH患者中表达量下降,miR-124-3p 可以靶向结合CTNNB1,并且过表达miR-124-3p可以促进BMSCs的成骨分化。
