兔膝骨关节炎成纤维样滑膜细胞分离培养方法的研究
2024-02-27陈芳朱以良张传成刘琴喻晶杨丽君张宜
陈芳 朱以良 张传成 刘琴 喻晶 杨丽君 张宜
膝骨关节炎(knee osteoarthritis, KOA)是一种临床上常见的慢性、膝骨关节退行性疾病,多见于中老年群体,主要病理表现为膝关节周围骨质增生、滑膜炎症、滑膜增生、关节软骨损伤等[1-3]。KOA 患者中约90%伴有滑膜组织炎症,贯穿KOA病程的各个时期[4]。KOA滑膜炎可以加剧软骨退化、软骨下骨增生及膝关节周围骨赘的形成,导致KOA 的病理进程加剧和症状加重[5-7]。但KOA滑膜炎的发病机理尚不完全明确[8]。成纤维样滑膜细胞(fibroblast-like synoviocytes, FLS)为滑膜中最主要的细胞,在KOA 的发病机制中有重要作用,可参与炎症发生、滑膜血管形成等过程[9]。KOA 中FLS 的过度增殖、凋亡不足促使滑膜组织异常增生,是造成关节和软骨破坏的主要原因[10-11],成纤维样滑膜细胞在KOA发病中扮演着重要作用,因此对FLS的研究意义重大。通过文献研究与初步探索,本研究在传统的组织块培养法的基础上优化分离培养出兔KOA成纤维样滑膜细胞,通过传代冻存满足后续实验需求,以期在细胞和分子水平对KOA 的作用机制进行深入研究,为KOA的药物筛选治疗提供了大量的细胞。
1 材料与方法
1.1 实验动物
选取16只健康的新西兰大白兔,购自万千佳兴实验动物养殖场,生产合格证号:SCXK(鄂)2021-0011,雌雄不限,体重均在2.5 kg 左右。实验地点:中部战区总医院实验动物室[SYXK(鄂)2019-0082]。
1.2 主要材料与仪器
主要材料:胎牛血清(FBS,美国Gibco 公司),DMEM 高糖培养基(美国Hyclone 公司);双抗(青霉素、链霉素,武汉博士德生物工程有限公司),PBS缓冲液、胰蛋白酶(上海碧云天生物技术有限公司);小鼠Vimentin抗体、荧光(Cy3)标记羊抗小鼠IgG(武汉博士德生物工程有限公司);MTT、DMSO(美国Amersco公司)。
主要仪器:倒置显微镜、DP70荧光显微镜(日本奥林巴斯公司);酶联免疫分析仪(深圳市雷杜生命科学股份有限公司);生物安全柜、二氧化碳恒温细胞培养箱[赛默飞世尔科技(中国)有限公司];迷你掌上离心机(北京大龙有限公司),康宁细胞计数器(广州科适特科学仪器有限公司)。
1.3 实验方法
1.3.1 兔KOA模型的制备及鉴定
将新西兰兔16 只随机分为正常组和模型组,每组各8只,造模方案根据本研究课题组预实验基础上制定,通过手术诱导建立膝骨关节炎兔模型,正常组正常饲养,不做任何处理。将模型组实验动物称重做好记录后,耳缘静脉注射3%戊巴比妥钠,根据体重按1 mL/kg量的标准给药麻醉,观察,待完全麻醉后将实验动物仰卧位固定,用剪刀剔除右下肢毛发,充分暴露皮肤,常规备皮,充分消毒右下肢侧膝关节,皮下注射利多卡因局部麻醉,取髌旁内侧切口,逐层分离切开,直到显露髌骨后将髌骨向外侧脱位,屈曲膝关节至完全暴露前交叉韧带,轻轻摘除半月板,剪断前交叉韧带,然后迅速彻底止血,将髌盖骨完全复位,充分消毒后逐层细致缝合切口并包扎,并注意观察术后实验动物状态。模型组兔手术后连续3 d 肌内注射青霉素40 万U/kg,预防感染。术后1 周等伤口逐渐恢复好后,开始每天固定时间段驱赶活动1 h,直至术后4周。术后满4周,随机抽取正常组和模型组各3只,对右下肢膝关节进行X 线检查;并随机抽取正常组和模型组各3 只,耳缘静脉注射过量麻药处死,解剖右下肢膝关节,观察其变化,鉴定模型。
1.3.2 兔KOA成纤维样滑膜细胞的分离培养
模型组术后4 周,经X 线确定为造模好的KOA 模型兔,取出4 只分别耳缘静脉注射过量的麻药处死。用剃毛刀刮净右下肢毛发,充分消毒,在膝关节正中纵行切开皮肤,再次充分消毒切口处及周围,在无菌环境下逐层分离组织直至关节囊后,用手术刀片轻轻刮离出关节囊的纤维层和滑膜层,通过手术止血钳,找到光亮、平滑的地方,即为滑膜层组织,迅速将其轻轻取出,放入含双抗(100 U/mL青霉素、0.1 mg/mL链霉素)的PBS液的无菌培养皿中。迅速移入超净工作台里面含有无菌生理盐水的培养皿中,用含双抗的PBS缓冲液清洗干净,轻轻将上面附着的纤维、脂肪等组织剔除,用提前准备好的灭菌滤纸轻轻吸净滑膜表面附着的液体,剪成2 ~ 3 mm3大小,置于提前用少量培养液湿润过的一次性无菌平皿(3.5 cm)中,每皿中放入6 ~ 7 块滑膜组织块,组织块均匀铺开且不要靠近皿壁,在培养箱内放置5 ~ 6 min 后取出,在超净台内加入1 mL含双抗、10%胎牛血清的高糖DMEM培养液,放入5% CO2、37℃培养箱内培养。24 h后镜下观察确定无污染后,每皿轻轻补加1 mL含双抗、10%胎牛血清的高糖DMEM 培养液。根据培养液的颜色及组织块状况4 ~ 5 d后进行首次换液,每天定时观察,约2 周后吸掉皿底的剩余组织碎块,待培养皿内细胞布满后,用含0.25%EDTA的胰蛋白酶液进行消化,按1∶2进行传代培养,每天在倒置显微镜下观察并适时拍照记录生长状况。
1.3.3 兔KOA成纤维样滑膜细胞鉴定
将处于对数生长期的第3 代细胞在15 mL 一次性无菌离心管中制成均匀单细胞悬液,用镊子将消毒好的盖玻片置于每孔中,将细胞悬液接种在6 孔板中,其接种浓度为4×107个/L,置于37℃、5%二氧化碳培养箱内培养,隔天在倒置显微镜下观察细胞状态及有无污染,确定无污染后,培养48 h后于倒置显微镜下观察细胞状态,在超净台内轻轻吸出培养液,注意枪头不要戳到无菌盖玻片上,用PBS缓冲液轻轻冲洗盖玻片2次,每次冲洗2 ~ 3 min。在6 孔板的每孔中加入2.5 mL 的4%多聚甲醛液,将洗净的盖玻片倾斜缓缓放入孔中,盖上盖子,于4℃冰箱中放置30 min,将细胞固定。取出盖玻片,用一定量的PBS 缓冲液轻轻洗掉盖玻片上多聚甲醛液,在室温下加入2.5 mL的0.5%Triton X-100,进行通透,时间约为25 min。用一定量的PBS缓冲液清洗掉通透液,吸净盖玻片上液体,让其上面无液体附着,在上面滴加山羊血清抗体进行封闭,作用30 min左右,取出盖玻片直接吸掉残余的液体,加入事先稀释好的一抗(小鼠Vimentin抗体),置于湿盒中,放在冰箱中冷藏过夜。用PBS缓冲液清洗掉一抗,吸掉盖玻片上液体,加入稀释好的二抗(荧光标记羊抗小鼠IgG),置于湿盒中,在常温下充分作用约60 min后,用一定量的PBS缓冲液清洗掉二抗,吸掉盖玻片上液体,滴加DAPI 液,在暗室中作用5 min,完成细胞核染色。用一定量的PBS缓冲液多次清洗,吸掉盖玻片上残余DAPI,让其上面无液体附着,然后进行封片,在荧光显微镜下观察。
1.3.4 MTT法绘制细胞生长曲线
将传至第三代的细胞制成均匀的单细胞悬液,稀释成浓度为5×106个/mL,置于15 mL一次性无菌离心管中,边摇动离心管边接种至96孔培养板内,每孔细胞悬液200 μL,每组设置8个复孔,共7组,放在37℃、5%二氧化碳培养箱内培养,24 h后取出一组,在8个孔中,分别加入25 μL的MTT 液共培养,其浓度为5 mg/mL,在培养箱中放置4 h后取出,可见孔底形成蓝紫色的结晶物,吸掉上清,每孔中依次加125 μL DMSO,震荡摇匀,使其充分作用,溶掉结晶物,液体变成酒红色,事先设置好酶标仪上波长(490 nm)参数,上机检测各孔的A值。同法依次测出48、72、96、120、144、168 h 各孔的A 值。根据记录各组A值,在电脑软件上绘制出细胞生长曲线。
2 结果
2.1 兔KOA模型的鉴定
术后4 周,X 线片结果显示,正常组关节面平整、光滑,无骨赘形成,无关节间隙狭窄;模型组关节面粗糙,有骨赘形成,关节间隙狭窄(见图1)。解剖可见关节腔有明显的积液(图2A 对比图2B),进一步剔除旁边的组织,暴露关节,可见微血管增生和关节面痰液样的炎性分泌物(图2C 对比图2D),提示兔KOA模型制备成功。
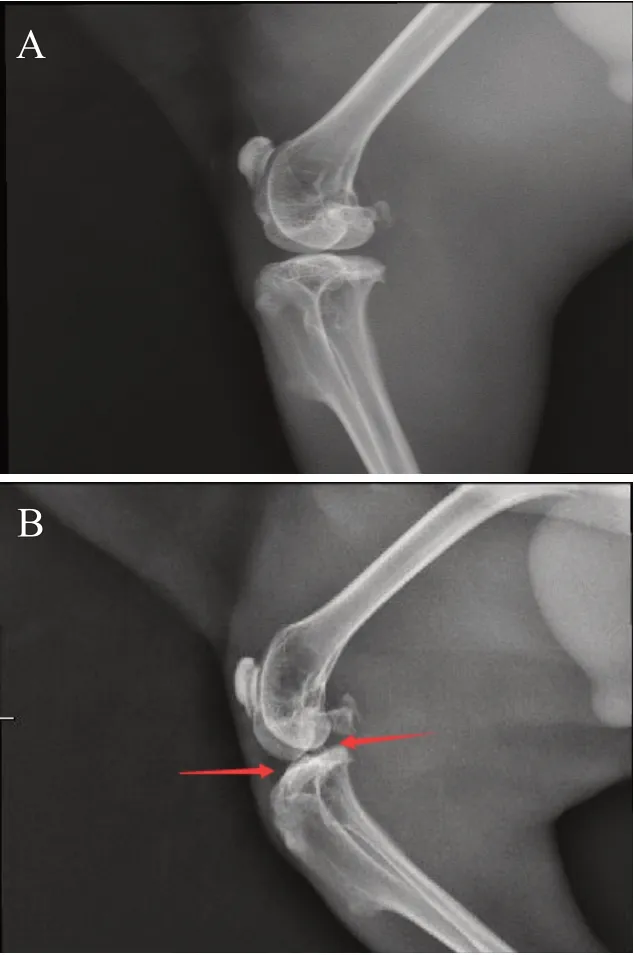
图1 各组兔膝关节X射线片:A. 正常组;B. 模型组(病变位置用红色箭头标出)

图2 两组兔膝关节病变特征:A. 正常组膝关节;B. 模型组膝关节;C. 正常组关节解剖面;D. 模型组关节解剖面
2.2 兔KOA成纤维样滑膜细胞形态观察
每天观察,当组织块接种5 ~ 7 d后,在倒置显微镜下可见组织块周围松散、透亮,有大量堆积的圆点,少量细胞从组织块周围爬出来,其形状似梭形(见图3A)。9 ~14 d 后,镜下可见组织块周边透亮,组织块变少,周边的细胞拥挤成片,大量细胞从组织块爬出,组织块周围像网状,以梭形为主,少数呈蝌蚪状(见图3B)。两周后,轻轻冲洗底部组织块并吸掉,进行换液。15 ~ 21 d后,数量明显增多,平皿底部布满细胞,以长梭形为主(见图3C)。约24 d 后,在倒置显微镜下可见平皿底部密密麻麻细胞,紧密排列,似长扁梭形(见图3D),换液、消化后按1∶2比例进行传达培养。

图3 原代兔关节炎成纤维样滑膜细胞培养(×100)。A. 原代培养5 ~ 7 d;B. 原代培养9 ~ 14 d;C. 原代培养15 ~ 21 d;D. 首次传代前细胞
2.3 兔KOA成纤维样滑膜细胞的鉴定
免疫荧光染色后,在镜下观察,检测结果显示,Vimentin 表达呈阳性,镜下观察不同放大倍数下染色的形态(见图4)。

图4 免疫荧光检测兔KOA 成纤维样滑膜细胞中波形蛋白表达情况:A. ×40; B. ×100;C. ×200;D. ×400
2.4 兔KOA成纤维样滑膜细胞生长曲线
根据MTT法检测不同时间段各孔光密度值,制作细胞生长曲线图,呈“S”形(见图5),表明传至第三代细胞活性强,生长旺盛,呈对数生长期。

图5 兔关节炎成纤维样滑膜细胞生长曲线
3 讨论
KOA 的发病受多种因素的影响,其发病机制尚不明确,目前尚无特效药物可以治疗此病,主要以对症治疗为主[12]。KOA的主要病变是关节软骨的退变与破坏,滑膜炎继发于软骨病变后,起着至关重要的作用;而且在KOA全膝关节成形术患者中,滑膜炎的严重程度直接与现行功能障碍及残疾程度密切相关[13]。随着滑膜炎病变加剧,对骨质、关节软骨会带来进一步破坏,导致KOA 患者病情加速,如活动受限、关节肿痛等症状的加重,但目前滑膜炎病变发病机制尚不完全明确,从细胞、分子学角度探索其发病机制与治疗效果有着重要的理论价值和指导临床给药作用,因此对膝骨关节炎成纤维样滑膜细胞培养方法的研究意义重大[14]。
关节囊分为内外两层,外层为致密结缔组织,在韧带和腱的相连处增厚;内层较疏松,称为滑膜。滑膜表面有2 ~ 4 层立方形或扁平的上皮样结缔组织细胞,即为滑膜细胞,细胞间有少量的基质和纤维。滑膜细胞分为两种,一种称为M 细胞似巨噬细胞,含较多溶酶体,有吞噬能力;另一种称为F 细胞似成纤维细胞,含较多的粗面内质网,可分泌黏蛋白和透明质酸,形成滑膜液,润滑关节,对关节软骨的软骨细胞提供营养及氧气[15-16]。滑膜组织中最活跃的细胞是滑膜成纤维细胞,对关节正常功能的维持起着重要作用,同时参与各种关节病变,通过旁分泌或自分泌方式产生大量的炎性细胞因子及免疫反应介质,加速软骨基质的降解,是引起各种临床症状的主要因素[17-18]。滑膜炎症及增生是膝骨关节炎的重要病理特征之一,滑膜组织中的滑膜成纤维细胞、单核细胞或巨噬细胞通过分泌相关基质金属蛋白酶(基质金属蛋白酶1、基质金属蛋白酶3 和基质金属蛋白酶9 等)和炎症细胞因子引起软骨损伤[18-19]。因此,治疗KOA的一种思路是抑制滑膜细胞增殖。体外原代细胞的培养能很好地模拟体内细胞的生长环境,通过多种因素的影响,在此基础上开展相关机理及药效学研究,是一种常见的研究手段,因此体外进行兔KOA模型的FLS原代培养能提供前期KOA相关机理研究的细胞工具。
深入研究KOA的发病机制和药效学评价离不开动物模型,目前膝骨关节炎模型的制备方法主要是手术创伤法[20]。手术创伤法包括传统Hulth法及改良Hulth法,但都对膝关节损害过大,成模过程与临床上膝骨关节炎的发病机理不能吻合[21]。大、小鼠膝关节过小,不利于后期的观察、操作,且取材困难;而兔子为中等体型动物,膝关节体积较大,价格也不贵。在衡量其利弊的基础上,本研究中采用的兔膝骨关节炎模型是课题组通过预实验反复对比摸索出来的,相比于传统手术创伤法既能达到成模要求,又可以减少膝关节损伤,更贴近临床膝骨关节炎的发病过程[22]。
原代细胞培养主要有机械分散法、组织块培养法和酶消化法[23]。目前,FLS 的原代培养主要是组织块培养法和酶消化法,但各有利弊:组织块培养法周期长,操作烦琐、容易污染,一些细节没把控好容易导致实验失败;酶消化法虽然能快速提取细胞,但酶的浓度及作用时间很难把控,酶消化过度很容易导致细胞死亡,酶消化时间不够则获得的细胞量太少。本研究在传统组织块培养法的基础上进行摸索和改进,组织块清洗完之后,未立即转移至培养皿,而是用无菌的吸水纸轻轻吸掉上面明显的液滴后置于培养皿底部,放培养箱5 min 后,滑膜组织块牢固贴在培养皿底部,轻轻加入培养液直到培养皿体积的一半,24 h后加满培养液。传统组织块培养法未进行吸去上面附着液体这一步的处理,组织块贴壁时间为2 ~ 4 h,由于贴得不够牢固,操作稍微不慎或是晃动一下组织块就会脱离皿底或漂浮在液面,影响细胞爬出量,导致培养失败。滑膜组织的取材相当烦琐,而且量比较少,需要反复操作,才能熟练掌握;取出的滑膜组织量少,显得非常珍贵,剔除上面少量的纤维和脂肪要特别小心,否则破坏滑膜;滑膜处理好后,不是剪得越碎越好,而是要在2 ~ 3 mm3,放在皿底的组织块也不是越多越好,而是要适量且保持一定的距离,每皿6 ~ 7 块。注意组织块大小和接种到皿底的组织块数量,都是通过前期预实验反复摸索出来的,没把握好这个标准就很容易导致培养实验失败。本研究通过差速贴壁法获得高纯度的KOA兔FLS,传至第三代细胞采用免疫荧光染色鉴定,Vimentin 蛋白表达阳性,染色显示细胞呈纺锤形,生长曲线呈“S”形,细胞活性强,可用于后续实验研究,与笔者及团队前期研究一致[24-25]。
兔成纤维样滑膜细胞原代培养过程中要特别注意以下事项:①取材过程要确保在无菌条件下进行,避免组织污染;②准确定位滑膜组织,快速取出,避免时间过长,导致组织活性丧失;③预估培养皿放置组织块间距,间距均匀,否则不利于细胞生长;④密切观察不同时间的细胞状态,注意把控换液时间、消化程度,否则会影响细胞生长,甚至导致细胞死亡。这些都需要通过前期大量的预实验来摸索,才能确保实验成功,以期为同行研究者提供实验方法的依据。
综上,通过手术诱导建立兔膝骨关节炎模型,对组织块培养法进行改进,培养的兔膝骨关节炎成纤维样滑膜细胞为典型的梭形,符合成纤维样滑膜细胞的生长特征,免疫荧光染色显示波形蛋白强表达。此法操作简单,可重复性强,可为后续开展KOA的机制研究提供大量细胞。
