荧光聚多巴胺纳米材料的构筑及对金属离子检测的应用进展
2024-02-27陈畅畅邓崇海刘仁勇陈丽娟
陈畅畅,邓崇海,刘仁勇,2,陈丽娟,2*
(1.合肥大学 能源材料与化工学院,安徽 合肥 230601;2.皖西学院 材料与化工学院,安徽 六安 237012)
2007年,Messersmith等[1]在国际著名期刊《Science》上报道了一种聚多巴胺(Polydopamine,PDA)功能涂层的构筑方法:将多巴胺(Dopamine,DA)在弱碱性、有氧环境下进行自聚合即可在材料表面形成一层具有粘附性的PDA 涂层。该涂层表面还可基于迈克尔加成/席夫碱反应进行二次修饰,与此同时,溶液中会形成大量的PDA 纳米颗粒[2-3]。基于这一开创性工作,在过去10 多年里,PDA 作为三维纳米颗粒、二维表面涂层/界面材料、一维聚合物和零维量子点材料得到了深入研究[4-7]。其中具有光致发光性能的荧光聚多巴胺(FPDA)纳米材料因制备方法简单,具有优异的光学性能、水分散性以及生物相容性,在化学传感、生物检测以及生物成像等领域得到了广泛应用[8-9]。
1 聚多巴胺的结构及光致发光性能
PDA 被认为是一种结构较为复杂的超分子化合物,除强碱性(pH>13.0)溶液外,在其它溶剂中几乎很难溶解,较难对其结构进行精确表征,故PDA 的具体化学结构至今不甚明确。同样地,关于PDA的形成机理也是众说纷纭,普遍观点认为DA 在碱性、有氧环境下,首先被氧化为多巴胺-醌(Dopamine-quinone),而后经历环化(Leukodopaminechrome)、氧化(Dopamine-chrome)、分子重排形成5,6-二羟基吲哚(5,6-Dihydroxyindole,DHI)。DHI 被认为是形成PDA 的重要前驱体[10]。PDA 的形成机理及结构剖析可归纳为以下观点(图1):
(1)超分子自组装理论,即认为PDA是由各种前驱体(多巴胺、多巴胺-醌、DHI以及真黑素类似物等)及其寡聚物组成的超分子聚集体,其间通过诸如氢键、π-π 堆积作用、阳离子-π 相互作用以及电荷转移等超分子相互作用进行进一步组装[12]。
(2)氧化-自由基聚合理论,该理论认为PDA为传统意义上的高分子量聚合物[13-14]。DA易被氧化生成5,6-吲哚醌(Dopamine-chrome),DHI 和5,6-吲哚醌容易在2,4,7 位置发生支化反应,生成丰富的二/三聚体,最终形成大分子量的寡聚物,寡聚物再通过邻苯二酚与醌之间的反歧化反应形成多重交联的聚合物。
也有观点认为PDA 的结构与天然黑色素相似,是一种非共价自组装和共价聚合共存的化学无序结构。天然黑色素具有极低(<0.1%)的辐射弛豫量子产率,吸收的大部分能量会以非辐射形式消散,光致发光性能较弱[15]。同样地,常规方法制备得到的PDA 在紫外光照射下几乎不发光,或者显示出微弱的荧光,这主要归因于PDA 微结构的复杂性,PDA分子链的强烈纠缠以及平面芳香环间的π-π堆积作用均不利于荧光的发射,分子间的聚集则会导致荧光猝灭[16]。因此,当前构筑FPDA 的关键在于抑制DA的聚合或减弱PDA分子间的π-π堆积作用。本文以报道的FPDA合成及对金属离子的检测应用为主线,综述了近些年FPDA的研究进展。
2 荧光聚多巴胺纳米粒子的构筑
如表1 所示,截至目前,有关FPDA 的文献报道40 余篇,其构筑方法主要包括:化学氧化法、共掺杂法、化学降解、碳化等,主要通过抑制PDA 的聚合度以及减弱分子间的π-π 堆积赋予FPDA 光致发光性能。
2.1 化学氧化法
化学氧化法是目前构筑FPDA 的主要方法之一,化学氧化可以促进PDA 的结构重排,减弱 π-π 堆积以增强荧光。2012 年,Zhang 课题组[17]首次利用H2O2氧化DA 构筑FPDA(图2A),首先将DA 在三羟甲基氨基甲烷碱性溶液中(pH 10.5)于有氧环境下预聚合,然后向反应液中加入一定量的H2O2(~2 mol/L)继续反应即可获得FPDA。该材料在365 nm 紫外灯照射下发出蓝色荧光,最大激发(Ex)和最大发射(Em)波长分别为440 nm 和493 nm,已成功用于细胞成像。在该体系中,DA 苯环上的邻苯二酚基团能快速氧化为苯醌并进一步自组装聚合成FPDA,研究还发现过量的H2O2会促使FPDA纳米粒子大规模聚集从而导致荧光猝灭。因此,有必要精确控制H2O2的使用量。2018 年,Pang 等[39]利用无花果蛋白酶(Ficin)作为类过氧化物酶与 H2O2共同作用氧化DA 制备得到FPDA(Ex=400 nm,Em=476 nm),并成功用于DA的选择性响应检测,最低检出限为5.5 nmol/L。
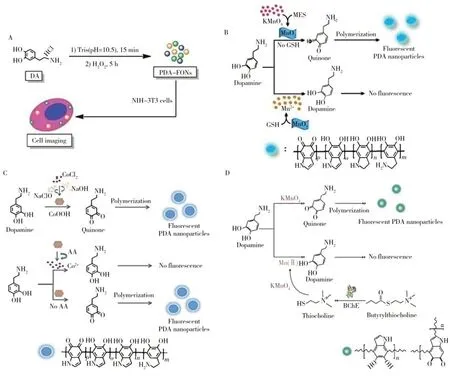
图2 氧化法示例Fig.2 Examples for oxidation method
H2O2是最常用的强氧化剂之一,但高危害性限制了其应用。近些年来,研究人员致力于寻找可替代性的无毒或毒性小的氧化剂,如:MnO2和CoOOH 纳米片。如图2B所示,2016年,Kong等[26]在酸性环境下(pH~5.0),利用MnO2将DA氧化为多巴胺醌的衍生物而后聚合成FPDA,该FPDA于Ex=400 nm/Em=485 nm 处的荧光强度最强。在该体系中,MnO2的氧化能力扮演着重要的角色,是DA 氧化聚合的诱导因素。然而,当有谷胱甘肽(GSH)存在时,GSH 会优先与MnO2发生氧化反应,将MnO2还原成Mn2+,此时DA 被MnO2氧化聚合为FPDA 的程度受到抑制,从而导致FPDA 的荧光强度减弱。利用该特点可以构筑GSH 传感器,该传感器检测GSH 的线性范围为0~350 μmol/L,最低检出限为1.5 μmol/L。与之相似,2019 年,杜方凯等[49]以DA 为原料,MnO2为氧化剂制备的水溶性FPDA 在Ex=415 nm/Em=458 nm 处获得了最强的荧光信号,将所构筑的增强型荧光探针用于乙酰胆碱酶的选择性检测,最低检出限为0.14 mU/mL。2017 年,Zhao 等[31]将CoOOH 纳米片与DA 混合,利用CoOOH 纳米片的氧化性使DA 发生氧化形成多巴胺醌的衍生物进而自聚合形成FPDA(图2C),该荧光纳米材料的粒径为10~50 nm,在Ex=400 nm/Em=500 nm下的荧光最强。该文基于CoOOH纳米片与抗坏血酸(AA)之间的氧化-还原反应构筑了AA 传感器:无AA 时,DA 被CoOOH 纳米片氧化成多巴胺醌衍生物,继而自聚合形成FPDA,荧光强度高;存在AA 时,CoOOH 纳米片被AA 还原成Co2+失去氧化性,此时DA 的氧化自聚合受到抑制,荧光强度减弱。该传感器对AA 的最低检出限为4.8 μmol/L。除上述氧化剂外,2018 年,Yin 等[40]利用NaIO4和NaBH4的氧化-还原性调节PDA 表面化学制备出的FPDA 在Ex=380 nm/Em=455 nm处发出强蓝光,量子产率达5.10%,基于FPDA酚羟基与Fe3+之间的配位作用,将FPDA用于Fe3+的选择性检测,得到的最低检出限为0.15 μmol/L。2022 年,Li等[54]以KMnO4为氧化剂,氧化DA 形成多巴胺醌衍生物而后发生自聚合制备得到FPDA,如图2D 所示。得到的FPDA 呈球形,粒径在4 nm 左右,并在Ex=400 nm/Em=480 nm 处发射蓝光。基于该FPDA 构建的无标记、灵敏测定丁酰胆碱酯酶(BChE)活性的荧光生物传感器的线性范围为0.5~200 U/L,最低检出限为0.047 U/L。
化学氧化法可有效缩短FPDA 的合成时间,但需控制体系中氧化剂的种类和用量。有研究表明:随着氧化剂用量的不断增多,荧光信号不断下降,过量氧化剂的使用将导致荧光信号猝灭。这可能是由于粒子之间的大规模聚集导致[57,61]。
2.2 共掺杂法
与化学氧化法相比,共掺杂法构筑FPDA 更为简便。该法通过在多巴胺的自聚合过程中掺杂其他组分反应物干扰多巴胺的自聚合,以达到减弱PDA 内部分子堆积,调控纳米粒子尺寸及增强荧光的作用,并在一定程度上提高FPDA 的荧光强度和量子产率。但该方法一般要求掺杂组分具有氨基(-NH2)或巯基(-SH)等官能团,能够参与或干扰DA 的自聚合反应。如图3A 所示,2015 年,Liu 等[22]在DA 的自聚合体系中掺杂超支化聚合物聚乙烯亚胺(PEI),由于PEI 中的-NH2与PDA 中的DHI 等氧化产物之间可发生迈克尔加成反应进而削弱PDA 分子内和分子间的相互作用,故可减小PDA的颗粒尺寸,形成荧光更强的 FPDA(Ex=380 nm/Em=526 nm)。该材料在365 nm 紫外灯下发出绿色荧光,并被成功用于细胞荧光成像。同年,Zhao 等[23]也通过将PEI 掺杂入DA 的自聚合体系得到荧光PDA-PEI(Ex=400 nm/Em=520 nm),通过研究该荧光材料对金属离子的识别能力,发现Ni2+、Fe3+以及Cu2+能够有效猝灭PDA-PEI 的荧光。其原因在于,PDA-PEI 中PDA 上的儿茶酚基团以及PEI 中的-NH2与Fe3+、Cu2+之间发生了相互作用从而改变了PDA-PEI 的电子结构导致荧光猝灭。该研究还发现,Fe3+与PDA-PEI 中儿茶酚基团的相互作用强于-NH2,而Cu2+与-NH2的相互作用强于儿茶酚基团。Zhong等[50]通过优化PEI的分子量、PEI 与DA 的质量比、反应介质的pH 值等条件获得了量子产率为12.5%,颗粒尺寸为(9.4 ±2.2)nm 的PDA-PEI(Ex=380 nm/Em=530 nm)。该PDA-PEI 可实现对Cu2+的高选择性和高灵敏度检测,线性检测范围为0.001 6~80 μmol/L,最低检出限为1.6 nmol/L。2023 年,Li 等[59]利用Cu2+猝灭PDAPEI 构筑了无荧光的PDA-PEI/Cu2+配合物,该配合物具有催化氧化能力,可以作为一种模拟过氧化物纳米酶将无色的3,3',5,5'-四甲基联苯胺(TMB)氧化为蓝色的oxTMB,并通过oxTMB 的内部过滤作用进一步导致荧光猝灭。由于草甘膦(Glyphosate)可与PDA-PEI/Cu2+配合物中的Cu2+形成更稳定的Glyp-Cu2+配合物,从而可使PDA-PEI 的荧光信号明显恢复,同时PDA-PEI/Cu2+配合物的过氧化物酶模拟活性受到阻碍,无法使TMB 氧化为oxTMB,故无显色反应。基于这一原理,该研究构建了一种新颖且方便的“turn-off”比色和“turn-on”荧光传感平台,用于草甘膦的双模式检测。

图3 共掺杂法示例Fig.3 Examples of conjugation method
除PEI 外,GSH 由于分子上的-NH2/-SH 可与PDA 之间发生迈克尔加成/席夫碱反应,也可参与PDA 粒子尺寸的调控,并通过减弱PDA 分子内部的π-π 堆积获得FPDA。2018年,Chen 等[43]利用GSH与DA 的一步共混法制备了FPDA(图3B)。在该工作中,只需调节DA 和GSH 混合物水溶液的pH 值即可触发反应,制备得到的FPDA 呈均匀的球形状态,颗粒尺寸在3 nm 左右,在365 nm 紫外灯下呈现出蓝绿光,量子产率为15.6%。将该荧光纳米粒子用于Cu2+和Fe3+的检测,检出限分别为0.73 μmol/L 和0.66 μmol/L。
此外,通过对DA 进行修饰引发聚合获得FPDA 也是掺杂的方法之一,如图3C 所示,Xiong 等[19]利用多巴胺上-NH2与戊二醛和甘氨酸之间的反应,使用冰NaBH4还原反应液后,再以氨溶液引发聚合,使得巯基乙醇终止聚合反应得到多巴胺衍生的FPDA纳米粒子。该FPDA纳米粒子实际为聚多巴胺的预聚物,数均分子量和重均分子量分别为1 505和1 713,呈现窄分子量分布的特征,该粒子在365 nm 紫外灯下发射蓝绿光(Ex=360~440 nm/Em=485 nm),量子产率为16.2%。该FPDA对Fe3+具有选择性响应,最低检出限为0.1 μmol/L。除此之外,被cRGD 肽链和G 蛋白偶联受体120(GPR 120)抗体功能化的FPDA 还可以实现目标活细胞成像以及膜蛋白标记的功能。该研究表明:通过抑制多巴胺的聚合度,可以有效改善聚多巴胺分子内的π-π堆积作用,增强FPDA的荧光发射。
除上述的PEI[22-23,50]、GSH[43]可以掺杂入DA 的自聚合体系获得FPDA 外,甘氨酸[19]、淀粉[47]、DNA[55]、叶酸[56]、葡萄糖[58]等也可参与到DA 的自聚合中,用以调控PDA 分子内的堆积状态,获得具有荧光特性的纳米粒子。
2.3 化学降解法
不同于以上两种由小分子DA 合成得到FPDA 的方法,化学降解法是通过减小PDA 纳米粒子的尺寸,减弱分子自组装堆积程度获得FPDA。2015年,Lin等[24]利用DA在NaOH溶液中的氧化自聚合制备PDA,再利用H2O2在NaOH 溶液中产生的羟基自由基诱导PDA颗粒降解,获得了平均粒径为(22±3) nm的低聚物,如图4A 所示。研究表明:部分羟基自由基可将PDA 降解成羟基多巴胺,剩余部分则与PDA 形成氢键以减少PDA 的π-π 堆积作用并增强荧光,进而获得FPDA。该体系制备得到的FPDA 在365 nm 紫外灯下发射蓝光(Ex=330 nm/Em=440 nm),量子产率为1.20%,可用于Fe3+的检测[24],也可用于构建“on-off-on”型荧光探针检测Ag+和GSH[57]。同样的,2021 年,Li等[52]在碱性环境下,利用DA的自聚合制备PDA,然后向反应液中加入H2O2和NaOH(图4B),利用产生的羟基自由基诱导PDA 颗粒降解,得到了粒径约4.8 nm均匀分布的球形FPDA,其在365 nm紫外灯下发射亮蓝色荧光(Ex=340 nm/Em=435 nm),量子产率为2.20%。在该体系中,鱼精蛋白(Protamine)的存在可诱导FPDA 粒子的聚集导致荧光猝灭,胰蛋白酶(Trypsin)的加入又可使得荧光恢复。这主要是因为胰蛋白酶可使鱼精蛋白发生水解,使得FPDA 粒子的聚集作用得到抑制,荧光恢复。基于此构筑的胰蛋白酶传感器具有较好的选择性,检测的线性范围为0.01~0.1 μg/mL,最低检出限为6.7 ng/mL。
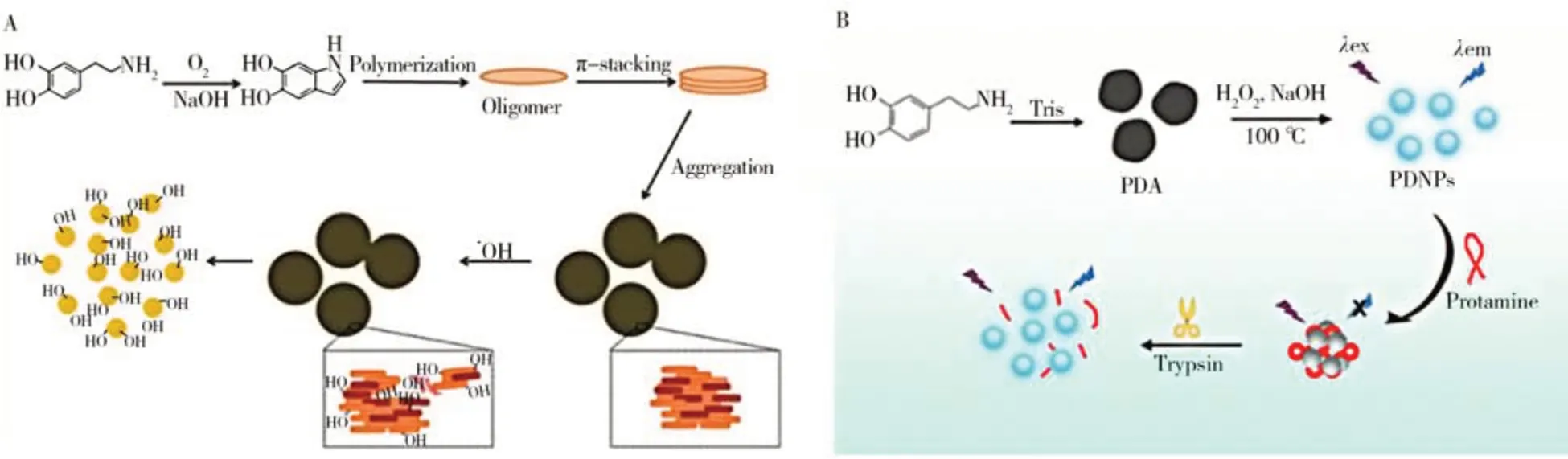
图4 化学降解法示例Fig.4 Examples of chemical degradation method
2.4 碳化法
相比于上述3种较为温和的方法,碳化法构筑FPDA一般需要在高温(水热合成)或强酸(如浓硫酸)环境下进行。2013年,Qu等[18]以DA为前驱体采用一步水热合成法(180 ℃,6 h)制备得到FPDA,粒径尺寸3.8 nm 左右。粒子的晶格间距为0.325 nm,接近石墨的(002)面,表明该条件下可实现DA 的碳化。该碳点在最大发射波长400 nm 处的荧光量子产率可达6.40%,其表面带有大量的儿茶酚官能团,可被Fe3+氧化为苯醌结构,并导致荧光猝灭。在该FPDA-Fe3+体系中加入DA 时,由于部分Fe3+与DA 反应,从而可减弱其对FPDA 的荧光猝灭效应,基于此可分别构筑Fe3+和DA 的荧光传感器,最低检出限分别为0.32 μmol/L 和68 nmol/L。2017年,Zhao等[29]选用DA、柠檬酸和过硫酸铵为前驱体,通过一步水热合成法(180 ℃,24 h)在酸性环境下制备得到了发射绿光的FPDA(Ex=331 nm/Em=495 nm),其平均粒径为3.02 nm,量子产率约93.0%。该FPDA 对Cr6+具有选择性识别能力以及快速响应性,响应时间为 0.01 s,最低检出限为1.0×10-11mol/L。
2.5 其他方法
除上述方法外,紫外线照射、微等离子体电化学处理等方法也可构筑FPDA。2014 年,Quignard等[21]报道了利用紫外光(UVA 范围:(365 ± 40) nm)照射制备FPDA 的方法。以紫外光照射PDA 中未环化的儿茶酚胺可使其发生光氧化、环化形成荧光单元(DHI)从而增强荧光。2018年,Wang等[45]利用微等离子体电化学方法调节DA 氧化聚合的形成过程,制备出尺寸均匀(约3.1 nm)和良好发光性能的FPDA。所得FPDA 在Ex=360 nm/Em=440 nm 下达到最大荧光强度,量子产率为0.58%,该方法构筑的FPDA对U6+具有选择响应性,最低检出限为2.1 mg/L。
3 荧光聚多巴胺纳米粒子对金属离子的检测
FPDA 中的儿茶酚基团与众多金属离子具有强螯合作用,两者间的配位作用可使FPDA 电子结构改变并导致荧光信号变化。目前已基于FPDA 构筑了可检测Fe2+[62]、Fe3+[18-19,24-25,40,43]、Cu2+[43,50,55]、Hg2+[56]、Zn2+[28]、Cr6+[29]、Al3+[37]、U6+[45]、Ag+[57]的荧光探针,且绝大多数是“turn-off”型荧光探针。
以Cu2+“turn-off”型荧光探针为例,Liu 等[55]以DNA、DA 及PEI 为原料,系统研究了不同DNA 序列对合成的FPDA 荧光强度的影响(图5A)。结果表明,DNA 介导形成的FPDA 颗粒均具有良好的稳定性和水分散性,尤其是序列长度为10 的多胞嘧啶(poly-C)能有效提高FPDA 的荧光强度。所合成的FPDA 对Cu2+有明显的选择性(Cu2+的加入将导致荧光明显猝灭),而其他金属离子不会引起荧光强度变化。基于此,该研究构筑了Cu2+“turn-off”型荧光探针,该探针对Cu2+的最低检出限为0.03 μmol/L,可应用于海水中Cu2+的检测。为了提高方法的实用性和便捷性,他们还设计了一种含有FPDA的试纸用于Cu2+的可视化检测。此外,他们将FPDA 负载于淀粉膜中构筑了一种可同时检测和去除Cu2+的吸附材料,在较宽的Cu2+浓度范围(20 ~ 300 μmol/L)内具有较高的去除率(≥99.41%)。

图5 Cu2+ “turn-off”型荧光探针[55](A)及 Zn2+ “turn-on”型荧光探针[28](B)Fig.5 Cu2+“turn-off”fluorescent probe[55](A) and Zn2+“turn-on”fluorescent probe[28](B)
2016 年,Liu 等[28]报道了一种基于FPDA 材料的“turn-on”型荧光探针用于Zn2+检测,如图5B 所示。该体系中,磁性纳米氧化铁(Fe3O4)颗粒作为模拟过氧化物酶,在温和条件下催化氧化DA 制备得到FPDA,该体系中仅用5 mmol/L H2O2即可比拟传统2 mol/L H2O2的氧化效果。所制备的FPDA 在360 nm 紫外灯照射下不发光,在Ex=480 nm/Em=530 nm 处发射黄绿光,量子产率为1.00%。加入Zn2+后,FPDA 在480 nm 波长激发下不发光,而在360 nm 波长激发下发射蓝光,且荧光强度随Zn2+浓度呈线性增长,该探针对Zn2+的最低检出限为60 nmol/L,其选择性被认为可能与反应过程中的光诱导电荷转移有关。
4 结论与展望
本文总结了2012 年至今有关FPDA 纳米材料的构筑策略、形态、发光性能及其在金属离子识别和检测中的应用。FPDA 纳米材料已取得了令人瞩目的研究进展,但未来仍有一些问题需要深入研究。一方面,由于缺乏精确、详细的FPDA 微观结构表征信息,其荧光产生机制仍不清楚;另一方面,由于FPDA 材料的形态未得到很好的控制,可能导致亮度和扩散系数不均匀,限制了其在生物定量成像中的应用。相信这些短板在未来都能补齐,FPDA 材料也会被开发出更多优异的性能以拓宽其应用领域。
