龙葵果酵素理化指标活性成分及其抑菌性研究
2024-02-27高灿灿钱荪宁林峻如夏秋霞
高灿灿,连 洁,钱荪宁,林峻如,童 菲,夏秋霞
(宿州学院生物与食品工程学院,安徽宿州 234000)
龙葵果又称野葡萄、黑茄等,酸甜可口,富含多糖、维生素等丰富的功能性物质,具有营养价值和生理保健作用[1-2]。酵素类食品是大多以果蔬类为原材料,采用微生物发酵得到的综合性功能食品[3-5],有一定的抑菌作用[6-7]。现有文献证明,果蔬原料经发酵后发酵体系中的总多酚等活性物质含量明显增加[8-9]。黄酮类物质与清除自由基有关,可抗衰老,且多酚类物质发酵后更易被人体吸收利用[10]。以成熟龙葵果为原料,测定自然发酵后期第3 个月内pH 值、色值、SSC 等基本理化指标,以及总糖(TS)、总酚(TP)和总黄酮(TF)等活性物质含量,并对3 种常见食品腐败菌金黄色葡萄球菌(SA)、大肠杆菌(EC)、李斯特菌(LM)的抑制作用进行研究,以期获得龙葵酵素发酵过程中理化指标的变化和抑菌能力,为龙葵果资源的进一步开发提供依据。
1 试验材料与方法
1.1 试验材料与仪器
龙葵果,生路龙葵果有限公司提供;受试菌种:大肠杆菌(EC)、金黄色葡萄球菌(SA)、李斯特菌(LM),均由实验室提供;BHT 培养基等,均为分析纯,海博生物技术生化试剂提供。
303-1A 型恒温培养箱,联鲸精密仪器有限公司产品;SW-CJ-1CU 型层流洁净工作台,安泰空气技术有限公司产品。
1.2 试验方法
1.2.1 龙葵果酵素的制备
在无菌的条件下按质量比1∶1 添加龙葵果和白砂糖于发酵罐中,于25 ℃下恒温避光发酵60 d,每隔5 d 取样测定。
1.2.2 龙葵果酵素基本理化指标的测定
pH 值的测定,采用酸度计[11];色值和透光率的测定,采用分光光度计,分别于λ=440 nm 和λ=660 nm处测OD 值[12];可溶性固形物的测定,采用手持式折光仪[13];可滴定酸的测定,采用滴定法[14]。
1.2.3 龙葵果酵素活性物质含量的测定
总糖含量的测定,采用蒽酮硫酸法[15],试验得到葡萄糖标准曲线Y=35.054X+0.146 7(R2=0.996 8);总多酚含量的测定,采用福林-酚试剂法[16],没食子酸标准曲线Y=0.144 6X+0.018 8(R2=0.999 6);总黄酮含量的测定,采用硝酸铝显色法[17-18],芦丁标准曲线Y=0.313X+0.005 2(R2=0.999 9)。
1.2.4 龙葵果酵素抑菌能力测定
牛津杯法测定抑菌性,采用牛津杯法测定龙葵果酵素对3 株菌株的抑菌性[19-20]。
2 结果与分析
2.1 龙葵果酵素基本理化指标变化
2.1.1 pH 值变化
pH 值变化曲线见图1。

图1 pH 值变化曲线
由图1 可知,龙葵果酵素发酵后期30 d 内,pH值从4.26 升至4.36;60~70 d 龙葵酵素的pH 值减少0.01;70~75 d,pH 值增大到最高点4.49,随后下降到最低点4.22。综上所述,从发酵60 d 到90 d 龙葵酵素中pH 值有明显起落,但较初始值4.26 波动上升较少。
2.1.2 色值变化曲线
色值变化曲线见图2。

图2 色值变化曲线
由图2 可知,龙葵果酵素发酵后期30 d 内,60~70 d 龙葵酵素的色值由0.684 下降至0.536,70~80 d色值逐渐下降到最低点0.512,并由此发生转折,80~90 d 色值逐步增大到最高点0.723。综上所述,从发酵60 d 到90 d 龙葵酵素中色值变化较小,较初始波动上升0.042。
2.1.3 透光率变化曲线
透光率变化曲线见图3。

图3 透光率变化曲线
由图3 可知,龙葵果酵素发酵后期30 d 内,60~70 d 龙葵酵素的透光率数值由0.52%增至0.74%,70~80 d 透光率数值缓慢上升到最大值0.76%,并随后发生骤降到最低点0.39%。综上所述,从发酵60 d到90 d龙葵酵素中透光率数值有一定的波动,较初始0.52%下降变化0.13%。
2.1.4 可溶性固形物含量变化曲线
可溶性固形物含量变化曲线见图4。

图4 可溶性固形物含量变化曲线
由图4 可知,龙葵果酵素发酵后期30 d 内,60~80 d,龙葵酵素的SSC 含量由24.2%降低到最低点为23.5%,降低了0.7%;80~85 d,SSC 含量又明显回升到最高点24.2%,与初始值相同,并由此发生转折;85~90 d,SSC 含量又下降至23.6%,下降了0.6%。综上所述,从发酵60 d 到90 d 龙葵酵素中SSC 含量有显著起落,但较初始值24.2%呈波动下降变化。
2.1.5 可滴定酸浓度变化曲线
可滴定酸浓度变化曲线见图5。

图5 可滴定酸浓度变化曲线
由图5 可知,龙葵果酵素发酵后期30 d 内,60~65 d 龙葵酵素的可滴定酸浓度由最高点5 mmol/100 mL逐渐下降到最低点3 mmol/100 mL,70 d 和80 d 可滴定酸数值又轻微地增加到次高点4 mmol/100 mL,85~90 d 可滴定酸浓度保持不变为3 mmol/100 mL。综上所述,从发酵60 d 到90 d 龙葵酵素中可滴定酸数值有明显的起伏,但较初始浓度波动降低2 mmol/100 mL。
2.2 龙葵果酵素活性物质含量变化
2.2.1 总糖质量浓度变化曲线
总糖质量浓度变化曲线见图6。

图6 总糖质量浓度变化曲线
由图6 可知,龙葵果酵素发酵后期30 d 内,总糖质量浓度由0.019 2 mg/mL 分别下降至0.018 2,0.017 9 和0.017 8 mg/mL,整体降低7.29%,其中上升2 次分别为0.018 8 和0.019 0 mg/mL,但均低于0.019 2 mg/mL。综上所述,从发酵60 d 到90 d 龙葵酵素中总糖质量浓度总体呈下降趋势。
2.2.2 总酚质量浓度变化曲线
总酚质量浓度变化曲线见图7。

图7 总酚质量浓度变化曲线
由图7 可知,龙葵果酵素发酵后期30 d 内,60~65 d 总酚质量浓度由1.211 mg/mL迅速增至1.712 mg/mL,增加了0.501 mg/mL,随后下降至1.322 mg/mL;70~75 d,总酚质量浓度再次上升到最高点1.993 mg/mL,而后又减少到1.721 mg/mL。综上所述,从发酵60 d到90 d 龙葵酵素中总酚质量浓度虽有上升和下降波动,但总体上升。
2.2.3 总黄酮质量浓度变化曲线
总黄酮质量浓度变化曲线见图8。

图8 总黄酮质量浓度变化曲线
由图8 可知,龙葵果酵素发酵后期30 d 内,总黄酮质量浓度先逐渐由1.304 mg/mL 降至最低点1.098 mg/mL,降低15.75%,5 d 后急剧增加至最高点2.407 mg/mL,增加1.307 mg/mL,之后依次缓慢下降至1.944 mg/mL,但都高于起始点1.304 mg/mL。综上所述,从发酵60 d 到90 d 龙葵酵素中总黄酮质量浓度不同程度下降和上升波动,但总体较初始呈上升趋势显著,可能是由于植物细胞破裂,抗氧化物质渗出与合成或是微生物活动。
2.3 龙葵果酵素抑菌能力变化
2.3.1 金黄色葡萄球菌(SA)的抑菌圈变化曲线
金黄色葡萄球菌的抑菌圈变化曲线见图9。

图9 金黄色葡萄球菌的抑菌圈变化曲线
由图9 可知,60~65 d 龙葵果酵素对SA 的抑菌圈直径增加到最高点39.47 mm;65~75 d 对SA 的抑菌圈直径减少到最低点32.52 mm,降低6.95mm,并由此发生转折;75~90 d,龙葵果酵素对SA 的抑菌圈直径增加到38.88 mm,增加6.36 mm。综上所述,从发酵60 d 到90 d 龙葵酵素中对SA 的抑菌圈直径在75 d 达到最低值,整体抑菌效果明显。
2.3.2 大肠杆菌(EC)的抑菌圈变化曲线
大肠杆菌的抑菌圈变化曲线见图10。
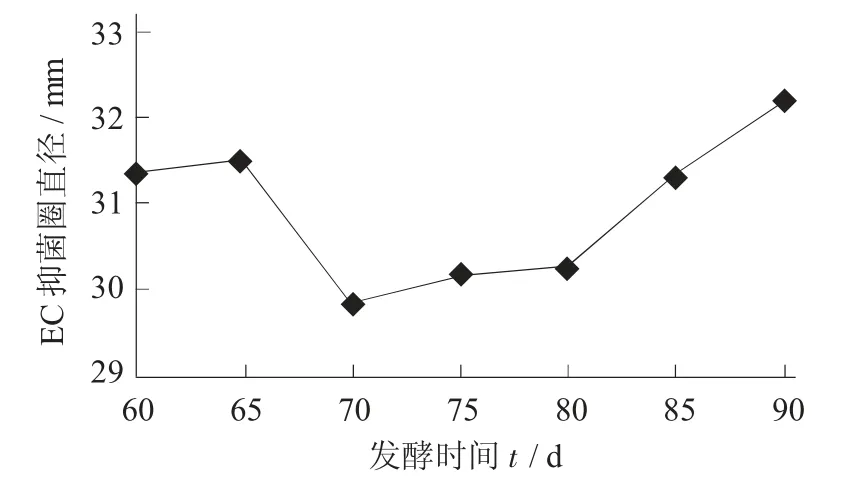
图10 大肠杆菌的抑菌圈变化曲线
由图10 可知,从60 d 至65 d 龙葵果酵素对EC的抑菌圈直径增多了0.14 mm,并由此发生转折;65~70 d,EC 的抑菌圈直径降到最低点29.81 mm;随后从70 d 至90 d 期间,EC 的抑菌圈直径逐步增加到最高点32.18 mm,增加2.37 mm。综上所述,从发酵60 d 到90 d 龙葵酵素中对EC 的抑菌圈直径有显著的变化,其总体呈上升趋势。
2.3.3 李斯特菌(LM)的抑菌圈变化曲线
李斯特菌的抑菌圈变化曲线见图见11。
由图11 可知,从60 d 至65 d 龙葵果酵素对LM的抑菌圈直径由27.45 mm 减至最低点24.48 mm,减少了2.47 mm;75~90 d,LM的抑菌圈直径又逐步增加到最高点31.81 mm。综上所述,从发酵60 d 到90 d龙葵果酵素对LM的抑菌圈直径有显著的变化,总体呈上升趋势。
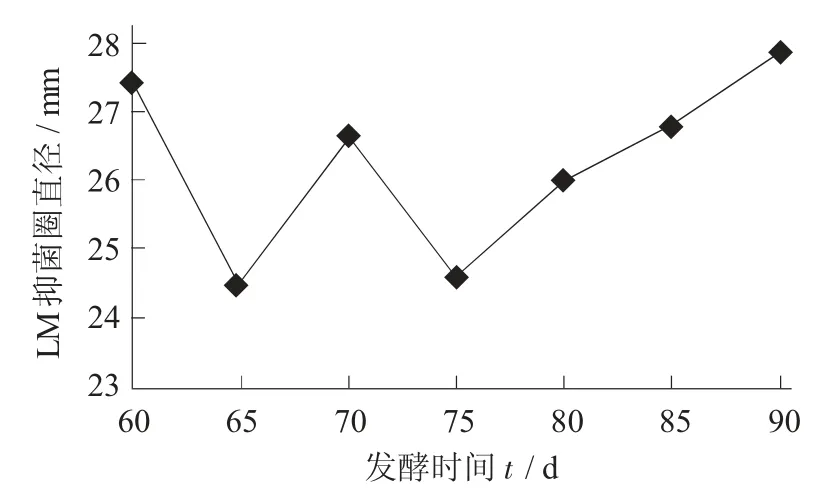
图11 李斯特菌的抑菌圈变化曲线
3 结论
对龙葵果自然发酵后期30 d 内基本理化指标(pH 值、色值、透光率、SSC、TA)和活性物质(总酚、总糖、总黄酮)质量浓度和对常见食品腐败菌SA,EC 和LM抑菌效果研究。结果表明,在龙葵果自然发酵后期,基本理化指标pH 值和色值基本保持不变,透光率、SSC 和TA 含量下降;龙葵果酵素中活性物质TS 含量下降,TP 和TF 含量明显上升;龙葵果酵素对SA,EC 和LM均有抑菌效果,30 d 内对SA 抑菌效果变化不大,EC 和LM 抑菌效果增加,但结合3 种食品腐败菌的抑菌圈直径可知龙葵酵素对3 株菌抑制能力为SA>EC>LM。探究龙葵果酵素功效和抑菌性,增加了龙葵果研发价值。
