组蛋白乙酰化抑制哮喘易感基因ADRB2的表达
2024-02-27郝忠分杨涓智
郝忠分 杜 娟 杭 芸 杨涓智 束 进
支气管哮喘是以反复发作的咳嗽、气急、胸闷、喘息为主要临床症状的慢性气道炎症,是影响全球儿童最常见的慢性呼吸系统疾病,表现为气道高反应性,可有气道重塑。随着对哮喘研究的深入,一系列的哮喘易感基因被发现,包括人血清类黏蛋白1样蛋白3(human orosomucoid 1-like protein3,ORMDL3)、胸腺基质淋巴生成素(thymic stromal lymphopoietin,TSLP)和β2肾上腺素受体(β2-drenergic receptor,ADRB2)等[1,2]。ADRB2 位于染色体5q31~32,是一个不含内含子、相对分子质量较小、编码 413 个氨基酸的基因,在身体各组织中广泛表达,与多种疾病的发生密切相关,如哮喘、心血管疾病、肺癌等[3~5]。ADRB2基因的多态性与儿童哮喘的易感因素、严重程度息息相关[6,7]。近年来关于哮喘易感性方面的研究主要集中在表观遗传学方面,表观遗传学是在不改变DNA序列的情况下影响基因表达的可遗传特征,DNA甲基化、组蛋白修饰、miRNA的表达是最常见的表观遗传机制,目前的研究主要针对DNA甲基化方面,而组蛋白修饰和miRNA表达方面的研究相对较少。
组蛋白乙酰化修饰是重要的表观遗传方式之一,组蛋白乙酰转移酶(histone acetyltransferase,HAT)和组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitors,HDACi)能使机体乙酰化蛋白堆积,从而影响基因的表达,通常组蛋白乙酰化能够上调基因的表达,但针对部分炎症和免疫基因则呈下调趋势,乙酰化在抗炎、抗免疫反应方面的作用越来越受到人们的关注。既往研究发现,HDACi介导的乙酰化在哮喘模型中具有抗炎、抗细胞增殖的作用,然而目前的研究尚未表明组蛋白乙酰化修饰是否参与哮喘易感基因ADRB2的表达[8]。本研究应用丁酸钠(sodium butyrate,SoB)、曲古抑菌素A(trichostatin A,TSA)两种HDACi和腺病毒 E1A相关的300kDa 蛋白(p300)一种HAT处理人正常支气管上皮细胞(BEAS-2B),研究组蛋白乙酰化对ADRB2的影响,为临床应用HDACi治疗哮喘等ADRB2基因相关疾病提供参考依据。
材料与方法
1.主要材料及试剂:BEAS-2B细胞、ADRB2启动子质粒(pADRB2-1918)、内参照荧光素酶报告基因质粒(pRL-TK)由本实验室保存。p300表达质粒及p300突变质粒由英国Joan Boyes教授(The Institute of Cancer Research)惠赠。SoB购自碧云天生物科技有限公司,TSA购自美国MCE公司,双荧光素酶报告基因试剂盒购自美国 Promega 公司,Trizol试剂、LipofectamineTM3000试剂购自美国Invitrogen 公司,反转录试剂购自北京天根生化科技有限公司,SYBR Green、ECL化学发光试剂盒购自南京诺唯赞科技有限公司,引物由上海生工生物工程股份有限公司合成,ADRB2抗体购自英国Abcam公司,GAPDH抗体、山羊抗兔二抗、鼠二抗购自中国 Proteintech公司,二甲基亚砜(DMSO)购自上海泽迈生物科技有限公司。胎牛血清、DMEM高糖培养基购自美国Gbico公司。
2.细胞培养及真核细胞转染:使用含有10% 胎牛血清、1%青霉素和链霉素的DMEM高糖培养基于温度为37℃、含有5% CO2和 95% 空气的细胞培养箱中培养,2~3天进行传代,选取对数生长期的细胞进行下一步实验。将BEAS-2B细胞接种在96孔板、24孔板或12孔板,用含10%胎牛血清的高糖DMEM培养基培养,待细胞密度生长至70%~90%按照LipofectamineTM3000转染试剂说明书进行真核细胞转染。当转染pADRB2-1918质粒时需同时转入pRL-TK质粒作为内参照质粒。
3.双荧光素酶报告基因分析ADRB2启动子活性:在96孔板中培养BEAS-2B细胞,将pADRB2-1918质粒、pRL-TK质粒转染到细胞中培养24h。分别向细胞中加入终浓度为1、2.5、5mmol/L的SoB为SoB处理组,向细胞中加入无菌双蒸水(ddH2O)为对照组;分别向细胞中加入终浓度为0.2、0.4、0.8μmol/L的TSA为TSA处理组,向细胞中加入0.1%DMSO为对照组;将pADRB2-1918质粒、pRL-TK质粒、p300表达质粒共转染到细胞为p300处理组,将pADRB2-1918质粒、pRL-TK质粒、p300突变质粒共转染到细胞为对照组。培养24h后取出,弃去培养液,洗涤,加入细胞裂解液室温震荡,显微镜下观看细胞裂解后检测荧光强度。荧光强度检测方法:按照双荧光素酶试剂盒说明书配置试剂在化学发光检测仪上分别检测萤火虫荧光素酶活性与海肾荧光素酶活性,以pRL-TK为内参,计算萤火虫荧光素酶活性强度与海肾荧光素酶活性强度的比值即为ADRB2启动子的相对活性。每次3复孔,每次实验重复3次。
4.细胞总RNA提取及实时荧光定量PCR(quantitative real time PCR,qRT-PCR)检测ADRB2mRNA的相对表达:在24孔板中培养BEAS-2B细胞,分别向细胞中加入终浓度为1、2.5、5mmol/L的SoB为SoB处理组,向细胞中加入ddH2O为对照组;分别向细胞中加入终浓度为0.2、0.4、0.8μmol/L的TSA为TSA处理组,向细胞中加入0.1%DMSO为对照组;将p300表达质粒转染到细胞为p300处理组,将p300突变质粒共转染到B细胞为对照组。24h后利用Trizol裂解法提取细胞总RNA,用光密度法测定提取的总RNA的浓度,按照天根反转录试剂盒说明书将提取的2μg RNA按照20μl的总体系反转录为cDNA进行qRT-PCR,qRT-PCR总体系为20μl,包含2μl cDNA、10μmol/L上游引物、10μmol/L下游引物和ddH2O。qRT-PCR反应程序:95℃10s预变性,95℃10s,53℃退火温度,共40个循环,以GAPDH基因为内参,分析数据,计算ADRB2mRNA相对表达量。ADRB2上游引物:5′-GTGATCATGGTCTTCGTCTACT-3′,下游引物: 5′-CATGATGATGCCTAACGTCTTG-3′;GAPDH上游引物:5′GCACCGTCAAGGCTGAGAAC-3′,GAPDH下游引物:5′-TGGTGAAGACGCCAGTGGA-3′。每次实验重复3次。
5.细胞总蛋白提取及Western blot法检测ADRB2 蛋白的相对表达:在6孔板中培养BEAS-2B细胞,分别向细胞中加入终浓度为1、2.5、5mmol/L的SoB为SoB处理组,向细胞中加入ddH2O为对照组;分别向细胞中加入终浓度为0.2、0.4、0.8μmol/L的TSA为TSA处理组,向细胞中加入0.1%DMSO为对照组;将p300表达质粒转染到细胞为p300处理组,将p300突变质粒共转染到B细胞为对照组。48h 后将细胞裂解、离心提取细胞总蛋白并测定总蛋白浓度,通过SDS-聚丙烯酰氨凝胶电泳分离等量蛋白,将蛋白转移到聚偏二氟乙烯膜上,用TBST buffer稀释的5%的脱脂牛奶在室温下慢摇封闭2h,TBST buffer洗涤3次,用稀释后的GAPDH抗体、ADRB2抗体在4℃下孵育过夜,TBST buffer洗涤3次,用二抗室温下孵育90min,TBST buffer洗涤3次,利用ECL化学发光试剂盒显影,并用Image J 软件进行各条带灰度分析,分析ADRB2蛋白的相对表达。每次实验重复3次。
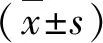
结 果
1.SoB和TSA对ADRB2基因启动子活性和mRNA的相对表达水平的影响:利用双荧光素酶报告基因分析发现SoB处理组ADRB2启动子活性与对照组比较均显著下降(P<0.01),TSA处理组ADRB2启动子活性与对照组比较均下降(P<0.05);利用qRT-PCR方法发现SoB处理组ADRB2mRNA的相对表达与对照组比较下降(P<0.05),发现TSA处理组ADRB2mRNA的相对表达与对照组比较明显下降(P<0.01),提示SoB和TSA在基因转录水平下调ADRB2,详见图1。
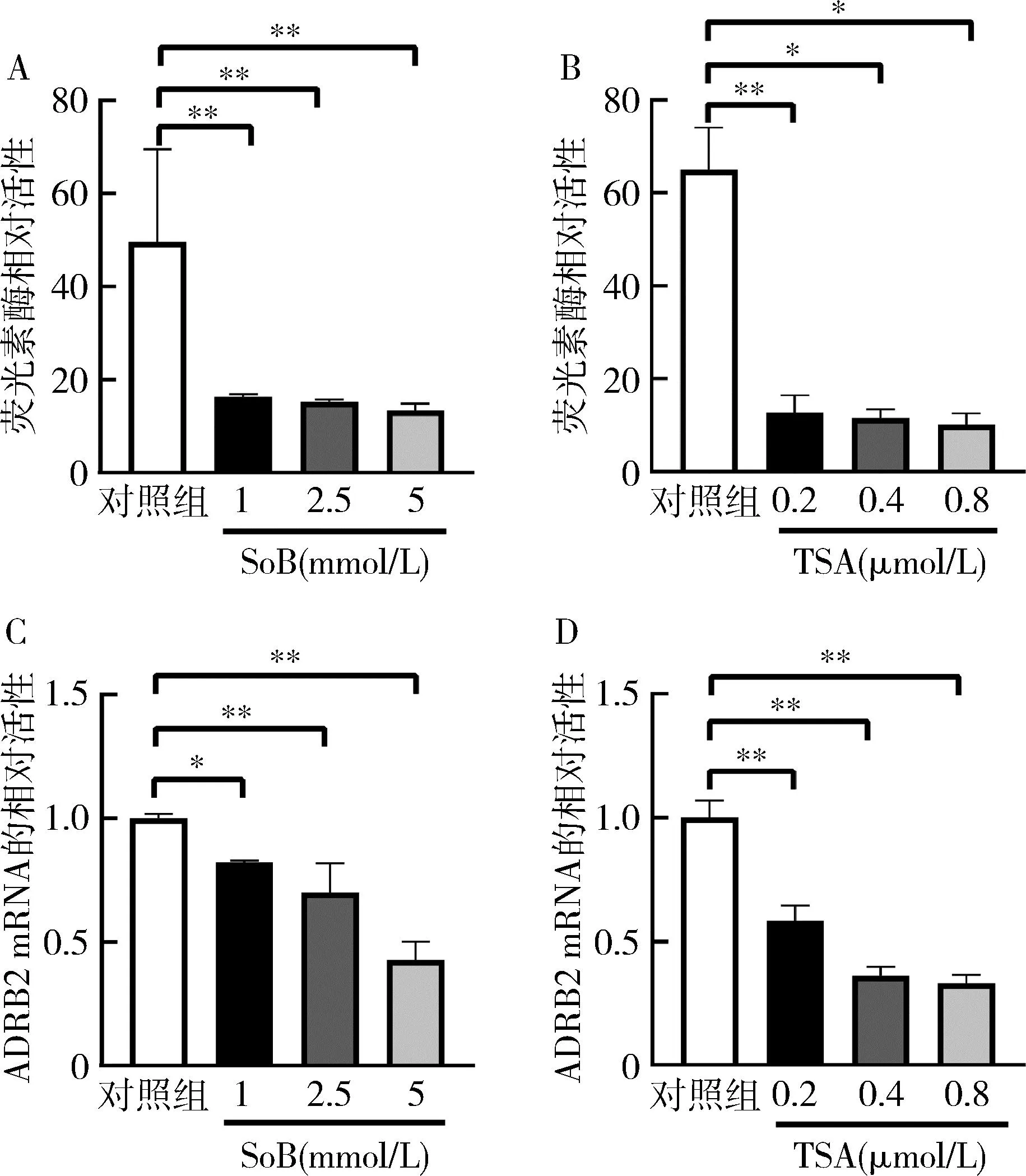
图1 SoB和TSA对ADRB2的启动子活性和mRNA的相对表达的影响
2.SoB和TSA对ADRB2蛋白表达的影响:使用Western blot法检测ADRB2蛋白的表达,发现SoB处理组ADRB2蛋白的相对表达较对照组均下降(P<0.05),TSA处理组ADRB2蛋白的相对表达较对照组下降(P<0.05),提示SoB和TSA在蛋白翻译水平下调ADRB2,详见图2。
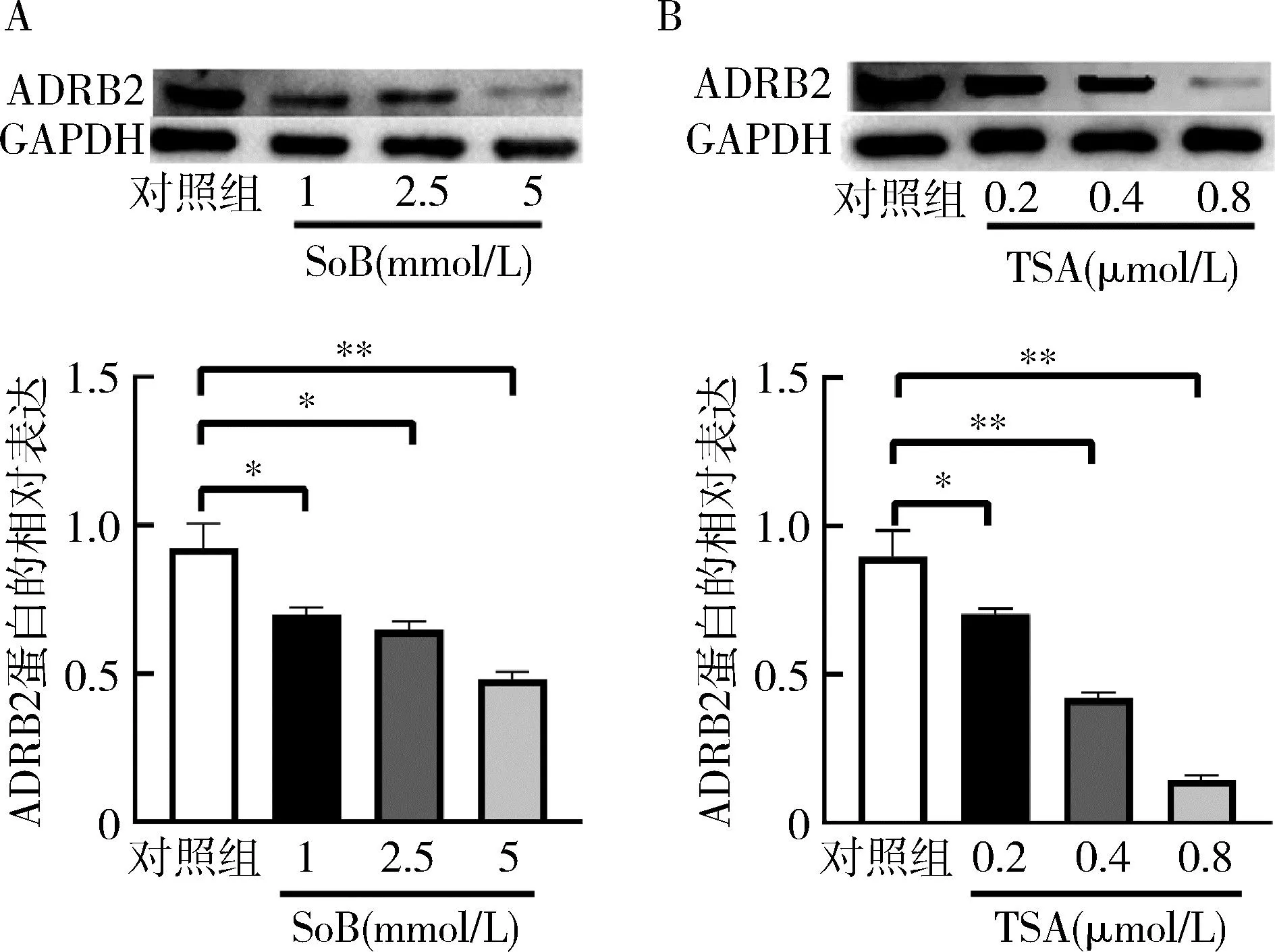
图2 SoB和TSA对ADRB2蛋白的相对表达的影响
3.p300对ADRB2基因启动子活性和mRNA表达水平的影响:利用双荧光素报告基因分析ADRB2启动子活性,p300处理组较对照组显著下降(P<0.01);利用qRT-PCR方法发现p300处理组ADRB2mRNA的相对表达水平较对照组明显下降(P<0.01),提示p300在基因转录水平下调ADRB2基因,详见图3。
图3 p300对ADRB2的启动子活性和mRNA的相对表达的影响
4.p300对ADRB2蛋白表达的影响:利用Western blot法检测ADRB2蛋白的表达,显示p300处理组ADRB2蛋白的相对表达较对照组显著下降(P<0.01),提示p300在蛋白翻译水平下调ADRB2,详见图4。
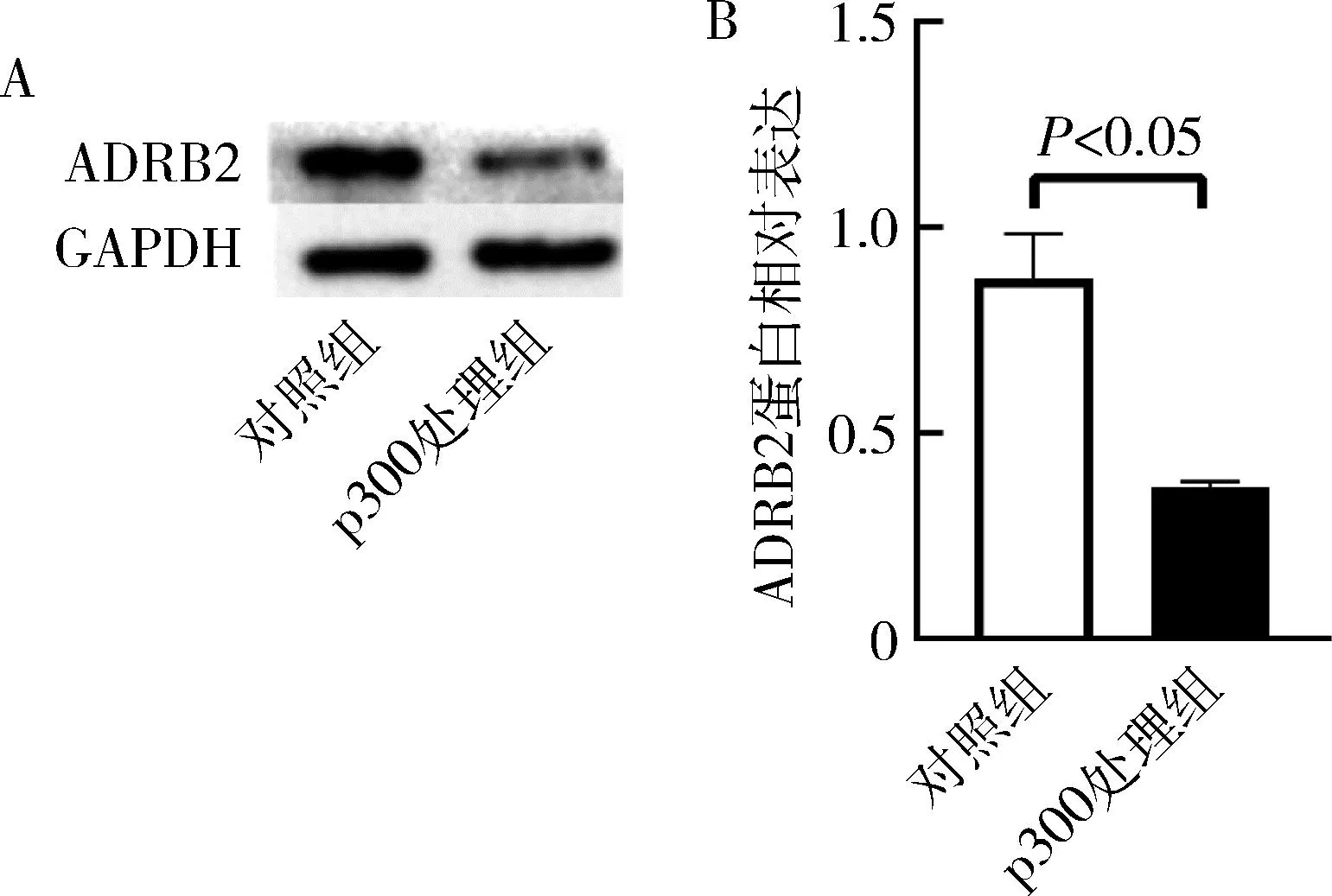
图4 p300对ADRB2蛋白的相对表达的影响
讨 论
以往研究证实HDAC的高表达是造成炎症发生的重要原因,抑制HDAC能有效的下调炎症的发生,抑制HDAC6和HDAC8的活性可能会减轻气道重塑,HDACi抑制HDAC的活性,和HAT共同参与调控组蛋白乙酰化修饰,能使染色质乙酰化,从而调控基因的表达,目前在临床治疗肿瘤方面已广泛应用,HDACi不仅对肿瘤有治疗作,如通过抑制MCM-2-7下调神经胶质瘤细胞的增殖,HDACi抑制乳腺癌的增殖和迁移等,还具有抗炎作用,HDACi抗炎作用已在包括哮喘在内的多种疾病中证实,如HDACi-PCI-34051能通过抑制VEGF/ERK信号通路缓解哮喘气道炎症和气道高反应性,HDACi-ACY1215能减轻急性肝衰竭小鼠模型中炎性反应,HDACi-VPA能减轻IgA肾病细胞模型中的炎性反应,上述研究均提示HDACi能减轻炎性反应[9~15]。
哮喘是由多种因素导致的复杂的遗传性疾病,免疫失调在哮喘的发生、发展中起重要作用,表现IgE水平升高、肥大细胞过度释放过敏介质、嗜酸性粒细胞渗入肺部、Th1/Th2紊乱和呼吸道炎症,肥大细胞、嗜酸性粒细胞和产生IgE的B细胞和细胞因子IL-4、IL-5、IL-13共同参与产生炎性反应,释放组胺、类胰蛋白酶的颗粒,并产生促炎性细胞因子,如前列腺素D2、半胱氨酰白三烯和腺苷,而嗜酸性粒细胞是通过释放蛋白酶引起大多数组织损伤的关键效应细胞,说明炎症增加哮喘的易感性,减弱中性粒细胞、嗜酸性粒细胞和T细胞募集和活化所需的炎性细胞因子的持续表达对控制哮喘极为重要[16,17]。上述研究提到HDACi能减轻炎性反应,缓解哮喘的发生、发展。HDACi按结构可分为4类,分别是羟肟酸类、环肽类、脂肪酸类和笨酰胺类,TSA是异羟肟酸类 HDACi,能有效抑制Ⅰ类、Ⅱa类HDAC,能抑制细胞增殖、降低细胞内炎性因子,从而达到相应的抗炎作用,用TSA处理小鼠哮喘模型发现气道内黏蛋白5AC明显降低,提示TSA在降低气道黏液分泌中起重要作用,TSA也能使中性粒细胞失活从而减轻炎性反应[18]。
丁酸钠是短链脂肪酸盐类HDACi,能参与调控机体组蛋白乙酰化修饰,使细胞生长周期停滞,发生细胞凋亡,从而发挥相应的抗炎作用,研究发现SoB可通过G蛋白介导的信号通路增强肠道先天免疫功能,同时通过抑制组蛋白去乙酰化酶来减轻炎性反应[19]。HAT按其结构特点可分为6种类型,p300属于p300/CBP家族中的一种HAT,与CBP结构相似,p300是关键的转录共激活因子和组蛋白乙酰转移酶,在许多细胞过程中是不可或缺的,在机体乙酰化中起重要作用,p300表达的改变与多种疾病有关,p300能使转录因子KLF2乙酰化,抑制NF-κB依赖性基因的转录,KLF2介导的NF-κB信号转导抑制使细胞对促炎性细胞因子反应减弱,从而减弱炎性反应[20]。上述研究说明了组蛋白乙酰化修饰在哮喘的发生、发展中起重要作用,本研究用SoB、TSA及p300处理BEAS-2B细胞,抑制了BEAS-2B细胞中ADRB2基因的启动子活性、mRNA及蛋白的表达,更进一步证实在体外研究中,组蛋白乙酰化抑制哮喘易感基因ADRB2的表达。
综上所述,组蛋白乙酰化抑制哮喘易感基因ADRB2的表达,为临床哮喘的防治提供了新思路。本研究使用人正常支气管上皮细胞进行实验,证实了SoB、TSA及p300参与的组蛋白乙酰化修饰抑制ADRB2的启动子活性、mRNA及蛋白的表达,但其通过何种分子通路机制进行抑制尚不明确,未来需进一步开展相关实验研究组蛋白乙酰化抑制哮喘易感基因ADRB2的分子机制。
