铁死亡参与无机砷致人肝星状细胞活化的研究
2024-02-27迪丽娜尔亚尔麦麦提丁关鑫赵丽君吴顺华
迪丽娜尔·亚尔麦麦提 黄 菲 丁关鑫 赵丽君 吴顺华
无机砷(inorganic arsenic,iAs)是存在于环境中的Ⅰ类致癌物[1]。据2020年地下水砷污染预测模型估计,目前全球范围内大约有2200万人生活在高砷浓度水地区(砷含量>10μg/L),其中94%分布在亚洲[2]。iAs作为一种潜在环境致癌物对机体多器官、多系统产生不可逆的损害,严重危害身体健康。其中,肝脏是iAs代谢的主要靶器官。长期摄入iAs通过肝纤维化、肝衰竭和肝硬化最终导致肝脏发生癌变[3]。然而,iAs致肝纤维化的发病机制尚不明确。
近年来研究发现,铁死亡(ferroptosis)是不同于细胞凋亡、坏死和自噬的由铁依赖性脂质过氧化物大量聚集引起的新型细胞程序性死亡方式[4]。铁死亡的典型形态特征是线粒体结构的改变而引起线粒体功能损伤。溶质载体家族7号成员11(solute carrier family number 7member 11,SLC7A11)作为细胞内谷氨酸和细胞外胱氨酸交换的阀门在铁死亡中起重要作用。SLC7A11被抑制引起胱氨酸摄取减少进而降低细胞谷胱甘肽(glutathione,GSH)含量,导致谷胱甘肽过氧化物酶 4 (glutathione peroxidase 4,GPX4) 的功能受损并导致脂质过氧化引起细胞死亡[5]。越来越多的研究表明,铁死亡与肝纤维化、癌症、缺血性再灌注损伤等疾病关系密切[6~8]。但铁死亡是否参与iAs致肝纤维化的研究鲜有报道。因此,本研究以人肝星状细胞(LX-2)为观察对象,探讨亚砷酸钠(NaAsO2)对LX-2细胞铁死亡水平的影响,继而从铁死亡的角度进一步探讨iAs致LX-2活化的可能机制。
材料与方法
1.主要试剂与仪器:LX-2细胞购自武汉普诺赛生命科技有限公司,NaAsO2购自北京化学试剂三厂,高糖培养基DMEM、PBS、胰酶、胎牛血清购自美国Gibco公司,FerroOrange荧光探针和CCK-8检测试剂盒购自日本同仁试剂公司,丙二醛(malondialdehyde,MDA)检测试剂盒购自南京建成生物工程研究所,BCA蛋白定量试剂盒购自美国Thermo Scientific Fisher公司,α-平滑肌肌动蛋白(α-SMA)购自英国Abcam公司,SLC7A11、GPX4、β-肌动蛋白(β-actin)抗体购自美国Proteintech公司,CO2培养箱购自美国Thermo Scientific Fisher公司,低温离心机购自美国Sigma 公司,荧光显微镜购自德国Leica 公司,多功能酶标仪购自美国Thermo Scientific Fisher公司。
2.实验分组:分为对照组、5μmol/L NaAsO2组、10μmol/L NaAsO2组和15μmol/L NaAsO2组。
3.细胞培养:在5% CO2和37℃条件下,采用含12%胎牛血清,1%双抗的DMEM高糖培养基培养细胞。待细胞密度达到80%时,使用0.25%胰酶消化、离心最终收集细胞。按1∶3进行传代培养。收集处于对数生长期且生长状态良好的细胞进行后续实验。
4.CCK-8检测细胞增殖率:收集对数生长期的LX-2细胞,按5000 个细胞/孔,向96孔板每孔加入100μl细胞悬液,边缘孔用 PBS填充。在CO2培养箱中孵育。12h后吸弃旧培养基,设NaAsO2不同浓度梯度(0μmol/L、5μmol/L、10μmol/L、15μmol/L、20μmol/L、30μmol/L、40μmol/L、50μmol/L、60μmol/L),向每孔中100μl不同浓度NaAsO2溶液,同时设立对照组与空白组,继续培养24h。次日,向每孔加入10μl CCK-8溶液,3h后用酶标仪测吸光度(A)值,并按公式计算细胞增殖率。细胞增殖率(%)=[A(实验)-A(空白)]/[A(对照)-A(空白)]×100%。
5.透射电子显微镜(transmission electron microscopy,TEM)观察LX-2细胞线粒体:NaAsO2处理LX-2细胞24h后收集细胞,用PBS冲洗3次,再用1mol/L磷酸缓冲戊二醛固定液固定2h。用磷酸盐缓冲液漂洗3次,加入1%的四氧化锇固定1.5h。丙酮梯度脱水,环氧丙烷包埋细胞并制作超薄切片。再分别用醋酸铀、枸橼酸染色切片,TEM观察线粒体超微结构。
6.Fe2+检测:LX-2细胞以1×104个/孔的密度接种于6孔板中,不同浓度NaAsO2干预LX-2细胞24h。次日用HBSS清洗2次,加入1μmol/L的FerroOrange荧光探针,在培养箱培养30min后用荧光显微镜观察细胞荧光强度,用荧光酶标仪检测胞内Fe2+的荧光强度,实验独立重复3次。
7.MDA含量检测:按试剂盒说明书, 将不同NaAsO2染毒组细胞沉淀中加试剂五提取液0.5ml,混匀2min,将细胞破碎制成悬液,取样0.1ml于1.5ml离心管中,向空白管、标准管分别加100μl无水乙醇和10nmol/ml标准品,旋涡混匀,95℃金属浴40min,冷却后,4000r/min(离心半径13.5cm)离心10min,吸取0.25ml各管反应液加入到新的96孔板中,530nm测定各孔吸光度,并计算MDA含量,实验独立重复3次。MDA含量(nmol/mg protein)=[A(实验)-A(空白)]/[A(标准)-A(空白)]×C标准/Cpr。
8.蛋白免疫印迹(Western blot)法检测:收集 NaAsO2处理 24h 的细胞,RIPA 裂解液提取各组细胞总蛋白,通过BCA法进行细胞蛋白定量,对蛋白浓度进行统一化,取同质量蛋白上样,经 SDS-PAGE 电泳、电转、封闭、清洗3次、4℃一抗过夜孵育、清洗3次、室温二抗孵育1h、超敏ECL发光液显影。使用Image J软件测量条带的灰度值,并计算和分析每组蛋白的相对表达量。
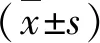
结 果
1.NaAsO2对LX-2细胞增殖率的影响:不同浓度NaAsO2染毒液处理LX-2细胞24h,观察到随着NaAsO2染毒剂量升高,LX-2细胞增殖率逐渐下降,IC50为21.44 (18.88~24.22)μmol/L,R2=0.91。当60μmol/L NaAsO2干预LX-2细胞时,细胞增殖率为0(图1)。因此,根据实验需求取5μmol/L、10μmol/L、15μmol/L 为后续实验染毒剂量。
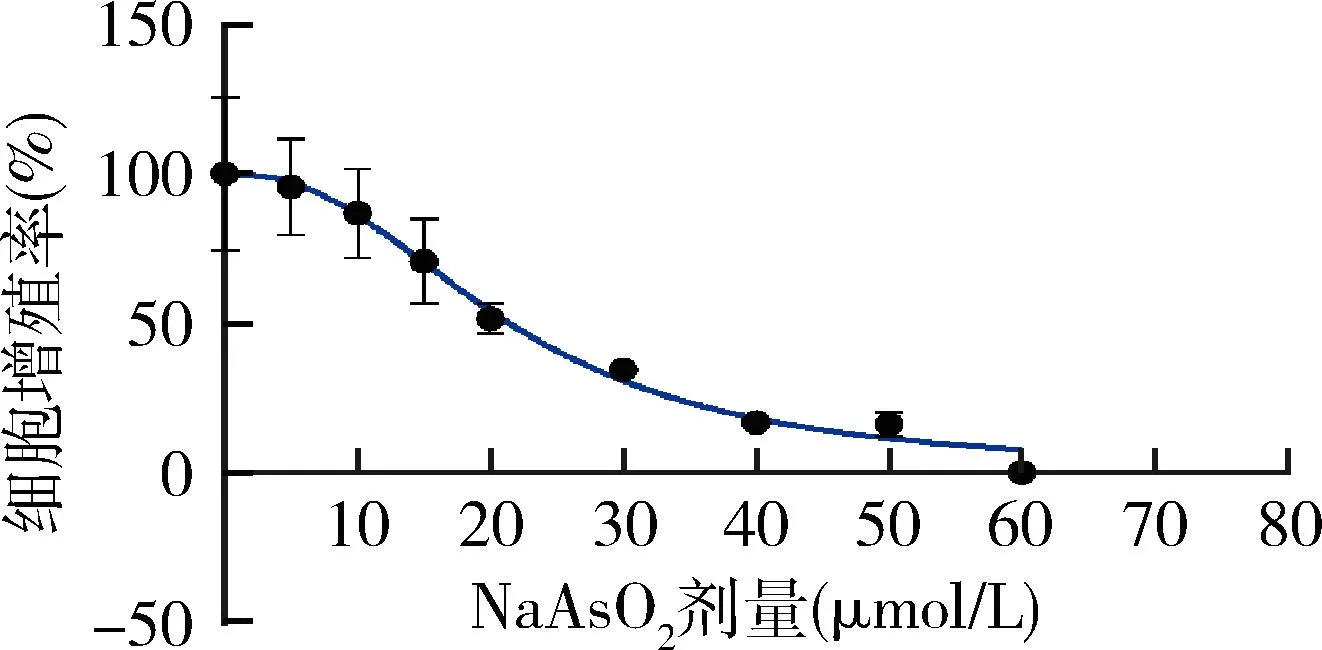
图1 细胞增殖率曲线

图2 TEM观察LX-2细胞线粒体(×30000)
2.TEM观察LX-2细胞线粒体:通过TEM观察到,对照组LX-2细胞线粒体结构为双层膜、光滑闭环且可清楚观察到线粒体嵴。然而15μmol/L NaAsO2组LX-2细胞线粒体数量减少、线粒体双层膜破坏、线粒体嵴减少,甚至观察到线粒体肿大、空泡化线粒体嵴消失现象(图2)。
3.Fe2+检测:荧光显微镜观察到不同剂量NaAsO2染毒LX-2 细胞24h后,Fe2+荧光强度随着NaAsO2剂量的升高而逐渐升高(图3)。不同剂量NaAsO2处理LX-2细胞组Fe2+水平比较,差异有统计学意义(F=10.77,P<0.05)。与对照组比较,NaAsO2染毒组Fe2+水平均升高(P均<0.05),且10、15μmol/L NaAsO2组Fe2+水平高于5μmol/L组(P均<0.05,图4)。

图3 荧光显微镜下LX-2细胞 Fe2+检测结果(×100)

图4 荧光酶标仪检测Fe2+荧光强度(n=3)
4.MDA含量检测:不同剂量NaAsO2处理LX-2细胞组MDA含量比较,差异均有统计学意义(F=7.18,P<0.01)。其中,与对照组比较,NaAsO2处理导致LX-2细胞MDA含量升高,5、15μmol/L NaAsO2处理组MDA含量均高于对照组(P<0.05)。然而10μmol/L NaAsO2组与对照组比较,差异无统计学意义(P>0.05)。此外15μmol/L NaAsO2组MDA含量高于10μmol/L 组(P<0.05,图5)。
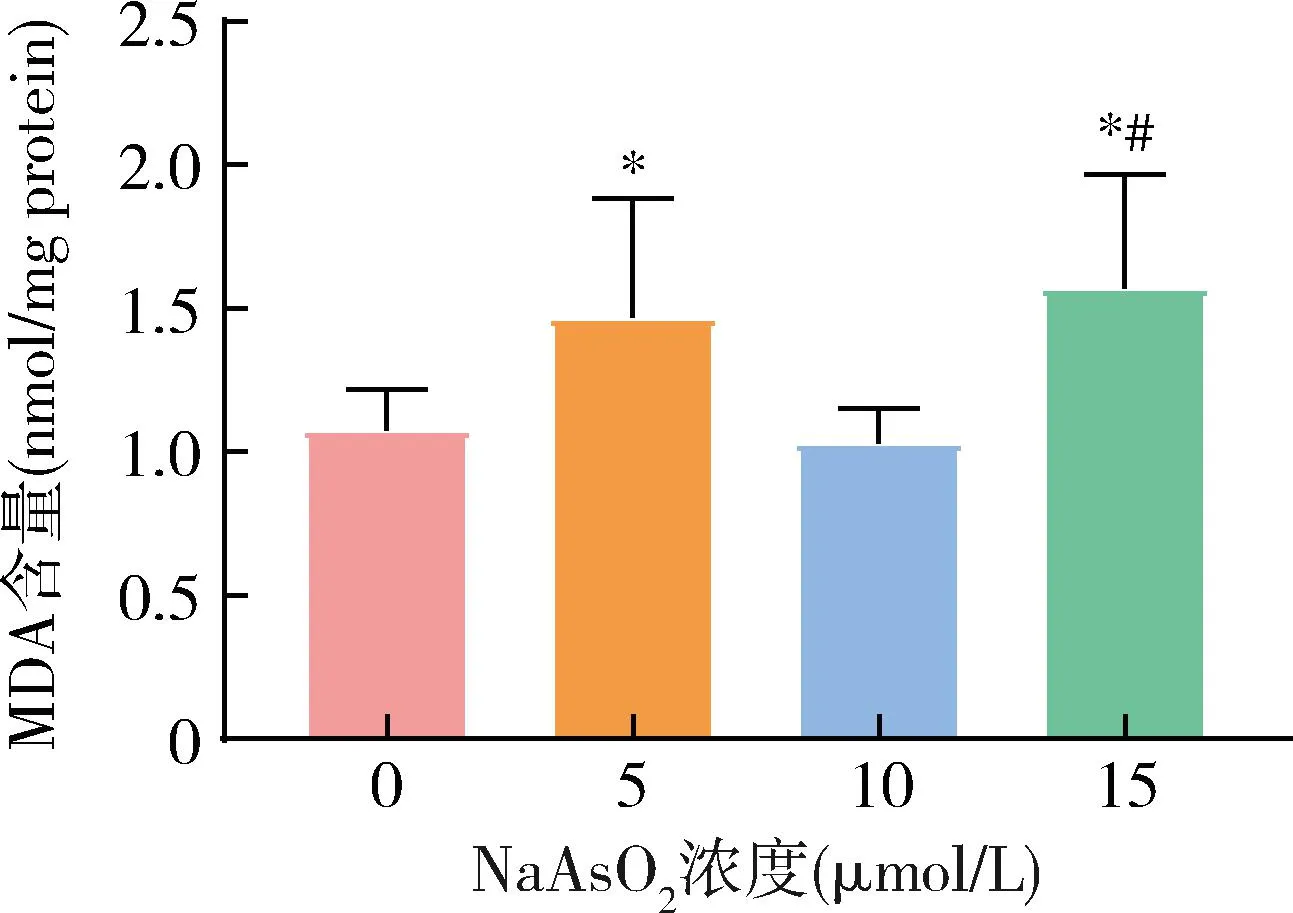
图5 不同组LX-2细胞MDA含量检测(n=3)
5.NaAsO2对LX-2细胞α-SMA、SLC7A11、GPX4 蛋白水平的影响:在不同 NaAsO2处理组,纤维化指标α-SMA蛋白表达水平比较,差异有统计学意义(F分别为782.86,P< 0.001)。其中,与对照组比较,5、10、15μmol/L NaAsO2组α-SMA蛋白水平均以剂量依赖方式升高(P<0.05)。此外,不同组间铁死亡指标SLC7A11和GPX4 蛋白表达水平比较,差异有统计学意义(F分别为274.03、206.83,P均<0.001),其中,5、10、15μmol/L NaAsO2组SLC7A11和GPX4 蛋白表达水平均以剂量依赖方式下调(P<0.05,表1,图6)。

表1 NaAsO2对LX-2细胞α-SMA、SLC7A11、GPX4 蛋白水平的影响
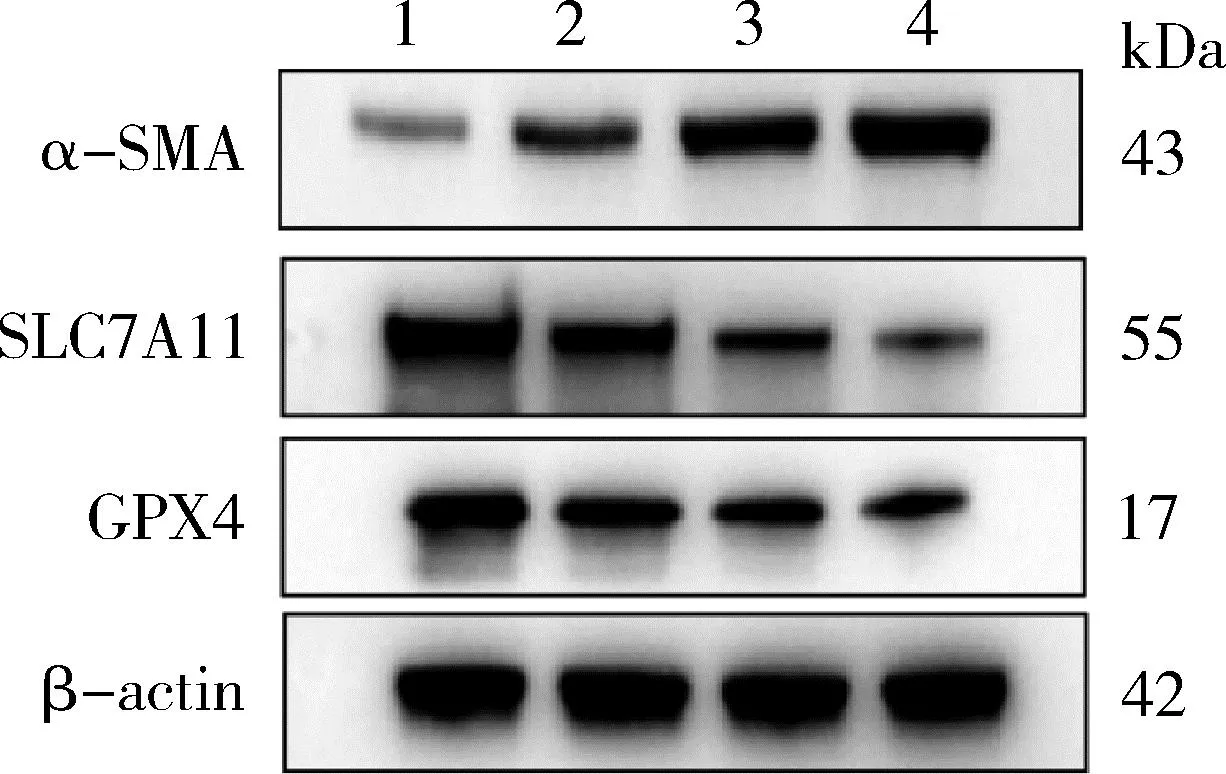
图6 Western blot法条带图(n=3)
讨 论
肝纤维化是由病毒、自身免疫性疾病、药物或毒性化学物质、代谢性或全身性疾病等多种因素引起的弥漫性疾病[9]。从形态学上看,肝纤维化的特点是细胞外基质(extracellular matrix, ECM)的积聚,随后形成纤维瘢痕和肝硬化。持续性肝损伤致肝星状细胞(hepatic stellate cell,HSC)激活,上调α-SMA的表达并产生ECM引起肝纤维化[10]。Tao等[11]研究表明,NaAsO2处理 HSC-T6细胞24h观察到细胞增殖率以剂量依赖性方式降低,然而α-SMA、TGF-β1表达上调证明HSC被NaAsO2激活。在本研究中用不同浓度NaAsO2干预LX-2细胞24h,发现随着NaAsO2浓度的升高LX-2细胞增殖率逐渐下降。此外,α-SMA蛋白水平以NaAsO2剂量依赖方式上调。由此可认为,体外NaAsO2干预LX-2活化模型建立成功。
流行病学研究发现,长期饮用含砷水可引起肝纤维化[12]。从iAs毒性研究进展来看,凋亡、氧化应激、甲基化、自噬与砷致纤维化机制相关[13~15]。然而,iAs如何引起LX-2活化及肝纤维化尚不明了。随着铁死亡研究的进展,多项研究表明,铁死亡参与肝纤维化过程。铁死亡的特点是线粒体结构改变,脂质过氧化物的积累和Fe2+水平升高[16]。本研究中,首先采用TEM观察到NaAsO2处理LX-2细胞导致线粒体双层膜完整性破坏、线粒体脊减少,甚至观察到线粒体肿大和空泡化线粒体脊消失等现象。由此推测,砷可能影响线粒体正常功能,从而导致细胞呼吸受损。研究表明,2.5μmol/L、5μmol/L、10μmol/L亚砷酸盐处理小鼠精母细胞时,细胞脂质过氧化产物MDA含量以剂量依赖性方式显著升高,Fe2+含量也逐渐升高[17]。同样,本研究结果显示,与对照组比较,随着NaAsO2染毒浓度的升高细胞MDA水平逐渐升高。此外,NaAsO2染毒的LX-2细胞内Fe2+水平也显著升高。因此,iAs致LX-2线粒体损伤而可能引起MDA堆积,Fe2+水平升高,这可能与铁死亡有关。
铁死亡作为一种新型调节性细胞死亡方式,氨基酸代谢、铁离子代谢、脂质过氧化物等多种通路及相关基因共同调控铁死亡的发生[18]。其中,SLC7A11、GPX4在调控铁死亡中起到重要作用。SLC7A11将胱氨酸运输至细胞内并被还原为半胱氨酸合成细胞内主要的抗氧化剂GSH。GSH辅助GPX4还原脂质过氧化物为无毒脂质醇,发挥保护细胞膜结构及功能的作用[19]。研究发现,亚砷酸盐急剧降低了PC-12 细胞和海马组织中SLC7A11和GPX4的表达而触发铁死亡[20]。因此,暴露于iAs可能破坏胱氨酸/谷氨酸逆向转运蛋白系统,进而抑制GPX4。GPX4 的消耗可导致脂质自由基的积累,引起细胞铁死亡。Wei等[21]研究发现,NaAsO2诱导的非酒精性脂肪性肝炎中存在铁死亡,当NaAsO2刺激肝细胞时可降低GPX4的表达,增加脂质过氧化产物进而引起铁死亡。本研究结果显示,与对照组比较,NaAsO2染毒的LX-2细胞SLC7A11和GPX4蛋白水平均随着iAs剂量的升高而降低。提示NaAsO2处理LX-2细胞可能通过降低SLC7A11、GPX4引起脂质氧化物MDA水平升高而引起铁死亡。
综上所述,本研究在NaAsO2致LX-2细胞活化模型中发现,iAs致LX-2细胞线粒体损伤、铁离子水平升高并促进铁死亡水平升高。因此,靶向铁死亡可能成为防治砷致肝纤维化的新方向。然而,本研究检测指标有限,未检测改变铁死亡水平后对纤维化指标的影响。为此,需做大量研究工作来揭示iAs致肝纤维化与铁死亡的关系。
