整合生物信息学分析基底型乳腺癌的核心基因
2024-02-27曹家兴刘九洋吴高松
曹家兴 张 旺 刘九洋 吴高松
乳腺癌是世界范围内最常见的恶性肿瘤之一,也是女性癌性死亡的主要原因[1]。GLOBOCAN 2020年统计数据显示,全球女性乳腺癌新发病例为226万例,死亡病例为68万例,分别占女性癌症新发和死亡病例的24.5%和15.5%[2]。乳腺癌是一种高度异质性疾病,基于分子表达差异可将其分为管腔上皮A型(Luminal A)、管腔上皮B型(Luminal B)、生长因子受体(HER-2)过表达型(HER-2 enriched)、基底型(basal-like breast cancer, BLBC)和正常乳腺样型(normal-like)5种类型[3]。其中BLBC约占乳腺癌的15%,且具有发病年龄低、进展快、易转移和预后差的特点[4]。此外,BLBC多表达基底细胞角蛋白CK5/17,而激素受体(hormone receptor,HR)、HER-2表达较低,故对内分泌治疗、HER-2靶向治疗反应较差[4, 5]。因此,探索BLBC核心基因对理解肿瘤进展、寻找新的治疗靶点至关重要。
加权基因共表达网络分析(weighted correlation network analysis, WGCNA)是一种寻找高度相关的基因模块并将模块与性状关联的生物学方法,已广泛用于筛选核心基因和治疗靶点[6]。肿瘤免疫浸润数据库TIMER2.0基于6种算法探索基因表达与免疫浸润的关系,为探索肿瘤免疫浸润提供了新思路[7]。基于GSE78958构建基因共表达网络,筛选出在BLBC高表达并与生存相关的核心基因[8]。此外,利用多种生信工具分析了核心基因表达和免疫浸润、免疫检查点的相关性。探索BLBC预后相关的生物学标志物并分析其潜在机制将有助于靶向药物的开发及提高患者的生存时间。
材料与方法
1.数据获取与处理:首先,从基因表达数据库(gene expression omnibus, GEO)下载GSE78958芯片数据,GSE78958由GPL571 [HG-U133A_2] Affymetrix Human Genome U133A 2.0 Array测序完成。然后对芯片数据进行基因注释以获得基因表达谱。最后,根据基因表达差异按照标准差从大到小排序,并提取样本中差异最大的前50%基因进行下一步分析。
2.加权基因共表达分析:利用Sangerbox在线网站中的“WGCNA”工具剔除离群基因和样本并构建无尺度共表达网络,高度协同的基因被划分为同一模块[9]。然后将各个模块与乳腺癌分型相关联。选择与BLBC相关性强的模块继续分析。
3.模块基因功能富集分析:用R软件包“clusterProfiler(version 3.14.3)”探索黑色模块基因的生物学功能和信号通路。具体而言,设置P<0.01,并利用R包“ggplot 2”进一步筛选出前10个结果并对其进行可视化。
4.PPI网络分析和核心基因的识别:为了进一步筛选核心基因,将黑色模块基因上传至STRING数据库用于构建PPI网络[10]。然后,将评分(0.4的差异基因纳入Cytoscape(v3.9.1)软件进行分析,利用插件cytohubba基于度算法提取黑色模块中差异最大的10%基因[11]。根据cytohubba分析结果,黑色模块中共80个基因作为候选基因继续分析。接下来,利用bc-GenExMiner对候选基因进行生存分析和表达分析,以P<0.05为差异有统计学意义[12]。
5.免疫细胞浸润分析:TIMER2.0免疫相关模块可探究BLBC乳腺癌核心基因表达与免疫细胞浸润的相关性。“肿瘤纯度”是该分析中的主要混杂因素。由于大多数免疫细胞类型与肿瘤纯度呈负相关,研究选择了“纯度调整”选项,该选项使用Spearman偏相关性检验进行分析。
6.肿瘤免疫相关分析:肿瘤和免疫系统相互作用在癌症的发生、发展和治疗中起着至关重要的作用。TISIDB是肿瘤免疫系统相互作用的集成储存库门户,可探索中枢基因表达和免疫抑制剂、免疫刺激剂和MHC分子及趋化因子之间的相关性[13]。
7.构建转录因子-核心基因调控网络:为了探索调节中枢基因表达的转录因子(transcription factor, TF)并揭示它们的调节关系,借助Cytoscape插件iRegulon预测核心基因上游TF并构建基于核心基因和TF的调控网络。
结 果
1.共表达网络的构建和模块的识别:对GSE78958进行基因注释后,获得424例乳腺癌患者表达数据和分子分型信息,其中Luminal A 226例,Luminal B 43例,Her-2过表达50例,BLBC 99例,normal-like 6例。提取方差较大的前50%(6717)基因进行WGCNA。通过平均连锁聚类将具有相似表达模式的差异基因划分为不同的模块。选择相关系数为0.87时的软阈值5,设置模块最小基因数为30,合并阈值为0.5。最终确定了14个模块,其中灰色模块是无法分配给任何的模块基因集合。通过计算模块与乳腺癌亚型的相关性,结果显示黑色模块与BLBC呈正相关且相关性最强(图1)。因此,选择黑色模块作为BLBC的关键模块进行下一步分析。
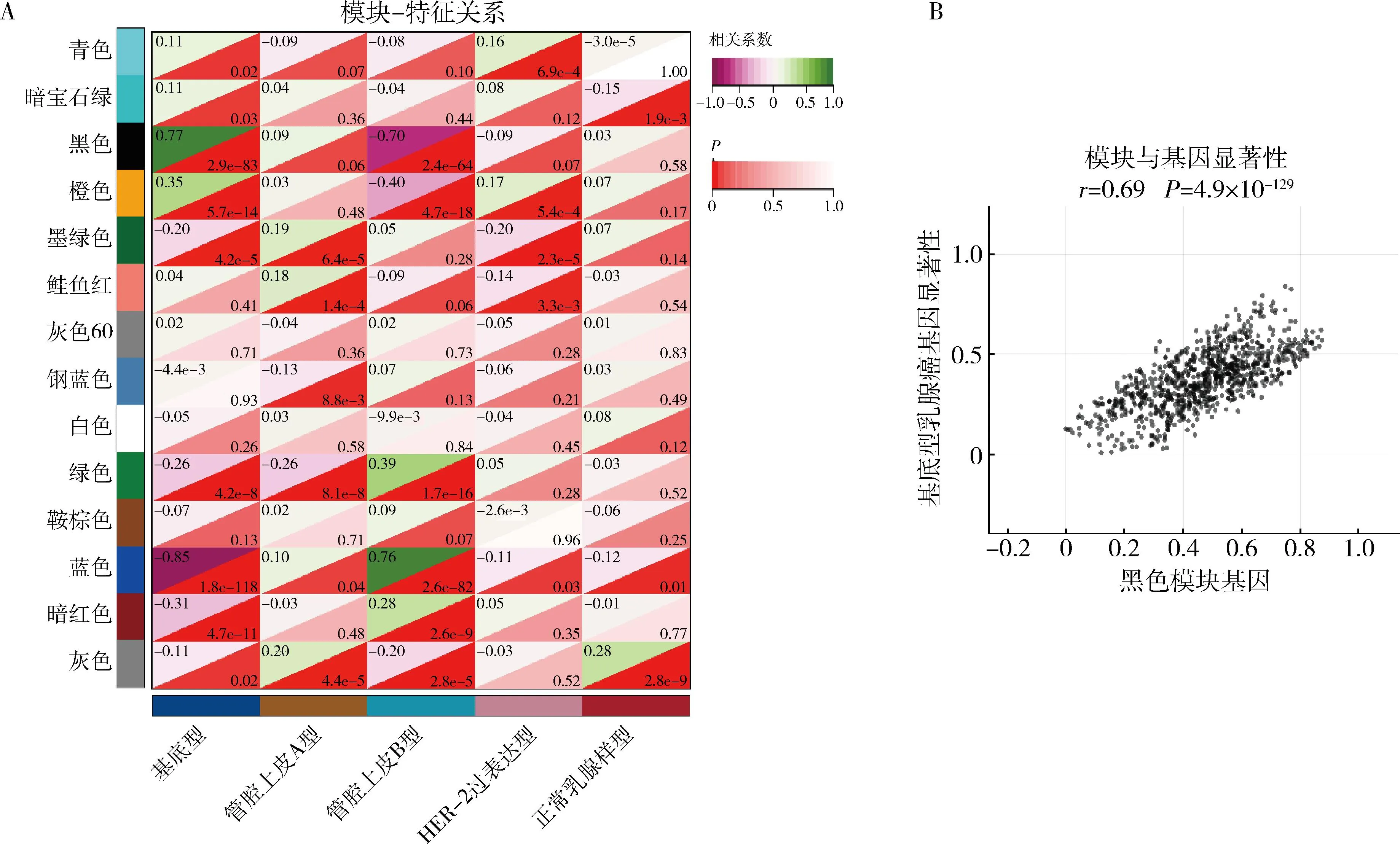
图1 加权基因共表达分析
2.黑色模块富集分析:接下来研究对黑色模块基因进行GO(gene ontology)富集和KEGG(kyoto encyclopedia of genes and genomes)通路分析以探索其生物功能。就GO而言,生物过程(biological process, BP)主要富集于细胞周期、细胞分裂过程;细胞成分(cellular component, CC)多富集于染色质、微管等区域,而分子功能(molecular function, MF)主要富集于核苷酸结合、酶结合等(图2中A、B、C)。此外,KEGG通路结果表明黑色模块基因通过细胞周期和肿瘤通路等发挥作用(图2D)。
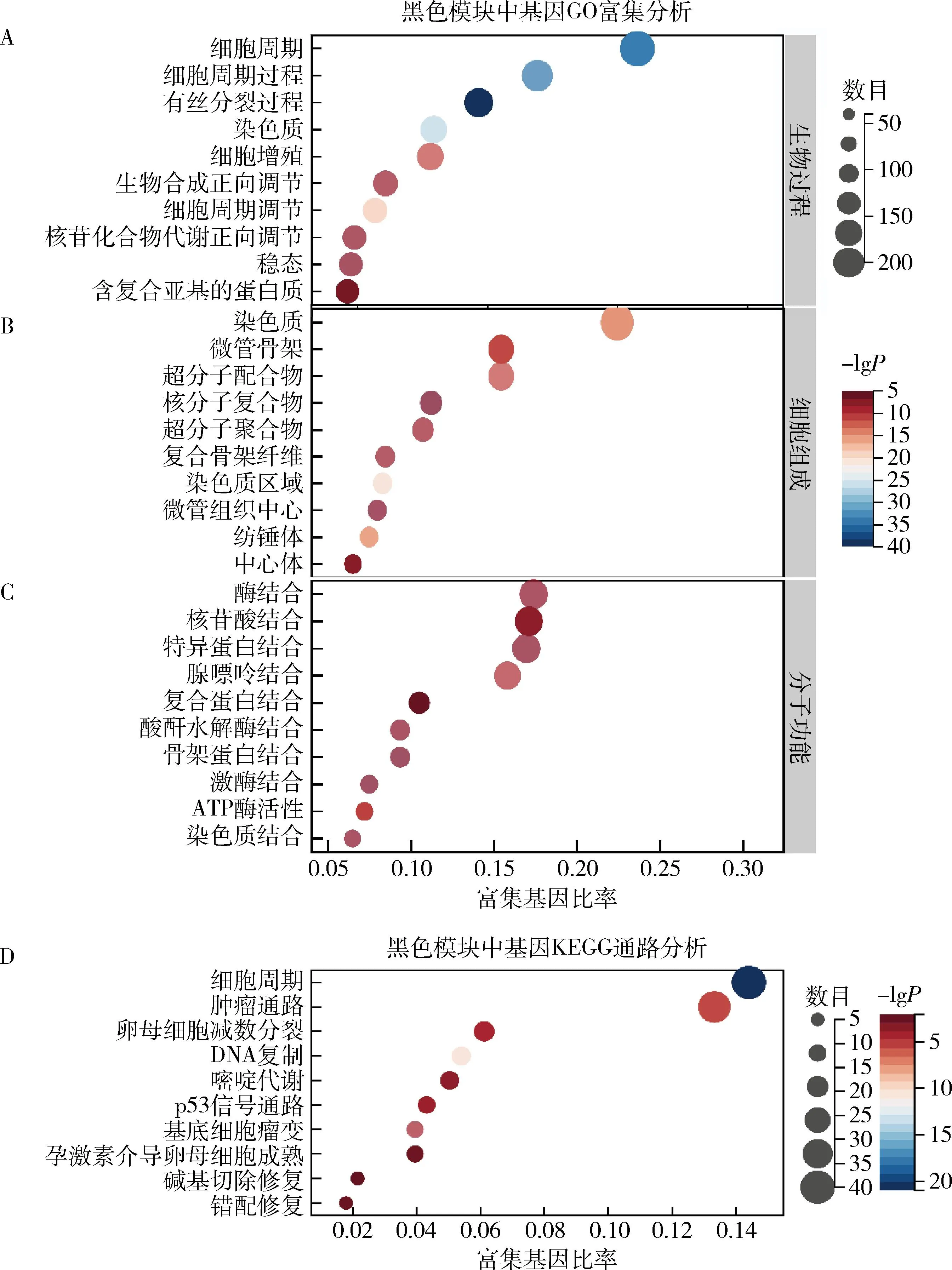
图2 黑色模块基因GO富集分析和KEGG通路分析图
3.PPI网络构建及核心基因的识别:基于STRING数据库和Cytoscape软件,黑色模块中总共891个基因被映射到PPI网络中,包括812个节点和12050条边。随后,使用Cytoscape软件中的cytohubba插件基于度排序,选择PPI网络中排名前10%的80个基因作为候选基因(图3A)。为了进一步缩小范围并验证研究结果,使用bc-GenExMiner对候选基因进行生存分析和表达分析。结果表明,80个候选基因中7个与无病生存期(disease free survival, DFS)相关,仅ESPL1和CCNB2同时与BLBC总生存期(overall survival, OS)和DFS相关(图3中B~E)。此外,表达分析表明,ESPL1和CCNB2在BLBC中表达高于其他分型(图3中F、G)。研究还发现,两个核心基因在BLBC中的表达水平彼此呈正相关,这表明两者存在潜在的共同调剂网络(图3H)。因此,以上结果表明,ESPL1和CCNB2可作为BLBC的核心基因。

图3 核心基因的识别和验证
4.核心基因免疫细胞浸润分析:为了确定核心基因表达和肿瘤免疫细胞浸润之间是否存在相关性,通过TIMER分析了BLBC多种免疫细胞的浸润水平。在两个核心基因的表达水平和Th2细胞、CD8+T细胞正相关,与肿瘤相关成纤维细胞、内皮细胞呈负相关(图4)。此外,TISIDB被用于检测核心基因和免疫调节剂之间相互作用关系。ESPL1和CCNB2均与趋化因子(CCL7、CCL18、CXCL10)及免疫调节剂的表达呈正相关,包括免疫刺激因子(PVR、ULBP1)及MHC分子(TAP1、TAP2)和免疫抑制因子(LAG3),详见图5~图7。
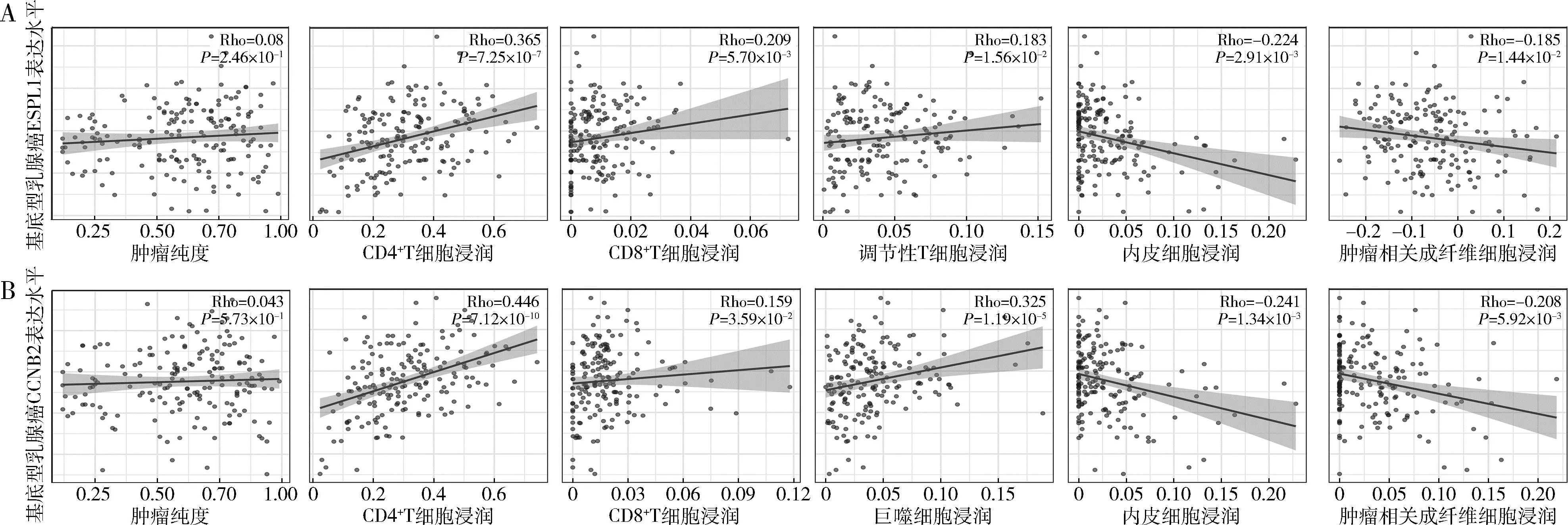
图4 两个核心基因表达水平与免疫细胞浸润关系
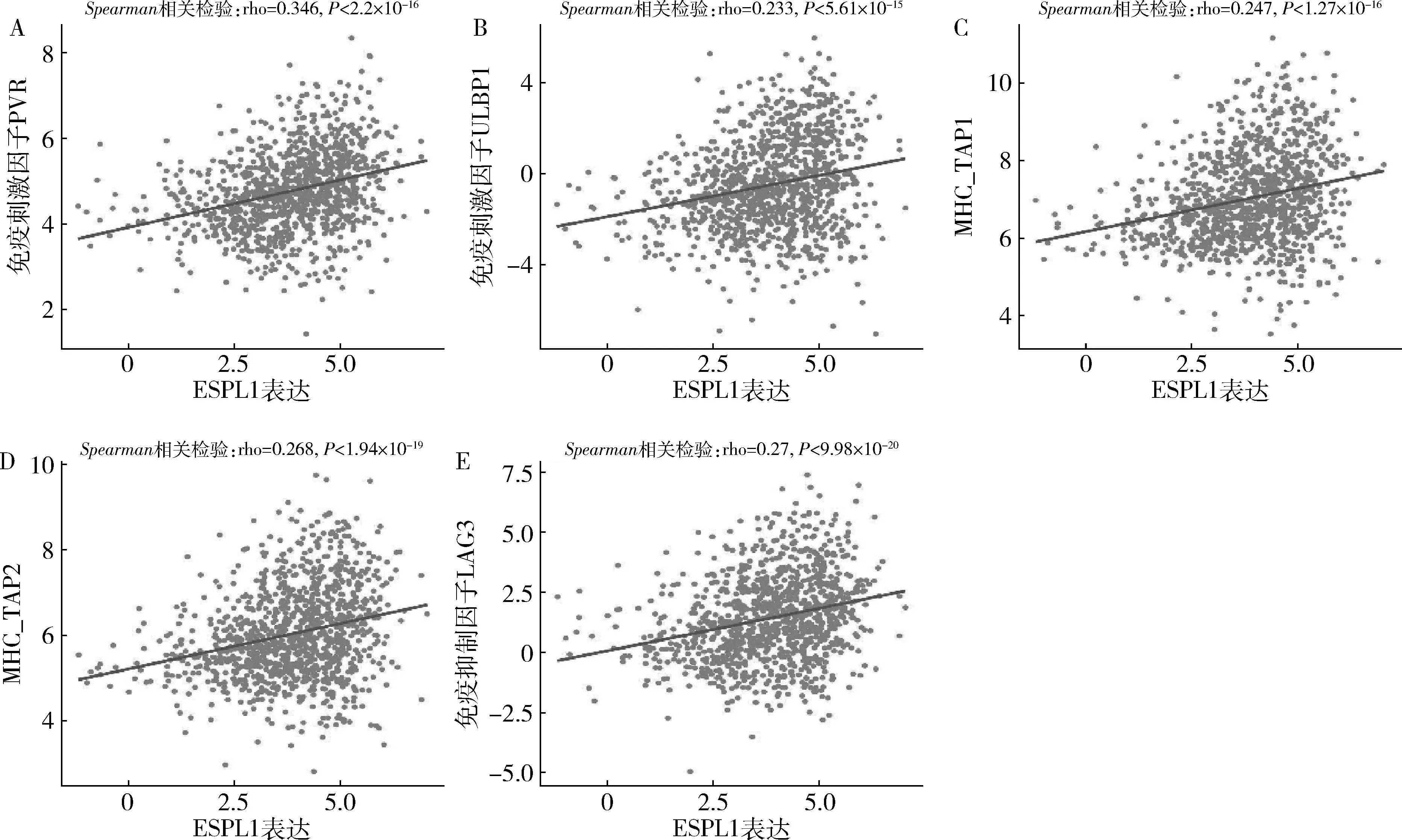
图6 乳腺癌中ESPL1的表达与免疫调节剂的关系
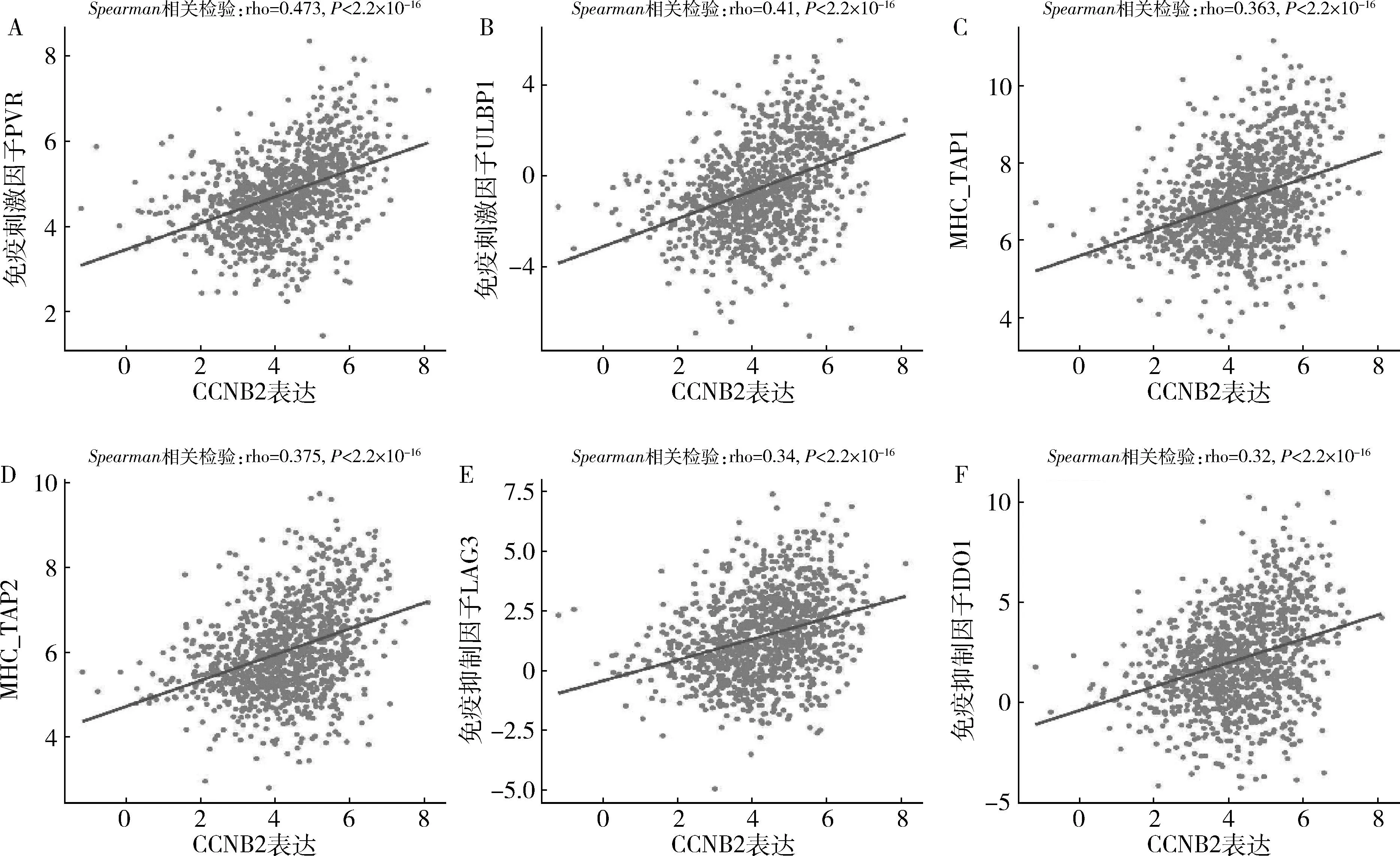
图7 乳腺癌中CCNB2的表达与免疫调节剂的关系
5.核心基因上游转录调控网络:最后,利用Cytoscape插件iRegulon构建了基于核心基因和上游TF的转录调控网络。共有56个TF参与了ESPL1和CCNB2的调节。值得注意的是,其中22个TF参与两者的共同调控。关注共同TF有助于理解BLBC进展中的激活表达模式(图8)。
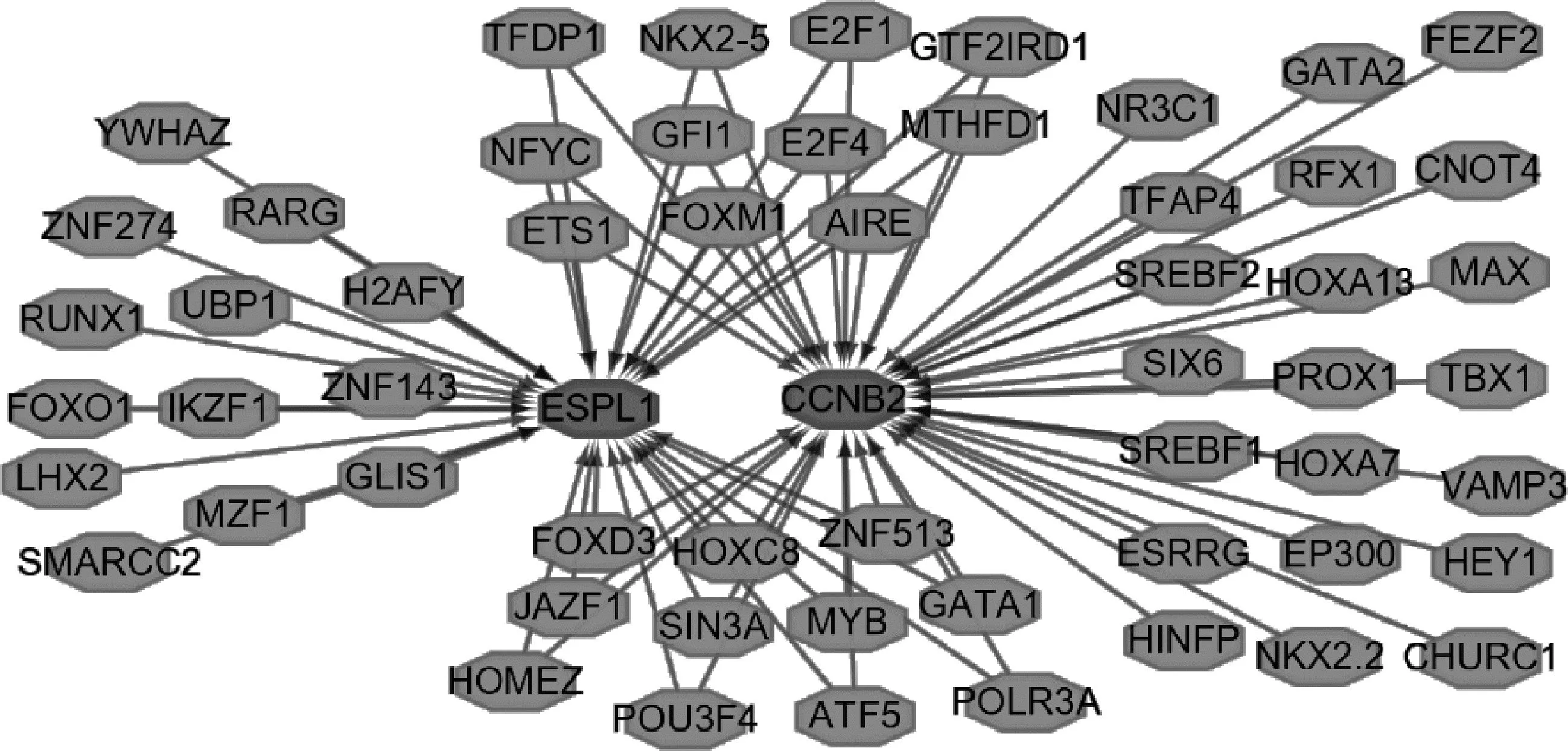
图8 上游转录因子与两个核心基因调控网络
讨 论
由于缺乏有效的治疗靶点,BLBC极易转移和复发,在所有亚型中预后最差[4, 5, 14]。目前BLBC的治疗主要包括手术和放化疗,迫切需要探索新的分子标志物和靶向药物[14]。因此,本研究应用WGCNA、TIMER及TISDB等在线网站证实ESPL1和CCNB2在BLBC中高表达且与预后密切相关,并初步探索了两者共同的潜在作用机制。
外纺锤体极体1(extra spindle poles-like 1, ESPL1)基因编码的分离酶可切割姐妹染色体间的粘连蛋白RAD21促进染色体分离,此外,分离酶还参与 DNA损伤修复和包膜运输过程[15,16]。ESPL1过表达导致基因突变和染色体错误分裂从而促使恶性肿瘤的发生[15,17]。近年来研究显示,ESPL1与胶质瘤、子宫内膜癌的预后相关[16,18]。分离酶抑制物Sepins可通过非竞争性的方式抑制分离酶活性以及癌细胞生长、细胞迁移和伤口愈合[19]。
细胞周期蛋白2(cyclins B2, CCNB2)通过调节细胞周期蛋白依赖性激酶CDC2的活性调节有丝分裂G2/M周期转变[20, 21]。CCNB2高表达与多种肿瘤的直径、淋巴结转移、远处转移及临床分期呈显著正相关[22]。此前研究证实,CCNB2过表达与多种恶性肿瘤的不良预后相关[23~25]。
有研究表明,细胞周期调控通路还与代谢重塑和免疫浸润有关。笔者的分析结果也提示两个核心基因表达与多种肿瘤免疫细胞浸润呈正相关,包括Th2细胞、CD8+T细胞、巨噬细胞和调节性T细胞。此外,两个核心基因转录表达水平均与趋化因子如CCL7、CCL10和CCL18呈正相关,其由肿瘤细胞分泌并将免疫细胞募集到肿瘤免疫微环境。免疫细胞成分很大程度上决定了微环境的炎性环境,并能调节肿瘤的进展。Th1/Th2比值升高提示着较好的预后,而Th2细胞升高与肿瘤转移与较高的病死率有关[26]。Th2细胞可分泌IL-4、IL-5和IL-13促进肿瘤的转移[27]。此外,Th2细胞还与肿瘤免疫逃逸相关[28]。相似的,调节性T细胞(regulatory cell,Treg)也可通过调节免疫监视并抑制抗肿瘤免疫反应促进肿瘤进展[27]。Treg水平升高与乳腺癌肿瘤患者疾病进展和生存期缩短有关[29]。总之,两个核心基因可能通过BLBC免疫细胞浸润过程调控肿瘤的进展及预后。
上游调控网络分析提示22种TF同时靶向调节两个核心基因,其中大多数TF在乳腺癌中高表达。这些上调的TF可能通过激活两个核心基因调控BLBC细胞周期及免疫反应。借助生物信息学,初步证实ESPL1和CCNB2是BLBC潜在预后和治疗靶点。同时,两个基因受共同的上游TF的调控并与BLBC患者免疫状态相关。
