秋水仙碱对心肌梗死后大鼠预后的影响
2024-02-27蒋学俊
陈 广 李 彬 文 英 蒋学俊
我国正面临人口老龄化和代谢危险因素持续流行的双重压力,心血管疾病负担仍在持续增加,心肌梗死(myocardial infarction, MI)是导致我国患者死亡的重要原因[1]。除了缺血和缺氧引起的心肌损伤,局部过度炎性反应会加重损伤,促进细胞凋亡和加速细胞外基质降解,导致心肌纤维化,负性心室重塑和心力衰竭[2]。鉴于炎症在MI中重要作用,MI的抗炎治疗正日益受研究者们关注。
作为经典抗炎药物,秋水仙碱是从秋水仙的球茎中提取的一种亲脂性三环生物碱,可以阻止有丝分裂纺锤体的形成,阻止微管聚合并抑制关键的炎症信号通路,如炎性小体、促炎性细胞因子以及黏附分子的表达,具有强大的抗炎作用[3]。近年来,随着临床试验COLCOT和LoDoCo2结果的陆续公布,揭示了秋水仙碱对于急性冠状动脉综合征及慢性冠状动脉疾病患者再发心血管事件的良好预防作用,激发了人们对于秋水仙碱在冠心病抗炎治疗中的研究热情[4,5]。然而由于秋水仙碱治疗窗窄,不良反应十分常见,超过20%的秋水仙碱使用者可能出现胃肠道反应,包括腹泻、呕吐和恶心,以及对肝肾功能的影响,严重限制了其临床上的使用[6,7]。因此,迫切需要寻找一种新的用药方法,在保证其对冠心病良好获益的同时提高患者的耐受性。
随着医学技术的迅速发展及精准医疗的提出,疾病诊疗新技术不断涌现。我国首例经导管心内膜注射水凝胶治疗慢性心力衰竭已于2022年取得圆满成功[8],使得心肌内注射技术进一步走近临床,为我们提供了一种能够减轻全身毒性不良反应的全新用药思路。然而目前秋水仙碱心肌内注射在MI的治疗中鲜有报道,故本实验通过比较秋水仙碱心肌内注射和常规口服用药在大鼠MI模型中的疗效及不良反应,探究秋水仙碱心肌内注射治疗MI的安全性及可行性。
材料与方法
1.实验动物的准备:研究中的所有动物程序均经武汉大学人民医院实验动物福利伦理审查委员会批准(伦理学审批号: WDRM 20211008)。动物使用过程严格按照北京大学制定的《动物保护与使用指南》执行。由武汉大学人民医院实验动物中心提供40只SPF级雄性Sprague Dawley(SD)大鼠,体质量为200±20g,动物合格证编号:00270753。在SPF环境中适应性饲养1周,给予标准饲料和饮水。
2.动物模型制备和干预流程:SD大鼠随机分为4组,即假手术组(Sham组,n=10)、MI+0.9%氯化钠溶液处理组(MI组,n=10)、MI+Col灌胃组(MI+Col/i.g组,n=10)和MI+Col心肌内注射组(MI+Col/i.m组,n=10)。大鼠术前12h禁食,称重后腹腔内注射1%戊巴比妥(40mg/kg),前胸部备皮消毒后,切开前颈部皮肤,钝性分离颈前肌肉暴露气管,气管插管后连接小动物呼吸机。切开胸前皮肤组织,暴露肋骨,断开心前肋骨,利用开胸器撑开胸壁,暴露大鼠心脏,结扎前降支。心前区迅速变白提示结扎成功。Sham组前降支只穿线不结扎。MI组及MI+Col/i.g组结扎冠脉后即刻在MI大鼠梗死周边3、6、9、12点钟方向分别注射15μl 0.9%氯化钠溶液。MI+Col/i.m组于同样的位置分别注射15μl秋水仙碱溶液(浓度为2mg/ml),依次缝合各层胸壁,待大鼠苏醒后撤去呼吸机。MI+Col/i.g组给予秋水仙碱[10μg/(kg·d)]灌胃,剩余3组给予等量0.9%氯化钠溶液灌胃治疗,术后观察4周,记录大鼠体质量变化及死亡情况。
3.超声心动图采集:MI后28天,每组随机抽取5只大鼠,戊巴比妥麻醉后将其固定于检测台上,于胸骨旁左心室短轴和胸骨旁左心室长轴切面观察,并以乳头肌水平进行M型超声心动图分析。取M型超声图像测量以下指标:射血分数(ejection fraction,EF,%)、短轴缩短率(fraction shortening,FS,%)、左心室收缩末期内径(left ventricular internal diameter at end-systole,LVIDs,cm)、左心室舒张末期内径(left ventricular internal diameter at end-diastole,LVIDd,cm)。
4.血清标本处理:心脏超声图像采集完毕后,采集大鼠颈静脉血,置于促凝管,室温放置30min后离心[3000r/min(离心半径:10cm)×15min],收集血清,冻存于-80℃。根据酶联免疫吸附测定试剂盒说明书,检测血清丙氨酸氨基转移酶(alanine amino transferase,ALT)、肌酐(creatinine,CREA)、IL-1β及肿瘤坏死因子-α(trmor necrosis facter,TNF-α)水平。
5.心肌病理学检查:完成上述操作后,腹腔注射过量戊巴比妥钠注射液安乐死处死大鼠,随后迅速开胸摘取心脏,4%多聚甲醛固定液固定后,梯度乙醇脱水,石蜡包埋,切片,Masson染色后拍照,使用Image Pro Plus 6.0软件测量分析,分别测量纤维化面积和心肌细胞面积,计算出纤维化及心肌细胞比率。
结 果
1.秋水仙碱治疗对MI后大鼠存活率的影响:大鼠MI术后,观察28天内生存情况,Sham组无死亡大鼠,MI组、MI+Col/i.g组、MI+Col/i.m组分别累计死亡了4、2、2只,3组之间比较差异无统计学意义,但较Sham组生存率明显下降(P<0.01,图1)。
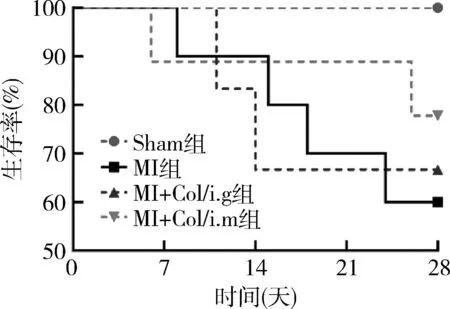
图1 各组大鼠生存率比较
2.秋水仙碱对MI大鼠心功能影响:术后第28天行超声心动图检查结果显示,与Sham组比较,MI组EF、FS显著降低(P<0.001),LVIDs、LVIDd显著升高(P<0.001),提示MI后28天大鼠心脏功能及结构收到严重损害。与MI组比较,MI+Col/i.g及MI+Col/i.m组EF、FS显著升高(P<0.001),MI+Col/i.g组LVIDs较之有所减低(P<0.05),MI+Col/i.m组LVIDs、LVIDd均较之明显减低(P<0.001、P<0.01),但MI+Col/i.g和MI+Col/i.m两组之间比较,EF、FS、LVIDs及LVIDd差异均无统计学意义(图2)。
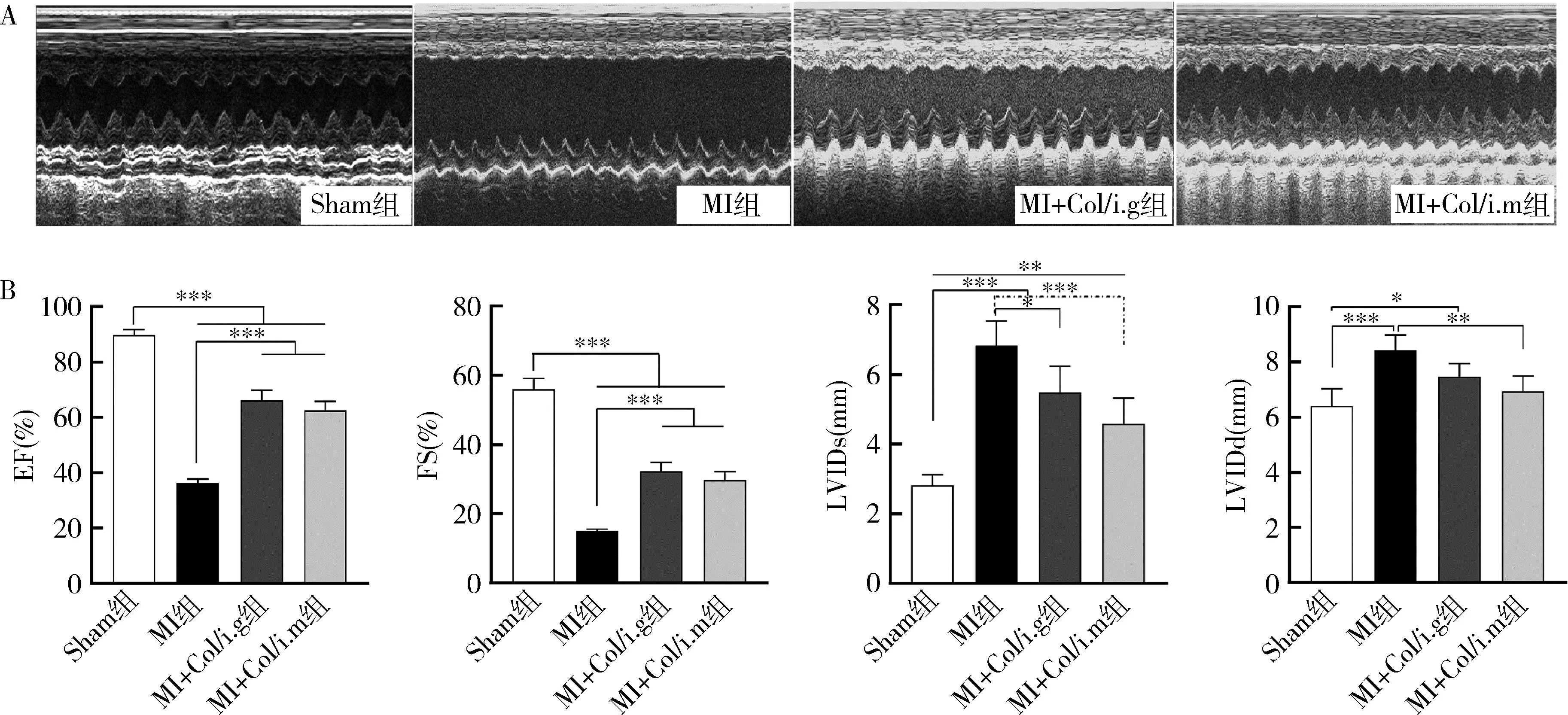
图2 各组大鼠超声心动图结果
3.秋水仙碱对MI大鼠体质量影响:记录大鼠28天体质量增长情况,4组大鼠在28天内体质量均持续增长,且体质量增长速率由大到小依次为Sham组、MI+Col/i.m组、MI组、MI+Col/i.g组。与Sham组比较,MI、MI+Col/i.g及MI+Col/i.m组体质量增长均显著降低(P<0.001);与MI组比较,MI+Col/i.m组体质量增长较快(P<0.05),而MI+Col/i.g组体质量增长较慢(P<0.01)。与MI+Col/i.g组比较,MI+Col/i.gm组体质量增长更快(P<0.001,图3)。
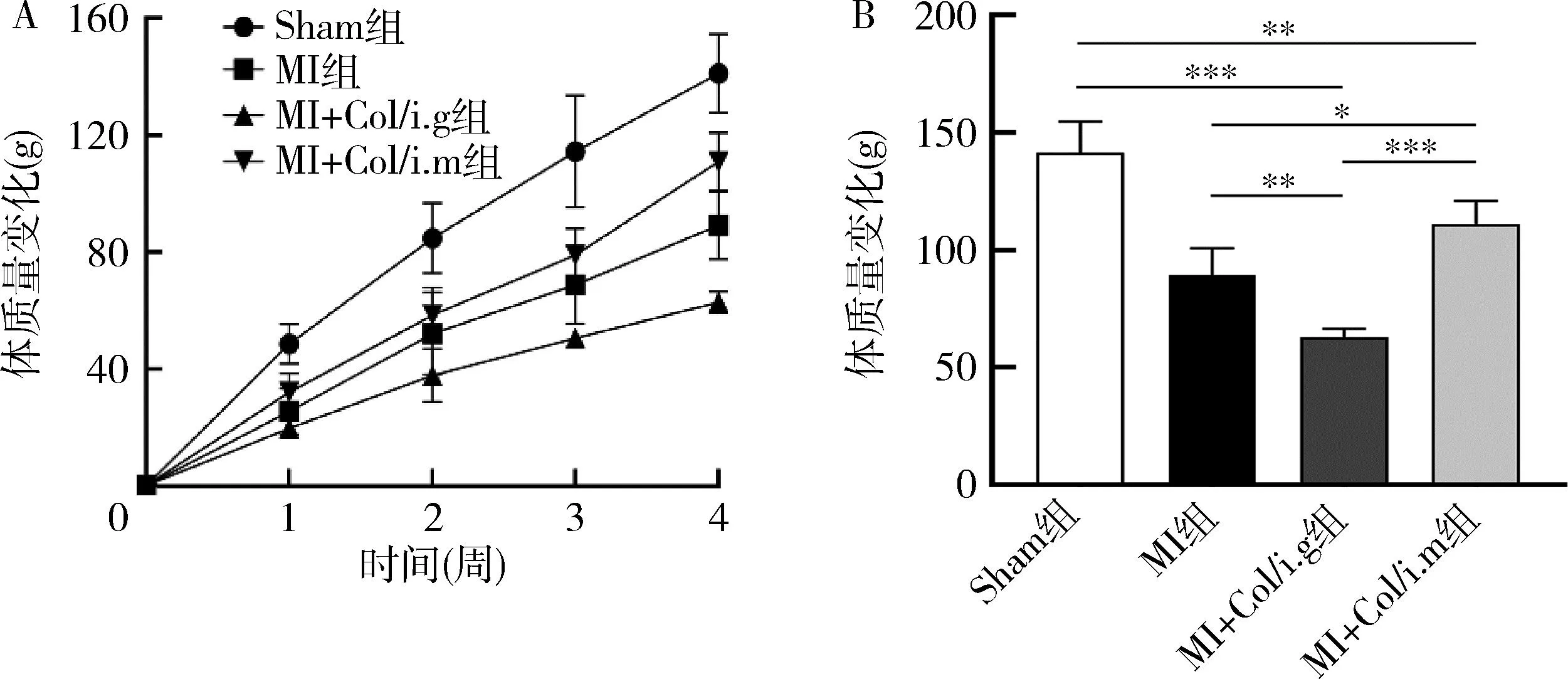
图3 MI后各组大鼠体质量变化
4.秋水仙碱对MI大鼠肝、肾功能影响:4组大鼠均未见明显肝功能受损,与Sham组比较, MI组、MI+Col/i.g及MI+Col/i.m组CREA均显著升高(P<0.05)。与MI组比较,MI+Col/i.g及MI+Col/i.m组CREA明显降低,但MI+Col/i.g和MI+Col/i.m组间CREA比较,差异无统计学意义(表1)。
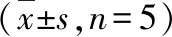
表1 各组大鼠肝、肾功能
5.秋水仙碱对MI大鼠血清炎症标志物影响:与Sham组比较,MI组、MI+Col/i.及MI+Col/i.m组IL-1β、TNF-α血清浓度均明显上升(P<0.05);与MI组比较,MI+Col/i.g及MI+Col/i.m组血清IL-1β、TNF-α浓度显著下降(P<0.05),但MI+Col/i.g和MI+Col/i.m组间比较,差异无统计学意义(表2)。
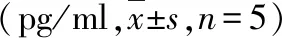
表2 各组大鼠血清炎症指标
6.秋水仙碱对MI大鼠心肌结构的影响:光学显微镜下阅片,大鼠心脏Masson染色Sham组室壁厚度正常,无明显室壁变薄及心肌纤维化现象,未见瘢痕组织形成;MI各组梗死壁厚度明显变薄,可见大量纤维瘢痕形成。高倍镜下可见,Sham组室壁心肌细胞结构完整,排列规则,细胞之间无明显胶原纤维沉积,无瘢痕形成。MI各组梗死区仅残存极少量心肌细胞,可见大量胶原纤维沉积。定量分析结果,MI+Col/i.g及MI+Col/i.m组心肌细胞存活数量较MI组显著增多(P<0.001),纤维化程度也较MI组明显减低(P<0.001,图4)。
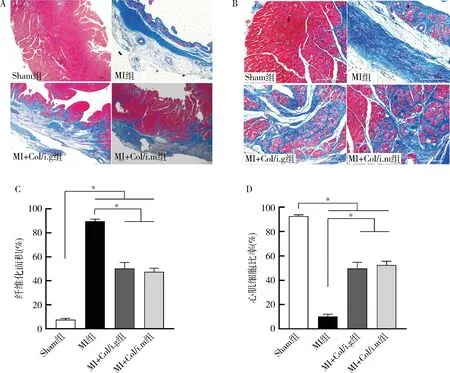
图4 秋水仙碱对MI大鼠心肌结构的影响
讨 论
秋水仙碱作为经典抗炎药物,是临床上治疗痛风的一线用药,近期的一系列研究揭示了其对于MI的心肌保护作用[9]。然而秋水仙碱口服用药存在治疗窗窄及不良反应大的问题,制约了其更好地临床应用。本研究中通过对大鼠急性心梗模型的实验研究,设计了秋水仙碱口服及心肌内局部注射两种治疗方式,发现MI组心肌梗死后28天内生存率明显下降,心功能显著恶化。口服及心肌内局部注射秋水仙碱抗炎治疗可降低大鼠血清炎性细胞因子水平,保护尚存心肌细胞,抑制梗死后纤维结缔组织增生,并显著改善大鼠心功能,对MI后28天生存率略有改善但差异无统计学意义。关于该实验中秋水仙碱引发的不良反应,MI+Col/i.g组表现出明显的体质量减低,考虑与秋水仙碱所导致的胃肠道反应(如腹泻)相关。相比之下,MI+Col/i.m组大鼠未出现腹泻情况,且体质量较MI组显著增加。与Sham组比较,实验组中肾功能的损害考虑心肾综合征所致,故本实验中未发现秋水仙素相关的肝肾功能恶化。目前关于秋水仙碱的临床研究大多将严重肾功能不全患者排除在外[10]。鉴于冠心病人群中肾功能不全患者常见,且秋水仙碱部分通过肾脏代谢,因此针对冠心病合并肾功能不全患者用药的安全性尤为重要。
作为古老抗炎药物,秋水仙碱主要通过抑制炎症小体、干扰中性粒细胞功能、干扰中性粒细胞-血小板相互作用3个方面起作用[11~13]。Toll样受体信号通路TLR4/NF-κB在缺血心肌中显著增强,于MI后的炎性反应中起着关键作用。当发生急性心梗时,TLR4受到刺激,导致NF-κB的活化,通过NLRP3、ASC和procaspase-1的寡聚化促进NLRP3炎症体的形成,NLRP3炎症体激活caspase-1,一方面导致IL-1β和IL-18等促炎性细胞因子的产生和分泌,另一方面诱发凋亡[14]。已有相关研究阐明秋水仙碱可以通过调节M1/M2巨噬细胞极化,抑制TLR4/NF-κB/NLRP3信号通路以及caspase-1蛋白,明显抑制MI后炎性反应[15,16]。
本实验中虽然通过心肌内注射秋水仙碱达到了改善MI后心功能的作用,同时减少了口服用药耐受性。然而尚有诸多不足之处,例如在研究药物不良反应时,没能对大鼠腹泻做量化统计分析。在对于秋水仙碱治疗MI作用机制的探讨暂引用目前已知的观点,未能进性更深入的研究。此外治疗效果上心肌内注射与灌胃治疗没有显著差异,考虑与缺乏有效的药物释放载体导致秋水仙碱在梗死周边区滞留时间过短相关。可注射水凝胶作为优良的药物释放载体,具有疏松多孔的三维结构以及良好的生物相容性,已在MI后心肌内注射的多个临床研究中展现出了优异的疗效[17,18]。未来将探究以可注射水凝胶为载体,通过心肌内注射的方式来达到秋水仙碱心肌局部缓慢释放的效果,实现更持久的抗炎疗效;同时将进一步探索秋水仙碱MI局部应用最适剂量,实现疗效与不良反应之间的最佳平衡。
综上所述,秋水仙碱用于MI的抗炎治疗安全可行,能明显缓解MI后的炎性反应,抑制心肌纤维化,改善心室重构,显著缓解心功能的恶化,且心肌内注射能有效提升对药物耐受性。作为冠心病治疗的新兴研究方向,目前关于秋水仙碱治疗冠心病的研究已取得诸多进展。鉴于低剂量秋水仙碱可广泛降低冠心病患者主要心血管不良事件风险[9]。2021年欧洲心脏学会指南建议将秋水仙碱用于心血管疾病的二级预防[19]。因此,秋水仙碱对于冠心病的治疗具有良好的应用前景,本实验为进一步研究MI抗炎治疗提供了可行的理论依据。
