4种不同来源花青素的稳定性及抗氧化性比较
2024-02-26马孟佳赵娟陈鹏飞陈祥贵黄玉坤
马孟佳,赵娟,陈鹏飞,陈祥贵,3,黄玉坤,3*
(1.西华大学食品与生物工程学院,食品微生物四川省重点实验室,四川成都 610039;2.四川合泰新光生物科技有限公司,四川成都 610000;3.川渝共建特色食品重庆市重点实验室,四川成都 610039)
花青素广泛存在于植物的果实、叶、种子,是一种天然着色剂,赋予植物从红橙色到蓝紫色的颜色呈现[1]。其在自然界中不稳定,所以通常以糖苷键与糖结合形成花色苷而存在[2]。常见植物中的花青素有天竺葵素、矢车菊素、飞燕草色素、芍药色素、牵牛色素和锦葵色素6 种[3]。研究表明,花青素具有多种生理活性,包括抗氧化、抑制肿瘤细胞、抑菌、调节肠道微生物等[4],其中抗氧化功能最为显著,这得益于其优异的自由基清除能力。
蓝莓中含有丰富的花青素且功能活性显著[5],被广泛应用于保健品行业。紫薯因其价格低廉,在活性色素提取中应用广泛,是天然花青素色素的重要来源[6]。此外,紫甘蓝和黑豆也是常见的富含花青素的食品原料,研究发现黑豆的花青素浓度和抗氧化能力高于其他豆类(平豆、红豆、海军豆和大北方豆)[7]。尽管花青素有较好功能特性,但由于分离出来的花青素高度不稳定,在各种环境因素下会变得非常敏感而使其降解,限制了其在食品中的应用[8]。并且已有研究主要对单一原料花青素的功能性质进行探讨,鲜见对不同原料花青素稳定性及抗氧化性进行比较。因此将上述4 种原料花青素的含量、稳定性、抗氧化性进行比较对不同原料花青素在工业上的应用有重要意义。
本文研究光照、pH 值、温度、金属离子、氧化剂、还原剂、葡萄糖、蛋白质对花青素的影响并比较4 种原料花青素的稳定性,探究4 种原料花青素对羟自由基、DPPH 自由基、ABTS+自由基清除率及总还原能力,以期为不同原料的加工利用和花青素的研究提供参考。
1 材料与方法
1.1 材料与试剂
蓝莓、紫薯、紫甘蓝、黑豆、纯牛奶:市售;盐酸、氢氧化钠、葡萄糖(一水)、过氧化氢、无水亚硫酸钠、氯化钙、氯化钾、硝酸铝、乙酸钠、三氯化铁(Ⅲ)六水合物、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazide,DPPH)、抗坏血酸、铁氰化钾、过硫酸钾:上海阿拉丁生化科技股份有限公司;五水硫酸铜:成都市科隆化学品有限公司;2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS]:生工生物工程(上海)股份有限公司;硫酸亚铁:天津市致远化学试剂有限公司。所用试剂均为分析纯。
1.2 仪器与设备
集热式恒温加热磁力搅拌器(DF-101S):郑州长城科工贸有限公司;超声波细胞粉碎机(SCIENTZ-ⅡD):宁波新芝生物科技有限公司;紫外可见分光光度计(UV-1900):成都艾普瑞实验设备有限公司;多功能酶标仪(SpectraMax i3x):美谷分子仪器(上海)有限公司;旋转蒸发仪(IKA-RV10):艾卡(广州)仪器设备有限公司;显数式pH 计(PHS-320):成都世纪方舟科技有限公司。
1.3 方法
1.3.1 样品制备
紫薯、紫甘蓝、黑豆在避光条件下烘干(50 ℃)、经粉碎机粉碎得到干粉状原料。在60 ℃黑暗条件下按料液比1∶20(g/mL)用浸提剂[(1%柠檬酸水溶液∶无水乙醇=1∶1(体积比)]浸提10 min 后,采用开2 s、关2 s方式多次超声(15 min,100 Hz,60 ℃)。蓝莓经清洗、研磨,在40 ℃按料液比1∶15(g/mL)用浸提剂[60% 乙醇(pH3)]浸提120 min。每种原料浸提液在60 r/min、50 ℃条件下旋转蒸发浓缩45 min 得到花青素浓缩液,所有样品避光保存备用。使用前将浓缩液进行稀释(1%,pH2)。
1.3.2 pH 示差法测定花青素含量
取1 mL 样品,分别用pH 值为1.0 和4.5 的缓冲溶液定容至10 mL,用去离子水作空白对照,分别在520、700 nm 处测吸光值(A)[9]。花青素含量按下列公式计算。
A=(A520-A700)pH1.0-(A520-A700)pH4.5
X=(A×Mw×DF)× 1 000/ε× 1
式中:A为花青素的吸光值;(A520-A700)pH1.0为pH1.0的缓冲溶液中花青素在520 nm 与700 nm 处吸光值的差值:(A520-A700)pH4.5为pH4.5 的缓冲溶液中花青素在520 nm 与700 nm 处吸光值的差值;X为花青素含量,mg/L;MW= 449.2 g/mol(以矢车菊素葡萄糖苷计);ε=26 900 L/(mol·cm);DF为样品的稀释倍数。
1.3.3 花青素稳定性比较
1.3.3.1 色素保存率测定
以色素保存率为指标评价花青素稳定性,按如下公式计算色素保存率。
Y=A1× 100/A0
式中:Y为色素保存率,%;A1为花青素保存后吸光值;A0为花青素保存前吸光值。
1.3.3.2 光照对花青素稳定性的影响
取40 mL 样品测其吸光值,在室温条件下分别放置于室外日光、室内自然光及暗柜,每24 h 测1 次吸光值,持续7 d。
1.3.3.3 pH 值对花青素稳定性的影响
分别取40 mL 样品,调整pH 值为2、4、6、8、10 并立即测定其吸光值。然后在室温避光条件每24 h 再次进行扫谱,持续7 d。
1.3.3.4 温度对花青素稳定性的影响
取40 mL 样品测其吸光值,分别于4、25、37、50、70 ℃下避光保温,每12 h 测1 次吸光值,持续2 d。
1.3.3.5 金属离子对花青素稳定性的影响
取40 mL 样品测其吸光值,分别加入2.5 mL 浓度为0.1 mol/L 的氯化钾、硫酸镁、五水硫酸铜、氯化钙、硝酸铝、三氯化铁(Ⅲ)六水合物的金属离子溶液于室温下避光条件下放置,每24 h 测1 次吸光值,持续7 d。
1.3.3.6 氧化剂及还原剂对花青素稳定性影响
取30 mL 样品,加入质量浓度分别为0.2、0.4、0.6、0.8、1.0 g/L 的H2O2溶液配成最终质量浓度为0.03 g/L的混合溶液;加入质量浓度分别为2、4、6、8、10 g/mL的Na2SO3溶液配成最终质量浓度为0.1 g/L 的混合溶液。立即测定吸光值并于室温避光条件下放置,每24 h 测1 次吸光值,持续7 d。
1.3.3.7 葡萄糖对花青素稳定性影响
取30 mL 样品,分别加入质量浓度为2、4、6、8、10 g/mL 的葡萄糖溶液配成最终质量浓度为0.1 g/L 的混合溶液。立即测定吸光值并于室温避光条件下放置,每24 h 测1 次吸光值,持续7 d。
1.3.3.8 蛋白质对花青素稳定性影响
取40 mL 样品测其吸光值,分别加入0.4、0.8、1.2、1.6、2.0 mL 的乳清蛋白溶液并于室温避光条件下放置,每24 h 测1 次吸光值,持续7 d。
1.3.4 花青素抗氧化性比较
1.3.4.1 羟自由基清除率的测定
取50 μL 样品于96 微孔板中,加入0.07 mL H2O2(6.0 mmol/L)、0.1 mL FeSO4溶液(1.5 mmol/L)、0.03 mL水杨酸溶液(20 mmol/L),混合均匀后恒温处理1 h(37 ℃),在510 nm 处测定吸光值,按如下公式计算羟自由基清除率[10-11],以VC为阳性对照。
Z=[(A0-AS)/A0]× 100
式中:Z为羟自由基清除率,%;AS为样品的吸光值;A0为空白组(去离子水代替样品)的吸光值。
1.3.4.2 DPPH 自由基清除率的测定
取2 mL 浓度为0.01 g/L 的样品,加入2 mL DPPH溶液(0.008 g 的DPPH 固体用无水乙醇溶解并定容至100 mL 容量瓶)振荡混合,30 min 后在517 nm 处测定吸光值。以VC为阳性对照。第2 组用无水乙醇代替DPPH 的醇溶液,其他操作一致。第3 组用去离子水代替样品,其他操作一致[9]。按如下公式计算DPPH自由基清除率。
P=[1 -(Ai-Aj)/Ac]× 100
式中:P为DPPH 自由基清除率,%;Ai为样品与DPPH 溶液混合后的吸光值;Aj为样品与溶剂混合后的吸光值;Ac为DPPH 溶液与溶剂混合后的吸光值。
1.3.4.3 ABTS+自由基清除率的测定
用去离子水配制7 mmol/L 的ABTS 与2.45 mmol/L的过硫酸钾的混合溶液,在23 ℃避光存放12~16 h 后得到ABTS+自由基基础液体。取3.9 mL ABTS 工作液加入5 mL 样品,放置6 min,测定在734 nm 处的吸光值[9]。以VC为阳性对照。去离子水做空白对照。
H=(1 -A1/A2)× 100
式中:H为ABTS+自由基清除率,%;A1为试验组吸光值;A2为空白组吸光值。
1.3.4.4 总还原能力测定
取样品、铁氰化钾溶液(质量分数1%)、磷酸缓冲液(0.2 mol/L,pH6.6)各2.5 mL 混匀,放置在50 ℃水浴锅中20 min,冷却后加入2.5 mL 三氯乙酸溶液(质量分数10%)振荡混合后,3 000 r/min 离心10 min,取2.5 mL 上清液,加入2.5 mL 去离子水和0.5 mL 三氯化铁溶液(质量分数0.1%),混匀,测700 nm 处的吸光值[9]。
1.4 数据处理
试验数据用平均值±标准差表示,利用Excel 和SPSS 进行数据统计分析,使用Origin 2021 软件作图。
2 结果与分析
2.1 4 种原料花青素的含量
利用pH 示差法测得蓝莓、紫薯、紫甘蓝、黑豆4种原料花青素的总含量见图1。

图1 蓝莓、紫薯、紫甘蓝、黑豆花青素的总含量Fig.1 Total content of anthocyanins in blueberry,purple sweet potato,purple cabbage,and black bean
由图1 可知,蓝莓、紫薯的花青素总含量相差不大,从大到小依次为紫甘蓝>紫薯>蓝莓。黑豆花青素总含量最少,为177.34 mg/L。
2.2 4 种原料花青素稳定性的比较
2.2.1 光照对花青素稳定性的影响
光照对4 种原料花青素稳定性的影响见图2。

图2 光照对蓝莓、紫薯、紫甘蓝、黑豆花青素稳定性的影响Fig.2 Effects of light on the stability of anthocyanins from blueberry,purple sweet potato,purple cabbage,and black bean
由图2 可知,色素保存率随储存时间的延长逐渐降低,黑暗条件下花青素降解速率最小,其次是室内,室外降解速率最大,可能是花青素暴露在阳光下发生了光降解作用,导致酰基脱落,使花青素的稳定性下降[12-13]。紫甘蓝花青素的色素保存率最高,第7 天(黑暗条件)为80.82%,而蓝莓花青素对光照较为敏感,不稳定性较强[10],仅有65.97%。不同光照下4 种原料花青素稳定性从大到小依次为紫甘蓝>黑豆>紫薯>蓝莓。
2.2.2 pH 值对花青素稳定性的影响
pH 值对4 种原料花青素稳定性的影响见图3。

图3 pH 值对蓝莓、紫薯、紫甘蓝、黑豆花青素稳定性的影响Fig.3 Effects of pH on the stability of anthocyanins from blueberry,purple sweet potato,purple cabbage,and black bean
由图3 可知,在pH 值为2、4 时,4 种原料的色素保存率变化不明显,而pH 值为6、8、10 时发生明显的降低,说明pH 值对花青素稳定性影响较大,pH 值为2 时花青素最稳定,花青素在不同pH 值条件下产生4种不同的化学形式,并且它们之间是可逆转变的[14]。蓝莓的色素保存率变化最小,可能是因为蓝莓中含有多种类型的花青素,可以通过糖基化增强其在不同pH值溶液中的稳定性。不同pH 值下4 种原料花青素稳定性从大到小依次为蓝莓>紫甘蓝>黑豆>紫薯。
2.2.3 温度对花青素稳定性的影响
温度对4 种原料花青素稳定性的影响见图4。

图4 温度对蓝莓、紫薯、紫甘蓝、黑豆花青素稳定性的影响Fig.4 Effects of temperature on the stability of anthocyanins from blueberry,purple sweet potato,purple cabbage,and black bean
由图4 可知,温度越高,花青素降解越快,这是因为在高温条件下,花青素可能会经历去糖基化、水亲核攻击、裂解和聚合等一系列反应而加快其降解[15]。48 h 时,色素保存率在4 ℃时高达88.41%~90.78%,而在70 ℃仅有38.74%~56.48%。温度对紫甘蓝花青素稳定性的影响最小,紫薯次之,黑豆和蓝莓花青素稳定性较差。
2.2.4 金属离子对花青素稳定性的影响
金属离子对4 种原料花青素稳定性的影响见图5。

图5 金属离子对蓝莓、紫薯、紫甘蓝、黑豆花青素稳定性的影响Fig.5 Effects of metal ions on the stability of anthocyanins from blueberry,purple sweet potato,purple cabbage,and black bean
由图5 可知,不同的金属离子对不同原料花青素稳定性影响均不同。蓝莓花青素在2~5 d 色素保存率达到高峰,5 d 后恢复稳定,其中Mg2+、Cu2+、Ca2+在2~5 d 提高蓝莓花青素的稳定性,5 d 后破坏其稳定性;K+破坏其稳定性;Al3+提高其稳定性;而加入Fe3+虽然吸光值升高,但溶液产生沉淀,所以Fe3+破坏蓝莓花青素的稳定性。紫薯花青素比蓝莓花青素稍稳定,其中K+在2~5 d 提高紫薯花青素的稳定性,5 d 后破坏其稳定性;Mg2+、Cu2+、Ca2+、Al3+提高其稳定性;加入Fe3+后溶液产生沉淀,破坏花青素的稳定性。K+、Mg2+、Ca2+、Al3+在1~5 d 提高紫甘蓝花青素的稳定性,5 d 后破坏其稳定性;Cu2+在1~3 d 对紫甘蓝花青素的稳定性影响不大,3 d 后破坏其稳定性;Fe3+破坏其稳定性,结束时色素保存率仅为45.3%。加入Fe3+后溶液产生沉淀,破坏黑豆花青素的稳定性;在其它金属离子的影响下,黑豆的色素保存率都呈缓慢下降的趋势,所以金属离子破坏黑豆花青素的稳定性。此结果和其他学者研究金属离子对蓝莓、紫薯花青素稳定性的影响基本一致(Mg2+、Cu2+的影响结果不一致,这可能是因为加入金属离子的浓度的不同而对花青素的影响也不同)[6,16]。研究报道金属离子提高花青素稳定性的机制可能是两者发生络合作用,其中花青素分子可以通过与金属离子的空轨道进行电荷转移,作为质子供体而与金属离子相互作用[3,17-18]。综上,紫甘蓝花青素在金属离子的影响下最稳定。
2.2.5 氧化剂对花青素稳定性的影响
氧化剂对4 种原料花青素稳定性的影响见图6。


图6 氧化剂对蓝莓、紫薯、紫甘蓝、黑豆花青素稳定性的影响Fig.6 Effects of oxidants on the stability of anthocyanins from blueberry,purple sweet potato,purple cabbage,and black bean
由图6 可知,随着H2O2浓度的递增,花青素的色素保存率下降更快,说明氧化剂加快花青素的降解,并且浓度越高对稳定性的影响越大。花青素的高度不饱和结构使其对氧化剂颇为敏感,并且H2O2可能会转化为其他活性氧(如羟自由基)引发脂质过氧化,对DNA造成损伤[19-20],从而影响花青素的稳定性及抗氧化性。不同氧化剂(H2O2)浓度下4 种原料花青素稳定性从大到小依次为紫薯>黑豆>紫甘蓝>蓝莓。
2.2.6 还原剂对花青素稳定性的影响
还原剂对4 种原料花青素稳定性的影响见图7。
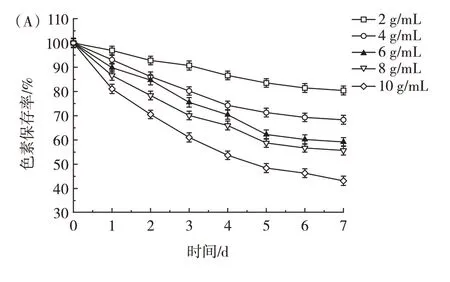
图7 还原剂对蓝莓、紫薯、紫甘蓝、黑豆花青素稳定性的影响Fig.7 Effects of reductants on the stability of anthocyanins from blueberry,purple sweet potato,purple cabbage,and black bean
由图7 可知,还原剂(Na2SO3)浓度越大,色素保存率越低,其原因可能是花青素碳骨架的C4 位与水合SO2发生加成反应而褪色[19,21],Na2SO3浓度越大,这种作用越强烈。蓝莓在不同浓度还原剂下的色素保存率差距较大,第7 天为43.16%~80.41%,说明蓝莓花青素对还原剂的浓度变化较敏感。相反,黑豆在不同浓度还原剂的条件下色素保存率较接近,第7 天为45.67%~53.15%。紫薯稳定性最强,这可能与它的花青素主要以酰基化形式存在有关。不同还原剂(Na2SO3)浓度下4 种原料花青素稳定性从大到小依次为紫薯>蓝莓>黑豆>紫甘蓝。
2.2.7 葡萄糖对花青素稳定性的影响
葡萄糖对4 种原料花青素稳定性的影响见图8。
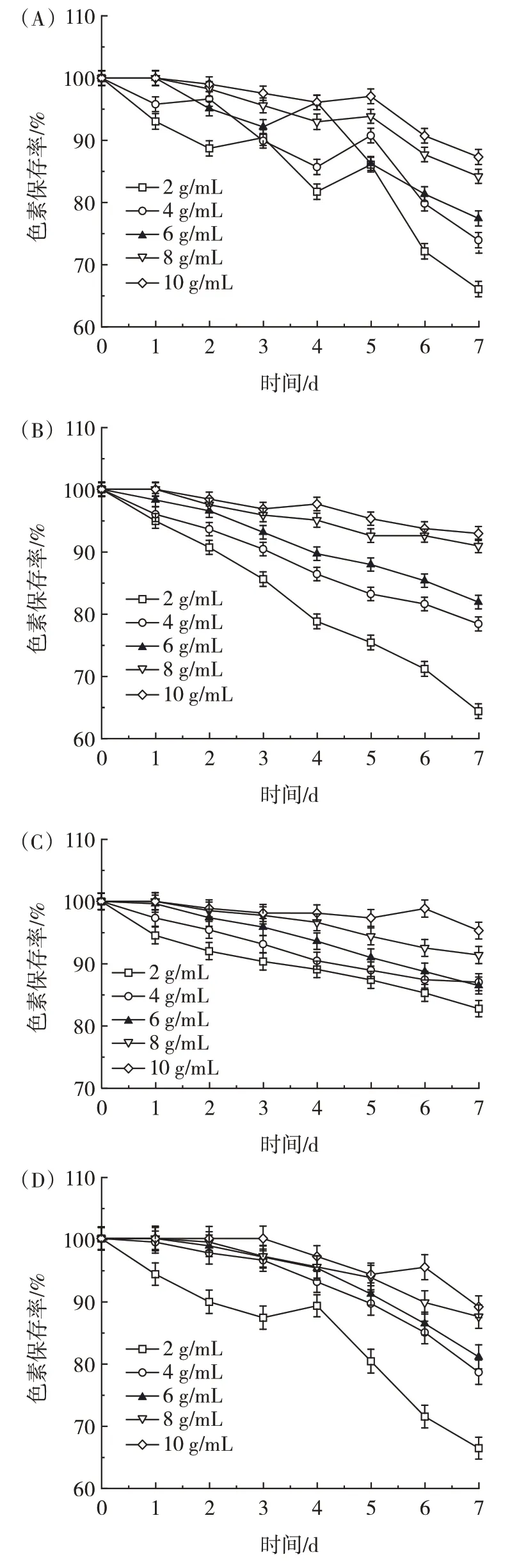
图8 葡萄糖对蓝莓、紫薯、紫甘蓝、黑豆花青素稳定性的影响Fig.8 Effects of glucose on the stability of anthocyanins from blueberry,purple sweet potato,purple cabbage,and black bean
由图8 可知,葡萄糖溶液浓度越高,色素保存率降低得越慢。第7 天(葡萄糖溶液浓度为10 g/mL)时花青素保存较完好,蓝莓、紫薯、紫甘蓝和黑豆花青素的色素保存率分别为87.32%、92.91%、95.28%、89.08%,说明高浓度的葡萄糖有利于提高花青素的稳定性,这可能是因为花青素与葡萄糖发生共色素沉着,或者通过与葡萄糖的糖基化而提高花色苷的稳定性[22]。葡萄糖也可通过破坏花青素与多酚聚合物的聚合,达到增强花青素稳定性的作用[16]。不同浓度的葡萄糖溶液下4 种原料花青素稳定性从大到小依次为紫甘蓝>紫薯>黑豆>蓝莓。
2.2.8 蛋白质对花青素稳定性的影响
蛋白质对4 种原料花青素稳定性的影响见图9。


图9 乳清蛋白对蓝莓、紫薯、紫甘蓝、黑豆花青素稳定性的影响Fig.9 Effects of whey protein on the stability of anthocyanins from blueberry,purple sweet potato,purple cabbage,and black bean
由图9 可知,加入乳清蛋白可以提高花青素的稳定性,此结果与已有研究结果一致[23],这是因为花青素可以通过氢键与乳清蛋白形成络合物,从而增强其稳定性[24]。但是随着加入乳清蛋白体积的增大,不同原料花青素的色素保存率变化趋势有较大的不同。其中紫薯、紫甘蓝随着时间的延长色素保存率波动较小;蓝莓花青素在2 d 内变化较小,2 d 后色素保存率急剧增大,与乳清蛋白体积没有明显关联;而黑豆的色素保存率先急剧增加,在1 d 后波动幅度减小。
2.3 4 种原料花青素抗氧化性的比较
4 种原料花青素抗氧化性比较见图10。

图10 4 种原料的抗氧化性比较Fig.10 Comparison of antioxidant activities of anthocyanins from four sources
花青素可以通过氢原子转移和单电子转移两种一般机制对活性氧表现出直接的抗氧化活性,通过向自由基提供质子和电子,将其转化为更稳定的产物[25]。由图10 可知,VC对自由基的清除效果最好。4 种原料花青素的羟自由基清除率、DPPH 自由基清除率、ABTS+自由基清除率及总还原能力排序为蓝莓>紫甘蓝>紫薯>黑豆。通常情况下,吡喃环周围的自由羟基数量(羟基数量越多=抗氧化能力越强)、羟基的相对位置、化合物的基本结构取向、环结构的共轭都是决定花青素抗氧化能力的重要因素[26],不同原料花青素的抗氧化活性不同可能与其含有的花青素种类有关。
3 结论
本研究比较蓝莓、紫薯、紫甘蓝、黑豆花青素的含量、稳定性和抗氧化能力。研究结果表明,4 种原料花青素含量排序为紫甘蓝>紫薯>蓝莓>黑豆。光照、pH值、温度、氧化剂对花青素稳定性的影响较大;还原剂对花青素稳定性的影响较小;金属离子对花青素稳定性的影响较复杂;糖和蛋白质有利于花青素的保留,提高花青素的稳定性。4 种食品原料中,紫甘蓝花青素在不同光照、温度、金属离子、葡萄糖、蛋白质条件下稳定性最好;蓝莓在不同pH 值条件下稳定性最好;紫薯在氧化剂和还原剂存在下稳定性最好;而黑豆花青素的稳定性无论在任何条件下都处于较中水平。综上所述,花青素含量最高和稳定性最佳的食品原料是紫甘蓝,抗氧化性最强的食品原料是蓝莓。这些数据能为不同原料花青素的研究以及对最佳加工方式和储存条件提供参考,以便提高在工业上的应用。
