电针对脑缺血大鼠前扣带皮质HMGB1和p-JNK蛋白表达的影响*
2024-02-26聂泽银李晨妤陈家乐缪化春
聂泽银,李晨妤,陈家乐,缪化春,吴 锋
(皖南医学院人体解剖学教研室,安徽芜湖 241002)
前扣带皮质是指大脑扣带回前半部分的皮质区域,易受到创伤性脑损伤、神经退行性疾病等的影响[1-2]。脑卒中是当今全球第二大死亡原因,发病原因主要是由于脑血管被血栓或栓子堵塞,其中缺血性脑卒中比脑实质或蛛网膜下腔出血引起的出血性脑卒中更为常见[3]。目前,有关缺血性脑卒中对前扣带皮质区域影响的报道甚少。电针现已广泛运用到临床以改善脑卒中患者的神经功能和生活质量。“百会”穴(GV20)和“足三里”穴(ST36)是电针治疗脑缺血常选的2个穴位,可以改善认知、感觉和运动等神经功能障碍[4-5]。既往研究表明,电针对于缺血性脑卒中的治疗具有确切疗效,但其具体机制尚不完全清楚。高迁移率族蛋白1(high-mobility group box 1,HMGB1)是一种非组蛋白DNA结合核蛋白,参与核小体的稳定和基因转录,当从组织的坏死细胞释放至胞外可加速炎症的级联反应,从而加快疾病的进展[6]。磷酸化的c-Jun氨基酸末端激酶(phosphorylated c-Jun N-terminal kinase,p-JNK)是HMGB1的下游通路,不仅参与凋亡途径,也参与细胞的调节机制[7]。本研究通过检测前扣带皮质组织形态学变化及HMGB1和p-JNK蛋白的表达情况,旨在从调控HMGB1和p-JNK的角度探讨电针对脑缺血大鼠前扣带皮质的神经保护作用及可能的潜在机制。
1 材料与方法
1.1实验动物及分组 成年雄性SD大鼠24只,体质量(230±20)g,购自南京青龙山动物实验中心,许可证号:SCXK(浙)2019-0002,随机分为假手术组、模型组、电针组和假电针组,6只/组。所有动物实验程序均符合皖南医学院实验动物福利与伦理委员会的指导原则。
1.2主要仪器及试剂 拴线(北京西浓科技有限公司),电针仪(苏州医疗用品厂有限公司),石蜡切片机(德国Leica公司),Nissl染色液(Leagene生物技术有限公司),HMGB1一抗(Abcam公司),p-JNK一抗(Cell Signaling Technology公司)。
1.3模型制备及筛选 参照Longa等[8]的方法制备永久性脑缺血大鼠模型,大鼠术前12 h常规禁食但不禁水,经腹腔注射戊巴比妥钠(30 mg/kg)麻醉,常规消毒后,依次进行颈正中切口及分离右侧颈总动脉、颈外动脉和颈内动脉,分离过程中注意避免损伤迷走神经。在颈外动脉上剪一小口,使拴线由颈外动脉进入颈内动脉,固定好拴线后缝合切口,手术过程中保持大鼠体温在37 ℃。假手术组仅分离出右侧颈总动脉、颈外动脉和颈内动脉,不插入栓线。参照Longa评分标准,对大鼠术后2 h进行神经功能缺损评分。评分细则为∶0分∶无神经功能缺损症状;1分∶对侧前爪不能完全伸直;2分∶行走时向对侧转圈;3分∶行走时向对侧倾倒;4分∶不能自发行走,并伴有不同程度的意识障碍。大鼠评分1~3分视为造模成功,纳入本次实验。
1.4干预方法 电针治疗过程使用一次性无菌针灸针,电针组选取“百会”穴(顶骨正中,向后斜刺2 mm)和左侧“足三里”穴(膝关节下方,腓骨小头下约5 mm处,直刺7 mm),连接电针仪,频率为2 Hz/10 Hz的疏密波,电流为1 mA,电针持续时间为30 min,1次/d,持续14 d。假电针组仅刺入“百会”、左侧“足三里”穴皮下,接电针仪但不通电[9]。另在第1、3、7、14天对各组大鼠进行Longa评分,以评估电针刺激后神经缺损功能有无恢复。
1.5Nissl染色 采用Nissl染色观察各组大鼠前扣带皮质区的神经元密度。在干预实验结束后,各组大鼠麻醉后用4%多聚甲醛灌注,取脑后固定,石蜡包埋,切片,片厚5 μm。切片经二甲苯和梯度酒精脱蜡后用Nissl染色试剂盒染色,先入Cresyl Violet Stain中,在56 ℃恒温箱中浸染1 h,双蒸水冲洗后入Nissl Differentiation分化30 s,中性树胶封片,400倍镜下拍片后用Image J软件统计分析神经元的数量。
1.6免疫组织化学染色 切片脱蜡后滴加1% Triton X-100以增加细胞膜的渗透性。滴加3%过氧化氢浸泡30 min,枸橼酸缓冲液修复。加入5%牛血清蛋白溶液封闭2 h,滴加HMGB1(1∶200),p-JNK(1∶100),4 ℃过夜。次日复温后滴加二抗,孵育30 min,DAB显色,二甲苯透明,中性树胶封片。400倍镜下拍照后,采用Image J软件测定HMGB1和p-JNK免疫反应阳性细胞的数量。
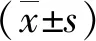
2 结果
2.1各组大鼠神经功能缺损评分结果 假手术组大鼠无神经功能缺损症状,模型组与假电针组大鼠在术后的2 h、1 d、3 d、7 d和14 d的神经功能缺损评分均高于假手术组(P<0.01),假电针组与模型组之间差异无统计学意义(P>0.05);与模型组相比,电针组大鼠在脑缺血第7天、14天神经功能缺损评分降低(P<0.05)。见图1。
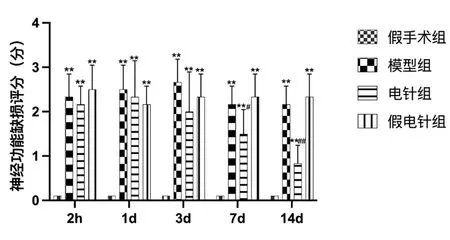
图1 各组大鼠神经功能缺损评分的比较
2.2各组大鼠右侧前扣带皮质Nissl染色结果 假手术组前扣带皮质区神经元分布较密集,其结构清晰完整,胞核可见。与假手术组相比,模型组和假电针组大鼠右侧前扣带皮质区神经元数量均明显减少(P<0.01);与模型组相比,电针组右侧前扣带皮质区神经元数量明显增多(P<0.01),而假电针组差异无统计学意义(P>0.05)。见图2。
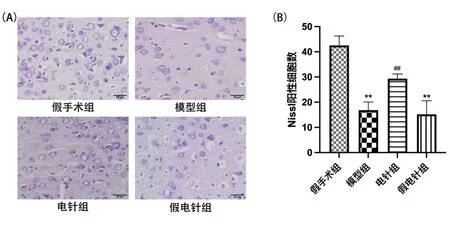
图2 各组大鼠右侧前扣带皮质Nissl染色结果
2.3各组大鼠右侧前扣带皮质HMGB1和p-JNK表达结果 免疫组织化学染色结果显示,各组大鼠右侧前扣带皮质区均有HMGB1和p-JNK免疫阳性细胞的表达。HMGB1和p-JNK的阳性细胞胞浆和胞膜大部分染色,呈棕黄色。与假手术组比较,模型组和假电针组右侧前扣带皮质区HMGB1和p-JNK阳性细胞数量均明显增加(P<0.01)。与模型组比较,电针组右侧前扣带皮质区HMGB1和p-JNK阳性细胞数量均明显减少(P<0.01),而假电针组HMGB1和p-JNK阳性细胞的数量差异无统计学意义(P>0.05)。见图3、图4。

图3 各组大鼠右侧前扣带皮质HMGB1免疫组织化学染色结果
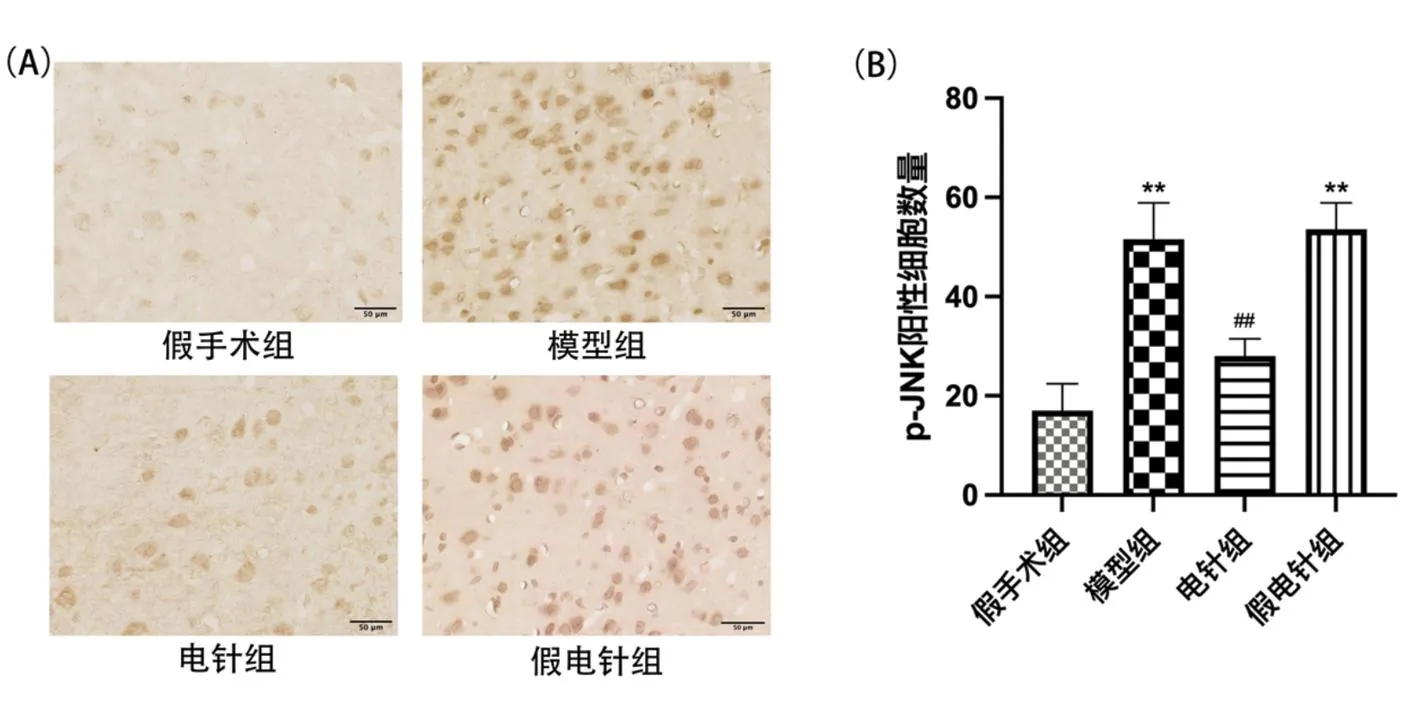
图4 各组大鼠右侧前扣带皮质p-JNK免疫组织化学染色结果
3 讨论
前扣带皮质与额叶皮质联系密切,且能够对其他脑区进行适当控制,与情绪、工作能力和社会行为等有关[1-2],在急性和慢性疼痛中均可被激活,可能导致疼痛相关的焦虑[10],而脑缺血也常伴随焦虑样行为[11]。有研究运用Nissl染色观察脑缺血后额叶皮质神经元的形态变化,结果显示脑缺血大鼠缺血侧额叶皮质神经元数量明显减少,胞体萎缩,呈空泡样变等现象,说明脑缺血可导致额叶皮质的神经元出现损伤[12]。本实验Nissl染色结果显示,模型组大鼠缺血侧前扣带皮质神经元排列疏松散乱,神经元数量明显减少,表明脑缺血也可导致前扣带皮质的神经元受损。
近年来,有研究认为HMGB1和p-JNK可能是脑血管疾病病理生理过程中的关键分子[6-7],尚不清楚HMGB1和p-JNK是否参与脑缺血导致前扣带皮质损伤的发生过程。研究报道HMGB1可调节细胞凋亡和氧化应激等多种病理生理过程,参与介导脑缺血损伤,脑损伤后大量HMGB1从细胞核分泌到细胞外,破坏血脑屏障,使脑组织出现继发性损伤,导致缺血后的脑细胞水肿、凋亡及坏死等[13]。既往有研究表明,HMGB1在阿尔兹海默病、帕金森病等神经系统疾病中扮演着重要角色,HMGB1可作为记忆障碍、慢性神经退行性变和神经炎症进展的危险因素[14-15],也有研究认为,HMGB1由坏死细胞被动释放,抑制HMGB1途径的激活提供神经保护作用[16],提示抑制HMGB1的激活可作为脑缺血损伤的潜在治疗靶点。另有研究表明,脑缺血导致坏死性脑细胞凋亡,引起感觉和运动缺陷,而抑制p-JNK的表达则可对脑缺血大鼠海马CA1区神经元起到保护作用[17],这提示p-JNK也是缺血性脑损伤治疗的又一有效靶点。本实验结果显示,模型组大鼠神经功能缺损评分明显高于假手术组,缺血侧前扣带皮质HMGB1和p-JNK阳性细胞表达也明显高于假手术组,结合Nissl染色结果提示,脑缺血后前扣带皮质中HMGB1和p-JNK过表达可能是导致其损伤的重要因素,因此抑制或下调脑缺血后HMGB1和p-JNK过表达可能是治疗缺血性脑损伤的有效策略。
目前临床上对脑缺血的治疗由于治疗窗很窄(一般不超过6 h),在实际应用中受到较大限制[18]。电针广泛应用于卒中等疾病的临床治疗,其疗效已得到肯定,但其机制尚不完全清楚,仍在不断研究中。有研究表明,电针通过调节中枢神经系统的不同机制,对缺血性中风发挥有益作用,其机制涉及抗脑缺血区的细胞凋亡、恢复性调节脑缺血区的脑血流量及神经化学物质,促进中枢神经系统的神经发生和细胞增殖,改善中风后受损的长时程增强和记忆力等[19]。GV20和ST36是治疗卒中的临床和实验动物研究中常用的穴位,中医理论认为GV20属于督脉,聚阳气,刺激GV20后,可为身体提供能量;ST36是胃经穴之一,富气血,刺激ST36,活气血,可调节机体的整体功能[20],这也是本文电针治疗时穴位选取的主要依据。本实验染色结果显示,电针刺激GV20和ST36可明显改善脑缺血大鼠的神经功能缺损症状,减缓脑缺血导致的前扣带皮质神经元的损伤,并且明显下调前扣带皮质区HMGB1和p-JNK蛋白的异常高表达。据此推测,电针减轻脑缺血导致的前扣带皮质神经元的损伤可能与抑制HMGB1和p-JNK过表达密切相关。
综上所述,电针可能通过抑制脑缺血大鼠前扣带皮质中HMGB1和p-JNK蛋白的过表达,以减轻神经元的损伤,从而发挥神经保护作用。本研究为阐明临床应用电针治疗缺血性脑损伤的潜在机制提供了一定的形态学依据与新的理论解释。然而,脑卒中后不同损伤机制可互相影响,电针可调节多种信号通路,对卒中起到治疗作用,其是否能同时调节HMGB1、p-JNK及其他通路以发挥增效作用,还值得进一步研究。
