生物炭对微塑料污染下普通白菜生长和土壤细菌群落结构的影响
2024-02-26王喜英莫忠妹李德燕张露露赵辉谭智勇侯建伟
王喜英,莫忠妹,李德燕,张露露,3,4,赵辉,3,4*,谭智勇,3,4,侯建伟
(1 铜仁学院,贵州铜仁 554300;2 安顺学院,贵州安顺 561000;3 铜仁学院乡村振兴研究中心,贵州铜仁 554300;4 贵州省高等学校山地国土空间智能监测与政策仿真工程研究中心,贵州铜仁 554300)
塑料污染已成为21 世纪全球最严重的环境污染问题之一。全球塑料总产量从20 世纪50 年代的200 万t 增加到2019 年的3.68 亿t,其中近80%的塑料垃圾直接或间接排放到自然环境中(Fan et al.,2022)。在紫外线、高温和生物作用下,塑料被分解成小于5 mm 的颗粒,即微塑料(MPs)(Thompson et al.,2004)。微塑料易吸收污染物和积累病原物等特定微生物,通过食物网和食物链对生态系统构成潜在风险(Ren et al.,2021)。土壤作为微塑料的主要载体,其微塑料含量是海洋的4~23 倍(Jacques & Prosser,2021)。近年来,由于微塑料对粮食安全和人类健康的潜在危害,农业土壤中微塑料污染问题已经引起全球的重点关注(Bank et al.,2020)。施用堆肥、污水灌溉、聚合物基肥料、大气沉降、温室材料和地膜被认为是农业土壤微塑料的主要来源(Kumar et al.,2020)。吴亚梅等(2022)研究表明,北京市设施菜地土壤微塑料丰度范围为(440 ± 179.63)~(2 366.67 ±347.21)n · kg-1,平均丰度为(1 405.19 ± 584.30)n · kg-1;微塑料主要类型为聚丙烯(PP)、聚乙烯(PE)。Zhang 和Liu(2018)研究表明,西南地区设施菜地土壤微塑料丰度范围为7 100~42 960 n ·kg-1。由此可知,设施菜地土壤微塑料含量普遍较高,不利于蔬菜生长。微塑料掺入和积累会直接或间接对土壤生态功能产生影响,改变土壤微生物群落多样性,对土壤质量的影响因微塑料类型不同而未达成共识(Almeida et al.,2020)。
土壤微生物作为生态系统的分解者,积极参与物质循环和能量流动,是土壤环境变化的敏感指标,在土壤生态系统中起着至关重要的作用(Ren et al.,2019)。微塑料通过改变土壤容重、孔隙度、电导率、pH 和养分含量,最终影响土壤微生物群落组成和代谢活性(Yan et al.,2021)。因此,微塑料介导下土壤微生物群落可能会改变生物地球化学循环,从而影响土壤生态系统的整体功能。Fei 等(2020)研究发现,添加1%~5%的聚乙烯或5%的聚氯乙烯微塑料会导致土壤细菌群落的丰富度和多样性下降。Yan 等(2021)研究认为,聚氯乙烯微塑料对土壤细菌群落多样性和组成无显著影响,然而一些细菌属存在显著减少或富集。Rong等(2021)研究发现,在低密度聚乙烯微塑料存在的条件下,土微菌属、分枝杆菌属和生丝微菌属能很好地生长,对微塑料具有耐受性。由此可知,微塑料类型对土壤微生物的影响具有差异性;同时,考虑到未来土壤微塑料污染可能会持续或变得更加严重,因此开展微塑料类型对土壤微生物群落影响的研究势在必行。
生物炭具有改善土壤质量,增强污染物吸附,提高有机污染物情况下的微生物活性或微生物利用能力的作用(He et al.,2018)。生物炭可直接为土壤微生物提供保护和营养供应,或间接通过改变土壤特性为微生物提供更适宜的生活环境(Zhu et al.,2017;Luo et al.,2018)。目前,关于单一微塑料类型或生物炭对土壤微生物影响的研究较多。然而,关于生物炭添加到微塑料污染土壤中,能否改善土壤质量,如何影响微生物群落结构、丰度及其生态功能尚不明确,需要开展进一步的研究。为此,本试验采用盆栽方式,应用荧光定量PCR 和MiSeq 高通量测序技术,开展生物炭对不同类型微塑料污染下普通白菜生长发育以及土壤细菌群落结构、丰度和功能预测的研究,以期从微生物角度为土壤生态系统中微塑料污染的潜在风险评价及修复提供科学依据。
1 材料与方法
1.1 供试材料
土壤采集于贵州省铜仁市土坪村(109°13′3″E,27°32′27″N)典型黄壤土,海拔650 m。土壤采样区域无塑料污染,且通过肉眼和显微镜在土壤中没有发现微塑料。0~20 cm 新鲜土壤经风干后过2 mm 筛,备用。土壤基本理化性质:pH 6.43,全氮含量1.54 g · kg-1,有机碳含量29.41 g · kg-1,速效钾含量47.22 mg · kg-1,速效磷含量19.23 mg · kg-1。
供试普通白菜品种为四季小白菜,购自天津市宏丰蔬菜研究有限公司。
聚 丙 烯(polypropylene,PP)、 聚 乙 烯(polyethylene,PE)、聚氯乙烯(polyvinylchloride,PVC)尺寸为180~200 μm,分别用超纯水洗涤3次,干燥箱干燥,并用紫外灯消毒。生物炭由马弗炉在500 ℃下对水稻秸秆进行热解产生,其基本理化性质:pH 8.56,有机碳含量535.07 g · kg-1,全氮含量6.37 g · kg-1,全磷含量5.78 g · kg-1,全钾含量11.15 g · kg-1,比表面积212 m2· g-1。
1.2 试验设计
普通白菜采用盆栽方式,共设计7 个处理,不同微塑料添加浓度按微塑料与土壤质量比计算,每处理3 次重复,分别为:CK,对照,不添加微塑料和生物炭;PP,添加1%聚丙烯;PE,添加1%聚乙烯;PVC,添加1%聚氯乙烯;PPR,添加1%聚丙烯 + 1%生物炭;PER,添加1%聚乙烯 + 1%生物炭;PVCR,添加1%聚氯乙烯 + 1%生物炭。试验中设置的微塑料和生物炭添加量主要参考了目前文献报道的土壤微塑料含量(费禹凡 等,2021;Han et al.,2022)。
试验于2022 年11 月在铜仁学院塑料大棚内进行,各处理添加的微塑料、生物炭与土壤混合均匀后,装入高21 cm、直径21 cm 塑料盆中,盆栽用土4 kg,共计21 盆。为保证添加微塑料在土壤中趋于均匀稳定,平衡培养20 d,同时保持土壤含水量在60%。培养结束后,播种普通白菜,每盆10粒;待普通白菜出苗后,每盆留苗4 株。普通白菜生长期间管理水平一致,为避免水中微塑料进入,均采用蒸馏水浇灌。播种60 d 后,进行普通白菜和土壤样品采集。每处理的普通白菜植株均用去离子水冲洗干净,然后用滤纸吸干表面水分,用于生长指标测定,并统计叶片数。采用5 点取样法在植株根系附近取土,每处理混合成1 份土样,去除植物根系并过2 mm 筛,然后分为2 份,1 份新鲜土壤用于铵态氮和硝态氮含量测定,余下部分室内风干后用于土壤理化指标测定;另1 份保存于-20 ℃冰箱,用于土壤微生物DNA 提取。
1.3 测定项目及方法
1.3.1 普通白菜生长指标测定 使用卷尺和电子天平测定株高、根长、单株鲜质量。
1.3.2 土壤化学指标测定 采用电位法测定pH,采用重铬酸钾氧化法测定有机碳(SOC)含量,采用凯氏定氮法测定全氮(TN)含量,采用靛酚蓝比色法测定铵态氮(NH4+-N)含量,采用酚二磺酸比色法测定硝态氮(NO3--N)含量,采用碳酸氢钠浸提-钼锑抗比色法测定速效磷(AP)含量,采用火焰光度法测定速效钾(AK)含量(鲍士旦,2000)。
1.3.3 土壤DNA 提取和荧光定量PCR 扩增 采用DNA 提取试剂盒(Omega,GA,USA),按照试剂盒步骤进行土壤DNA 提取。利用核酸定量仪(NanoDrop ND-2000) 对DNA 浓度和纯度进行检测。利用实时荧光定量PCR(qPCR)技术对细菌(16S rRNA)丰度进行分析,细菌16S rRNA 基因的V3~V4 区扩增引物为:338F(5′-ACTCCTACGGGAGGCAGCAC-3′)和519R(5′-GGACTACNNGGGTATCTAAT-3′)(Zheng et al.,2019)。每个PCR 扩增样品重复3 次,通过Minipre Kit 获得样品质粒,根据样品质粒的标准曲线,分别计算基因拷贝数。
1.3.3 高通量测序 采用2%琼脂糖凝胶电泳检测PCR 产物。利用Illumina MiSeq 平台对细菌16S rRNA 进行测序(上海派森诺生物科技有限公司)。对原始数据进行质量控制后,在97%相似度水平下进行OTU 划分和归并。应用RDP-classifier分别在16S rRNA 数据库中对97%相似水平的OTU 代表序列进行分类注释。使用Mothur 软件分别对细菌群落的α 多样性指数进行分析。
1.4 数据分析
采用SPSS 21.0 软件对普通白菜农艺性状、土壤化学性质和细菌群落α 多样性指数、群落组成相对丰度进行方差分析和显著性检验。利用R 软件进行土壤细菌群落结构聚类、主坐标和冗余分析。利用PICRUSt 平台对细菌功能基因进行预测。
2 结果与分析
2.1 生物炭对微塑料污染下普通白菜生长的影响
由表1 可知,不同微塑料、生物炭处理对普通白菜鲜质量、株高和根长有显著影响。普通白菜鲜质量在微塑料和生物炭共存处理中均显著高于其他处理,而微塑料单一处理均低于对照。株高在微塑料及其与生物炭共存处理中均高于对照,其中微塑料和生物炭共存处理高于相应的微塑料单一处理。与对照相比,微塑料和生物炭共存增加了根长,其中PPR 处理最长,显著高于对照。叶片数在微塑料及其与生物炭共存处理中均小于对照。因此,微塑料单一处理对普通白菜鲜质量和叶片数有抑制作用,而添加生物炭对微塑料污染下的普通白菜鲜质量、株高和根长均有促进作用。

表1 生物炭对普通白菜微塑料污染下生长指标的影响
2.2 生物炭对微塑料污染下土壤化学性质的影响
由表2 可知,土壤pH 和有机碳、速效钾含量在微塑料和生物炭共存条件下均显著高于其他处理,而微塑料单一处理与对照之间差异不显著。土壤全氮含量在微塑料和生物炭共存处理中均显著低于对照,但与微塑料单一处理之间差异不显著。与微塑料单一处理相比,微塑料和生物炭共存增加了土壤速效磷和铵态氮含量,降低了土壤硝态氮含量。土壤pH、有机碳、速效磷、速效钾和铵态氮含量均是PVCR 处理最高,且显著高于对照。

表2 生物炭对微塑料污染下土壤化学性质的影响
2.3 生物炭对微塑料污染下土壤细菌基因丰度的影响
细菌16S rRNA 基因丰度在不同处理中有显著差异。各处理细菌16S rRNA 基因拷贝数为1.27 ×109~1.94 × 109个 · g-1(图1)。微塑料及其与生物炭共存处理均显著高于对照,且微塑料和生物炭共存处理高于微塑料单一处理;PER 处理显著高于其他处理,分别比对照及PP、PE、PVC 处理提高了53.41%、23.52%、20.70%、15.90%。可见,微塑料及其与生物炭共存对土壤细菌数量均有促进作用。
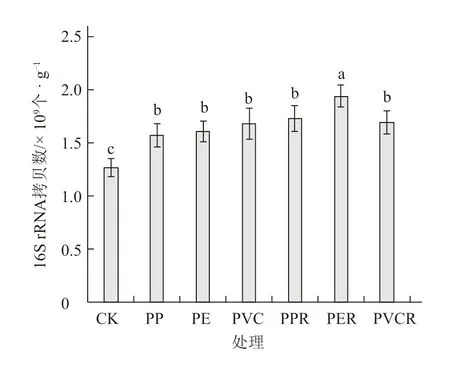
图1 生物炭对微塑料污染下土壤细菌基因丰度的影响
为明确土壤细菌16S rRNA 基因丰度差异的影响因素,分别与土壤化学性质以及普通白菜鲜质量、株高、根长进行相关性分析(图2)。细菌16S rRNA 基因丰度分别与土壤pH、速效钾含量和普通白菜株高呈极显著正相关关系,与土壤全氮含量呈显著负相关关系,与土壤有机碳、速效磷含量和普通白菜鲜质量呈显著正相关关系。
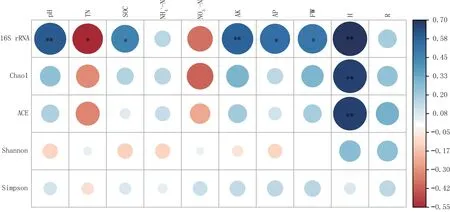
图2 细菌群落α 多样性指数、基因丰度与土壤化学性质以及普通白菜鲜质量、株高、根长的相关性
2.4 生物炭对微塑料污染下土壤细菌16S rRNA测序结果和α 多样性指数的影响
利用Illumina MiSeq 平台对土壤细菌16S rRNA 测序结果进行分析(表3)。不同处理土壤细菌获得质控后序列数为62 600~71 809 条。土壤细菌Chao1 指数和ACE 指数变化大致相同,均为PE 处理最高,分别为4 122.87、3 536.03,均显著高于对照和PP 处理;各处理的土壤细菌Shannon指数和Simpson 指数差异均不显著,其中PE 处理Shannon 指数最高,而对照Simpson 指数最高。表明,微塑料及其与生物炭共存对土壤细菌群落丰富度有促进作用。
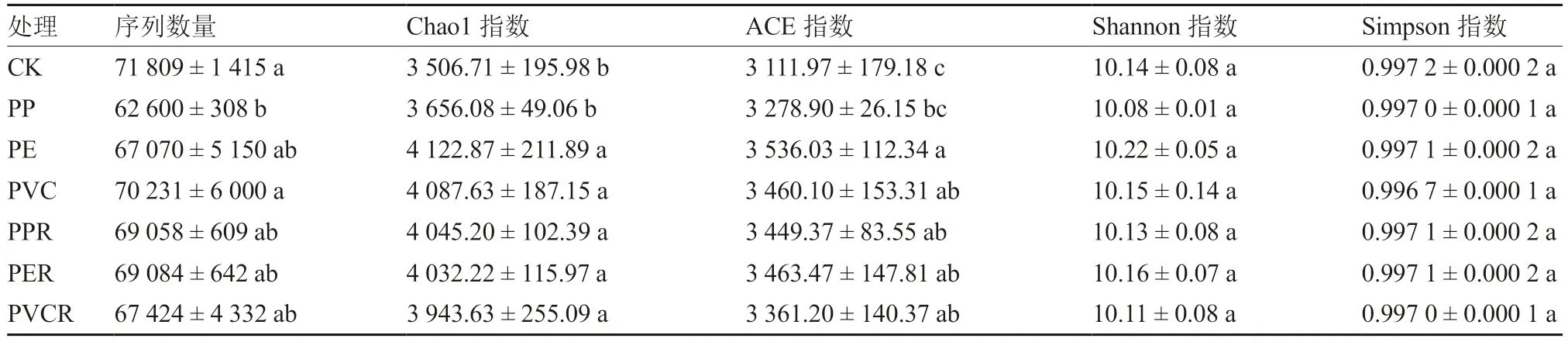
表3 生物炭对微塑料污染下土壤细菌16S rRNA 测序结果及群落α 多样性指数的影响
相关性分析结果表明(图2),土壤细菌Chao1指数、ACE 指数与普通白菜株高呈极显著正相关关系,即土壤细菌丰富度与普通白菜生长关系较为紧密。
2.5 生物炭对微塑料污染下土壤细菌群落组成的影响
通过对土壤样品OTUs 进行归类, 在门水平上, 将平均相对丰度< 1% 的类群归类为其他, 得到6 个类群( 图3), 分别为放线菌门(Actinobacteria)、 变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、 酸杆菌门(Acidobacteria)和芽单胞菌门(Gemmatimonadetes), 其中放 线 菌 门(44.13%~53.85%)、 变 形 菌 门(24.01%~27.96%)、绿弯菌门(5.70%~9.23%)、厚 壁 菌 门(4.81%~5.74%) 和 酸 杆 菌 门(3.87%~6.74%)为优势菌门,优势类群相对丰度的占比为91.28%~95.38%。
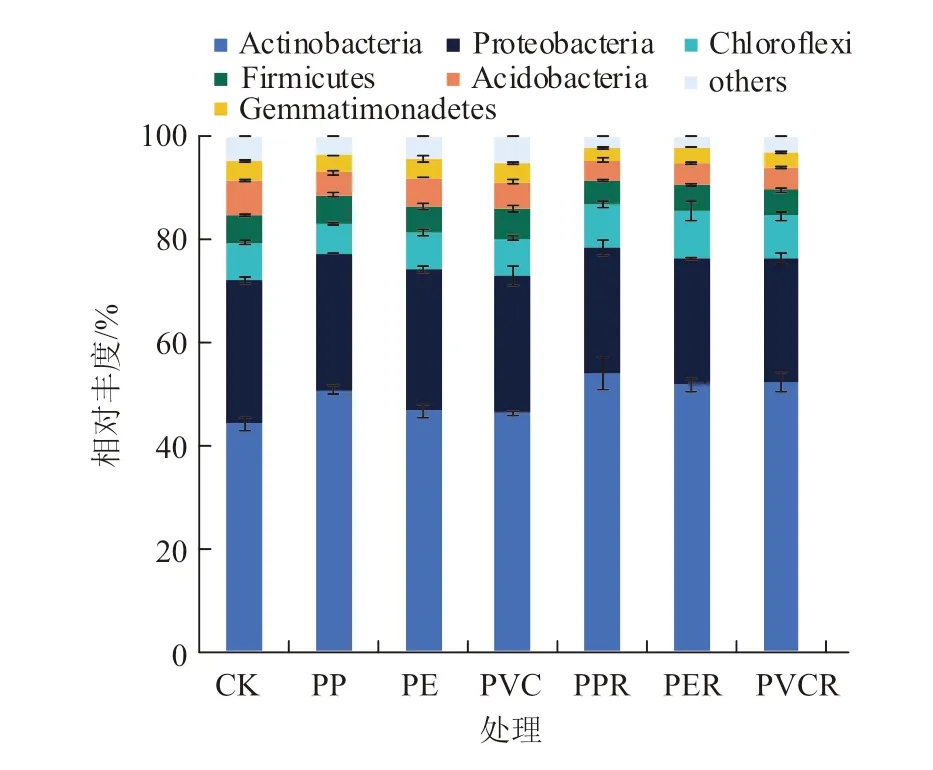
图3 生物炭对微塑料污染下土壤细菌门水平群落组成的影响
由图4 可知,除PE 和PVC 处理外,其他处理的放线菌门相对丰度均显著高于对照,微塑料和生物炭共存处理高于微塑料单一处理;PPR 处理的放线菌门相对丰度最高,为53.85%,分别比对照及PP、PE、PVC 处理增加了22.03%、6.23%、15.54%、16.56%,差异均达显著水平。对照的变形菌门相对丰度最高(27.96%),与微塑料单一处理之间差异不显著,但均显著高于微塑料和生物炭共存处理。微塑料和生物炭共存处理绿弯菌门相对丰度高于其他处理,其中PER 处理最高,为9.23%,显著高于对照及PP、PE、PVC 处理。厚壁菌门相对丰度各处理间差异不显著。酸杆菌门相对丰度以对照最高(6.74%),显著高于其他处理;PE和PVC 处理的酸杆菌门相对丰度显著高于PP、PPR、PER、RVCR 处理。
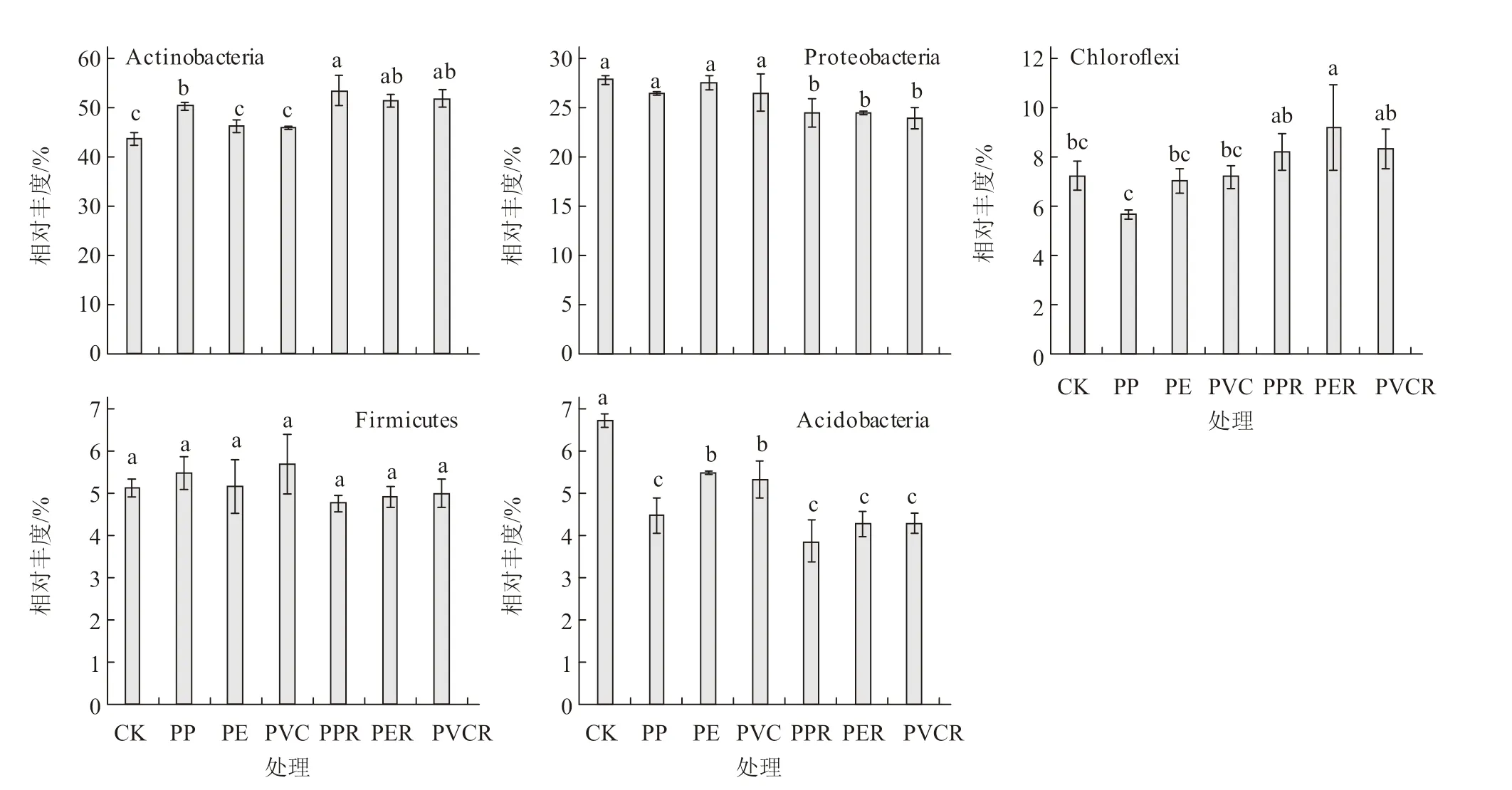
图4 生物炭对微塑料污染下土壤细菌门水平优势类群的影响
在属水平上,得到相对丰度在1%以上的18个类群(图5),其中类诺卡氏菌属(Nocardioides)和Oryzihumus相对丰度高于其他属。对照的类诺卡氏菌属相对丰度低于其他处理,PPR、PER 和RVCR 处理的类诺卡氏菌属相对丰度均高于PP、PE、PVC 处理;其中PER 处理的类诺卡氏菌属相对丰度最高,为6.34%,显著高于对照及PP、PE、PVC 处理。PP、PE 和PVC 处理的Oryzihumus相对丰度显著高于其他处理及对照。
2.6 土壤细菌群落结构及其与土壤化学性质的关系
聚类分析结果表明,微塑料和生物炭共存处理距离较近,与微塑料单一处理距离较远(图6-a)。PCoA 分析进一步证实了微塑料及其与生物炭共存处理与微塑料单一处理的土壤细菌群落结构差异明显,PCoA1 和PCoA2 分别解释了土壤细菌群落变异的12.3%和8.8%(图6-b)。其中对照和PVC处理分布在同一象限内,距离较近;PP、PE 处理之间距离近于其他处理;PPR、PER、RVCR 处理之间距离较近,说明微塑料和生物炭共存处理的土壤细菌群落结构相似度较高。总体而言,微塑料和生物炭共存处理的土壤细菌群落与微塑料单一处理之间差异较明显,且影响高于微塑料单一处理。
为进一步分析土壤化学性质对细菌群落结构的影响,对细菌群落结构与土壤化学性质进行冗余分析(图7)。通过冗余分析可知,RDA1 和RDA2 分别解释了土壤细菌群落变异的38.04%和15.24%,前两轴解释了总变异的53.28%。土壤pH和有机碳、铵态氮、硝态氮、速效钾含量对土壤细菌群落结构具有极显著影响,土壤全氮和速效磷含量对土壤细菌群落结构具有显著影响。
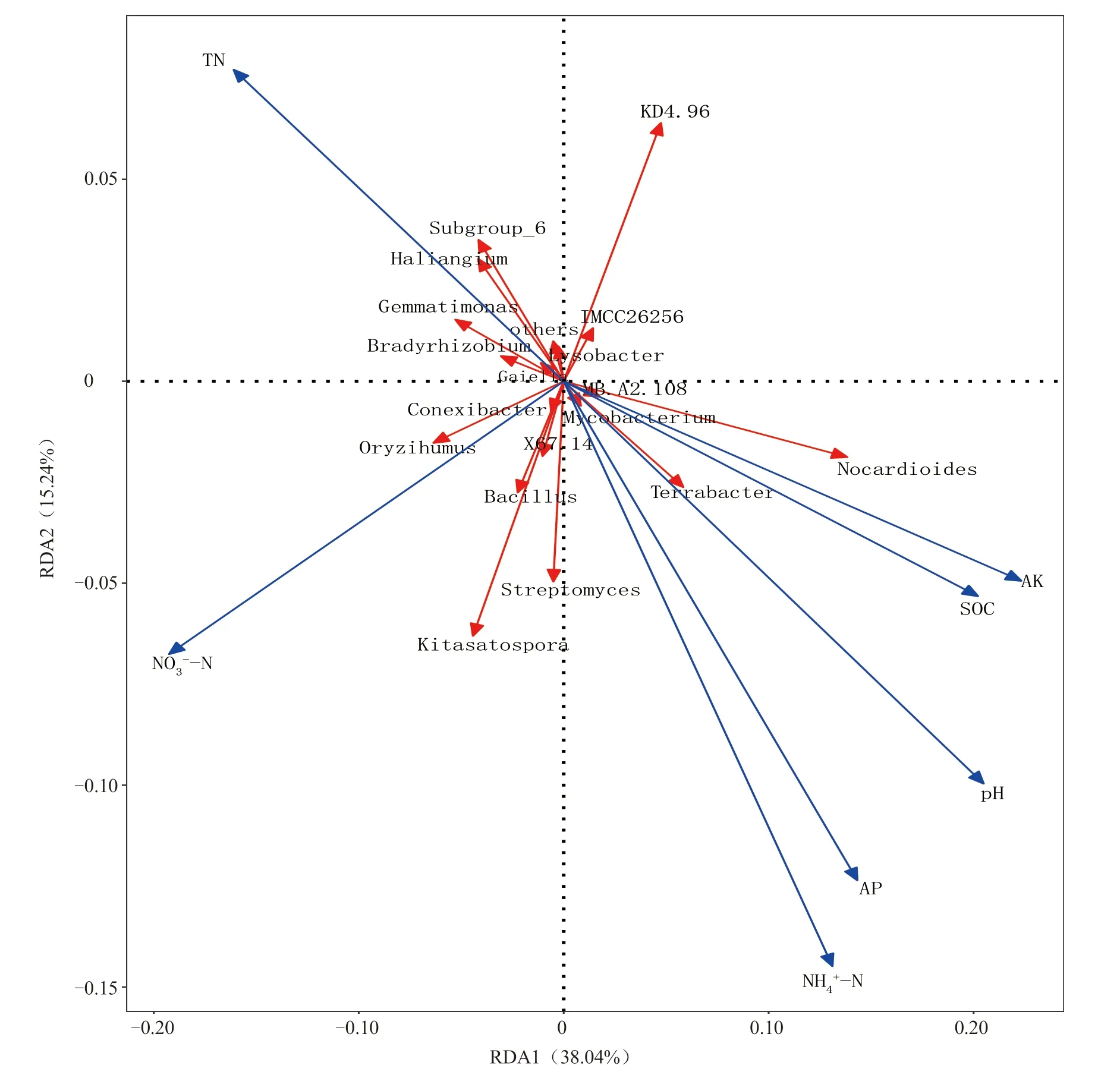
图7 属水平土壤细菌群落和化学性质的冗余分析
2.7 土壤细菌群落功能预测
根据OTUs 信息与KEGG 数据库的OTUs 比较和注释,获得了6 类初级功能代谢传递(Ⅰ级)和45 类次级功能代谢途径(Ⅱ级)(图8)。6 类主要代谢途径的相对丰度顺序为新陈代谢(65.78%)>遗传信息处理(10.42%)>环境信息处理(8.88%)>细胞过程(7.01%)>人类疾病(4.98%)>有机系统(2.93%)。微塑料及其与生物炭共存处理的新陈代谢、环境信息处理和有机系统的功能基因相对丰度均高于对照,而细胞过程、遗传信息处理和人类疾病的功能基因相对丰度均低于对照。其中,微塑料和生物炭共存处理的新陈代谢功能基因相对丰度高于微塑料单一处理。45 类二级功能代谢通路中,相对丰度大于1%的二级功能代谢通路有21 类。其中,碳水化合物代谢、氨基酸代谢、能量代谢、辅助因子和维生素代谢、膜转运和核苷酸代谢的相对丰度均大于5%,为土壤细菌的主要子功能。微塑料及其与生物炭共存处理的碳水化合物代谢、氨基酸代谢、能量代谢和膜转运功能基因丰度均高于对照,其中PPR 处理最高;而辅助因子和维生素代谢功能基因丰度则是对照最高(表4)。

图8 不同处理的土壤细菌功能多样性热图

表4 不同处理的土壤细菌主要功能代谢通路 %
3 讨论
3.1 生物炭对微塑料污染下土壤化学性质的影响
相关研究认为,微塑料暴露在土壤中可导致土壤理化性质发生变化(Ren et al.,2022)。pH 是决定土壤特性的主要非生物因素之一,对营养物质的“生物利用度”和微生物群落组成及活性有重要影响(Rousk et al.,2010)。本试验中,微塑料单一处理的土壤pH 增加不显著,微塑料和生物炭共存处理的土壤pH 显著增加,且与微塑料类型关联性较强。微塑料在老化和降解过程中,其含有的化合物会释放到环境中从而影响土壤pH(Feng et al.,2022)。此外,不同类型的微塑料由于表面特性(如表面电荷)的差异,可以选择性吸附带负电荷或带正电荷的物质,改变土壤溶液中离子交换,最终诱导土壤pH 变化(Feng et al.,2022)。土壤微生物群落结构和活性对土壤pH 高度响应,微塑料可能通过改变土壤微生物群落结构间接影响土壤pH。Zhou 等(2021)研究认为,微塑料诱导土壤pH 变化部分归因于对土壤生物区系的干扰。低密度PE可改变氨氧化细菌丰度,随着释放H+离子,进一步改变土壤pH(Rong et al.,2021)。今后,需进一步揭示微塑料对土壤pH 的影响机制。微塑料和生物炭共存处理下土壤pH 显著增加,可能与生物炭为碱性物质有关。然而,生物炭与微塑料共存条件下土壤pH 也可能因微塑料类型的不同而有所不同,比如PE、PVC 和生物炭共存处理的土壤pH显著高于其他处理。
土壤有机质含量与土壤肥力和微生物活性密切相关。本试验中,单一微塑料处理降低了土壤有机碳含量,与Li 等(2021)的研究结果一致。其中,PE 处理的土壤有机碳含量最低,可能与PE 具有线性烃类结构,分子尺寸大,缺乏官能团和疏水性高有关,这使得该微塑料在自然条件下具有较强的抗降解能力(Miranda et al.,2020)。然而,戚瑞敏(2021)研究表明,微塑料(PE 和PVC)在恒温培养箱中培养45 d 后,土壤有机碳含量随微塑料添加量增加而增加,微塑料降解可作为土壤利用的碳源。本试验中,3 种类型的微塑料和生物炭共存处理均显著提高了土壤有机碳含量,可能与含有生物炭有关,有利于提高土壤碳含量。不同类型微塑料单一处理均降低了速效钾含量,可知微塑料对土壤速效钾含量有负面影响。PP 和PE 处理增加了土壤速效磷含量,与Chen 等(2020)的研究结果一致。然而,Yang 等(2021)研究认为,微塑料(PS、PE)可显著降低土壤速效磷和速效钾含量。本试验中,除PVC 处理外,其他处理速效磷含量均高于对照,其中PPR、PER 和PVCR 处理显著高于对照。Yan 等(2021)研究认为,1%的PVC 微塑料显著降低了速效磷含量,而本试验中PVC 处理也降低了速效磷含量。然而,微塑料和生物炭共存处理显著提高了土壤速效磷和速效钾含量,说明添加生物炭能够减轻微塑料对土壤磷、钾循环的负面影响。微塑料及其与生物炭共存下土壤磷和钾转化的机制及其影响还有待进一步研究。
微塑料单一处理降低了土壤铵态氮含量,增加了硝态氮含量,可能是由于微塑料含有碳基和羟基基团,吸收NH4+等阳离子;同时,微塑料通过改善土壤孔隙度和通气性,增强土壤中O2扩散,进一步加速铵态氮硝化(Green et al.,2016)。微塑料和生物炭共存处理的土壤硝态氮含量有所下降,可能与土壤pH 急剧上升有关,导致土壤氨氧化微生物数量减少,对硝化过程有抑制作用(Wang et al.,2017);同时,微塑料和生物炭共存处理促进了植株生长,增强了植株对硝态氮的吸收。
3.2 生物炭对微塑料污染下土壤细菌多样性和群落结构的影响
土壤微生物负责维持土壤活力,并在维持土壤生态系统的整体服务功能方面发挥着重要作用。当土壤微生物生态环境受到干扰时,微生物数量、活性、多样性和群落结构就会受到影响。微塑料及其与生物炭共存处理的土壤细菌丰度均显著高于对照,可能与土壤pH 有关,pH 升高有利于养分转化,有利于微生物生长和繁殖。总体上,微塑料和生物炭共存处理的细菌丰度高于微塑料单一处理,可能由于生物炭的添加提高了土壤有机碳含量,为微生物生长提供充足的碳源。Feng 等(2022)研究表明,微塑料对微生物群落丰富度和多样性有负面影响,与本试验结果不一致。本试验中,微塑料及其与生物炭共存对土壤细菌丰富度有促进作用,对细菌多样性无显著影响,可能与不同土壤类型具有抵抗各种干扰的内在能力差异有关(Lee et al.,2017)。细菌丰富度增加,反映出微塑料可作为土壤稀有生物种类的食物资源,显著改变一些细菌类群丰度,导致主要细菌定殖,意味着存在可以分解和利用塑料的代谢高效物种(McCormick et al.,2014)。微塑料和生物炭共存下土壤细菌Chao1 指数和ACE 指数较高,可能是由于生物炭的高表面积有助于微生物定殖,以及生物炭中的高灰分含量可为微生物提供必需的矿物质(Igalavithana et al.,2019)。
微塑料通过影响土壤理化性质,对土壤微生物群落和功能产生影响(Rillig et al.,2019)。微塑料可提供新的微生物生态位,促进特定微生物群增殖,对生态系统功能产生不可预测的后果。不同类型微塑料由于吸附能力的差异,对微生物群落的影响也有所不同(Brodhagen et al.,2017)。微塑料可为某些异养微生物提供一种底物,作为一种“特殊的微生物积累器”,吸引参与MPs 生物降解的类群。费禹凡等(2021)研究也认为,添加微塑料对土壤细菌群落组成有显著影响。本试验中,微塑料及其与生物炭共存不影响整体的细菌群落多样性及组成,但改变了土壤微生物的群落结构,使特定的细菌优势类群相对丰度发生了显著变化。放线菌门、变形菌门、绿弯菌门、厚壁菌门和酸杆菌门为优势菌门,与Fan 等(2022)的研究结果一致。放线菌门是包括极端环境在内的各种生态区域中最丰富的种群之一,能够在恶劣的环境条件下生存(Rampelotto et al.,2013)。微塑料及其与生物炭共存处理的放线菌门相对丰度均高于对照,除PE、PVC 处理外均与对照差异显著。可见,放线菌门具有在微塑料污染土壤中生长的能力,可能是由于某些物种能够使用合成水解酶降解微塑料(Zhang et al.,2019);微塑料和生物炭共存时,放线菌门相对丰度较高,可能与土壤养分增加有关(Wang et al.,2019)。
变形菌门被认为是最大的细菌门之一,其具有相当大的生理、形态和代谢多样性,是附着在微塑料上最常见的细菌门,在碳质化合物的降解中起着重要作用,属于异养性细菌(Spain et al.,2009)。Zhang 等(2019)研究认为,变形菌门在聚乙烯降解中发挥着重要作用。微塑料单一处理的变形菌门相对丰度高于微塑料和生物炭共存处理,可能与变形菌门对土壤污染具有一定的耐受能力有关(François et al.,2012)。绿弯菌门含有绿色色素,具有降解纤维素作用,与作物地上部生物量呈显著正相关关系(Podosokorskaya et al.,2013)。微塑料和生物炭共存处理的绿弯菌门相对丰度高于其他处理,其中PER 处理通过影响蔬菜生长来促进绿弯菌门繁殖和生长。酸杆菌门是嗜酸性细菌,酸性土壤环境有利于其代谢活动,偏好营养贫乏的环境(Ito et al.,2017)。酸杆菌门相对丰度以对照最高,显著高于其他处理,可能与土壤pH 最低有关;微塑料和生物炭共存处理的酸杆菌门相对丰度最低,进一步证实了其为贫营养型细菌。
3.3 生物炭对微塑料污染下土壤微生物功能的影响
微生物群落变化可能间接影响其代谢功能的多样性。通过与KEGG 数据库比较和注释,发现微塑料及其与生物炭共存处理改变了土壤微生物的某些代谢功能。杜宇佳等(2019)研究认为,土壤细菌群落功能特征与群落多样性呈显著正相关关系。微塑料及其与生物炭共存处理的新陈代谢、环境信息处理和有机系统的功能基因相对丰度均高于对照,有利于促进土壤细菌生长繁殖,提高微生物群落结构多样性(Kanokratana et al.,2011)。马欣等(2021)研究表明,土壤细菌群落中主要的代谢功能为新陈代谢中的碳水化合物代谢、氨基酸代谢、能量代谢、辅助因子和维生素代谢。膜转运对细胞的存活至关重要,可以承受细菌环境中的任何不良变化。Fei 等(2020)研究认为,微塑料处理的碳水化合物相关基因丰度均大于对照,与本试验结果一致。微塑料和生物炭共存处理提高了碳水化合物代谢、氨基酸代谢、核苷酸代谢等必需代谢功能基因丰度,且均高于其他处理,可能由于添加生物炭增强了土壤有机碳含量,促进了细菌对土壤氮、磷的利用能力,增强了细菌群落对外界的抵抗能力(Zhang et al.,2021)。然而,考虑到PICRUSt 分析只能提供细菌群落的预测功能,需要进一步结合宏基因组分析来评估微塑料及其与生物炭共存对土壤微生态造成的影响。
4 结论
施用生物炭可显著提高微塑料污染下普通白菜鲜质量、土壤pH 以及有机碳、速效钾含量。微塑料及其与生物炭共存对土壤细菌丰度有显著促进作用;除PP 处理外,微塑料及其生物炭共存对土壤细菌Chao1 指数和ACE 指数有显著促进作用。添加生物炭显著增加了微塑料污染下土壤放线菌门相对丰度,显著降低了变形菌门相对丰度,酸杆菌门相对丰度也降低。土壤细菌群落功能预测表明,微塑料及其与生物炭共存处理增加了细菌中新陈代谢、环境信息处理和有机系统的功能基因相对丰度。
