阔叶十大功劳抗炎作用机制的实验研究及网络药理学分析
2024-02-26付朝举成果林登梅李军张楠楠
付朝举 成果 林登梅 李军 张楠楠
摘要:基于網络药理学及动物实验研究苗药阔叶十大功劳抗炎的有效成分及作用机制。用二甲苯、角叉菜胶分别制作小鼠及大鼠的炎症模型,并灌胃阔叶十大功劳(小鼠剂量为1.950 mg/kg;大鼠剂量为1.350 mg/kg)。通过TCMSP、SymMap、SwisstargetPrediction、SEA、STICH等数据库,以口服生物利用度≥30%、类药性≥0.18获取阔叶十大功劳的活性成分及其相应靶点;通过GeneCards、DisGeNET、TTD、DrugBank、OMIM等数据库获取炎症相关靶点;通过Venny 2.1.0获取疾病和药物的交集靶点,通过Cytoscape的MCODE、CytoHubba插件得到10个关键靶点,并构建药物-成分-靶点网络图;对10个Hub gene进行KEGG(Kyoto encyclopedia of genes and genomes )和GO (gene ontology)富集分析以及分子对接。动物实验结果表明,阔叶十大功劳能够减轻小鼠和大鼠的炎症症状。网络药理学分析获得28个阔叶十大功劳活性化合物,753个药物作用靶点,1 025个炎症靶点,阔叶十大功劳-炎症交集靶点225个,Hub gene 10个。GO及 KEGG富集分析结果显示,阔叶十大功劳主要参与JAK-STAT信号传导途径、Th17细胞分化和一些癌症通路。分子对接结果显示,小檗碱、异博尔定等11个活性成分与JUN、JAK3等8个靶点对接成功。动物实验结果表明阔叶十大功劳具有抗炎作用,抗炎的主要成分为槲皮素、小檗碱等化合物,抗炎的机制可能是通过作用于IL-2、JAK1等靶点,参与JAK-STAT信号传导途径、Th17细胞分化等通路抗炎,初步揭示了阔叶十大功劳发挥抗炎作用的物质基础及作用机制。
关键词:阔叶十大功劳;网络药理学;炎症;分子机制;有效成分
中图分类号:R285 文献标志码:A 文章编号:1002-4026(2024)01-0024-08
Experimental study and network pharmacological analysis of the anti-inflammatory action mechanism of ‘Mahonia bealei ‘(Fort.) Carr.
Abstract∶The aim of this study was to investigate the active ingredients and mechanism of action of the anti-inflammatory effect of ‘Mahonia bealei ‘(Fort.) Carr. in Hmong medicine based on network pharmacology and animal experiments. Inflammation models of mice and rats were generated using xylene and carrageenan gum, respectively, and ‘Mahonia bealei ‘(Fort.) Carr. was gavaged (dose of 1.950 mg/kg for mice; 1.350 mg/kg for rats). The active ingredients and their corresponding targets of ‘Mahonia bealei ‘(Fort.) Carr. were obtained using TCMSP, SymMap, SwisstargetPrediction, SEA, and STICH, among other databases, with oral bioavailability ≥30% and drug-likeness ≥0.18. Inflammationrelated targets were obtained through GeneCards, DisGeNET, TTD, DrugBank, OMIM and other databases. The intersection targets of diseases and drugs were determined using Venny 2.1.0, and 10 hub gene were obtained through Cytoscape′s MCODE, CytoHubba plug-in and constructed drug-component-target network diagram; Kyoto Encyclopedia of Genes and Genomes (KEGG), and Gene Ontology (GO) enrichment analysis and molecular docking were performed for the 10 Hub gene. The results of animal experiments showed that ‘Mahonia bealei ‘(Fort.) Carr. could be used to reduce the inflammatory symptoms in mice and rats. The network pharmacological analysis revealed 28 ‘Mahonia bealei ‘(Fort.) Carr. active ingredients, 753 drug action targets,1 025 inflammatory targets, 225 ‘Mahonia bealei ‘(Fort.) Carr. inflammatory crossover targets and 10 hub genes. The results of GO and KEGG enrichment analysis showed that ‘Mahonia bealei ‘(Fort.) Carr. top ten utilities were predominantly involved in the JAK-STAT signaling pathway, Th17 cell differentiation and some cancer pathways. The molecular docking results demonstrated that 11 active ingredients, including berberine and isoboridine, were successfully docked with 8 targets, including JUN and JAK3. The results of animal experiments showed that ‘Mahonia bealei ‘(Fort.) Carr. has anti-inflammatory effects, and the main ingredients of anti-inflammation include quercetin and berberine, among other compounds, and the mechanism of anti-inflammation may be through the action onIL-2, JAK1 and other targets, involved in JAK-STAT signaling pathway, Th17 cell differentiation, and other pathways of anti-inflammation. The present study initially revealed the material basis and mechanism of action of the anti-inflammatory effect of ‘Mahonia bealei ‘(Fort.) Carr.
Key words∶Mahonia bealei ‘(Fort.) Carr.; network pharmacology; inflammation; molecular mechanism; active ingredient
阔叶十大功劳Mahonia bealei (‘Fort.) ‘Carr.属小檗科(Berberidaceae),灌木或小乔木,主要生长于广西、四川、贵州、湖北、江西、浙江等地,是我国传统药用植物[1],在《中国苗族药物彩色图集》[2]和《苗族医药学》[3]等苗药相关著作中均有记载。阔叶十大功劳有清热燥湿、泻火解毒之效,可用于治疗湿热泻痢、黄疸尿赤等症,该中药以根茎入药称为功劳木,以叶入药称为功劳叶。现代药理学研究表明,阔叶十大功劳具有抗氧化、抗炎、抗菌的作用[4]。
近年来,网络药理学在中药物质基础、作用机制等方面的研究中发挥着重要的作用。炎症是人体对微生物感染、组织损伤和毒素等刺激因素的一种高度协同反应,中等程度的炎症反应对人体有利,但过度炎症反应可引起糖尿病、动脉粥样硬化及高血压病等许多疾病,而抑制炎症反应可减少一些疾病的发生[5-7]。本文主要采用网络药理学、分子对接及动物实验的方法对阔叶十大功劳抗炎作用进行研究,旨在寻找阔叶十大功劳中具有成药性、口服吸收较好的成分,并预测这些成分的抗炎作用靶点及相关信号通路,为阔叶十大功劳抗炎作用的深入研究提供参考,为阔叶十大功劳的二次开发提供依据。
1 材料与方法
1.1 动物实验
1.1.1 实验动物及药物制备
KM小鼠30只,雄性,4~5周龄,体重(25±5)g。SD大鼠18只,雄性,6~8周齡,体重(250±20) g,均购于贵州中医药大学动物研究所,实验动物生产许可证号:SCXK(黔)2021-0003,实验动物使用许可证号:SYXK(黔)2021-0005。阔叶十大功劳木采集于贵州省开阳县,样本存放于贵州苗医药博物馆,编号GZT2020121021530306,经贵州中医药大学肖承鸿高级实验师鉴定为小檗科十大功劳属植物阔叶十大功劳 Mahonia bealei( Fort.) Carr.。阔叶十大功劳根茎干燥粉碎,取药物粉末100 g转移到2 L圆底烧瓶,加95%乙醇1 L,浸泡0.5 h后采用超声提取0.5 h,所得溶液过滤并浓缩,制得质量浓度4 g/mL的醇提液25 mL,并用蒸馏水稀释成0.4 g/mL的水提液备用。动物实验方案经贵州中医药大学动物实验福利伦理审查委员会审查,实验动物伦理审查表编号20220130。
1.1.2 抗炎实验
动物实验分别采用二甲苯致小鼠耳肿胀和角叉菜胶致大鼠足肿胀的方法,研究阔叶十大功劳的抗炎作用。阔叶十大功劳用量参照临床每日15 g的给药量,以体重70 kg为准,换算为小鼠和大鼠的给药剂量。
二甲苯致小鼠耳肿胀法:将KM雄性小鼠随机分为3组,分别为空白对照组、阳性对照组、阔叶十大功劳组,每组10只,分别给予0.9%生理盐水、1%阿司匹林、95%阔叶十大功劳醇提稀释水提液。各组小鼠分别给药1次,0.5 h后用二甲苯50 μL涂抹于小鼠右耳正、反面,左耳作为对照不予处理,0.5 h后处死小鼠,用打孔器在小鼠的左右耳同一部位打下圆耳片,称重。同一小鼠的右耳与左耳质量之差即为小鼠耳肿胀度,并计算小鼠耳廓肿胀抑制率。耳廓肿胀度抑制率(%)=(右耳质量-左耳质量)/左耳质量×100%。
角叉菜胶致足肿胀法:将SD大鼠随机分为3组,分别为空白对照组、阳性对照组、阔叶十大功劳组,每组6只,分别给予0.9%生理盐水、1%阿司匹林、95%阔叶十大功劳醇提稀释水提液。各组大鼠分别给药1次,0.5 h后每只大鼠均在其右后足足跖皮下注射1%角叉菜胶致炎,每只0.1 mL。于注射后0.5、1.0、1.5 h时测量大鼠右后足足跖厚度,致炎前后足跖厚度之差作为肿胀度(mm),并计算大鼠的足跖肿胀率。足跖肿胀率(%)=(致炎后足跖厚度-致炎前足跖厚度)/致炎前足跖厚度×100%。
1.1.3 统计分析
本实验采用GraphPad Prism 9.4.1软件分析,GraphPad Prism是一种高效且易于使用的科学研究绘图分析软件,结合了科学图形、综合曲线拟合(非线性回归)、可理解的计算数据和数据组织,能够准确对各种数据进行分析,然后可视化形成各种图表[8]。实验数据均采用(‘x±s)表示。使用GraphPad Prism 9.4.1软件进行数据单因素方差分析,P<0.05表示差异具有统计学意义。
1.2 网络药理学分析
1.2.1 数据库及网站
依托网络数据库平台及在线作图网站进行网络药理学研究,所使用的数据库、在线作图网站有TCMSP(https://tcmsp-e.com/)、Symma(https://www.symmap.org)、SEA数据库(https://sea.bkslab.org)、STITCH数据库(http://stitch.embl.de/)、PubChem(https://pubchem.ncbi.nlm.nih.gov/)、SwissTargetPrediction(http://www.swisstargetprediction.ch/predict.php)、DrugBank(https://go.drugbank.com)、TTD(https://db.idrblab.net)、DisGeNET(https://www.disgenet.org)、GeneCards(https://www.genecards.org/)、OMIM(https://omim.org/)、Venny2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/index.html)、STRING(https://cn.string-db.org/)、DAVID(https://david.ncifcrf.gov/home.jsp)、PubMed(https://pubmed.ncbi.nlm.nih.gov/)、PDB(https://www.rcsb.org/)、微生信(http://www.bioinformatics.com.cn/)。
1.2.2 收集阔叶十大功劳靶点和炎症靶点
通过 TCMSP和Symmap数据库以及相关文献对阔叶十大功劳化学成分进行检索,根据口服利用度(oral bioavailability,OB)≥30%和类药性(drug-likeness,DL)≥0.18筛选出满足条件的化合物为候选化合物。将药物成分SMILES结构从PubChem中下载到SwissTargetPrediction、SEA和STITCH数据库中预测靶点,剔除重复的靶基因,获取阔叶十大功劳成分的潜在目标基因。将关键词“inflammation”输入到 OMIM、GeneCards、 DrugBank、TTD和DisGeNET数据库中,搜索与炎症有关的基因,提取GeneCards检索结果中score≥5的基因和DisGeNET、OMIM、DrugBank、TTD的所有“Human”基因,去重汇总后,得到与炎症相关靶点。
1.2.3 筛选交集靶点并构建蛋白质-蛋白质相互作用网络
通过Venny 2.1.0对药物靶点和疾病靶点进行在线作图,数据取交集即阔叶十大功劳潜在的抗炎靶点。将阔叶十大功劳潜在的抗炎靶点导入STRING数据库,将“Minimum required interaction score” 设置为“highconfidence (0.900)”,其他参数保持默认,将tsv.格式的数据结果上传至Cytoscape(3.9.1版),构建目标蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络,同时利用 Cytoscape软件插件MCODE及Cytohubba在PPI网络上搭建分子相互作用模块,筛选出核心靶点。
1.2.4 构建药物-成分-靶点网络
通过Cytoscape 3.9.1软件,将1.2.2获得的225个靶点与阔叶十大功劳药效成分相对应,构建出阔叶十大功劳药物-成分-靶点的网络图。
1.2.5 GO和KEGG功能富集分析
将1.2.3中得到的10个关键靶点导入 DAVID数据库里,选择“Homo sapiens”物种,进行基因本体(gene ontology,GO)功能富集和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路分析。通过微生信在线绘图软件,将GO和KEGG分析结果进行可视化。
1.2.6 分子对接
将阔叶十大功劳药对活性成分与10个关键靶点一一对应并进行分子对接,活性化合物小分子配体的2D结构从PubMed中获取,Hub蛋白结构文件从PDB数据库中获取,并将活性化合物配体和Hub蛋白结构导入DS BIOVIA Discovery Studio 2016 v16.1进行分子对接模拟,对接分数表明配体与受体间亲和能力的大小。
2 结果
2.1 动物实验
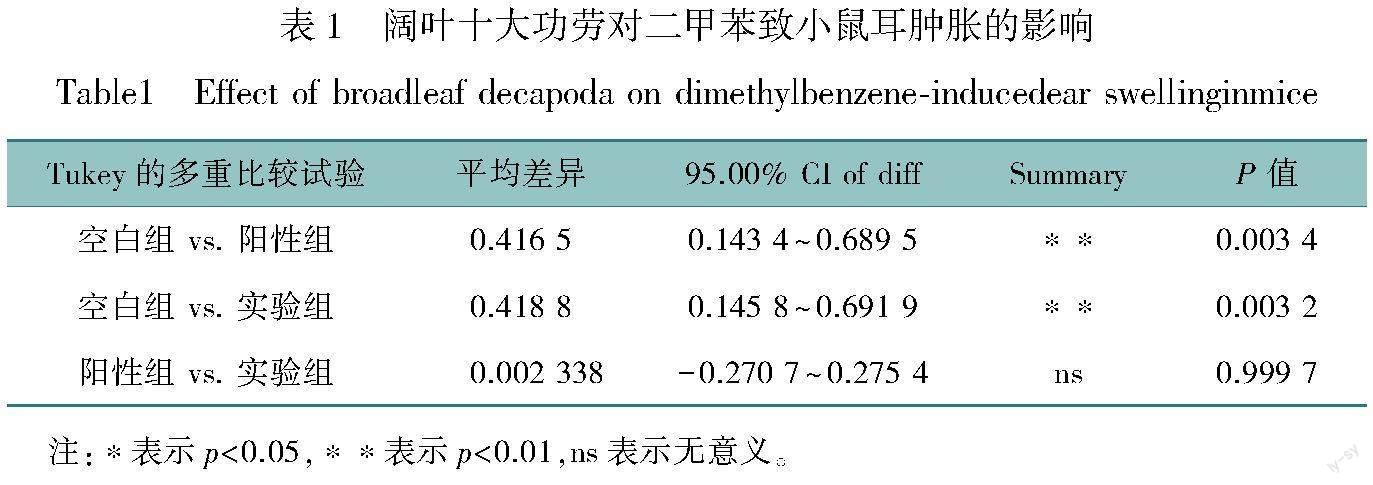
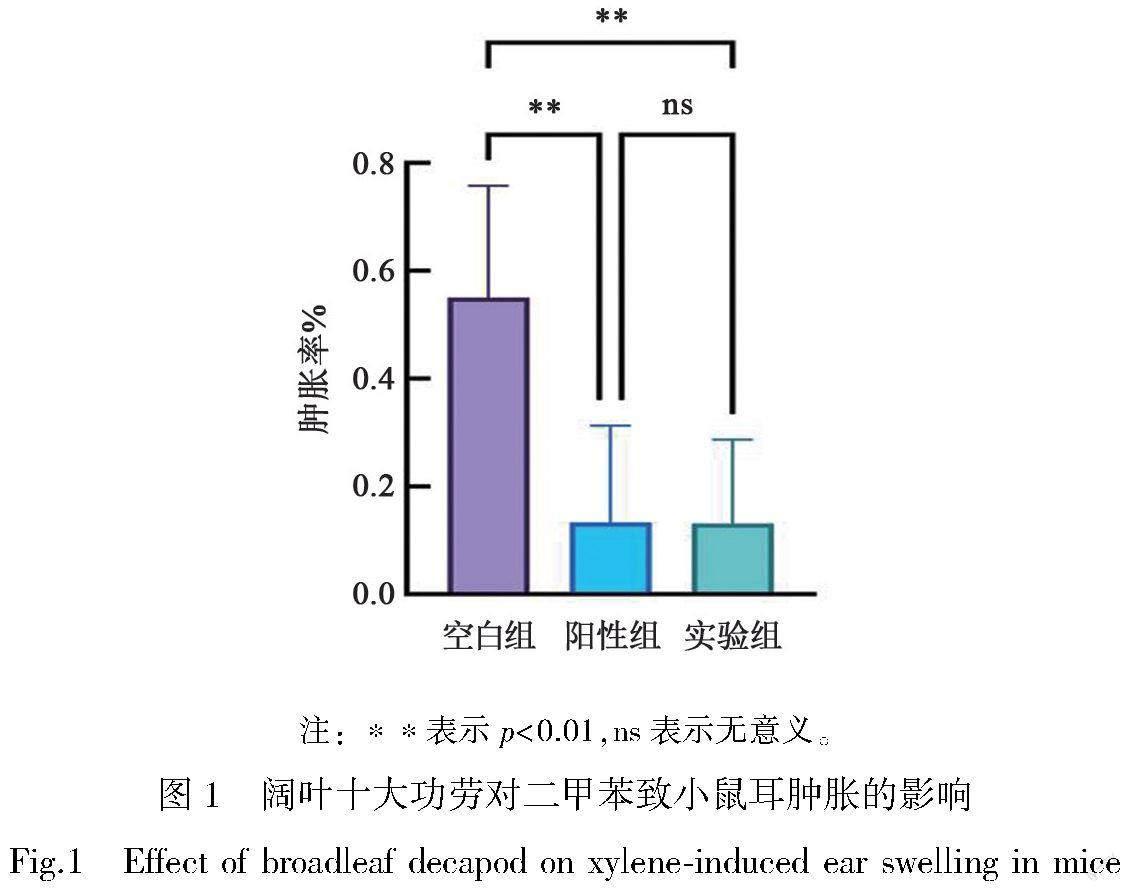
2.1.1 阔叶十大功劳对二甲苯致小鼠耳肿胀的影响
小鼠抗炎结果如图1所示,与生理盐水组(空白对照组)比较,阔叶十大功劳组(实验组)、阿司匹林组(阳性对照组)小鼠耳肿胀明显减轻,且均能有效降低小鼠两耳片质量的差值(‘p<0.01,表1)。
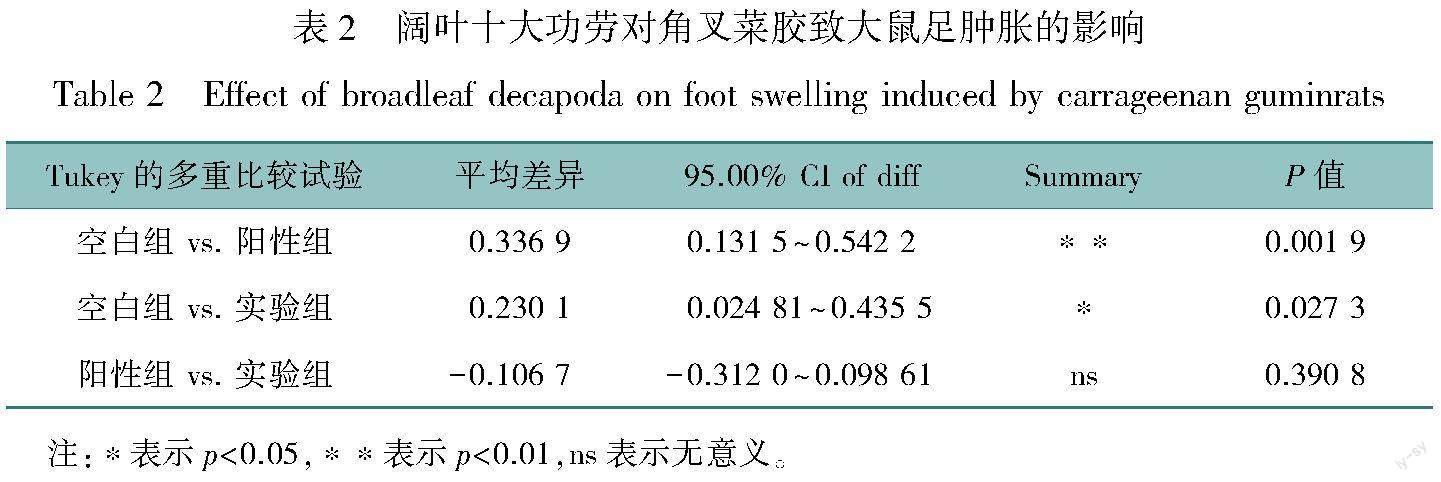
2.1.2 阔叶十大功劳对角叉菜胶致大鼠足肿胀的影响
大鼠抗炎结果如图2所示,与生理盐水组(空白对照组)相比,阔叶十大功劳组(实验组)与阿司匹林组(阳性对照组)均能有效降低角叉菜胶诱导的大鼠足肿胀率(‘p<0.05,见表2) ,但是阔叶十大功劳组效果不如阳性对照阿司匹林组。
2.2.1 阔叶十大功劳成分與靶点
在TCMSP、Symmap数据库及文献中查阅检索阔叶十大功劳化学成分,按OB值≥30%和DL值≥0.18筛选,总共筛选出阔叶十大功劳成分31个,除去无靶点的化合物,获得阔叶十大功劳成分28个,主要药效成分见表3,全表见OSID科学数据与内容附表1。采用“Homo sapiens”作为物种筛选的条件,去重汇总后获得阔叶十大功劳成分753个潜在靶点。
2.2.2 炎症靶点
以“inflammation”在GeneCards、OMIM等数据库检索与炎症有关的靶点,去重汇总后,得到1 054个靶点基因。通过Venny 2.1.0对2.2.1得到的753个阔叶十大功劳靶点基因和炎症靶点基因进行映射,获得药物和疾病的共同靶点225个,见OSID科学数据与内容附图1。
2.2.3 药物-成分-靶点网络分析
将2.2.2节的225个交集靶点,通过创建属性文件整理成分-靶点,得到药物-成分-靶点文件,将文件导入Cytoscape 3.9.1得到药物-成分-靶点网络图(见OSID科学数据与内容附图2)。附图2体现了阔叶十大功劳药物-成分-靶点的网络关系,图中蓝色圆形为成分对应的基因,橙色三角形表示阔叶十大功劳中能与这些基因反应的有效成分,共28个。
2.2.4 PPI网络分析
将2.2.2节225个共同靶点导入STRING数据库进行PPI分析,以置信度最大(0.900)为条件筛选,将数据结果上传至Cytoscape 3.9.1软件进行分析,去除游离蛋白,得到PPI图,见OSID科学数据与内容附图3。蛋白连接的线越多,表明该蛋白degree值越高,是关键蛋白。利用插件Cytoscape 3.9.1软件中MCODE 和 CytoHubba 插件筛选PPI 网络中的核心蛋白,得到了PIK3CA、SRC、EGFR、MAPK1、IL-2、STAT3、JUN、JAK3、JAK1、MAPK14等10个蛋白,表明这些蛋白与阔叶十大功劳抗炎作用有着更为直接的关系。
2.2.5 GO和KEGG功能富集分析
将2.2.4节得到的10个关键基因进行功能富集分析,其结果如OSID科学数据与内容附图4(a)所示,主要富集的细胞成分包括细胞核、细胞质、细胞骨架等;主要富集的生物过程有白细胞介素-6介导的信号传导途径,细胞对活性氧的反应,STAT蛋白的酪氨酸磷酸化等;主要富集的分子功能包括蛋白激酶结合,蛋白酪氨酸激酶活性,跨膜受体蛋白酪氨酸激酶活性等。在 KEGG 通路富集分析结果中(OSID科学数据与内容附图4(b)),富集的通路有新型冠状病毒感染、麻疹、人类巨细胞病毒感染、JAK-STAT信号传导途径、Th17细胞分化、Th1和Th2细胞分化等。
2.2.6 分子对接
为了测试化合物-靶点相互作用的可靠性,根据2.2.4的结果对选取的核心靶点进行分子对接验证。对接分数越高说明蛋白与配体的结合能越低,越容易结合。结果显示,11个活性成分与8个蛋白对接成功,其山茱萸苷H、异博尔定、硫唑胺、异鼠李素、鸦胆子苷M、鸦胆子苷J、槲皮素、不列颠宁、弗拉辛、小檗碱、与 JUN、JAK3、IL-2、MAPK14、EGFR、MAPK1、SRC、JAK1等蛋白有较好的亲和力。部分分子对接结果见表4,全表见OSID科学数据与内容附表2。部分分子对接结果示意图见OSID科学数据与内容附图5。
3 讨论
炎症是人体对致炎因子的损伤作用所引起的反应,能引起人体充血、肿胀、渗出和变性,局部组织缺血缺氧并伴有代谢机能的变化,严重者可引起多种疾病[9]。因此,控制过度的炎症反应对于机体的功能恢复非常关键。动物实验结果显示,阔叶十大功劳具有良好的抗炎效果。在对二甲苯致小鼠耳肿胀实验中,阔叶十大功劳与阳性对照阿司匹林表现出同等的抗炎效果;在对角叉菜胶致大鼠足肿胀实验中,阔叶十大功劳的抗炎效果相对阳性对照阿司匹林较弱,其原因可能是大、小鼠之间的种属差异所致。本研究通过网络药理学和分子对接的方法,构建了阔叶十大功劳的药物-成分-靶点网络,探索了阔叶十大功劳抗炎的物质基础和潜在作用机制。
本研究结果展示了阔叶十大功劳中小檗碱、槲皮素、不列颠宁、异博尔定等化合物具有抗炎活性,IL-2、SRC、EGFR、MAPK14等是阔叶十大功劳抗炎的核心靶点。IL-2是一种刺激细胞生长的因子,在免疫细胞中,IL-2与IL-2受体共同作用可导致Jak/STAT信号通路、PI3K/Akt信号通路和MEK/ERK信号通路活化,这些通路与炎症的发生密切相关[10]。EGFR是上皮生长因子(EGF)细胞增殖和信号传导的受体,降低 EGFR的含量,能有效控制其前期炎症发生发展,其作用机制可能是通过下调EGFR抑制PI3K-AKT信号通路的激活,促进细胞凋亡[11]。MAPK14是4个p38 MAPKs家族之一,p38 MAPKs 调节的转录级联过程中,相关促炎细胞因子IL-β 和 TNF-α会产生,炎症反应有关的酶会激活[12]。
分子对接结果表明JUN、JAK3、IL-2、MAPK14、EGFR等8个蛋白能够与小檗碱、槲皮素、不列颠宁、黄连素等11种有效成分稳定地结合。研究表明,异博尔定是林氏基(TARL)总生物碱中的主要生物活性成分之一,能够减轻小鼠胶原蛋白引起的关节炎和关节损伤[13]。不列颠宁是一种倍半萜化合物,具有显著的抗氧化和抗炎活性,能够减少炎症细胞浸润和黏液分泌的增加。研究表明,不列颠宁抑制HMC-1中促炎细胞因子的基因表达和分泌,口服给予不列颠宁(10~20 mg/kg)能够降低IgE致敏小鼠肥大细胞介导的PCA反应[14-15]。小檗碱可通过调控NF-κB、MAPK、PPARγ信号及其他途径来影响免疫细胞中Treg与Th17细胞间的平衡,并抑制IL-1β、IL-6、IL-8、IL-17、TNF-α及ICAM-1等炎症因子的分泌及表达,能阻礙白细胞黏附,迁移内皮,减少中性粒细胞的浸润,促使细胞凋亡及减少组织损伤[16-18]。槲皮素能通过沉默Toll样受体(TLR),进而抑制细菌脂多糖(LPS)诱导的细胞膜表面黏附分子和炎症介质的表达,从而发挥抗炎作用[19]。因此,结合靶点与成分分析,推测阔叶十大功劳中的小檗碱等成分通过抑制MAPK14等使IL-β与TNF-α等促炎细胞因子释放减少,达到抗炎作用。
炎症作为机体对于刺激的一种保护性反应,免疫细胞、血管和多种分子介质均有参与。KEGG 信号通路分析发现,阔叶十大功劳发挥抗炎的作用通路主要与癌症中途径、JAK-STAT信号传导途径、Th17细胞分化、Th1和Th2细胞分化等有关。研究表明炎症反应是肿瘤发生、发展的重要因素,可诱发肿瘤的发生、发展和转移[20]。JAK-STAT信号通路通过负调控因子(SOCS和PIAS)功能失调使得JAK/STAT信号通路持续激活,导致体内促炎细胞因子TNF-α、IL-1β、IL-6、生长因子等水平显著升高,而JAK-STAT信号传导途径是细胞因子分泌的运输枢纽,因此对于炎症反应的调节至关重要[21]。Th17和Th1免疫应答是一种促炎反应[22],TH2免疫应答是一种抗炎反应,通过促进特应性中的IgE和嗜酸性粒细胞反应并产生抗炎作用[23-25]。结合成分与通路分析,推测阔叶十大功劳中槲皮素、不列颠宁等成分作用于Th1、Th2和Th17等免疫细胞,参与JAK-STAT信号通路发挥抗炎作用。此外,KEGG结果中显示硫唑胺、鸦胆子苷等成分作用于乙型肝炎、新型冠状病毒感染、卡波西肉瘤相关的疱疹病毒感染、病毒性癌症的发生、麻疹等通路,这表明阔叶十大功劳中可能含有治疗癌症、麻疹、肺炎、肝炎的成分靶点,当然还有待于今后进一步的研究证实。
本研究利用体内实验证实了阔叶十大功劳的抗炎作用,同时利用网络药理学和分子对接对阔叶十大功劳抗炎物质基础及作用机制进行预测。研究结果表明,阔叶十大功劳能够有效减轻小鼠及大鼠的炎症反应,抗炎的主要成分可能为小檗碱、槲皮素、不列颠宁等,抗炎的机制可能是通过作用于IL-2、MAPK14、EGFR等靶点参与JAK-STAT信号通路。
参考文献:
[1]中国科学院中国植物志编辑委员会.中国植物志第二十九卷[M]. 北京: 科学出版社,2001: 235.
[2]汪毅. 中国苗族药物彩色图集[M]. 贵阳: 贵州科技出版社, 2002.
[3]贵州省民委文教处. 苗族医药学[M].贵阳:贵州民族出版社,1992.
[4]刘偲翔, 刘布鸣, 何开家, 等. 两种十大功劳叶中生物碱成分的分析与比较[J]. 中国药业, 2010, 19(5): 4-5. DOI: 10.3969/j.issn.1006-4931.2010.05.002.
[5]郭立敏, 吕洁丽, 张来宾. 天然倍半萜类化合物抗炎作用机制的研究进展[J]. 中国中药杂志, 2018, 43(20): 3989-3999. DOI: 10.19540/j.cnki.cjcmm.20180726.013.
[6]KIM H J, JOE H I, ZHANG Z Y, et al. Anti-inflammatory effect of Acalypha australis L. via suppression of NF-κB signaling in LPS-stimulated RAW 264.7 macrophages and LPS-induced septic mice[J]. Molecular Immunology, 2020, 119: 123-131. DOI: 10.1016/j.molimm.2020.01.010.
[7]LI S S, LI J, SUN J, et al. Berkeleyacetal C, a meroterpenoid isolated from the fungus Penicillium purpurogenum MHZ 111, exerts anti-inflammatory effects via inhibiting NF-κB, ERK1/2 and IRF3 signaling pathways[J]. European Journal of Pharmacology, 2017, 814: 283-293. DOI: 10.1016/j.ejphar.2017.08.039.
[8]MITTEER D R, GREER B D, RANDALL K R, et al. Further evaluation of teaching behavior technicians to input data and graph using GraphPad Prism[J]. Behavior Analysis: Research and Practice, 2020, 20(2): 81-93. DOI: 10.1037/bar0000172.
[9]楊翰林, 罗川晋, 吴伟. 湿热与瘀热类炎症的中医思考[J]. 中西医结合心脑血管病杂志, 2019, 17(3): 464-467. DOI: 10.12102/j.issn.1672-1349.2019.03.042.
[10]YE C X, BRAND D, ZHENG S G. Targeting IL-2: an unexpected effect in treating immunological diseases[J]. Signal Transduction and Targeted Therapy, 2018, 3: 2. DOI: 10.1038/s41392-017-0002-5.
[11]缪志伟, 徐艳, 宁丽琴, 等. 白头翁汤治疗溃疡性结肠炎分子机制的网络药理学分析及初步验证[J]. 中国中药杂志, 2020, 45(8): 1808-1815. DOI: 10.19540/j.cnki.cjcmm.20191112.406.
[12]KIM D K, LIM J H, LEE J, et al. Synthesis and biological evaluation of trisubstituted imidazole derivatives as inhibitors of p38α mitogen-activated protein kinase[J]. Bioorganic & Medicinal Chemistry Letters, 2008, 18(14): 4006-4010. DOI: 10.1016/j.bmcl.2008.06.007.
[13]LI Y, ZENG R J, CHEN J Z, et al. Pharmacokinetics and metabolism study of isoboldine, a major bioactive component from Radix Linderae in male rats by UPLC-MS/MS[J]. Journal of Ethnopharmacology, 2015, 171: 154-160. DOI: 10.1016/j.jep.2015.05.042.
[14]PARK H H, KIM S G, PARK Y N, et al. Suppressive effects of britanin, a sesquiterpene compound isolated from inulae Flos, on mast cell-mediated inflammatory responses[J]. The American Journal of Chinese Medicine, 2014, 42(4): 935-947. DOI: 10.1142/s0192415x14500591.
[15]KIM S G, LEE E, PARK N Y, et al.Britanin attenuates ovalbumin-induced airway inflammation in a murine asthma model[J]. Archives of Pharmacal Research, 2016, 39(7): 1006-1012. DOI: 10.1007/s12272-016-0783-z.
[16]LI C L, TAN L H, WANG Y F, et al. Comparison of anti-inflammatory effects of berberine, and its natural oxidative and reduced derivatives from Rhizoma Coptidis in vitro and in vivo[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2019, 52: 272-283. DOI: 10.1016/j.phymed.2018.09.228.
[17]李紅枚, 党万太, 杨小红. 小檗碱抗炎机制的研究进展[J]. 中国医药导报, 2017, 14(33): 31-34.
[18]CALICETI C, FRANCO P, SPINOZZI S, et al.Berberine: new insights from pharmacological aspects to clinical evidences in the management of metabolic disorders[J]. Current Medicinal Chemistry, 2016, 23(14): 1460-1476. DOI: 10.2174/0929867323666160411143314.
[19]BYUN E B, YANG M S, CHOI H G, et al. Quercetin negatively regulates TLR4 signaling induced by lipopolysaccharide through Tollip expression[J]. Biochemical and Biophysical Research Communications, 2013, 431(4): 698-705. DOI: 10.1016/j.bbrc.2013.01.056.
[20]范丽梅, 柳昀熠, 潘钰, 等. 炎症与肿瘤的关系研究进展[J]. 江汉大学学报(自然科学版), 2016, 44(5): 432-437. DOI: 10.16389/j.cnki.cn42-1737/n.2016.05.009.
[21]BANERJEE S, BIEHL A, GADINA M, et al. JAK-STAT signaling as a target for inflammatory and autoimmune diseases: current and future prospects[J]. Drugs, 2017, 77(5): 521-546. DOI: 10.1007/s40265-017-0701-9.
[22]DONG C. Differentiation and function of pro-inflammatory Th17 cells[J]. Microbes and Infection, 2009, 11(5): 584-588. DOI: 10.1016/j.micinf.2009.04.001.
[23]MOSS R B, MOLL T, EL-KALAY M, et al. Th1/Th2 cells in inflammatory disease states: Therapeutic implications[J]. Expert Opinion on Biological Therapy, 2004, 4(12): 1887-1896. DOI: 10.1517/14712598.4.12.1887.
[24]ROMAGNANI S. Th1/Th2 cells[J]. Inflammatory Bowel Diseases, 1999, 5(4): 285-294. DOI: 10.1097/00054725-199911000-00009.
[25]WALKER J A, MCKENZIE A N J. TH2 cell development and function[J]. Nature Reviews Immunology, 2018, 18(2): 121-133. DOI: 10.1038/nri.2017.118.
