藏药脑神宝丸方中应用培育牛黄与天然牛黄对高原性心脏病患者症状表现、心功能、凝血功能及血清氧化应激水平的影响Δ
2024-02-26桑德才让拉毛措华青加
桑德才让,拉毛措,华青加
(1.果洛州藏医院高原心脏病专科,青海 果洛 814000; 2.果洛州藏医院妇儿科,青海 果洛 814000; 3.果洛州藏医院制剂管理部,青海 果洛 814000)
高原性心脏病(high altitude heart disease,HAHD)是慢性心血管疾病,多发于海拔3 000 m以上地区,因机体长时间处于低压低氧环境中,肺小动脉出现功能性、器质性变化引起肺动脉高压,进展引起心力衰竭[1-2]。藏药脑神宝丸是治疗心血管疾病的常用药物之一,主要成分包括丁香、水牛角、麝香、肉豆蔻、牛黄和沉香等,具有滋补肝肾、通经活血和养心安神的功效,对血运受阻引起的头痛头晕、精神紧张、情绪波动和心慌心悸等具有良好效用,符合中医治疗高血压通窍活血、调理脏腑的治疗原则。但组方中牛黄为罕见、珍贵中药材,价格较高,增加了患者经济负担。自20世纪90年代体外培育牛黄研制成功以来,其培训工艺及技术不断完善,产量不断增加,可弥补天然牛黄获取稀少的局限性[3]。且既往有研究证实,培育牛黄在不同疾病中具有良好的使用价值[4-5]。但关于天然牛黄与培育牛黄在心血管疾病中的作用效果对比研究较少。为探明培育牛黄与天然牛黄制成的藏药脑神宝丸在HAHD患者治疗中是否存在疗效差异,本研究分析了藏药脑神宝丸方中应用天然牛黄与培育牛黄对患者症状表现、凝血功能、心功能及血清氧化应激水平的影响,以期为临床选择经济学价值更高的治疗方案提供参考。
1 资料与方法
1.1 资料来源
选取2019年9月至2022年8月就诊于我院的HAHD患者80例。纳入标准:(1)符合HAHD诊断标准[6], ①心电图显示右心室肥厚;②超声心电图显示右心室内径≥23 mm,右心室流出道≥33 mm;③胸部X线检查显示右肺下动脉干横径与气管横径比值≥1.1或右肺下动脉干横径≥17 mm; ④心导管显示肺动脉平均压≥25 mm Hg(1 mm Hg=0.133 kPa);符合以上2项即确诊为HAHD;(2)患者来自高原地区(海拔3 000 m以上);(3)年龄18~60岁;(4)患者自愿参与本研究,已签署同意书。排除标准:(1)合并心肌病、先天性心脏病、慢性阻塞性肺疾病、冠心病和急性心肌梗死等心脏疾病者;(2)合并免疫、凝血功能障碍者;(3)严重感染者;(4)合并恶性肿瘤者;(5)重要器官出现器质性病变者;(6)精神类疾病者;(7)依从性较差,不能完成饮食、运动、用药等要求者。
以单盲随机数字表法分为天然组(n=40)、培育组(n=40)。具体分组步骤:预设1—80个编号,将编号导入随机数字表中,按照1∶1的比例随机生成两组,于患者就诊确诊后,征求患者同意将其纳入研究对象,根据就诊顺序将对应编号患者归于相应组别,同时向患者设盲,由医师给予对应方案治疗。本研究经我院伦理委员会审核批准[院科伦审:(2019)伦审第(263)号]。两组患者临床资料均衡可比,见表1。

表1 两组患者临床资料比较
1.2 方法
两组患者均根据病情给予常规治疗:指导患者卧床休息,采用持续或间断吸氧干预;对症给予强心、平喘、利尿或维持电解质平衡等药物治疗;治疗期间,指导患者清淡饮食,禁食辛辣、刺激食物,杜绝烟酒等不良生活习惯,禁止剧烈运动。
(1)天然组患者在常规治疗的基础上联合藏药脑神宝丸治疗,组方为水牛角15 g、丁香15 g、麝香10 g、牛黄15 g、肉豆蔻15 g和沉香15 g,其中牛黄采用天然牛黄。由我院制剂科制成丸剂,每丸6 g,口服,1次1丸,1日2次,连续用药14 d。(2)培育组患者在常规治疗基础上联合藏药脑神宝丸治疗,组方中牛黄选用培育牛黄,其他药材种类、剂量等与天然组完全一致,且保持两组患者药丸外观、性状和包装一致,服用方法同天然组,连续用药14 d。
1.3 观察指标
(1)临床症状:参照《中药新药临床研究指导原则:试行》[7],将患者呼吸困难、头晕/头痛、疲乏、烦躁不安和胸闷症状按照无、轻、中及重分别记为0、2、4及6分,得分越高,提示患者临床症状越严重。(2)心率、心功能:治疗前后采用IE33型心脏彩色超声仪测定患者心率、右心室射血分数(RVEF)、肺动脉收缩压(SPAP)和右心房收缩波(As)。(3)凝血功能:治疗前后采集患者静脉血,抗凝后离心,后取血浆,采用SysmexCA-1500型全自动凝血分析仪检测活化部分凝血活酶时间(APTT)、纤维蛋白原(FIB)、纤维蛋白原降解产物(FDP)和凝血酶原时间(PT)。(4)血清氧化应激指标:治疗前后采血分离后取血清,采用黄嘌呤氧化酶法测定超氧化物歧化酶(SOD)水平,采用硫代巴比妥酸法测定丙二醛(MDA)、脂质过氧化物(LPO)水平,采用双抗体夹心法测定谷胱甘肽过氧化物酶(GSH-Px)水平。(5)安全性:统计两组患者在治疗过程中出现的恶心、腹痛、腹泻和头晕等不良反应。
1.4 统计学方法
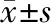
2 结果
2.1 临床症状
两组患者治疗后呼吸困难、疲乏、头晕/头痛、胸闷和烦躁不安评分低于治疗前,差异均有统计学意义(P<0.05);天然组患者治疗前后呼吸困难、疲乏、头晕/头痛、胸闷和烦躁不安评分与培育组同时间比较,差异均无统计学意义(P>0.05),见表2。
2.2 心率、心功能
两组患者治疗后心率、As和SPAP水平低于治疗前,RVEF水平高于治疗前,差异均有统计学意义(P<0.05);天然组患者治疗后心率、RVEF、As和SPAP水平与培育组比较,差异均无统计学意义(P>0.05),见表3。

表3 两组患者治疗前后心率、心功能比较
2.3 凝血功能
两组患者治疗后APTT、PT长于治疗前,FIB、FDP水平低于治疗前,差异均有统计学意义(P<0.05);天然组患者治疗后APTT、PT、FIB和FDP水平与培育组比较,差异均无统计学意义(P>0.05),见表4。

表4 两组患者治疗前后凝血功能比较
2.4 血清氧化应激指标
两组患者治疗后SOD、GSH-Px水平高于治疗前,LPO、MD水平低于治疗前,差异均有统计学意义(P<0.05);天然组患者治疗后SOD、LPO、GSH-Px和MD水平与培育组比较,差异均无统计学意义(P>0.05),见表5。

表5 两组患者治疗前后氧化应激指标比较
2.5 安全性
天然组患者出现腹泻2例,恶心1例,不良反应发生率为7.50%(3/40);培育组患者出现腹泻1例,不良反应发生率为2.50%(1/40)。两组患者不良反应均为轻度,未停药未干预,在疗程中自行恢复。天然组、培育组患者的不良反应发生率比较,差异无统计学意义(χ2=0.263,P=0.608)。
3 讨论
HAHD以心悸、胸闷和呼吸困难为典型特征,成人HAHD多为慢性疾病,治疗不当易发展为心力衰竭,危及患者生命[1]。相关研究表明,长期低强度、慢性缺氧会促使肺血管壁异常收缩,刺激内皮细胞过量分泌内皮素,引起肺动脉血管重构,造成肺动脉高压,损伤患者右心室结构与功能[8]。中医尚无关于HAHD的明确解释,根据患者临床症状尝试将其归于“心悸”“胸痹”和“水肿”范畴,其病位在心,心主血脉,心气虚弱,鼓动无力,久则水湿痰饮内生,故治疗应温补心阳、通路活血[9]。藏药脑神宝丸方中含有多种中药材,其中丁香可助阳补肾,温中降逆;麝香有通经活络之效;沉香可温中止呕,纳气平喘,止行气痛;水牛角有凉血定惊之效;肉豆蔻可温中行气;牛黄有清心开窍、解毒凉肝之效[10-12]。现代药理学研究证实,麝香、水牛角和牛黄均具有良好的强心效果,联合施治,可增强疗效[13]。陈海等[14]在动物实验中指出,联合培育牛黄可促进大鼠血管新生。王素玉等[15]在相关研究中表示,安宫牛黄丸以牛黄为主药,应用安宫牛黄丸治疗可调节患者血液黏度,改善局部微循环,这有助于缓解缺氧缺血引起的心肌损伤。本研究中,两组患者服用的藏药脑神宝丸组方完全一致,且方中天然牛黄与培育牛黄纯度一致、用量一致,仅制备方法不同。治疗后,两组患者临床症状、心功能和心率均显著改善,而组间比较的差异无统计学意义(P>0.05),说明藏药脑神宝丸方辅助治疗可缓解HAHD患者的临床症状,改善心功能,且培育牛黄与天然牛黄效果相当。Yu等[16]也在研究中表示,培育牛黄可发挥与天然牛黄相似治疗作用。
高原环境具有显著的生物学效应。既往研究证实,在慢性缺氧状态下,机体会通过自我调节以维持生命活动平衡,促使红细胞生成速率增加,而血液中红细胞水平升高,会导致血液黏滞,加重肺动脉高压及心脏负荷的同时,还会刺激炎症因子大量分泌,损伤血管内皮细胞[17]。APTT、PT、FIB和FDP为血液检查常见指标,可反映机体凝血系统功能状态。段唐海等[18]指出,老年冠心病患者处于高凝状态。本研究对HAHD患者治疗前数据进行统计,也发现相似情况,提示患者血栓形成风险较高。两组患者治疗前后APTT、PT、FIB和FDP水平比较,差异均无统计学意义(P>0.05);两组患者治疗后的APTT、PT均长于治疗前,FIB、FDP水平均低于治疗前,差异均有统计学意义(P<0.05),提示患者的凝血功能得到改善。分析原因,牛黄具有抑制血小板聚集的作用;水煎水牛角可抑制实验性凝血障碍;丁香具有良好的抗凝血作用[19]。匡柏成等[20]的研究证实,丁香中的有效成分甲基丁香酚还能抗缺氧。多种药物联合,可降低血小板聚集效应,改善凝血功能。本研究中,两组患者治疗后凝血指标水平的差异无统计学意义(P>0.05),也在一定程度上说明培育牛黄与天然牛黄在抗血小板聚集中具有相似效力。进一步分析HAHD的发生机制,发现低压低氧带来的氧化应激损伤与HAHD密切相关。温玉等[21]的动物实验也证实,心功能异常大鼠存在明显的氧化应激。
LPO具有细胞毒性,可改变细胞膜通透性,诱导溶酶体酶释放,破坏细胞结构,其参与脂质过氧化过程,会产生大量自由基,经过一系列断裂反应最终会分解为MDA[22]。MDA、SOD为氧化应激常用评价指标,MDA可反映机体受自由基攻击的严重程度;SOD是机体中重要的抗氧化酶,可清除多余自由基,缓解细胞损伤[23]。GSH-Px也是一种分解酶,可通过清除细胞外过氧化氢产物参与氧化应激过程[24]。机体氧化应激反应越明显,对血管细胞的损伤越严重,从而影响局部血液微循环,加重HAHD患者的临床症状。本研究中,两组患者治疗后的SOD、GSH-Px水平均较治疗前升高,LPO、MDA水平均较治疗前降低,差异均有统计学意义(P<0.05),且两组患者氧化应激指标改善幅度的差异无统计学意义(P>0.05),提示在常规治疗的基础上联合天然牛黄或培育牛黄配制的藏药脑神宝丸治疗均可减轻机体氧化应激损伤,有助于恢复血管等组织细胞代谢稳定,缓解病症。
综上所述,藏药脑神宝丸方中选用天然牛黄或培育牛黄均能促进HAHD患者病情好转,还能缓解氧化应激损伤,调节凝血功能,且不良反应少。本研究仅从药效价值进行调查,发现培育牛黄与天然牛黄作用相当,但未对其微量元素的差异进行分析,可以肯定的是,培育牛黄的胆红素含量可稳定控制在35%以上,已达到良好药用价值,具体的微量元素差异还需进一步实验学数据予以验证。提示临床还需开展专项研究,从分子学角度分析培育牛黄的作用。
