基于硅基过滤片的精子优选芯片设计与优化
2024-02-24李金坤童先宏江小华周典法周成刚
李金坤,童先宏,江小华,周典法,魏 钰,周成刚,
(1.中国科学技术大学 微电子学院,安徽 合肥 230026;2.中国科学技术大学附属第一医院(安徽省立医院)生殖中心,安徽 合肥 230001;3.中国科学技术大学微纳研究与制造中心,安徽 合肥 230026)
0 引言
随着生存环境和生理条件的变化,男性不育率逐年增加,人类对辅助生殖技术(assisted reproduction technology,ART)的应用需求日益增长[1]。自1978年首例试管婴儿诞生以来,在全球约有800 万婴儿是借助ART 诞生的,并且新生儿数量每年都在持续增加[2]。宫腔内人工授精(intrauterine insemination,IUI)和体外受精(in vitro fertilization/intracytoplasmic sperm injection,IVF/ICSI)技术已成为治疗不孕症的有效手段[3~5]。健康精子的选择对于ART 至关重要,它既影响ART的成功率,又影响后代健康。
在ART中,精液处理方法主要有密度梯度离心法和直接上游法。这些方法均使用了离心富集精子的步骤,离心会产生活性氧(reactive oxygen species,ROS),导致精子过氧化损伤,影响DNA碎片率(DNA fragmentation index,DFI)并损害精子功能[6~9]。过多的ROS含量,还会引起精子质量降低而影响精卵结合,可能降低ART 成功率[10~13]。近些年,随着微纳米制造技术的发展涌现许多新技术,如微流控、电泳技术等,消除了离心步骤,可以选择具有较低的DFI、更高活力的精子,并改善了ART结果[14],但这些设备的精液处理的吞吐量低,因此限制了他们在生殖医学临床的应用[15~18]。
为了解决传统精子优选和当前微流控精子优选方法的局限性,本文构建了一种基于微孔过滤片的精子优选微流控设备,通过对硅基过滤片的孔间距和优选时间进行优化,利用高活力的健康精子可以抵抗重力,在微孔的引导下游向样本收集腔,提供了一种可以从未处理的精液样本中高通量地分离出高活力、高DNA完整性和高形态正常率精子的优选方法,可满足ART临床需要。
1 实验部分
1.1 实验材料
1.1.1 精液样本
本文研究所用精液样本全部来自安徽省立医院生殖中心就诊的男性患者,共20 例,年龄22~48 岁,禁欲3~7天,患者通过手淫方式取精于干燥无菌取精杯中,置于37 ℃水浴箱内30 min 后液化,实验在液化后10 min 内进行。纳入标准:按WHO 标准,精液量≥2 mL,精液密度≥15×106(百万个/mL),正常形态率≥4%。排除标准:少弱精症或畸形精子症患者的精液。
1.1.2 试剂与仪器
人类输卵管液(human tube fluid,HTF)(M1130,南京爱贝生科技有限公司);聚二甲基硅氧烷(polydimethylsiloxane,PDMS)(Sylgard 184,Dow Corning);精子形态检测试剂盒(快速染色法,安科生物);精子DNA碎片染色试剂盒(流式细胞法,浙江星博生物科技股份有限公司);接触式紫外光刻机(MABA6,Karl Suss);磁控溅射(LAB 18,Kurt J.Lesker);反应离子刻蚀机(PlasmaPro NGP 80,Oxford);等离子清洗机(PTL-VM500,PTL电气科技)。
1.2 实验方法
1.2.1 硅基过滤片设计与加工
利用标准的光刻技术,在表面覆盖100~200 nm 的氮化硅(Si3N4)片的正反两面先后进行光刻显影与干法刻蚀。硅片正面光刻图形为直径10 μm的圆形孔阵列,背面套刻图形为边长为10mm 的正方形阵列。用黑蜡涂覆硅片正面,保护正面图形,然后将硅片放入氢氧化钾(KOH)溶液中,从背面正方形窗口进行湿法刻蚀。预留约80 μm 厚的硅薄膜,再使用干法刻蚀从正面将微米(μm)级的孔阵列刻穿,最后用激光将硅片划成15 mm×15 mm 独立的过滤片。硅基过滤片掩模版及实物如图1所示。硅基过滤片的孔径固定为10 μm,通过改变孔的边缘距离(孔间距),进而改变过滤片的通量。
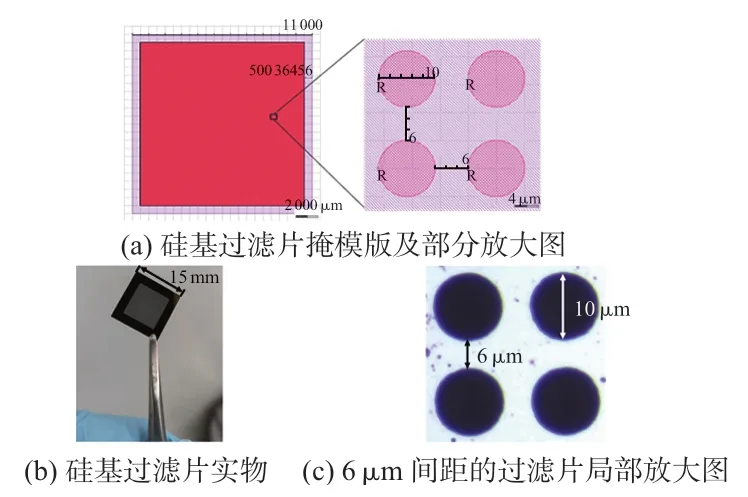
图1 硅基过滤片示意
图1(a)为硅基过滤片掩模版,硅基过滤片过滤膜部分为边长11 000 μm的正方形,有微孔部分为边长10 000 μm的正方形,其中过滤片微孔的孔径固定为10 μm,孔间距分别为4,6,10 μm,3 种不同孔间距的过滤片通量比为即40∶35∶28,即使最大孔间距10 μm的过滤片也有25万个微孔。在微孔全部导通的情况下,单位时间内最高可处理25万个精子。
1.2.2 PDMS芯片设计
根据所设计的PDMS器件,使用数控机床加工聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)—铝(Al)模具,然后将适量PDMS前聚合物和固化剂按照10∶1 体积比混合,充分搅拌后,用真空泵去除气泡。将混合后PDMS缓慢地浇筑在模具中,放置在75 ℃烤箱中。2 h 后,PDMS 固化成型,将PDMS从模具中取出,然后使用氧等离子体分别处理PDMS、硅基过滤片和玻璃基底表面,再进行键合。键合后的PDMS芯片原理如图2所示。

图2 PDMS芯片结构示意
由图2可知,精子优选芯片由PDMS、硅基过滤片和玻璃基底3部分组成,PDMS 与玻璃基底键合形成水平通道。硅基过滤片水平放置,将精液腔室分成精液存储池和精液收集池。图中尺寸标注单位为mm。
1.2.3 精子活力筛选时间优化
在收集池中加入400 μL 的HTF,精液液化后,混匀等分为4组,4组精液按同样标准处理。取500 μL 液化后的精液样本,缓慢加入精子优选芯片的进样池,精液液面至硅基过滤片下表面,加样期间避免气泡产生。将带有精液样品和HTF的芯片水平放入37℃恒温箱中静置,分别于7,15,30,60 min,从收集池取20 μL 精液样本,精液样本参照《WHO人类精液检查与处理实验室手册(第五版)》的标准进行处理,使用计算机辅助精子分析(computer-assissted sperm analysis,CASA)系统进行精液常规分析,每次每组实验重复3次。
1.2.4 过滤片孔间距优化
选取最优精子活力筛选时间(15 min),用于芯片的过滤片孔间距优化,分别在过滤片孔间距为4,6,10 μm 的芯片的收集池加入400 μL的HTF,然后在进样池加入500 μL精液。将芯片放入37 ℃恒温箱中,经过15 min,在收集池取20 μL精液样本进行精液常规分析,每次每组实验重复3次。
1.2.5 精子形态学染色
使用精子形态学快速染色液(Diff-Quik 法)对精子形态染色。评估200个没有重叠的完整精子,对每个精子的各个部位进行仔细观察,严格区分正常与缺陷的精子。
1.2.6 精子DFI分析
所用精子DNA碎片染色试剂盒是一种基于流式细胞术的精子DNA完整性检测技术,实验操作步骤严格按照试剂盒说明书实施。精液经过酸化变质处理,去除核蛋白,保留精子DNA部分。经过酸处理的精子和细胞核在丫啶橙染色后,异常的单链DNA结构与染料结合发出红色荧光,正常的双链DNA结构与染料结合发出绿色荧光,最终通过流式细胞仪读取比例得出结果。
1.2.7 分组设计
每份精液收集液化后,完成精液常规检查和形态学分析,符合纳入标准的精液等分为4份。
1.2.8 观察指标
获得足够多且活力高的精子是精子筛选实验的主要目的,因此实验结果主要从这两方面进行评估:1)收集池精子活力=(收集池前向运动精子数目/收集池总精子数目)×100%;2)收集池活动精子回收率=(1 mL 收集池样本中前向运动精子数量/1 mL进样池样本中前向运动精子数量)×100%。其中,收集池精子活力可以使用精液常规参数中前向运动精子百分比表示,收集池活动精子回收率计算方法为:[(收集池前向运动精子百分比×收集池精子浓度×收集池体积)/(进样池前向运动精子百分比×进样池精子浓度×精液体积)]×100%。
1.2.9 统计学处理
采用SPSS24.0统计软件进行数据处理与统计分析,呈正态分布、方差齐的计量数据以表示,组间比较采用单因素方差分析,两两比较采用最小显著差异t 检验(LSD-t),P <0.05为差异有统计学意义。
2 结果与讨论
2.1 精子活力筛选与筛选时间优化结果
通过硅基过滤片的精子优选,精子活力明显升高,但随着上游时间的延长,收集池中精子活力逐渐下降,且差异有统计学意义(F =22.894,P <0.05)。如图3 所示,实验开始7 min后,精子活力从原液的(36.99 ± 3.08)%上升到(88.68 ±3.40)%,60 min 时,精子活力下降至(78.43 ±2.43)%;但前向运动精子回收率明显升高,前向运动精子回收率从7 min时为(5.79 ±3.71)%,60 min 时为(62.58 ±18.05)%,但15 min和30 min的活动精子回收率数据之间的差异无统计学意义。综合考虑精子活力和活动精子回收率,因此15 min为理想的精子的优选时间。

图3 收集池精子活力和活动精子回收率随时间的变化
2.2 精子活力筛选与过滤孔间距优化结果
使用孔间距分别为4,6,10 μm 3 种规格的过滤片进行精子活力和回收率的优选实验。将芯片放置在恒温箱保温15 min后进行精液常规检测和活动精子回收率的计算。3种规格芯片的回收率分别为(39.79 ± 12.06)%、(37.26 ±19.73)%、(21.71 ±8.91)%,各组数据差异有统计学意义(F =7.63,P <0.05)。优化结果如图4 所示,从图中可以看出,精子活力随着硅基过滤片孔间距的增大而升高,而活动精子回收率随着过滤片孔间距的增大而逐渐降低,且各组数据之间有统计学差异。综合考虑收集池精子活力和活动精子回收率,从3 种规格的过滤片中选择6 μm孔间距的过滤片作为最优的精子筛选器件。
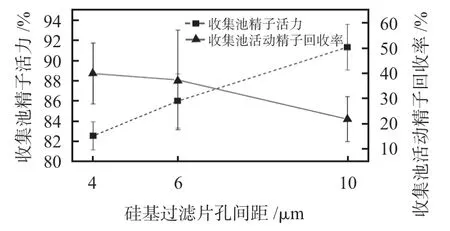
图4 收集池精子活力和活动精子回收率随过滤片孔间距的变化
2.3 优选后精子形态和DFI分析结果
选择6 μm孔间距过滤片的精子优选芯片进行精子筛选实验,在筛选15 min后,对收集池的精子DFI和精子形态正常率进行分析。未筛选的精液样本DFI 为(20.86 ±2.61)%,筛选后收集池中精液DFI降低至(6.77 ±0.64)%,两组数据差异有统计学意义(t =9.087,P <0.05)。筛选前精液样本中精子形态正常率为(10.33 ±5.69)%,筛选后形态正常率提高至(58.00 ±12.00)%,两组数据差异有统计学意义(t =-6.217,P <0.05)。该实验装置筛选后的精子具有较低的DFI和较高的形态正常率,如图5 所示。其中,图5(c)、(d)为精子染色后使用40倍油镜观察图。

图5 优选后精子DNA碎片和形态分析
2.4 结果讨论
实验结果显示,使用硅基过滤片可以对精子质量进行有效筛选,筛选后的精子具有更高的活力、DNA 完整性和形态正常率。精子活力、数量与DFI和形态正常率呈一定的相关性[19],相比于未经筛选的精液样本,收集池中的高活力精子的DFI降低,形态正常率得到提升。硅基过滤片的孔间距对筛选后的精子活力和活动精子回收率有明显影响。
筛选时间和过滤片孔间距对精子活力和活动精子回收率的影响是相互制约的。较长的筛选时间,允许更多的活动精子通过过滤片,但是同时也有一些低活力精子被带入到收集池,所以相比于15 min,30 min的活动精子回收率较高,但精子活力有所下降。较小的孔间距意味着在相同面积的硅基过滤片上有更多的微孔,这允许更多的精子通过过滤片,所以在相同时间内收集池中会有更多的活动精子,但较小的孔间距同时也增大了低活力精子被带入收集池中的风险。所以相比于4 μm的孔间距的过滤片,使用10 μm的过滤片收集的精子具有更高的活力值,但回收率较低。
3 结论
本文开发了一种简单的微流控精子优选芯片,该芯片利用过滤片中数十万微米尺度的小孔,高活力精子会克服重力穿过微孔,游向精子收集池。使用该方法可以从液化后的精液样本中优选出具有高活力、高DNA完整性和高形态正常率的精子。根据精子活力和活动精子回收率两项标准,对精子筛选时间和硅基过滤片的孔间距进行了优化,确定了一般情况下的最优筛选时间为15 min,过滤片孔间距为6 μm。
综上,利用该精子优选芯片可以有效地筛选出足够多的前向运动的精子。筛选后的精子同时具有较高的DNA完整性和形态正常率。芯片精液吞吐量大,活动精子回收率较高具有一定的临床应用价值,为后续进行体外受精实验奠定基础。
