CH4和CO2共转化反应机理研究进展
2024-02-23成昊霖年瑶韩优
成昊霖,年瑶,2,韩优,2
(1 天津大学化工学院,天津 300072;2 物质绿色创造与制造海河实验室,天津 300192)
二氧化碳(CO2)和甲烷(CH4)是导致全球气候变暖的第一和第二大温室气体,两种气体的排放量与全球气候变化密切相关[1-2]。在过去几十年中,化石能源的燃烧导致大气中温室气体的含量显著增高,其中CO2的排放量以平均每年1%的速度逐步增长。国际能源部署(IEA)发布的报告中指出,截至2022 年12 月,全球与能源相关的CO2的排放量已达到368 亿吨的历史新高[3],而CH4作为一种温室效应指数是CO2的25倍的温室气体,与能源相关排放量达到1.33 亿吨,同2021 年相比增幅达0.9%。尽管随着清洁能源及其相应技术的应用使能源使用活动中CO2和CH4排放量的增长速度减缓,但整体来看目前温室气体排放量仍呈增长趋势。全球气温上升的三分之一与能源使用活动排放出的强效温室气体直接相关[4]。为解决能源使用活动排放温室气体造成的全球气候变暖问题,CO2与CH4共转化反应的相关研究近年来逐渐活跃。作为天然气中两种的主要成分,如能实现将天然气中的CO2和CH4共同转化,不仅能有效减少温室气体排放的压力,还能够将天然气转变为具有高附加值的化学品或清洁燃料[5]。这对于实现中国双碳目标和能源高效综合利用具有重要意义。
CO2和CH4共转化涉及的反应见表1。CO2在热力学上极为稳定(ΔGf⊖=-394.6kJ/mol),而CH4则具有烃类化合物中最稳定的C—H 键(434.1kJ/mol),因此CO2与CH4共转化反应在热力学上受到限制,导致反应物转化率低。此外,由于CO2和CH4共转化反应涉及复杂的化学反应路径和催化机制,如何对目标反应产物的选择性进行精准调控也是目前该领域面临的主要难题。要解决上述问题则需要对CO2和CH4共转化的反应机理进行深入研究,从而针对性地提出反应物转化率和目标产物选择性的优化策略。

表1 CH4和CO2共转化相关反应的焓变和自由能变[6]
目前对CO2与CH4的共转化反应机理的研究已取得一定进展,反应网络如图1所示。大多数反应路径经历以下几个步骤:①反应物(CH4、CO2)在催化剂表面上的吸附与活化;②C—H键或C= = O键的断裂;③根据具体反应条件生成不同的中间体并最终生成产物;④产物的脱附。由于CO2和CH4共同转化涉及多个可能的反应路径,因此反应产物种类分布较广。从经济效益的角度考虑,一般认为生成合成气、乙酸和C2烃的反应路径具有更广阔的应用前景[7]。然而,上述3个反应路径中涉及多个中间产物,而中间产物的不稳定性使得反应过程中伴随多种副反应发生,由于CH4和CO2反应路径的复杂性,仅依靠经验性的方法实现副产物的控制极为困难。因此,通过研究CO2和CH4共转化的反应机理,揭示反应中的速率控制步骤及其对反应物转化率和产物选择性的影响十分重要。本文将以CO2和CH4共转化直接生成合成气、乙酸及C2烃3 个反应路径为例,对CO2-CH4共转化的反应机理进行综述,以促进对该反应动力学及热力学本质的深入了解,从而为CO2和CH4共转化反应的反应物转化率提升和目标产物的选择性调控提供理论依据。
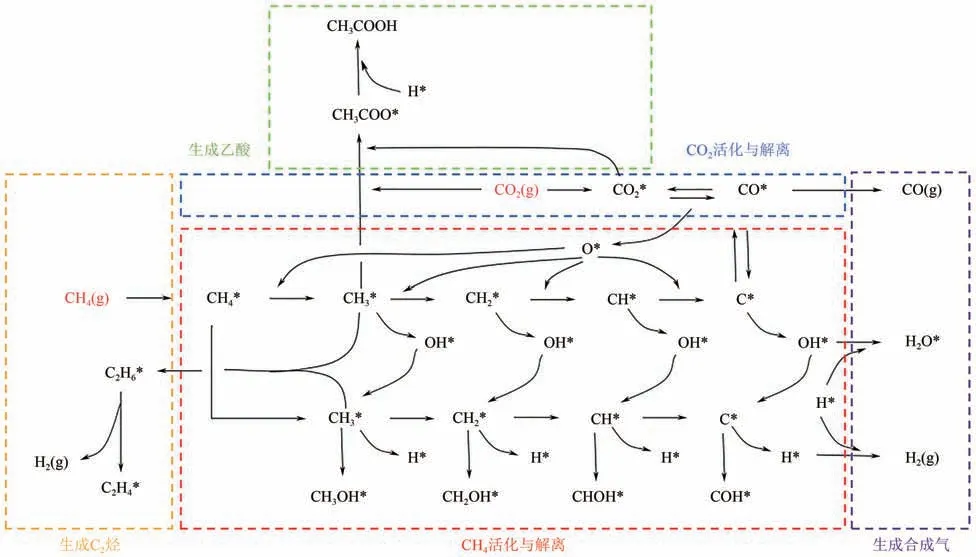
图1 CO2与CH4的共转化反应网络
1 CH4和CO2共转化生成合成气
1.1 反应机理
CO2和CH4在高温(T>1000K)下经催化作用直接反应生成合成气(CO与H2)的反应即CH4-CO2干重整(dry reforming of methane,DRM)。反应中因高温产生的积炭会阻碍反应物与活性位点的接触,导致催化剂通常在5h内几乎完全失活,催化剂失活后的CO 与H2的选择性均低于2%,产率则均不足1%[8]。因此研究DRM反应机理对合成气选择性和产率的提升具有重要意义。由于Ni基催化剂较高的催化活性和较低廉的价格,使得研究基于Ni基催化剂的DRM反应机理具有更为广泛的应用价值[9]。Ni基催化剂上的DRM 反应机理研究最早被报道于1964 年,Bodrov 等[10]首先提出了Ni 基催化剂上的DRM反应机理,如式(1)~式(5)所示,其中*代表吸附活性位。
Bodrov认为DRM反应从CH4和CO2的吸附开始进行。首先CH4被吸附在催化剂活性位点上,在高温条件下被活化,导致两个C—H 键断裂形成中间体CH2*的同时产生H2,而H2能迅速从催化剂表面解吸离开催化剂表面,吸附态的CH2*与水蒸气发生反应,生成一个CO*和两个H2分子。与此同时,CO2分子也被吸附到催化剂活性位点上。在吸附的过程中CO2被活化并发生解离,导致其中一个C= = O键发生断裂,生成一个表面氧活性物种O*和CO,其中O*与H2结合,生成水蒸气和一个新的活性位点,而式(4)(CH2*与H2O分子反应)产生的CO*在催化剂表面脱附并重新暴露催化剂的活性位点。
虽然该反应机理的描述与此前Bodrov根据实验结果提出的动力学模型相吻合,但仍是一个相对简化的理想形式。1993 年,Rostrupnielsen 等[11]在此基础上进行了改进,他们提出的反应机理如式(6)~式(11)所示。
与Bodrov 观点不同的是Rostrupnielsen 认为CH4的解离是在催化剂活性中心逐步进行的[式(6)和式(7)],并且CH4解离产生的H*在反应中不仅能促进CO2的解离[式(8)],使其发生逆水煤气变换反应,还能通过与自身结合产生H2。这种机理解释提供了一种新的视角,揭示了吸附H 原子在反应过程发挥的重要作用。
随着研究不断深入,人们发现催化机理与催化剂的性质有关。目前的DRM 反应机理主要分为两种,即单功能机理和双功能机理[12]。单功能机理是指CH4和CO2反应生成合成气的过程中,CH4与CO2在同一种催化活性位点被活化。在单功能机理中CH4先被吸附于催化剂表面上的金属活性位点,随后受热解离生成H2和CHx*,同时被吸附的CO2也在金属表面上解离产生吸附的CO*和O*,吸附O*和吸附CHx*在金属位点上反应生成CO*和H*。同时,O*也会与吸附H*反应生成OH*,而随后OH*迁移至载体上与H结合形成水分子。Zhang等[13]研究了基于NixAl1O2-δ催化剂的CH4和CO2反应,并通过漫反射红外傅里叶变换光谱(DRIFTS)等手段证实了在NixAl1O2-δ催化剂表面Ni 活性位点上发生的DRM 反应遵循单功能机理,反应机理如图2所示。

图2 NixAl1O2-δ催化剂上的DRM反应机理[13]
相较于单功能机理,目前研究中发现更多DRM 反应催化剂遵循双功能机理,即CH4和CO2在不同的催化活性位点被活化。首先CH4在金属表面活性位点上解离生成CHx*和H*,而CO2则在载体上解离产生活性氧O*。随着反应的进行,O*迁移到催化剂金属活性位点并与CH4解离产生的中间体发生反应,产生CO 与H2。双功能机理由于更多种活性位点的参与而通常具有更高的催化活性,因此基于双功能机理的新型催化剂设计引发了研究者的广泛关注,目前研究中最普遍的设计方法是在现有催化剂中添加氧化物组分并进行结构调控。Das 等[14]通过观察DRIFTS 光谱发现,SiO2载体上的Ni 金属催化剂DRM 反应符合单功能催化机理(图3),即SiO2载体在反应过程中没有直接产生影响。他们在此基础上合成了一种夹层核壳结构的Ni-SiO2@CeO2催化剂,该催化剂由一层固定在球形核心的SiO2、薄的CeO2壳及壳核之间的Ni 纳米粒子组成,其中Ni 活性位点吸附并活化CH4,而CeO2上的活性位点则参与了CO2的解离,使Ni-SiO2催化剂上的DRM 的反应机理由单功能机理转变为双功能机理。

图3 催化剂改性前后进行甲烷干重整催化的单功能和双功能反应机理对比[14]
DRM 反应过程中遵循哪种反应机理主要与催化剂载体的化学性质有关。对于单功能机理,常见的催化剂载体包括氧化物(如Al2O3、SiO2)和氮化物等,其特点是表面性质呈酸性或中性,一定程度避免了对反应物和产物的吸附和活化产生较大影响,从而在反应中表现为惰性载体。而对于双功能机理,载体普遍呈现出表面碱性(如Ni-YSZ、Rh/CeO2等),碱性的催化表面能够在一定程度上提供适宜的催化反应环境,从而诱导CO2在载体表面上发生C= = O的断裂。Yentekakis等[15]研究了氧化物载体上Rh等贵金属催化剂催化DRM的反应机理,他们发现当以γ-Al2O3做载体时反应遵循单功能机理,而当以Ce0.5Zr0.5O2-δ作载体时,反应机理遵循双功能机理。此外,助催化剂、反应条件等因素也对DRM的反应机理有一定影响。
DRM 反应机理中涉及许多中间体的形成,因此具体过程尚未形成统一共识。除了上述机理中产生的中间体。也有研究者认为根据特定催化剂的组成和性质,DRM 反应过程中还可能会生成碳酸盐或甲氧基等中间体。Zhou 等[16]报道了一种由负载Cu纳米颗粒的g-C3N4纳米片和负载Pd纳米颗粒的掺硼氮缺陷型g-C3N4纳米片组成的新型催化剂Cu-CNN/Pd-BDCNN。他们通过密度泛函理论(DFT)揭示了Cu-CNN/Pd-BDCNN 催化剂上CH4和CO2存在的双重反应途径(图4),即甲氧基(CHxO)和甲基中间体同时脱氢,并通过原位红外光谱观察到反应过程中Cu-CNN 位点上形成了CH3O,随后CH3O 逐步脱氢分解生成CO 与H2。Azancot 等[17]将K 作为助剂添加到Ni-MgAl2O4催化剂中研究DRM 反应过程,发现在Ni-K/MgAl2O4上强碱性的Mg-O-K 位点能够促进CO2形成活性碳酸盐中间体,碳酸盐再被反应过程中产生的积炭还原为CO。
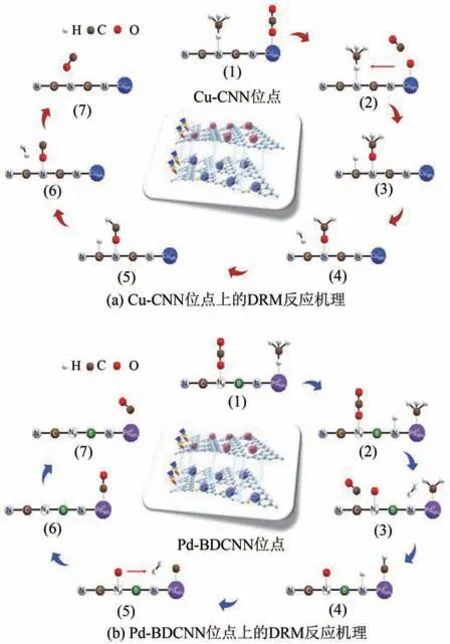
图4 Cu-CNN位点与Pd-BDCNN位点上的DRM反应机理[16]
1.2 速率控制步骤
速率控制步骤又称速控步,是反应机理中准稳态下连续反应步骤序列中唯一的致敏步骤,而所有其他步骤都处于准平衡状态[18]。速控步对整个反应的反应速率起到关键影响,因此速控步的确定对于理解反应机理和改善催化剂催化活性至关重要。目前对DRM反应的速控步尚未有统一定论。一方面,由于C—H 键具有较高的键能,目前多数人倾向于将CH4在金属催化剂上的解离视为DRM 反应的速控步。Chen等[19]提出CH4的解离是整个反应的速控步,随后Wei等[20]通过动力学模拟和同位素评估的方式印证了这一结论,他们发现反应动力学模型中的一阶速率常数及活化能等参数与CH4分解所测得的参数在数值上十分近似,因此认为反应过程中甲烷C—H的活化是唯一的速控步。
然而,Bradford等[21]通过原位DRIFTS的手段发现,对于在Ni/SiO2上发生的DRM反应,CO2首先经过水汽变换产生OH 基团,OH 与CHx*反应生成CHxO*,CHxO*再分解生成CO和H2,而CHxO*分解的能垒不可忽视,因此他们认为CH4的解离和CHxO*的分解都是DRM反应的速控步。Osaki[22]在Ni基催化剂的基础上添加了K助剂并研究了经改性后Ni/Al2O3上的DRM 反应机理,研究结果印证了Bardford 的推断,此外,他们采用热重分析和部分扫描拉曼分析等手段测定了Ni/Al2O3上DRM反应各基元步骤的速率,发现通过减小Ni纳米颗粒直径能够使CHxO*分解的反应速率常数上升,如图5所示。当Ni的纳米颗粒直径为4nm时,CH4的解离成为唯一的速控步。余长春等[23]研究了Ni/MgO 上的DRM反应过程,发现由于Ⅷ族金属Ni的外层轨道中含有丰富的d电子,会导致金属活性位点对CH4解离生成的H*和CHx*具有较强的吸附作用,从而使CH4逐步脱氢所需的能垒下降。基于此,他们认为CO2与催化剂表面吸附的CH3*生成CO 和CHxO*是整个反应的速控步。Wang等[24]通过DFT计算和微观动力学计算的方法研究了不同温度下DRM 反应在Ni(111)表面上的速控步,他们发现在823K 和923K 时CO2解离生成CO*和O*是最可能的速控步,而在1023K下由CH*和O*生成CHO*为速控步的置信度更高。

图5 Ni纳米颗粒直径对DRM反应各基元步骤速率的影响[22]
Ni 基催化剂上的DRM 反应机理研究为该反应速控步的深入探究提供了一些有价值的见解。表面碳氢物种CHx是整个反应过程中的关键中间体,根据脱氢程度的不同,CHx能部分解离脱氢后结合O*生成CHxO*,也能完全解离脱氢再与O*结合生成CO,这主要取决于催化剂表面的氧含量和催化剂表面的局域环境。当催化剂表面的氧含量较低时会限制CHxO 的生成速率,而催化剂表面上的环境会影响CHxO 的吸附构型及活性中心的形成,从而影响C—O 键的强弱。此外,CHxO 中C= = O 键的强弱也与金属氧化物催化剂表面阳离子附近形成的局域电场有关,从而影响CHxO生成与解离的能垒。
1.3 积炭机制与产物选择性的主要影响因素
在DRM反应中,催化剂表面通常会产生积炭,即反应过程中产生的碳在催化剂表面沉积,从而导致DRM 反应活性位点的阻塞和失活。积炭问题是目前致使DRM 反应中合成气产物选择性不理想的主要原因。主要导致生成积炭的副反应如式(12)、式(13)所示。
DRM 反应体系中甲烷的深度裂解和CO 的歧化(Boudouard 反应)会导致沉积炭(C*)的产生,这些中间体C*在催化剂表面上吸附并将活性中心覆盖,最终形成积炭。由于在多数情况下CH4解离是速控步,为了克服该过程中C—H 键断裂所需的能垒,实际中的DRM 反应温度通常较高(>800℃)[25-26]。而Boudouard 反应作为放热反应,高温对CO 的歧化反应产生抑制,故通常积炭更多来源于甲烷深度裂解。因此促使CH4解离的同时抑制—CH3的深度解离是减少DRM 反应积炭的关键,这对催化剂的设计提出了更高的要求。此外,增大反应进料的CO2/CH4比也有利于抑制积炭[20]。然而从工业生产的角度考虑,人们更希望反应在较低的操作温度和一定范围内随机的CO2/CH4比下进行,这使得对积炭抑制的研究更具有挑战性。
基于对反应机理的理解,可以采取一些策略来减少积炭的形成,提高反应产物中合成气的选择性。其中催化剂是最为主要的影响因素,因此对催化剂改性以减少反应积炭的研究受到了更多关注。Mortensen 等[27]通过加入硫黄使催化剂中最活跃的一部分活性位点中毒,以防止积炭的形成。Álvarez Moreno 等[28]在Ni/MgAl2O4催化剂中分别添加了几种贵金属(Ru、Re),实验结果表明贵金属的引入改善了Ni 的还原性和对氢的化学吸附,并且有助于形成双金属协同效应,从而抑制积炭的形成并改善催化剂的活性,其中经质量分数0.5%的Ru 掺杂后催化剂性能最优异,不仅能提升10%的催化活性,同时在反应进行50h 后样品中的炭沉积最少。Lu等[29]在Ni基催化剂上引入V,制备了Ni9.6-V@HSS 催化剂,发现反应过程中产生了VOx中间体,其通过与Ni 接触并发生相互作用形成Ni-VOx结构(图6)。VOx结构的产生有助于生成O 空位,促进了CO2解离产生活性氧物种O*,O*能与C 反应生成CO 从而有助于抑制积炭。尽管改性剂被广泛应用于Ni 基催化剂的改良,但多数改性剂对Ni 基催化剂的稳定性和寿命有一定损害,因此在催化剂设计时应尽量平衡活性和稳定性之间的关系,此外还需要综合考虑催化剂的经济性和可持续性。纳米催化剂具有较高的比表面积和丰富的活性位点,能够有效抑制反应积炭的同时保持较高的反应活性和稳定性。Lovell 等[30]研究了Ni-SiO2催化剂上DRM 反应的积炭机制,发现Ni 基催化剂上DRM 反应的积炭与金属Ni 的尺寸有关,他们通过还原-氧化-还原法(ROR)对Ni-SiO2进行了预处理,得到了尺寸更小、高度分散的金属Ni 颗粒。与未经预处理的样品相比,在经ROR 预处理的催化剂上,CO 分子能够更容易脱附,导致CO歧化产生的积炭明显减少,此外催化剂的稳定性显著提升,在600℃条件下,未经ROR 预处理的催化剂在使用3h 后失活,而预处理后的使用寿命提升至6h。

图6 在Ni9.6-V@HSS催化剂上进行DRM反应的反应机理[29]
2 CH4和CO2共转化直接生成乙酸
2.1 反应机理
与CO2和CH4反应生成合成气再转化为其他高附加值化学品相比,CO2和CH4反应直接生成乙酸能够一步合成目标产物,并且该反应的原子利用率为100%,具有良好的应用前景。然而该反应在热力学上不利于发生(表1),即使在1000K、100atm(1atm=101.325kPa)及CO2与CH4进料比(体积比)为95∶5 的极端条件下,CH4的表现转化率也仅为1.6×10-6[31]。而反应机理可以揭示反应中发生的原子及电子尺度的反应过程及其能垒,能够为克服反应热力学障碍提供理论指导,因此CH4与CO2直接生成乙酸的反应机理具有较高的研究价值。一般认为,CO2和CH4直接生成乙酸反应分为5 步,见式(14)~式(18)。
首先,CH4被吸附到催化剂表面上发生解离,断裂一个C—H键,与催化剂活性位点M形成甲基化物种(M—CH3)和Brønsted 质子。同时,CO2在催化剂表面被吸附并生成CO2*吸附物种。随后,活化的CO2*吸附物种插入M—CH3中发生C-C 耦合,生成表面的乙酸盐物种(M—OOCCH3)。而之前CH4解离产生的Brønsted 质子将与乙酸盐物种结合使O—H成键并形成乙酸吸附物种,最后乙酸从催化剂表面脱附,产生乙酸产物。
由上述过程可知,CO2和CH4生成乙酸的反应机理一定程度上受到催化剂的影响,具体的反应机理应结合催化剂进行探讨。目前对CH4和CO2共转化合成乙酸的研究可分为均相体系和非均相体系。Kurioka等[32]首先报道了在均相体系中采用三氟乙酸(CF3COOH)和过硫酸钾(K2S2O8)作为溶剂,以Pd、Cu等有机络合物作催化剂合成乙酸。Taniguchi等[33]发现在K2S2O8和CF3COOH溶液中添加乙酰丙酮氧钒[VO(acac)2]能显著提升反应转化率,实验结果激发了人们对反应机理的探究兴趣。Zerella等[34]采用H2SO4和K2S2O8作为溶剂,以VO(acac)2作为催化剂研究了CO2和CH4生成乙酸的均相反应机理,其反应见式(19)~式(21)。
首先K2S2O8通过热解作用裂解为KSO4-,在VO(acac)2的催化活性位点上引发CH4解离并产生CH3•自由基,随后CH3•与CO2反应形成CH3CO2•。CH3CO2•会在VO(acac)2中的V(Ⅳ)离子的作用下转化为CH3CO2-并与SO3及质子H 发生反应,形成CH3C(O)—O—SO3H,随后CH3C(O)—O—SO3H 进一步水解生成CH3COOH 和H2SO4,而生成的H2SO4将继续参与下一轮反应。
对于多数均相反应而言,由于溶剂在高温下易挥发,因此反应温度通常低于100℃,通常需要使用H2O2等氧化剂在反应条件下产生甲基自由基物种以促进反应进一步发生。近年来,非均相反应由于无须使用氧化剂受到更多关注。Wu 等[35]提出了CH4和CO2在Zn/H-ZSM-5 沸石上共转化生成乙酸的反应机理。CH4在Zn/H-ZSM-5 沸石上的金属活性位点上被吸附,在Zn2+和氢键的作用下完成C-H断裂形成—Zn—CH3,同时CO2被吸附在催化剂的O活性位点上并被活化生成碳酸盐中间体,随后碳酸盐中间体插入到—Zn—CH3中发生C-C 耦合,形成—Zn—OOCCH3中间体,该中间体再进一步从Brønsted酸位点提取质子生成乙酸,反应机理如图7所示。

图7 甲烷和二氧化碳在双功能Zn/H-ZSM-5沸石上共转化为乙酸的反应机理[35]
2.2 速率控制步骤与C-C耦合机制
在大多数催化剂上,C-C耦合基元步骤由于具有最大的反应活化能而被认为是整个反应的速率控制步骤[36]。现有研究表明CH4和CO2共转化生成乙酸反应过程中的C-C 耦合步骤遵循Eley-Rideal(E-R) 机 理 或Langmuir-Hinshelwood (L-H) 机理,两种机理的本质区别是气相中CO2进攻路线的不同(图8)。在E-R机理中,CH4在被催化剂表面活性位点吸附并解离后直接与气相中的CO2发生C-C 耦合。Zhang 等[37]通过DFT 方法研究了Cu(111)表面上CO2和CH4反应直接生成乙酸的反应机理,其计算结果表明,CH4在Cu 表面解离生成甲基化物种后,反应体系气相中的CO2直接插入到M—CH3键中生成乙酸盐物种。而在L-H 机理中,CO2和CH4分别在催化剂表面上的不同活性位点发生吸附并活化,随后CO2再进攻已被活化的CH3*,此时多个位点协同催化C-C耦合。Zhou等[38]探究了ZnO-In2O3催化剂上CH4和CO2的活化过程,发现Zn和In2O3中O空位界面为催化剂的活性位点,CH4和CO2在其表面活化,随后再发生C-C耦合过程。

图8 CO2与CH4分子C-C耦合的E-R机理与L-H机理
CO2的吉布斯生成自由能为ΔGf⊖=-394.6kJ/mol,在热力学上极其稳定,因此E-R机理中未经活化的CO2直接进行C-C耦合的基元过程通常具有较高的反应能垒。Mahyuddin 等[39]发现,CO2和CH4在Zn-ZSM-5催化剂上发生反应生成乙酸过程的C-C耦合属于E-R机理,该步骤反应能垒达1.83eV,很大程度上限制了反应发生。
与E-R机理相比,L-H机理中的CO2由于经过活化而使得C= = O更易于断裂,因而通常L-H机理中C-C 耦合步骤的能垒更低。多靶向位点催化剂能够提供多种合适的催化位点,实现CH4和CO2的共吸附与共活化,从而在L-H 反应机理下促进更多吸附态中间体的生成。这些吸附态中间体在多个活性位点的协同作用下能形成更强的相互作用,并提升转化速率。因此,可以同时活化CH4和CO2的多靶向位点催化剂将是未来的研究热点。
2.3 产物选择性的主要影响因素
在CO2和CH4共转化反应体系中,乙酸的选择性极低。从反应机理的角度来看,提高乙酸的选择性需要克服C-C耦合的高能垒并控制CH4的选择性解离。C-C耦合在大多数情况下是整个反应的速控步,较高的能垒与耦合过程中反应分子的空间位阻限制了反应的发生。此外,也有研究指出CH4的选择性断键也是提高乙酸选择性的关键[40]。表2展示了CH4在不同金属上的吸附能,结果表明在第1个C—H 键被活化之后,后续的脱氢反应在热力学上非常容易发生。这导致直接参与C-C 耦合的CH3*分子较少,更多CH3*分子将进一步发生脱氢反应,从而使得最终产物中乙酸选择性较低。因此,如何抑制CH3*的深度解离以及促进CH3*与活化后的CO2物种耦合对于提升乙酸选择性具有重要意义。

表2 CHx在Ru、Rh和Pd上的吸附能[41] 单位:eV
催化剂的改性是实现CH4选择性断键的调控、降低C-C 直接耦合能垒最精准与高效的手段之一,近年来得到了广泛研究。在催化剂表面构建两个独立的活性位点是避免CH4和CO2之间吸附与活化竞争的有效方法,不仅能够提供额外的活性位点,不同组分间还能够通过协同作用促进活性位点的形成并提升中间体的稳定性,有效降低C-C 耦合的能垒,从而提升乙酸产物的选择性。
Shavi 等[42]制备了由两种不同金属氧化物(CeO2-ZnO/MMT、MnO2-ZnO/MMT 和CeO2-MnO2/MMT)组成的双活性位点催化剂,其中CH4和CO2分别在两种金属氧化物上被吸附活化,从而避免了两种分子之间对活性位点的竞争,反应机理也相应地从E-R机理转变为L-H机理。章日光等[43]制备了Co/Pd-TiO2催化剂用于催化CH4和CO2直接合成乙酸反应,研究结果表明,与单金属Co催化剂相比,Co/Pd-TiO2催化剂展现出良好的催化活性,其中Pd组分在乙酸的生成过程中起关键的作用,Co 组分在活化甲烷中起主要作用,当Co/Pd=2时的催化活性最佳,此时乙酸生成速率为1550μg/(g·h)且乙酸选择性为87%。李志勤等[5]在此基础上采用酸处理方法对CoPd/TiO2催化剂进行改性,并将酸处理后的催化剂在温和条件下用于CH4和CO2直接合成乙酸反应,通过XRD 等手段表明酸处理明显提高了CoPd/TiO2上乙酸的生成速率和选择性。
最近研究发现对催化剂进行金属掺杂能够显著降低C-C 耦合能垒的同时抑制CH4的深度解离。Nie等[44]对ZnO进行Fe掺杂,发现掺杂的Fe能够对催化剂表面的酸碱位点进行调控,有利于催化剂表面CH4的选择性解离。DFT 计算结果表明,解离CH4的Fe 位点和吸附CO2的Zn…O—Zn 位点上发生协同催化C-C 耦合,该基元步骤的反应活化能为0.75eV,相较于改性前的ZnO其能垒显著降低。反应各步骤能垒如图9所示。
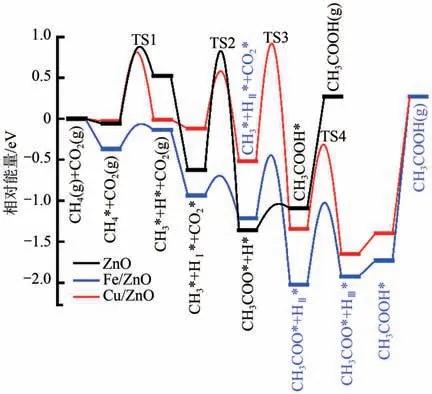
图9 不同催化剂下CH4-CO2合成乙酸的反应路径势能面[44]
Zhao 等[45]在CeO2上掺杂Zn 作为催化剂,通过DFT 计算发现经过掺杂后的Zn/CeO2有利于CH4的吸附,其吸附能为-0.53eV,并且通过形成Zn-C键阻碍了CH4的过度脱氢,而后CO2以活化的弯曲构型插入Zn-C 键,过渡状态为三心Zn-C-C 分子结构形式,活化势垒为0.51eV[图10(a)]。他们还研究了不同金属掺杂CeO2对催化C-C 耦合反应活性的影响,发现掺杂金属的电负性与C-C 耦合的能垒之间存在正相关关系,如图10(b)所示。

图10 CeO2催化剂的金属元素掺杂对C-C耦合势垒的影响[45]
综上所述,目前的研究多通过金属掺杂在催化剂表面构建多种反应活性位点,这种多金属协同催化主要能通过提供多种催化位点并通过位点之间的协同作用降低C-C耦合步骤的能垒,最终将CH4和CO2高效转化为乙酸。但由于反应热力学上的限制,同时提高该反应的产物收率和选择性是目前面临的主要问题。此外,多金属催化剂在高温高压条件下容易发生表面重构,从而使原来的活性位点发生变化,导致多金属催化剂的稳定性较差,甚至可能发生不可逆的催化位点失活。为此,未来的研究应深入探究多金属催化剂的构-效关系,揭示金属间的协同作用对催化性能的影响机制。另外,开发新型的载体材料也是提高催化剂催化活性的关键。
3 CH4和CO2共转化直接生成C2烃
3.1 反应机理
乙烷和乙烯是重要的化工原料,目前已有大量文献报道采用O2作为氧化剂应用于CH4的氧化偶联反应(oxidative coupling of methane,OCM)生产C2烃[46-49],但是OCM 反应通常导致大量的COx副产物产生,不仅增加了温室气体的排放量,而且其中CO2副产物生成时伴随的强放热反应过程也容易导致催化剂飞温烧结。而如果采用CO2作氧化剂则只有唯一的副产物CO,更易于处理。因此CO2和CH4共转化生成C2烃是颇具潜力的反应路径。虽然CO2和CH4生成的合成气再通过费-托合成反应也能够间接生成C2烃,但以CO为中间体的费-托合成反应中C2烃产物的选择性较低,通常需要采用Rh、Ru、Pd 等贵金属催化剂才能有较为理想的C2烃选择性和产率,导致工业化困难[50-51]。相比之下,CO2和CH4直接生成C2烃的反应流程较简单,更易针对反应机理进行调控,因而具有更高的研究价值。
目前关于CH4和CO2直接生成C2烃的催化方式主要分为化学催化和等离子体催化两种,它们在催化机理和反应条件上存在一定差异。
CH4和CO2直接生成C2烃的化学催化最早被报道于1995年,Asami 等[52]在高温下以金属氧化物作催化剂直接合成了C2烃,并探究了含不同金属元素的金属氧化物对催化活性的影响,研究发现稀土金属氧化物具有更好的C2烃选择性,但CH4转化率和C2烃收率并不理想。实验结果引起了人们对其反应机理的研究兴趣。Liu等[53]以Na2WO4/SiO2作催化剂,运用O2-TPD手段进行测试,提出了CH4和CO2直接合成C2烃的反应机理,如式(22)~式(25)所示。
首先,CO2被吸附到催化剂表面的活性位点,经过活化断裂C= = O 键分解为CO 和O*,随后O*促进CH4解离并夺取一个H形成OH基团,剩下的CH3*自由基自身发生C-C耦合生成C2H6,部分乙烷在高温及催化剂作用下发生脱氢反应生成C2H4和H2。
该机理与Asami 等[54]后来在1123K 条件下研究的14种镧系元素氧化物上的反应机理基本一致。蔡迎春等[55]在Mn-CaO 催化体系中也提出了相似的反应机理,他们认为催化剂组分中Ca的主要作用是为CO2提供吸附位点,Mn 则参与反应中间体的形成,其组分含量与催化活性相关。经CO2-TPD的结果表明Mn元素在反应过程中会出现变价现象,说明反应过程中形成的Mn2+/Mn3+参与了CO2和CH4的活化与解离过程。Zhang等[56]则认为在CO2和CH4的共转化反应直接生成C2烃反应中,催化剂表面上具有较高活性的氧物种O*起到了重要作用,其促使CH4发生解离形成CH3*,同时产生了晶格氧空位,CO2在与晶格氧空位发生吸附并解离时会生成CO 和新的活性氧物种O*,后者再参与反应构成循环。
等离子体是由大量高能带电粒子组成的非凝聚体,其能够通过与反应分子发生非弹性碰撞,使反应分子吸收能量转变为激发态,从而提升反应分子的反应活性和选择性。Van Alphen 等[57]在等离子体作用下研究了CH4-CO2的共转化反应,当通入CO2∶CH4∶N2=2∶2∶1 时,C2烃 选 择 性 可 达40%。Savinov等[58]对等离子体催化CH4-CO2共转化生成C2烃的反应机理进行了研究,发现在等离子体作用下产生了非常活泼的激发态活性氧物种,并提出了如式(26)~式(32)的反应机理。
等离子体中的高能电子先与CO2分子发生非弹性碰撞,通过高能电子传递能量给CO2分子中的一个氧原子,从而使其脱离CO2分子形成CO 和活性氧物种。同时,CH4分子与催化剂表面上的活性氧物种发生反应,CH4的一个氢原子被氧原子夺取,产生CH3·和OH,两个甲基自由基自聚生成C2H6。生成的C2H6一部分在等离子体作用下再次被激发发生解离,产生C2H5·和H,一部分与催化剂表面上的活性氧物种反应产生C2H5·和OH,C2H5·中的一部分再与自身发生重排反应生成C2H4和C2H6,而另一部分和CH3·结合生成C2H4和CH4。
对于CO2和CH4共转化直接生成C2烃反应,虽然化学催化和等离子体催化的反应机理有所区别,但二者之间仍存在一定联系,应在研究和应用中互为补充。不同的催化方式有着各自的优势和适用条件,化学催化更易于控制和规模化,而等离子体催化具有更高的反应活性和选择性。因此,选择适当的催化方式应取决于具体的生产目的、催化剂性能和反应条件的要求。
3.2 速率控制步骤及活性氧物种的形成
目前对于CH4和CO2生成C2烃的反应研究中对速率控制步骤的讨论较少且未形成统一认知,但众多研究认为活性氧物种在其中起到了重要作用。CH4分子中的C—H键极为稳定,断键需要较高的能量,但在催化剂表面上活性氧物种和CH4的共吸附状态下,活性氧物种与CH4中的H产生氢键相互作用,使CH4分子的一个氢原子迁移至催化剂表面的活性氧物种(O—M)上,形成M—O—H—CH3中间体,从而使原来甲烷C—H键断裂所需的能垒降低。
活性氧物种的形成在整个反应机理中十分关键,而目前对活性氧物种形成的来源存在争论。Chen 等[59]认为活性氧物种来源于催化剂中的晶格氧。他们观察到CH4单独通过La2O3-ZnO 催化剂与CH4和CO2同时通过催化剂生成的产物相同,主要是C2烃。根据实验结果,他们推测CO2在反应过程中没有起到关键作用,即CO2没有直接参与活性氧物种的形成。基于此,他们进一步提出La2O3-ZnO催化剂中的晶格氧是表面氧物种的主要来源,CO2的作用主要是通过解离来对活化CH4所消耗的晶格氧进行补充。Zhang 等[60]的研究支撑了Chen 等[59]的观点,他们制备了一种Ca-Na-O-Cl 催化剂用于催化CH4和CO2生成C2烃,研究发现催化剂中的Cl能够促进催化剂表面晶格氧物种的电子传递效率,从而更容易与CH4分子发生相互作用促进其活化并解离为CH3(图11)。

图11 Ca-Na-O-Cl催化剂上CH4和CO2生成C2烃的反应机理[60]
Wang 等[61]基于对CaO-CeO2催化剂的研究提出了另一种观点,他们认为在CaO-CeO2上活性氧物种主要来源于CO2的解离。Wang首先对CH4单独通过CaO-CeO2催化剂床层进行了反应实验,结果表明CH4主要转化为H2和CO。而在CO2存在的情况下,C2烃为主要产物,并且即使反应时间超过10h,CH4的转化率和C2烃的选择性也没有明显变化。类似的实验结果也在CaO-ZnO和CaO-Cr2O3催化剂上被观察到。因此他们提出在CaO-CeO2催化体系中CO2直接参与了反应过程,即CO2是活性氧物种的主要来源,在反应过程中作为氧化剂。
活性氧物种是反应中的关键中间体,其来源直接决定了CO2和CH4生成共转化的反应途径和效率,但是活性氧物种的生成和利用过程往往受到多种因素的影响,目前对于活性氧物种的生成及其反应机制还有待深入研究。在反应过程中,活性氧物种可能与其他反应物或中间体发生非选择性的反应,形成不稳定的化合物,导致活性氧物种被消耗而使催化效率降低。此外,对于活性位点的竞争吸附也应被充分考虑。因此,提高活性氧物种的反应选择性、优化活性位点的分布和密度从而实现活性氧物种的精准调控是提升该反应C2烃选择性的良好思路。
3.3 产物选择性的主要影响因素
C2烃是CH4部分氧化的产物,当采用CO2对CH4进行氧化时,产物的碳原子理论上存在多个可能的价态组合,因此产物中的C2烃非常容易被深度氧化,从而限制了C2烃产物选择性的提高。对C2烃产物的选择性的调控是目前该反应工业化应用的主要难题。
基于对反应机理的理解,许多学者对CH4和CO2共转化反应中C2烃的选择性影响因素进行了广泛的研究。由于CO2能提供活性氧物种,因而在反应中发挥重要作用。热力学分析表明,在800~900℃、大气压力和CH4/CO2反应物比为1∶1的反应条件下,CH4平衡转化率可达10%~30%[图12(a)]。同时CO2是O2作为氧化剂发生OCM 反应时的主要副产物,因此一些研究将CO2与O2共同作为氧化剂氧化CH4,以确定CO2对反应的影响。Yoon 等[63]通过实验证实了CO2的存在有利于C2烃产物选择性的提升,他们以Na2WO4/Mn/SiO2作催化剂,在750℃下通入进料摩尔比CH4∶O2∶N2∶CO2=3∶1∶0.2∶0.8的反应气,对比在相同条件下反应气进料摩尔比为CH4∶O2∶N2=3∶1∶1 时,C2烃 选 择 性 提 升 了4.7%,并且当体积空速(GHSV)>2000h-1时,C2烃选择性提升更为显著。Yoon 等的发现与传统的观点不同,通常认为CO2作氧化剂时易使碱性催化剂中毒,因此CO2的存在会使氧化产物选择性下降。而根据反应机理[图12(b)],CO2能促进表面活性氧物种的生成,故许多研究对此进行了合理解释。Shi 等[64]认为在OCM 反应体系中存在适量CO2时,将导致Na2WO4/Mn/SiO2催化剂的结构发生变化,从而促进O从催化剂主体向表面迁移,导致表面活氧物种浓度增加。他们的实验结果表明,当反应气中摩尔比CH4∶O2∶CO2=3∶1∶2 时,催化剂表面活性氧物种的浓度达到最大,此时C2烃选择性也达到最大值74.9%。Wang 等[65]的研究结果表明,在CO2少量存在的条件下,主要由催化剂中的晶格氧参与CH4氧化偶联反应,主产物为H2和CO,此时C2烃的选择性较低。随着CO2含量的增加,催化剂上吸附的CO2浓度增加,CO2解离生成的表面活性氧物种抑制了晶格氧参与反应,此时主要反应路径发生了改变,从而使C2烃选择性升高。
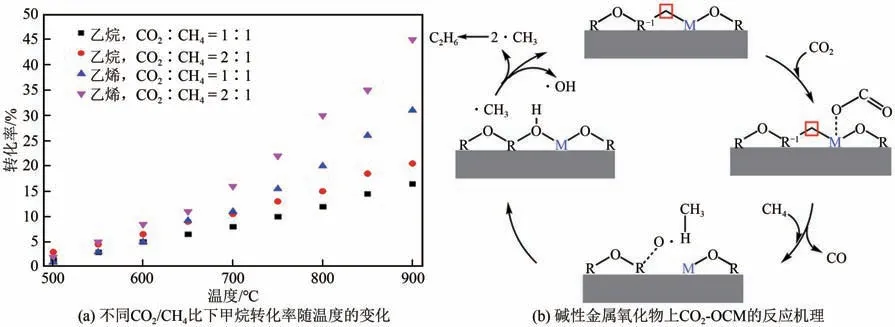
图12 操作条件对CO2-OCM反应CH4转化率的影响及其反应机理[62]
翟林燕等[66]的研究佐证了这一点观点,他们对常压等离子体作用下CO2与CH4的共转化反应过程进行了分析,通过光谱原位诊断技术在200~900nm 范围内采集并标识了不同CO2添加量时CH4等离子体光谱,发现体系中由CO2产生的活性氧物种为主要活性物种,且活性氧物种的谱峰相对强度随CO2添加量增加而迅速增加,当CO2超过一定程度时会导致主反应路径发生改变。与化学催化不同的是,他们发现在等离子体催化中,当CO2添加量小于30%时,以C-C偶联生成C2烃为主,而当CO2添加量大于30%时,以氧化重整生成合成气为主。
此外,催化剂也因能显著影响反应的选择性而备受研究者的关注,目前研究和应用最为广泛的是金属氧化物催化剂。Asami 等[52]首先总结了金属氧化物催化剂中金属元素对催化性能的影响,结果表明含稀土元素氧化物的催化剂表现出约30%的高选择性,其中Sm2O3作催化剂时选择性最高,而Y2O3由于能够提升CH4转化率而具有更高的C2烃产率,但总体来看单金属氧化物作催化剂时C2烃的选择性和产率仍然较低。
许多研究表明二元金属氧化物体系对CO2氧化CH4反应展现出更优异的催化活性,常见的催化剂体系见表3。Chen 等[59]首先将二元金属氧化物用于CO2氧化CH4生成C2烃中,在La2O3-ZnO 催化剂上得到2.8%的C2烃产率,高于之前所有报道过的单金属氧化物上的C2烃产率。Cai 等[67]进一步研究了MnO2-SrCO3催化体系用于CH4和CO2反应生成C2烃的选择性,在Mn/Sr 比分别为0.1 和0.2 的催化剂上,C2烃的选择性达到88.0%和79.1%,C2烃的产率为4.3%和4.5%。而Filardi 等[68]发现二元金属氧化物催化剂良好的催化活性通常是由可还原性金属氧化物与碱性金属氧化物组成,通过少量的金属掺杂便能形成复合型的双功能催化剂,他们仅在ZnO催化剂表面添加了摩尔分数0.6%的Ca,C2烃的选择性便从5%提升到58%。通过进一步研究,他们认为选择性的显著提升与催化剂表面的碱性活性位点直接相关,由于添加Ca 之后,形成的碱性CaO表面有利于CO2形成碳酸盐中间体,从而极大地增强了CO2的吸附强度。
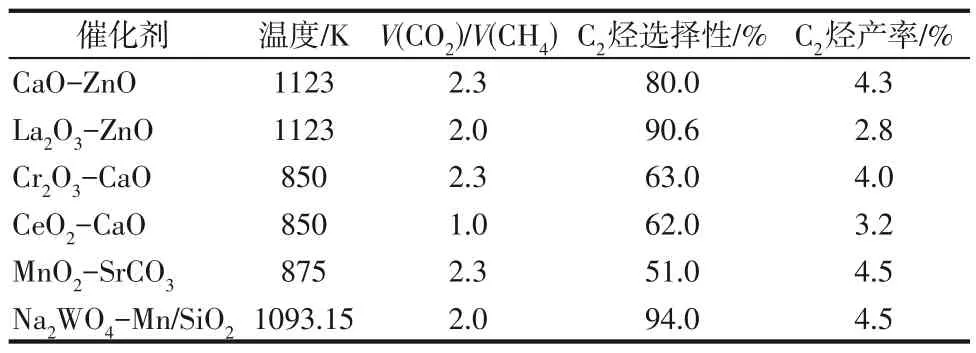
表3 CO2和CH4生成C2烃反应中二元金属氧化物催化剂的催化性能
由Liu 等[69]设计的Na2WO4-Mn/SiO2催化剂目前在CH4-CO2直接合成C2烃反应中表现最佳,在820℃、CO2/CH4=2.0 的条件下能够达到94.0%的C2烃选择性和4.5%的C2烃产率。Kiani 等[70]在此基础上进一步研究,发现Na2WO4-Mn/SiO2催化剂的高催化活性是由于其中WO4四面体的结构特征与CH4分子相近,这种几何形状能有助于与CH4进行合适的能量匹配,从而能够高效活化CH4分子。
目前已有许多研究表明,以二元金属氧化物作催化剂能有效提升催化效率,但对其反应机理的研究相对较少,尤其是在工业中真实反应过程机理方面的研究仍不够充分。在实际工业反应过程中,催化剂所处的工作环境往往是动态变化的,特别是反应温度、压力、反应物浓度的变化以及反应中可能产生的杂质,这些因素对催化剂的表面结构、活性位点会产生重要影响,进而影响反应机理,而这些影响难以通过简单的实验手段来定量解析。可见,在实验和模拟过程中应充分考虑反应过程中的动态演变因素,并通过先进的表征技术和模拟方法准确捕获反应过程中的动态变化,以获得更深入、全面的反应机理认识,从而为CH4和CO2生成C2烃反应的工业生产提供可靠的理论指导。
4 结语
实现CH4和CO2的共转化不仅是缓解全球气候变暖的重要技术路线,也是利用天然气资源合成高附加值产物的理想方式。但由于反应物的热力学稳定性和繁杂的反应路径,较低的CH4转化率和难以调控的目标产物选择性成为该反应体系走向工业化所面临的主要难题。虽然已有研究者从反应条件优化、催化剂改性等角度提出了一些解决措施,但仅依靠经验性的探索得出的结论难以在复杂的反应网络和不同的反应条件中得到普适性的应用。因此,对反应机理进行深入研究显得尤为重要,本综述对CO2和CH4共转化分别生成合成气、乙酸和C2烃的反应机理进行了分析梳理,得到如下结论。
在CO2和CH4共转化生成合成气的反应过程中,CO2和CH4在活性位点上经历吸附、解离形成CHx*、O*、H*等关键中间体,再在催化剂表面反应形成CO 和H2。根据CO2和CH4活化中心位点的不同分为单功能和双功能催化机理。对于表面呈中性或酸性的载体,CO2和CH4遵循单功能催化机理在同种活性位点被活化;对于表面呈碱性的载体,CO2和CH4则按照双功能催化机理分别在不同活性位点被活化。其中多数情况下CH4的解离是速率控制步骤,可通过对催化剂改性等方式提高催化剂表面活性位点的利用效率,促使CH4和CO2的低温活化,以达到抑制积炭和提升合成气产物选择性的效果。
在CO2和CH4共转化直接生成乙酸的反应过程中,CO2和CH4主要经历活性位点上的吸附活化、C-C 耦合生成乙酸盐物种,乙酸盐物种再与Brønsted 质子结合形成乙酸脱附等步骤。其中C-C耦合被多数研究者认为是反应的速率控制步骤,该步骤反应机理根据CO2进攻路线的不同分为E-R机理和L-H机理。E-R机理中气相CO2直接插入催化剂表面活性位点上的CH4中发生C-C耦合,而L-H机理中CO2先被吸附再进行C-C耦合。相较于E-R机理,L-H机理的反应能垒可能更小,可通过对催化剂改性,如金属掺杂等方式在催化剂表面构建两个独立的活性位点,将E-R机理转化为L-H机理。
在CO2和CH4共转化直接生成C2烃反应中,CO2被吸附、活化并解离,随后产生的O*促使CH4解离生成CH3·中间体,CH3·再自身发生C-C 耦合生成C2H6,部分C2H6再经脱氢得到C2H4。该反应的催化方式主要分为化学催化和等离子体催化,采用等离子体催化往往会产生更多中间体,反应机理更复杂,但同时反应活性更高。两种催化方式的反应机理中活性氧物种的形成都是影响C2烃产物选择性和产率的关键因素,改变CO2含量和对催化剂改性可影响活性氧物种的形成和分布浓度,从而影响C2烃选择性。其中,对多数化学催化反应来说,适当提升反应气中CO2的含量有利于C2烃选择性的提升,对等离子体催化反应则相反。此外,二元金属氧化物催化剂也是提升C2烃选择性和产率的有效手段。
近年来,CH4和CO2共转化反应在应用方面有所突破,尤其是合成气制备技术有较大进展。通过开发新型载氧体,实现了CH4高选择性氧化和CO2还原再生的稳定循环,其中CH4单程转化率高达80%以上,合成气选择性大于99.5%[71]。同时,通过开发设计高性能新型Ni 基催化剂,我国5 千万吨/年合成气规模的甲烷重整制合成气示范工艺取得成功,CO2处理量达10万吨/年[72]。尽管对CO2和CH4共转化反应的研究已经取得了一些进展,但大多的反应机理研究主要聚焦于催化剂应用层面。很少有对反应中动态催化过程的基础内容进行深入探究,尤其是对中间体识别、催化剂表面重构和活性位点局域环境等方面的研究比较有限。虽然通过金属掺杂等方式实现多位点协同催化的研究已被实验证明能有效提升反应产物选择性,但要在工业上真正实现反应产物选择性的调控仍任重而道远。后续的研究可着重于结合先进的模拟计算方法和原位表征手段,进一步揭示反应过程中催化剂和反应中间体的动态演变过程和机理,从而为真实的CO2和CH4共转化反应过程提供理论指导。
