胫骨横向骨搬移治疗糖尿病足的机制研究*
2024-02-23陈子豪艾尔肯热合木吐拉周泓宇李靖扬
陈子豪,黎 立,艾尔肯·热合木吐拉,司 裕,周泓宇,李靖扬
(新疆医科大学附属中医医院骨五科,乌鲁木齐 830000)
糖尿病足(diabetic foot,DF)是糖尿病患者最严重的慢性并发症之一,由于糖尿病引发的血管与神经病变,下肢微循环受到阻碍,最终可能导致肢体末端缺血性坏死、溃疡和感染[1-3],其患病率为6.3%,预计到2040年全球范围内的DF患者将达到6.42亿[4-5]。25%的DF患者伴有溃疡,而常规治疗的1年复发率约为40%,3年和5年复发率为60%与65%[6],85%~90%的DF患者需要截肢,但其术后的5年死亡率仍高达25%~50%[7-9]。DF的临床治愈十分困难且费用高昂,给家庭与社会带来极大的负担[10-11]。因此,迫切需要有效提高DF患者保肢率、降低死亡率的新的治疗策略。
基于张力-应力法则的胫骨横向骨搬移(tibial transverse transport,TTT)技术,通过持续应力性牵拉,能够加速细胞新陈代谢,改善微循环,促进组织再生,近年来在DF治疗方面受到广泛关注[12]。目前研究表明,TTT治疗DF具有成本低、手术简便、创伤小、保肢率高等优势[13],但其具体的作用机制尚不明确。基质细胞衍生因子-1(stromal cell-derived factor-1,SDF-1)及其趋化因子受体(chemokine receptor type 4,CXCR4)可调控骨髓源间充质干细胞归巢,并在促进DF溃疡愈合方面发挥关键作用[14]。近期研究还发现,SDF-1/CXCR4信号轴能够活化磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路,促进细胞迁移[15-16]。因此,本研究旨在探讨并验证TTT技术是否通过SDF-1/CXCR4信号轴调控PI3K/Akt信号通路,促进DF溃疡愈合,为TTT治疗DF的机制研究提供更多的数据支持。
1 资料与方法
1.1 一般资料
选取2021-2022年在本院接受治疗的63例DF患者为研究对象。纳入标准:(1)符合《中国糖尿病足诊治指南》[17]与《中西医结合防治糖尿病足中国专家共识(第1版)》[18]中的诊断标准,且Wagner分级为2~4级的2型糖尿病并发DF患者;(2)民族不限,性别不限,年龄≥30岁;(3)下肢血管造影检查提示下肢主要动脉无明显堵塞;(4)创面局部组织无明显感染或感染已经得到控制;(5)保肢意愿强烈,要求行TTT或常规保守治疗。排除标准:(1)患足局部有恶性创面或未选择保肢治疗;(2)纳入研究前30 d内接受过生长因子或高压氧治疗;(3)患有严重的蜂窝织炎或骨髓炎;(4)合并严重肝肾功能损害、恶性肿瘤、血液系统疾病等;(5)由于主观或客观因素无法配合手术或自愿退出研究。根据不同治疗方式分为试验组与对照组,两组患者性别、年龄、BMI、糖化血红蛋白、空腹血糖、糖尿病病程、Wanger分级、DF溃疡面积与部位、创面感染程度与合并症比较差异均无统计学意义(P>0.05),具有可比性,见表1。本研究经医院医学伦理委员会审查(2021XE0102-1),患者均签署知情同意书。
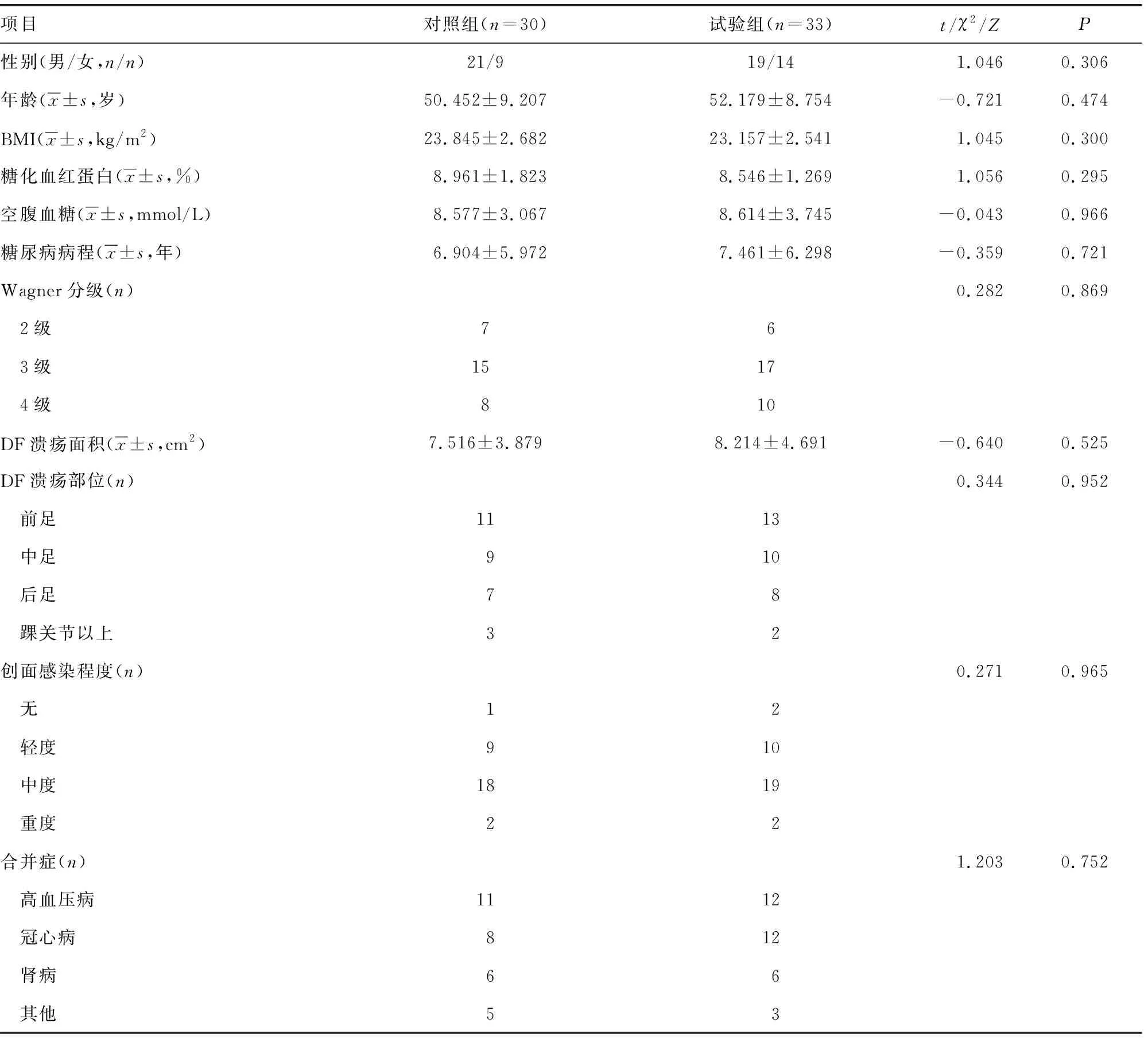
表1 两组患者一般资料比较
1.2 方法
1.2.1试验组采用TTT治疗
术前患者进行专科检查和下肢血管造影检查,严格监测并调节血糖水平,辅助抗生素控制感染,改善周围神经功能,维持机体内环境平衡等。术中对患者病变部位进行麻醉处理后取平卧位,安装横向骨搬移外固定支架,于胫骨中上段内侧做弧形切口,不同切口之间的距离在3~5 cm,全层切开至骨膜,将骨膜剥离后按照要求截取单层骨皮质,调整胫骨搬移外支架至合适位置固定,缝合骨膜和软组织,敷料包扎。术后对患者应用抗生素预防感染,定期更换创面敷料及消毒针孔,于术后第5天使用外固定支架搬移骨块,按照1 mm/d的速度向外侧搬动,每天分4次搬移(0.25 mm/次);2周后以相同速度反向搬移,待骨块复位即可择期拆除外固定支架,横向搬移共耗时4周。在搬移过程中,应注意防止发生创面感染,复查X线片后除去外固定支架,并再次进行下肢血管造影检查。
1.2.2对照组采用常规保守治疗
患者均在内分泌科医师的指导下应用胰岛素控制血糖,改善周围神经功能,纠正内环境失衡,应用抗生素控制感染,并结合局部清创进行保守治疗。
1.2.3疗效标准
根据两组患者的临床症状与表现情况,判定临床疗效。显效:创面愈合,红肿、溃疡、感染等临床症状全部或基本消失;有效:创面部分愈合,肉芽组织生长良好,红肿、溃疡、感染等临床症状有所改善;无效:创面未愈合,红肿、溃疡、感染等临床症状未好转甚至加重。总有效率(%)=(显效例数+有效例数)/总例数×100%。
1.2.4外周血采集与单个核细胞分离
分别于治疗前后抽取患者空腹外周静脉血,将血液置于离心管当中适当翻转以避免发生凝血现象,2 000 r/min离心10 min后去除上层血清,在剩下的细胞当中添加DMEM培养基,对其进行稀释处理,混合均匀后获得细胞样本。加入淋巴细胞分离液后2 000 r/min离心30 min,分离并收集单个核细胞,以用于进一步实验。
1.2.5多色流式细胞术检测T细胞亚群指标变化
采用FACS Calibur流式细胞仪(美国BD公司)进行多色流式细胞检测,其中FITC标记CD3抗体,APC标记CD4抗体,PE标记CD8抗体,PerCP标记CD45抗体。将患者的外周血根据上述方法收集与分离后,重悬单个核细胞并调整细胞浓度为1×107/mL,再分别加入20 μL荧光抗体CD3FITC/CD4APC/CD8PE/CD45PerCP,通过MultiSET软件获取数据,建立SSC/CD45PerCP、CD8PE/CD3-FITC、SSC/CD3FITC、CD4APC/CD8PE荧光散点图,使用SSC/CD45PerCP-Gating细胞群圈门排除碎片干扰,每管获取15 000个细胞,计算CD4+与CD8+比值。
1.2.6Western blot检测相关蛋白表达情况
将收集的细胞样品加入裂解液后匀浆,提取蛋白,采用二喹啉甲酸法对提取蛋白质进行定量。取20 μg蛋白经十二烷基硫酸钠聚丙烯酰胺凝胶电泳转印至聚偏二氟乙烯膜,5%脱脂牛奶室温封闭2 h,分别加入一抗SDF-1抗体(1∶1 000,美国Abcam公司,ab9797)、CXCR4抗体(1∶1 000,美国Abcam公司,ab124824)、PI3K抗体(1∶8 000,美国CST公司,#4292)、p-PI3K抗体(1∶3 000,美国CST公司,#4228)、Akt抗体(1∶8 000,美国Abcam公司,ab8805)、p-Akt抗体(1∶3 000,美国Abcam公司,ab81283)、GAPDH抗体(1∶1 000,美国Abcam公司,ab181602)。GAPDH作为内参,4 ℃孵育过夜,缓冲液洗涤后加入二抗羊抗兔IgG(1∶2 000,美国Abcam公司,ab6721)室温孵育2 h,增强化学发光法显影,ImageJ软件分析蛋白条带灰度值,计算各蛋白相对表达水平。
1.3 统计学处理
2 结 果
2.1 临床疗效比较
试验组的总有效率(93.94%)明显高于对照组(73.33%),差异有统计学意义(P<0.05),见表2。试验组患者术中可见感染性溃疡,术后1个月原溃疡处可见新生肉芽组织,且未见感染等不良反应,3个月后可见DF创面愈合良好,见图1。

A~C:试验组DF患者术中、术后1个月、术后3个月右足背部创面恢复情况;D、E:试验组DF患者TTT术后外固定支架侧面与正面图。
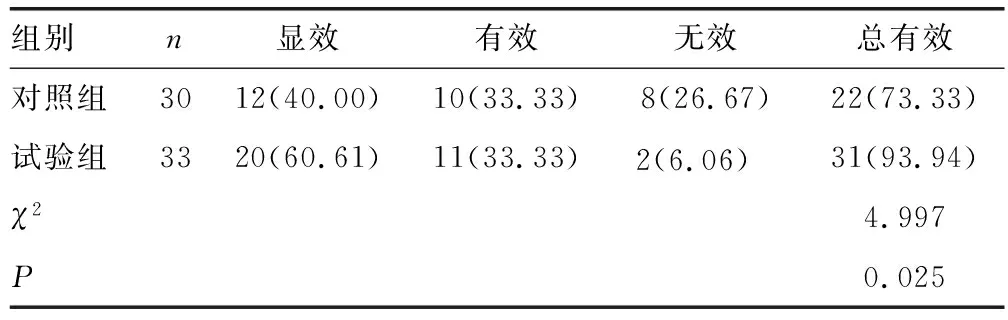
表2 两组临床疗效比较[n(%)]
2.2 T细胞亚群指标比较
治疗前两组患者CD3+、CD4+、CD8+、CD4+/CD8+水平比较差异均无统计学意义(P>0.05)。治疗后试验组CD3+、CD4+及 CD4+/CD8+水平均高于对照组,CD8+水平低于对照组,差异有统计学意义(P<0.05),见表3。

表3 两组T细胞亚群指标比较
2.3 SDF-1/CXCR4信号轴与PI3K/Akt信号通路相关蛋白表达情况
治疗前两组患者SDF-1、CXCR4、p-PI3K、p-Akt蛋白表达水平比较差异无统计学意义(P>0.05);治疗后试验组SDF-1、CXCR4、p-PI3K、p-Akt蛋白表达水平均高于对照组,差异有统计学意义(P<0.05),见表4、图2。
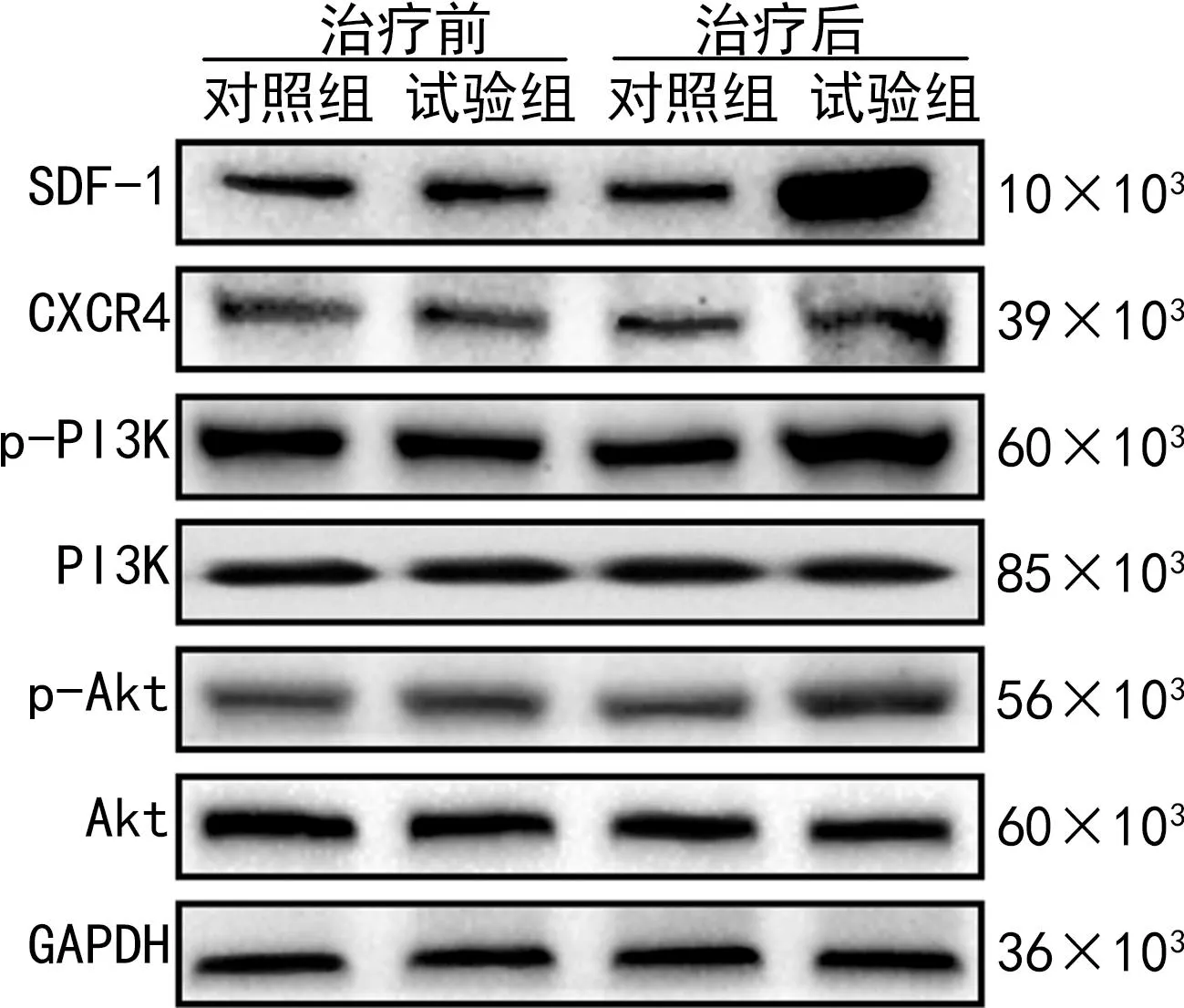
图2 治疗前后两组SDF-1/CXCR4信号轴与PI3K/Akt信号通路相关蛋白表达情况

表4 两组SDF-1、CXCR4、p-PI3K、p-Akt蛋白表达水平比较
3 讨 论
DF溃疡的病理机制复杂,与糖代谢紊乱、微血管功能障碍、周围神经病变、免疫系统失调等因素密切相关[19-21]。DF的发病与进展通常由多种因素互相作用引起,最终导致足部受损和组织坏死,尤其针对重度DF溃疡甚至坏疽,临床治疗只能选择截肢手术以防止DF患者进一步发生感染性休克与死亡。因此,在临床治疗中需要能够降低截肢率和保留DF患肢及其功能的治疗方式,这对于DF患者的康复与预后具有重要的意义。
有学者发现在同一方向持续牵拉骨、肌肉、神经、血管可以刺激组织再生,并提出了遵循组织张力-应力法则的骨搬移技术[22-23]。骨搬移按照骨干长轴与骨块搬移方向的关系分为横向与纵向,Ilizarov技术的出现解决了临床治疗长骨骨不连与大段骨缺损等难题[24-25]。随着近年来骨搬移技术的不断发展,TTT已在临床中广泛运用于治疗DF与下肢血栓闭塞性脉管炎等下肢缺血性疾病,尤其在DF微血管重建方面表现出较好的应用前景[26-29]。虽然研究已证实骨搬移的骨窗牵拉区域内会发生微循环重建,且多数研究认为是由于其牵拉应力动员了机体内某种生物因子,从而促进血管与神经等组织再生[13],但目前TTT技术牵引组织再生的详细机制尚未完全阐明。
T细胞可分为CD4+与CD8+两大亚群,其中CD4+与CD4+/CD8+水平降低是免疫缺陷的重要指征[30],而维持CD4+和CD8+T细胞之间的相互作用与平衡能够使机体产生正常免疫应答[31]。此外,早期研究还认为T细胞在创面修复中能够产生多种炎症因子,且创面的损伤与CD8+T细胞的作用密切相关[32]。本研究结果显示,DF患者治疗前均存在T细胞免疫功能缺陷,这与既往研究结果基本一致[33-34]。对比两组DF患者治疗前后T细胞亚群的变化,发现TTT治疗DF患者的CD3+、CD4+及CD4+/CD8+水平均高于对照组,而CD8+水平低于对照组,表明TTT技术可以明显改善DF患者的T细胞免疫功能,加速创伤修复。
SDF-1/CXCR4信号轴不仅能通过激活多种信号通路从而介导细胞增殖与迁移,而且能在DF溃疡等慢性创伤修复的过程中发挥重要的生物学作用,近期研究还发现SDF-1/CXCR4信号轴能够参与并激活PI3K/Akt信号通路[14,35-37]。本研究结果显示,与常规治疗相比,TTT治疗DF患者SDF-1、CXCR4、p-PI3K、p-Akt蛋白表达水平均明显升高。LEE等[38]研究也证实了轴向牵张应力可引起血浆中SDF-1蛋白表达水平升高。此外,LI等[15]与XIU等[16]研究均表明SDF-1/CXCR4信号轴能够通过PI3K/Akt信号通路促进骨髓源干细胞的迁移。因此,TTT治疗DF可能通过上调SDF-1/CXCR4信号轴激活PI3K/Akt信号通路,促进细胞迁移到受损组织进行再生与修复。PI3K/Akt信号通路可能是SDF-1/CXCR4信号轴重要的下游之一,在调节干细胞向创伤组织迁移中发挥关键性作用。
综上所述,TTT治疗DF可能是通过激活SDF-1/CXCR4信号轴介导的PI3K/Akt信号通路,参与调控骨髓源干细胞的迁移,进而改善DF溃疡愈合。TTT技术涉及医学、生物学、力学等多学科领域,还有待深入研究以阐明其作用机制。
