肿瘤最大径对完全切除术后胸腺瘤远期复发的预测价值*
2024-02-23崔莹珊丁叔波
崔莹珊,丁叔波
(金华市中心医院放疗科,浙江金华 321000)
胸腺肿瘤主要起源于胸腺上皮,总体发病率低,为1.3/100万~3.2/100万,中国发病率较欧美国家高[1],是最常见的前上纵隔原发恶性肿瘤。胸腺肿瘤病理组织学类型包括胸腺瘤、胸腺癌和神经内分泌肿瘤等,其中胸腺瘤最常见。胸腺瘤属于惰性恶性肿瘤,手术完全切除后可获得长期生存,完全切除术后的复发率为5%~30%[2-3],复发时间在术后数年至数十年[4]。不少患者死于其他疾病而非胸腺瘤本身。正是因为发病率低、生存期长和非胸腺瘤死亡混杂等因素,胸腺瘤预后因素和复发模式难以确定。国际胸腺肿瘤协作组(ITMIG)规范了临床试验报告标准,建议以无复发生存(RFS)作为胸腺瘤完全切除术后患者预后的最佳评估指标[4]。然而现有研究里,评估终点主要为总生存(OS)率,以RFS率为评估指标的研究仍较少见。
在多数实体肿瘤中,肿瘤最大径在肿瘤分期中占据重要位置,是影响患者预后的关键因素[5]。但关于肿瘤最大径对胸腺瘤完全切除术后患者复发风险的研究不多。本研究拟回顾性分析胸腺瘤完全切除术后患者肿瘤最大径与RFS率之间的关系,探讨根据术前胸部CT测量的肿瘤最大径在预测胸腺瘤完全切除术后复发风险中的临床应用价值,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2007年8月至2017年8月于本院行根治性切除的90例胸腺瘤患者的病例资料。纳入标准:(1)术后经病理确诊为Masaoka-Koga Ⅰ~Ⅲ期的胸腺瘤患者;(2)术前行胸部CT检查;(3)世界卫生组织(WHO)组织学分型[6]为A、AB、B1、B2、B3型。排除标准:(1)合并其他恶性肿瘤;(2)术后有镜下或肉眼残留;(3)胸腺癌;(4)失访。90例患者中男50例,女40例;年龄25~79岁,中位54岁;WHO组织学分型A、AB型28例(31.1%),B1型8例(8.9%),B2型26例(28.9%),B3型28例(31.1%)。Masaoka-Koga Ⅰ期11例(12.2%),Ⅱ期66例(73.3%),Ⅲ期13例(14.4%)。本研究经本院医学伦理委员会审查通过[批准号:(2021)伦审第(54)号]。
1.2 方法
1.2.1资料收集
收集患者手术前末次胸部CT纵隔窗测量肿瘤最大径,根据既往研究报道的肿瘤最大径临界值为4~9 cm[7],按临界值4、5、6、7、8、9 cm分别分为≤4和>4 cm、≤5和>5 cm、≤6和>6 cm、≤7和>7 cm、≤8和>8 cm、≤9和>9 cm,计算5、10年RFS率。胸腺瘤分期参照Masaoka-Koga分期,病理组织学分类参照WHO组织学分型。手术方式包括经胸骨正中切口开胸治疗和胸腔镜治疗,切除范围分为胸腺肿块切除和全胸腺切除。对Masaoka-Koga Ⅱ、Ⅲ期患者推荐术后放疗[8],但是否放疗由患者决定。放疗技术采用三维适形放疗或调强放疗,靶区为瘤床,处方剂量50 Gy/25次,每周5次。
1.2.2复发定义及随访
根据ITMIG定义,临床强烈怀疑复发即可定义为复发,不需病理证实。复发时间记为首次强烈怀疑的时间。RFS时间定义为从手术日期到首次复发或末次随访的时间。复发包括局部复发(前纵隔)、区域复发(胸膜或心包结节、区域淋巴结转移)和远处转移(胸外复发、下颈部复发、肺内结节)[9]。疾病特异性生存(DSS)时间定义为从手术日期开始到由胸腺瘤导致的死亡时间,如果不是胸腺瘤导致的死亡则不计入结局指标。患者治疗结束后每6个月随访1次,随访方式为门诊复查或电话咨询。
1.3 统计学处理
采用SPSS26.0软件进行数据分析,计量资料以M(Q1,Q3)表示,比较采用秩和检验;计数资料以例数或百分比表示,比较采用χ2检验或Fisher确切概率法,采用Kaplan-Meier法分析生存率,采用log-rank法评估组间差异,使用Cox比例风险回归模型进行单因素和多因素分析,将单因素中P<0.1的指标纳入多因素分析,采用向前步进法,计算HR和95%CI,采用双边检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 生存分析
末次随访时间点为2021年11月20日,中位随访时间为79(8,171)个月。所有患者5、10年OS率分别为89.3%、78.8%,中位OS时间未达到。所有患者5、10年DSS率分别为96.2%、88.1%,中位OS时间未达到。所有患者5、10年RFS率分别为89.2%、83.0%。13例(14.4%)患者出现死亡,其中6例死于胸腺瘤复发,1例死于心脏病,1例死于肺部感染,2例猝死,3例死因不详。11例(12.2%)患者出现复发,经再次手术、放化疗等综合治疗后5例长期带瘤生存,6例发生疾病相关死亡。复发患者5、10年DSS率分别为72.7%、32.3%,中位OS时间为83.0个月。
肿瘤最大径≤5 cm的DSS率为100.0%,>5 cm 的DSS率为81.2%(χ2=3.659,P=0.056);≤8 cm的DSS率为94.8%,>8 cm 的DSS率为58.3%(χ2=2.536,P=0.111)。
≤5 cm的RFS率高于>5 cm,≤8 cm的RFS率高于>8 cm,差异有统计学意义(P<0.05),见表1。而≤5和>5 cm的一般情况比较,差异无统计学意义(P>0.05)。但≤8和>8 cm的一般情况比较,除性别外差异无统计学意义(P>0.05),见表2。
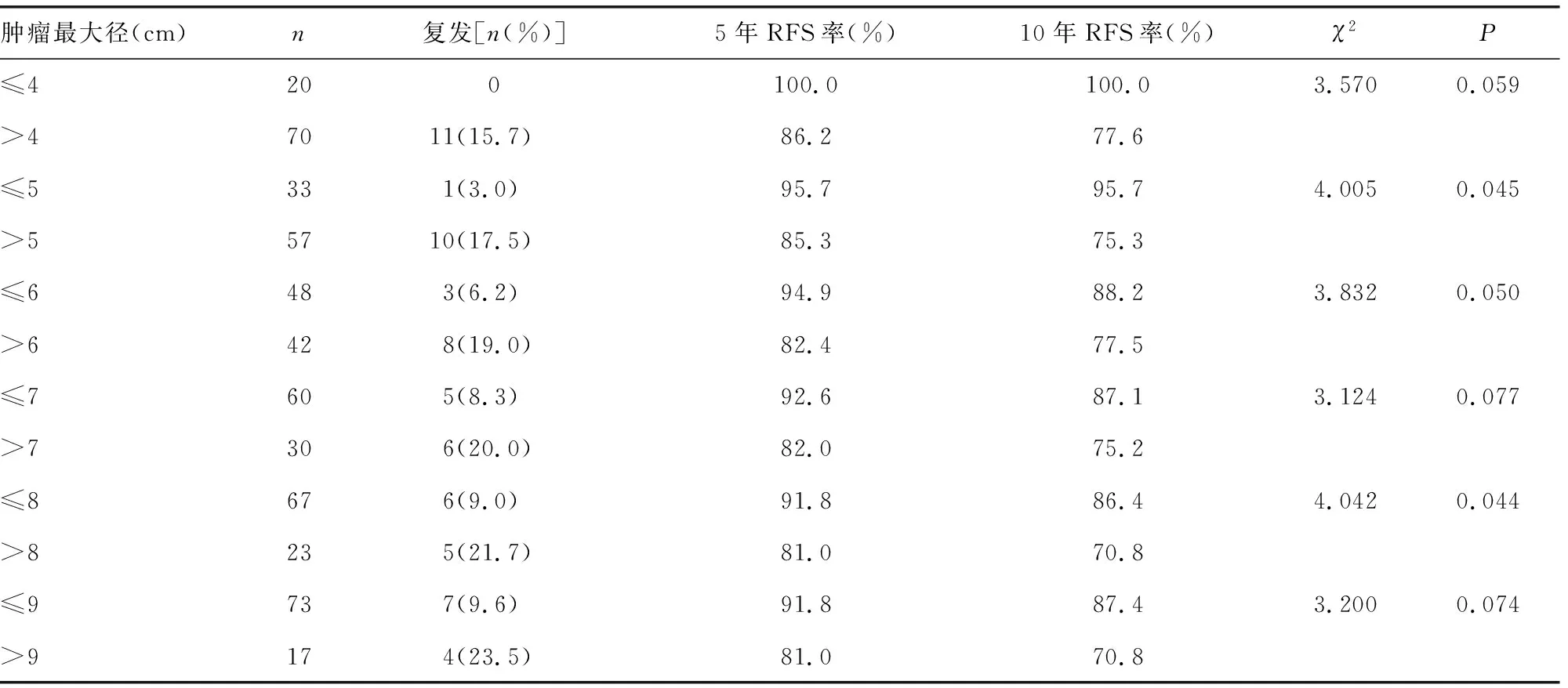
表1 不同肿瘤最大径的RFS率比较
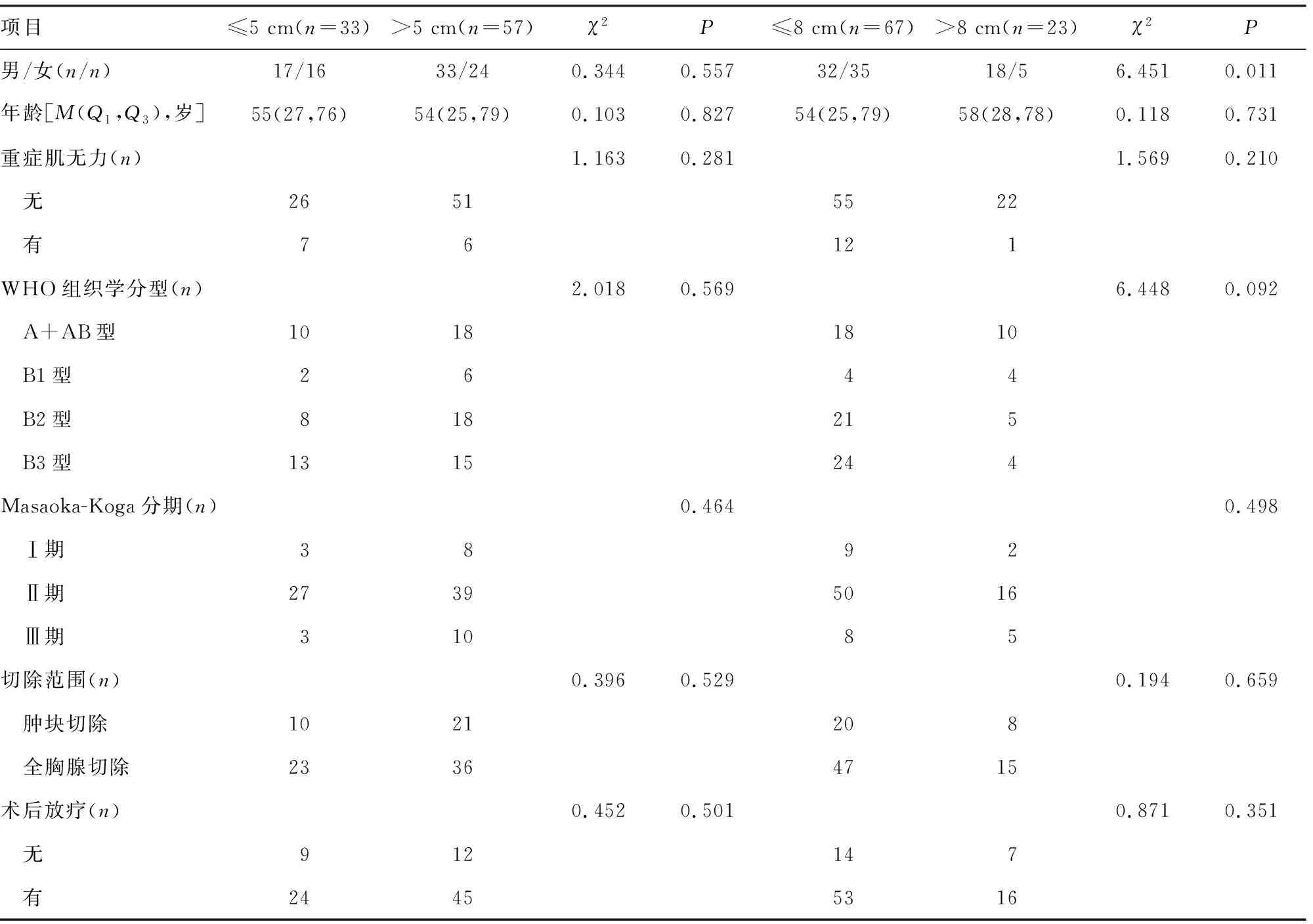
表2 ≤5和>5 cm、≤8和>8 cm患者一般资料比较
2.2 RFS时间的危险因素分析
对肿瘤最大径(临界值为5、8 cm)、性别、年龄、重症肌无力、WHO组织学分型、Masaoka-Koga分期、切除范围及术后放疗进行Cox回归分析。单因素分析结果显示,年龄和Masaoka-Koga分期是RFS时间的影响因素(P<0.05),见表3。将单因素分析中P<0.1的影响因素纳入多因素分析,结果显示肿瘤最大径(临界值为8 cm)、年龄和Masaoka-Koga分期是RFS时间的影响因素(P<0.05),见表4。

表3 RFS时间的Cox单因素分析

表4 RFS的Cox多因素分析
2.3 复发情况
11例复发患者中有8例(72.7%)为多部位复发转移,10例(90.9%)出现胸膜转移(区域复发),6例(54.5%)出现远处转移,1例(9.1%)出现瘤床局部复发。肿瘤最大径≤8 cm的患者中有6例出现复发转移,其中6例(100%)出现胸膜转移,1例(16.7%)出现区域淋巴结转移,3例(50.0%)出现远处转移,1例(16.7%)出现纵隔局部复发。中位复发时间为42.5个月,1例(16.7%)3年内复发,4例(66.7%)4~6年复发,1例(16.7%)11年复发。肿瘤最大径>8 cm的患者中有5例出现复发转移,4例(80.0%)出现胸膜转移,1例(20.0%)出现区域淋巴结转移,3例(60.0%)出现远处转移,无局部复发。中位复发时间为34.0个月,4例(80.0%)3年内复发,1例(20.0%)7年复发。
肿瘤最大径≤8 cm患者的5、10年复发率为8.2%、13.6%,肿瘤最大径>8 cm患者的5、10年复发率为19.0%、29.2%,差异有统计学意义(χ2=4.042,P=0.044)。
3 讨 论
胸腺瘤发病率较低,完全切除后生存期长,相当一部分患者死于胸腺瘤以外的疾病。马超等[10]随访了182例胸腺瘤切除术后患者,其中15例患者死亡,4例死于胸腺瘤复发,6例死于重症肌无力,2例死于肺炎,1例死于直肠癌,1例死于心肌梗死,还有1例死因不详。本研究结果显示13例(14.4%)患者出现死亡,其中6例死于胸腺瘤复发,1例死于心脏病,1例死于肺部感染,2例猝死,3例死因不详。发现受其他因素的影响导致的死亡甚至超过胸腺瘤本身。因此,用OS时间来进行胸腺瘤预后分析存在一定问题。
本研究对90例胸腺瘤完全切除术后患者进行长期随访,所有患者10年DSS率、RFS率分别为88.1%、83.0%。12.2%的患者出现复发,复发患者10年DSS率只有32.3%,与既往研究[11-12]结果基本一致。这些结果提示胸腺瘤患者完全切除术后生存率高,生存期长,但复发后生存率明显下降。焦鹏等[13]研究发现,胸腺瘤复发是影响患者生存的不良预后因素。有研究显示,对于复发性胸腺瘤患者尽早行二次肿瘤切除以获得更好的预后[14-16]。但临床上很多医师不清楚较大直径胸腺瘤患者完全切除术后的复发风险及模式,作者基于此进行研究并提出建议,达到尽早发现肿瘤复发、及时挽救治疗、提高生存率的目的。
在多数实体瘤中,肿瘤最大径是重要的预后因素,与肿瘤分期及生存密切相关。肿瘤越大,TNM分期越晚,治疗后复发率越高,生存率越低。而肿瘤最大径在胸腺瘤中的价值一直被低估,无论是Masaoka-Koga分期或第8版TNM分期,目前均未纳入肿瘤最大径这一重要预后指标[17]。SAFIEDDINE等[18]研究了262例手术切除的胸腺瘤患者,发现肿瘤最大径的增加与复发风险增加相关。OKUMURA等[19]对2 083例接受手术治疗的胸腺瘤患者进行统计,发现肿瘤最大径<5、5~10、>10 cm患者病理诊断为N1或N2所占的比例分别为0.3%、2.1%、3.5%,TNM分期Ⅲ或Ⅳ期的肿瘤所占比例分别为9.6%、21.4%、36.9%;肿瘤最大径<8 cm患者的10年DSS率高于>8 cm患者。YUN等[20]发现肿瘤最大径对有限阶段肿瘤(Masaoka-Koga分期Ⅰ/Ⅱ期或TNM分期Ⅰ期)的OS率(P=0.003)和RFS率(P<0.001)都有明显影响。本研究发现,肿瘤最大径>5 cm患者Masaoka-Koga分期Ⅲ期占比(10/57)高于≤5 cm患者(3/33),肿瘤最大径>8 cm患者Masaoka-Koga分期Ⅲ期占比(5/23)高于≤8 cm患者(8/67)。肿瘤最大径≤5 cm患者10年RFS率(95.7%)高于>5 cm患者(75.3%),肿瘤最大径≤8 cm患者10年RFS率(86.4%)高于>8 cm患者(70.8%),差异有统计学意义(P<0.05)。肿瘤最大径≤8 cm患者10年DSS率(94.8%)高于>8 cm患者(58.3%),但差异无统计学意义(P>0.05),这可能是由于随访截止时终点事件即胸腺瘤死亡数量过少引起。
为进一步探讨肿瘤最大径是否为胸腺瘤完全切除术后患者的独立预后因素,本研究进行了单因素和多因素Cox回归分析,结果显示只有肿瘤最大径临界值为8 cm是胸腺瘤完全切除术后患者复发的独立危险因素(HR=3.828,95%CI:1.038~14.116,P=0.044),这更加证实肿瘤最大径能够影响胸腺瘤完全切除术后患者的预后。BIAN等[21]、MIYASHITA等[22]、SAKAI等[23]研究也认为肿瘤最大径是判断预后的指标,但各研究的临界值并不统一。但也有研究认为肿瘤最大径对完全切除术后胸腺瘤的预后无影响[11],这可能是因为:(1)未采用合适的临界值;(2)纳入的病例包含非胸腺瘤死亡患者,存在偏倚。由于临界值在不同的报告中有所不同,导致结果不一致,这可能是肿瘤最大径价值被低估的原因。
本研究进一步分析了胸腺瘤完全切除术后复发模式,发现最常见的复发部位是胸膜(90.9%),其次是远处转移(54.5%),与既往研究[24]结果一致。此外,还发现肿瘤最大径>8 cm患者复发转移时间要早于≤8 cm患者,常发生在3年内,而肿瘤≤8 cm患者复发常发生在3~6年,且肿瘤最大径>8 cm患者发生远处转移的比例高于≤8 cm患者。KAMATA等[25]发现RFS时间<3年的胸腺瘤患者预后较差。JIAO等[26]认为复发时间较长,对患者有明显的好处。因此作者建议,对于肿瘤最大径>8 cm的胸腺瘤患者在完全切除术后应进行更为严密的随访,至少在3年内每半年复查1次;检查方式除胸部CT外,在怀疑胸腔外转移时还应进行相关的检查,以明确是否合并远处转移。这有助于临床医师尽早发现大肿块胸腺瘤的复发并及时进行挽救治疗。
本研究发现,可根据患者术前末次胸部CT纵隔窗测量的肿瘤最大径来判断胸腺瘤完全切除术后患者复发风险。由于Masaoka-Koga分期或TNM分期目前均根据胸腺瘤侵犯深度及范围制订,大部分胸腺瘤术后病理报告中并未包括肿瘤最大径这一重要基本特征,较易导致临床医师忽略较大胸腺瘤切除术后的复发风险。随着时代与科技发展,现有胸部CT已基本取代胸部X线片成为胸腺瘤的检查方式[27-28],尤其是低剂量胸部CT的普遍应用,极大地降低了患者对扫描CT而受到辐射损害的担心。临床医师甚至可以通过扫描影像报告上的二维码来获取非本院影像数据,从而轻易获得术前肿瘤最大径这一重要数据。
综上所述,肿瘤最大径(>8 cm)是胸腺瘤完全切除术后患者复发的独立影响因素之一。术前CT提示肿瘤越大,术后复发风险越高。此外,本研究对大肿块胸腺瘤完全切除术后患者复发模式的分析可为临床医师对患者的诊疗决策提供参考。本研究存在一定的局限性:(1)大多数患者未达到随访终点,需要更长时间的持续随访来获得更精确细致的复发情况;(2)单中心、小样本量可能会使结果产生一定的偏差,更详细的随访策略需要多中心、更大样本量的研究来制订。
