UPLC-MS/MS法测定麦冬中6种植物生长调节剂残留量
2024-02-23史达曹玉张玲
史 达 曹 玉 张 玲
南京市食品药品监督检验院,江苏 南京 211100
麦冬为百合科植物麦冬Ophiopogonjaponicus(L.f.)Ker-Gawl.的干燥块根,具有养阴生津、润肺清心的功效,临床用于肺燥干咳、阴虚痨嗽、喉痹咽痛、津伤口渴、内热消渴、心烦失眠、肠燥便秘等症[1],同时也是国家卫生健康委员会公布的可用于保健食品的中药品种之一[2]。中国是麦冬主产国,为了提高麦冬产量,种植户常在种植过程中使用植物生长调节剂(plant growth regulators,PGRs)[3]。植物生长调节剂是一类经人工提取、合成的能调节植物的生长发育和生理功能的化学物质,主要包括矮壮素、甲哌鎓、丁酰肼、多效唑、烯效唑、4-硝基苯酚钠等[4]。使用植物生长调节剂能提高麦冬的产量,但盲目、过量使用会导致麦冬中甾体皂苷、高异黄酮类等主要次生代谢产物含量显著降低,影响药材的有效性[5-6]。此外,部分植物生长调节剂具有一定的安全风险,如矮壮素具较高的急性毒性和刺激性[7],丁酰肼存在潜在的致癌、致畸、致突变毒性[4],多效唑有繁殖毒性和神经毒性[8],长时间、高剂量的使用会导致其在麦冬中残留,危害食用者的健康。我国制定的《食品安全国家标准——食品中农药最大残留限量》(GB 2763—2021)[9]中规定了部分食品中多种植物生长调节剂的限度,但目前尚无针对药材中植物生长调节剂残留的限量标准。
植物生长调节剂检测的方法主要有酶联免疫吸附法(ELISA)、气相色谱法(GC)、高效液相色谱法(HPLC)、气相色谱-串联质谱法(GC-MS/MS)和液相色谱-串联质谱法(LC-MS/MS)等[10]。由于色谱-质谱联用法具有灵敏度高、专属性强等特点,已成为麦冬中植物生长调节剂检测的主流方法[11-13]。QuEChERS方法是一种简单有效、安全快速、高通量的净化方法,已被广泛应用到农药等多残留的前处理当中。研究[11]发现QuEChERS净化材料如C18、PSA、石墨碳等会对不同结构的植物生长调节剂产生吸附,导致丁酰肼、烯效唑等化合物回收率低于70%。本文使用的直接提取法避免了净化材料的使用,进一步降低了检测成本,简化了前处理操作,可以用于麦冬中植物生长调节剂的快速筛查。本实验通过文献研究,并结合《食品安全国家标准—食品中农药最大残留限量》(GB 2763—2021)[9],筛选出麦冬中检出率较高的矮壮素、甲哌鎓、丁酰肼、4-硝基苯酚钠、多效唑、烯效唑等6种植物生长调节剂作为检测指标,采用UPLC-MS/MS法进行定性定量分析,建立了麦冬中植物生长调节剂快速筛查检测技术,并对收集到的35批麦冬进行了检测,为指导植物生长调节剂类农药的合理应用提供技术支撑。
1 仪器与材料
1.1 仪器 1260 Infinity II-6470 LC/MS/MS高效液相-三重四极杆液质联用系统(安捷伦科技有限公司);XS205DU电子分析天平(梅特勒-托利多仪器有限公司);KQ-800DE超声清洗器(昆山市超声仪器有限公司);Allegra X-30离心机(贝克曼库尔特有限公司);Milli-Q纯水仪(德国默克集团);TM-2F涡旋振荡器(德国WIGGENS集团)。
1.2 材料 甲酸(色谱纯,德国Fluka公司);醋酸铵(色谱纯,上海阿拉丁生化科技股份有限公司);甲醇(色谱纯,德国Merck公司);试验用水为超纯水。对照品:甲哌鎓[批号:1ST24022-100M,100 μg/mL甲醇溶液,天津阿尔塔科技有限公司];矮壮素[批号:21111XM,100 μg/mL甲醇溶液,曼哈格(上海)生物科技有限公司];丁酰肼[批号:21609XM,100 μg/mL甲醇溶液,曼哈格(上海)生物科技有限公司];烯效唑(批号:1ST24012-100A,100 μg/mL乙腈溶液,天津阿尔塔科技有限公司);多效唑(批号:1ST24027-100M,100 μg/mL甲醇溶液,天津阿尔塔科技有限公司);4-硝基苯酚钠(批号:1ST9022-100MW,100 μg/mL甲醇∶水(9∶1)溶液,天津阿尔塔科技有限公司)。35批麦冬样品为南京市抽验性评价样品,由南京市食品药品监督检验院药品所曹玉主任鉴定。
2 方法与结果
2.1 UPLC-MS/MS条件
2.1.1 色谱条件 色谱柱:Agilent Rapid Resolution HD C18色谱柱(50 mm×2.1 mm,1.8 μm);流动相A为0.1%甲酸的5 mmoL/L醋酸铵溶液,流动相B为乙腈;梯度洗脱程序:0~2.0 min,95% A;2.0~5.0 min,95%~25% A;5.0~9.0 min,25%~10% A;流速0.3 mL/min;柱温:40 ℃;进样量:1 μL。
2.1.2 质谱条件 离子源:ESI电喷雾;扫描方式:正负离子同时扫描;检测方式:多反应监测(multiple reaction monitoring,MRM);毛细管电压:4000V(+)3500(-);干燥气温度:300 ℃;干燥气流速:6 L/min;鞘气温度:350 ℃;鞘气流速:11 L/min;优化后的质谱采集参数见表1,各成分离子流色谱图如图1所示。

表1(续)

1.总离子流图(TIC);2.甲哌鎓;3.矮壮素;4.丁酰肼;5.烯效唑;6.多效唑;7. 4-硝基苯酚钠;A.对照品代表图谱;B.样品代表图谱图1 各成分离子流色谱图
2.2 供试品溶液的制备 精密称取粉碎后的麦冬2 g于50 mL离心管中,加入10 mL含0.1%甲酸的乙腈溶液,涡旋混匀30 s,超声提取(功率800 W,频率40 KHz)30 min,10000 rpm离心5 min,取上清液,残渣加入0.1%甲酸的乙腈溶液10 mL同法再提取一次,合并上清液,用0.22 μm滤膜过滤,供UPLC-MS/MS分析。
2.3 标准溶液的制备 精密吸取矮壮素、甲哌鎓、丁酰肼、4-硝基苯酚钠、多效唑、烯效唑各对照品溶液适量于20 mL容量瓶中,加乙腈稀释至刻度,制成每1 mL含矮壮素100 ng、甲哌鎓50 ng、丁酰肼5 μg、4-硝基苯酚钠5 μg、多效唑2 μg、烯效唑2 μg的混合标准储备液,密封,置于4 ℃保存,即得。
2.4 方法学考察
2.4.1 线性关系考察 以未检出6种植物生长调节剂的麦冬作为空白基质,按“2.2”项下方法制备麦冬基质提取溶液,稀释混合标准溶液配制基质标准工作溶液,制成每1 mL含矮壮素0.1 ng、0.2 ng、0.5 ng、1 ng、2 ng、5 ng,含甲哌鎓0.05 ng、0.1 ng、0.25 ng、0.5 ng、1 ng、2.5 ng,含丁酰肼/4-硝基苯酚钠5 ng、10 ng、25 ng、50 ng、100 ng、250 ng,含多效唑/烯效唑2 ng、4 ng、10 ng、20 ng、40 ng、100 ng的S1~S6系列混合溶液,分别进样。以标准溶液质量浓度为横坐标(X),化合物定量离子对峰面积为纵坐标(Y),进行线性回归计算。实验结果表明,6种化合物相关系数R2均大于0.99,线性关系良好。见表2。
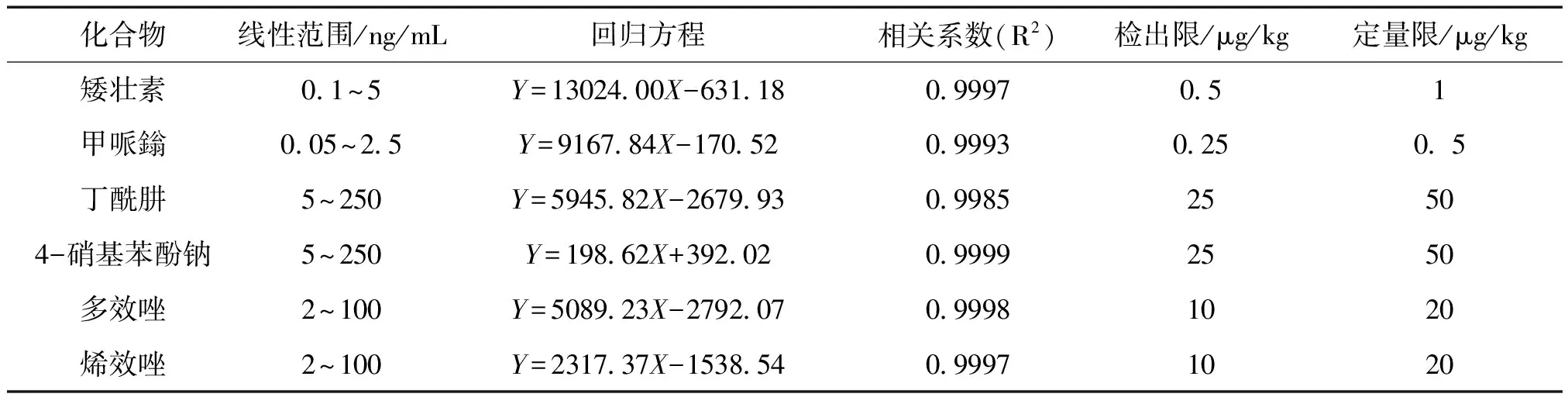
表2 6种植物生长调节剂的线性范围、回归方程、检出限和定量限
2.4.2 检出限与定量限 以系列不同质量浓度混合标准溶液加标空白基质中,按“2.2”项下方法制备,在“2.1”项条件下进样分析,以信噪比S/N=3质量浓度为检出限,以信噪比S/N=10质量浓度为定量限,结果见表2。《食品安全国家标准—食品中农药最大残留限量》(GB 2763—2021)[9]规定矮壮素、甲哌鎓、丁酰肼、4-硝基苯酚钠、多效唑和烯效唑的最大残留限量分别为100 μg/kg(菜籽毛油)、50 μg/kg(大豆等)、50 μg/kg(花生仁)、100 μg/kg(大豆等)、50 μg/kg(大豆等)和50 μg/kg(小麦等),本实验中6种植物生长调节剂的定量限均满足要求。
2.4.3 精密度实验 取“2.4.1”项下S2标准工作溶液,在“2.1”项条件下连续进样6次,测得矮壮素、甲哌鎓、丁酰肼、4-硝基苯酚钠、多效唑、烯效唑峰面积RSD分别为1.1%、0.7%、0.9%、1.4%、1.7%、1.3%,表明仪器精密度良好。
2.4.4 回收率和重复性实验 取麦冬空白基质2 g,精密称定,按低、中、高浓度水平分别精密加入“2.3”项下的混合标准储备液20 μL、100 μL、500 μL,每水平浓度平行6份,按“2.2”项下方法制备回收率和重复性样品。6 种植物生长调节剂平均加样回收率为80.7%~105.1%,重复性RSD为0.9%~8.1%。具体数据见表3。

表3 6种植物生长调节剂回收率和重复性实验结果 (n=6)
2.4.5 稳定性实验 取“2.4.4”项下加标溶液,分别在室温下放置0 h、2 h、4 h、6 h、8 h,在“2.1”项条件下进样分析,结果矮壮素、甲哌鎓、丁酰肼、4-硝基苯酚钠、多效唑、烯效唑峰面积的RSD分别为2.4%、1.7%、1.9%、2.1%、1.2%、1.5%,说明样品溶液在室温8 h内稳定。
2.5 样品的测定 取市售35批麦冬样品(涉及 25 家生产企业),按“2.2”项下方法制备成供试品溶液,在“2.1”项条件下进样分析,结果见表4。样品中检出矮壮素、甲哌鎓和多效唑,其中矮壮素、多效唑的检出率均为100%,甲哌鎓的检出率为80%。35批麦冬中多效唑残留量51.6~190.0 μg/kg,是《食品安全国家标准—食品中农药最大残留限量》(GB 2763-2021)[9]规定的大豆等食品中最大残留限量的1~4倍;样品中矮壮素残留量较低,有8批低于定量限但高于检出限,其余27批残留量在1.0~23.4 μg/kg范围内,低于GB 2763-2021规定的菜籽毛油等食品中最大残留限量100 μg/kg;5批样品中甲哌鎓高于定量限,残留量为0.53~0.99 μg/kg,远低于GB 2763-2021规定的农产品中甲哌鎓的最大残留限量50 μg/kg(大豆);所有批次样品均未检出丁酰肼、4-硝基苯酚钠和烯效唑。以上结果表明麦冬中矮壮素、多效唑等植物生产调节剂残留检出率较高,存在潜在安全隐患。
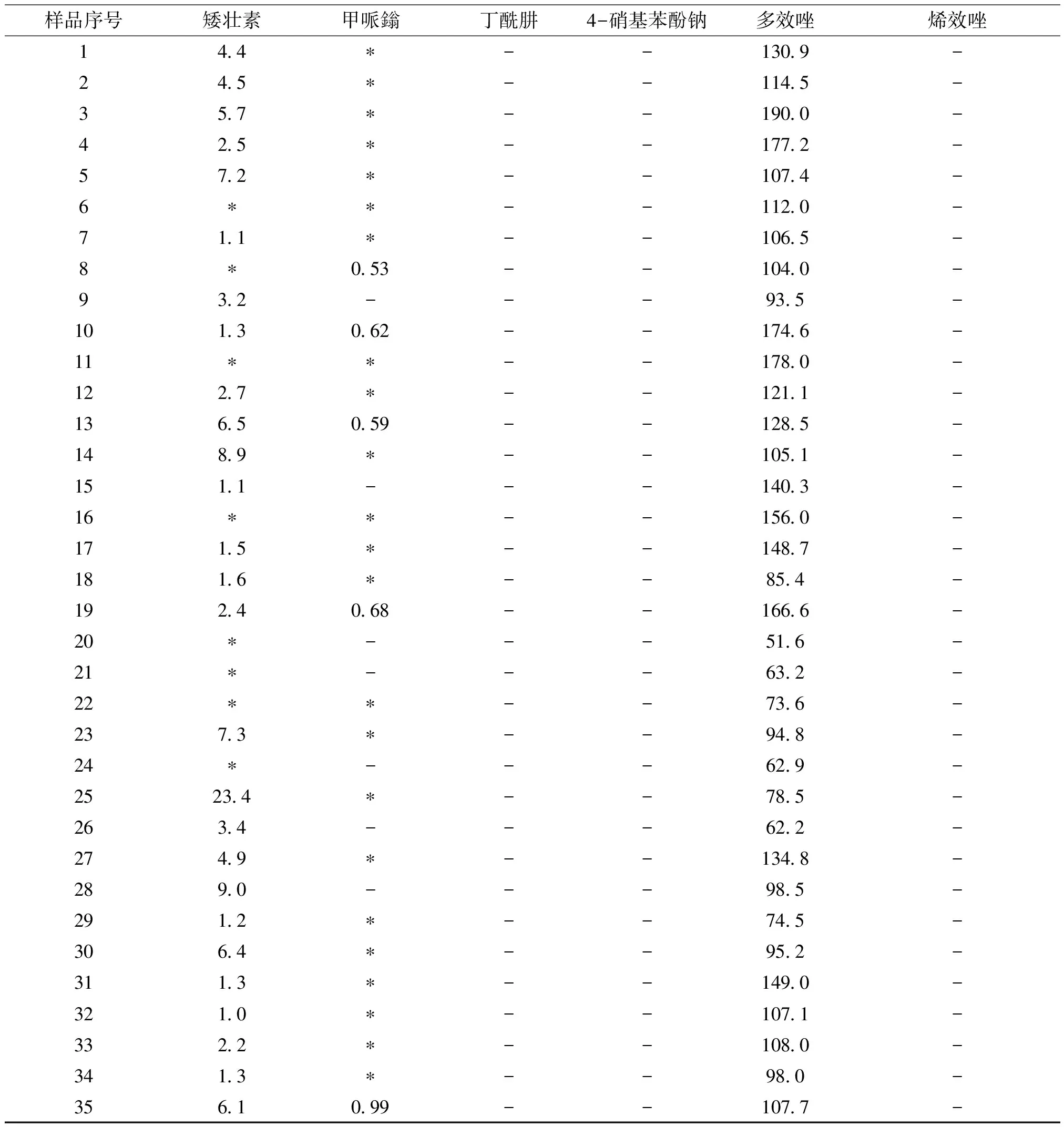
表4 35批样品测定情况 (μg/kg)
3 讨论
3.1 前处理方法的优化 在提取溶剂的选择上,乙腈对基质中的脂肪、色素等非极性成分提取较少[14],能更好地保护色谱柱,且实验发现乙腈中加入0.1%甲酸能进一步提高提取效率,因此选择含0.1%甲酸的乙腈溶液作为提取溶剂。实验比较了超声时长对提取效率的影响,发现超声时间越长,提取效率越高,至30 min时提取效率增长趋于平缓,故选择超声处理30 min。
3.2 色谱条件的优化 实验考察了甲醇、乙腈、甲醇-乙腈(1∶1,V∶V)等有机相对各植物生长调节剂响应值的影响,发现乙腈体系下化合物的响应值更好,因此选择乙腈为有机相。实验发现水相中加入0.1%甲酸能改善拖尾现象,同时比较了不同醋酸铵浓度(1 mmoL/L 、2 mmoL/L、5 mmoL/L)下各化合物的响应情况,最终选择含0.1%甲酸的5 mmoL/L醋酸铵溶液作为水相。
3.3 质谱条件的优化 对6种植物生长调节剂分别进行了正、负离子扫描,结果显示矮壮素、甲哌鎓、丁酰肼、多效唑、烯效唑5个化合物在正离子监测模式下响应较好,而4-硝基苯酚钠在负离子监测模式下响应较好,因此采用正负离子同时扫描模式。选择离子丰度较高的离子对作为监测离子对,并在此基础上优化碎裂电压和碰撞能量,最终优化结果见表1。
3.4 基质效应的考察 基质是样品中被分析物以外的组分,常对分析物的分析有显著干扰,并影响分析结果的准确性,这些影响和干扰被称为基质效应[15]。可通过对比基质匹配标液与相同浓度的纯溶剂标液的仪器响应值来考察基质效应,二者的比值若在85%~115%,则基质效应可以忽略。本实验对比了6种植物生产调节剂基质匹配标液与纯溶剂标液的仪器响应值,发现丁酰肼基质增强效应超过20%,因此采用基质匹配标准曲线进行校准定量。
本实验为麦冬中多种植物生产调节剂的快速筛查提供了一种准确灵敏的检测方法,从35批麦冬中检出多效唑、矮壮素和甲哌鎓残留,其中多效唑和矮壮素的检出率为100%,甲哌鎓的检出率为80%,提示植物生产调节剂的使用存在一定风险,需加强引导和监管。
