4种沙漠植物固氮菌的分离与固氮活性检测
2024-02-22王丽君孙蓓蓓王春燕夏占峰马国财
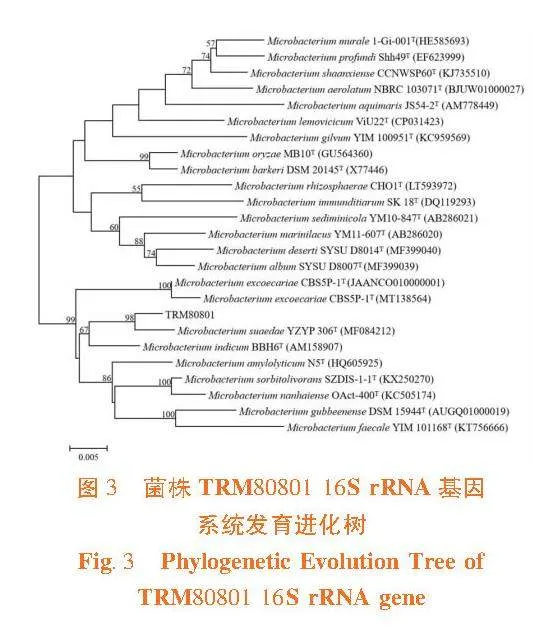



摘"要:【目的】""研究塔克拉玛干沙漠植物获取氮素营养的途径,为塔克拉玛干沙漠固氮菌资源的开发和干旱区生态环境的保护提供支持。
【方法】""以沙漠典型豆科植物苦豆子、柽柳科植物多枝柽柳、菊科植物花花柴和蓼子朴为研究对象,利用YMA(酵母甘露醇琼脂)和Ashby(阿须贝)无氮源培养基从植物根部分离固氮菌。
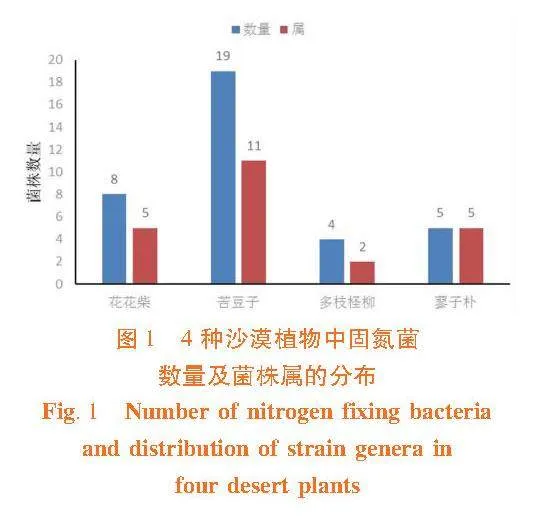
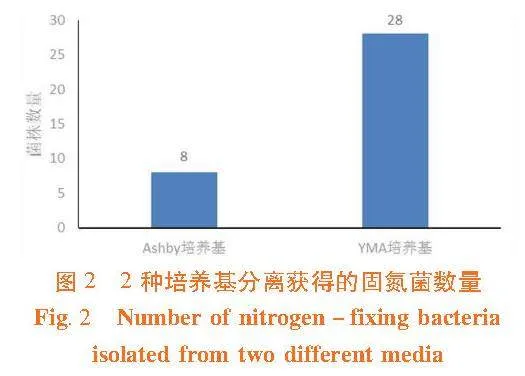
【结果】""从苦豆子样品分离获得19株菌,分布于11个属;从花花柴样品分离获得8株菌,分布于5个属;从蓼子朴样品分离获得5株菌,分布于5个属;从多枝柽柳样品分离获得4株菌,分布于2个属。YMA培养基分离获得28株菌,分布于15个属;Ashby无氮培养基分离获得8株菌,分布于7个属。10株菌有固氮活性,从多枝柽柳中获得的Rhizobium sp."80417、从苦豆子中获得的Enterobacter sp.81227和Acinetobacter sp.81240、从花花柴中获得的Paenibacillus sp.80802 和Microbacterium sp.80803具有较强的固氮能力。
【结论】""固氮菌种类的多样化,促进了营养贫瘠环境氮元素的补充。
关键词:""塔克拉玛干沙漠;苦豆子;多枝柽柳;花花柴;蓼子朴;固氮菌
中图分类号:"S188""""文献标志码:"A""""文章编号:"1001-4330(2024)11-2742-08
0"引 言
【研究意义】塔克拉玛干沙漠位于新疆塔里木盆地中部,面积3.376 ×105 km2,是我国最大的流动沙漠,该沙漠远离海洋、高山环绕、降水稀少、极度干旱和生态环境脆弱。特殊气候与贫瘠营养条件导致该沙漠区域内以抗旱耐贫瘠的植物为主[1],塔克拉玛干沙漠腹地和边缘花花柴、多枝柽柳、蓼子朴和苦豆子较为常见。花花柴(Karelinia caspia)是菊科花花柴属多年生草本植物,多生长于干旱、半干旱地区的冲积平原及沙质草甸盐土地[2]。花花柴作为重要的防风固沙植物,具有耐盐碱、耐干旱、耐高温以及耐沙埋等生理特性,是一种改善荒漠地区生态平衡的重要植物[3]。多枝柽柳(Tamarix ramosissima)为柽柳科柽柳属植物,主要分布于荒漠河岸和冲积平原盐渍化沙地[4],具耐干旱、耐盐碱,抗风沙等特点,是干旱区优良的防风固沙植物,也是盐碱地的绿化造林树种[5]。蓼子朴(Inula salsoloides)是菊科旋覆花属,多年生草本植物,根状茎横走,具有较强的繁殖能力,主要分布于我国华北典型草原至荒漠草原带地区[6]。苦豆子(Sophora alopecuroides)是豆科槐属的一种多年生草本植物,多生于干旱沙漠和草原边缘地带,其根、茎、叶和种子均可入药,具有重要的药用价值[7]。植物根际存在大量的固氮微生物,能固定空气中的氮气为植物生长提供氮素,还可拮抗植物病原菌提高植物的抗病能力。固氮微生物是指能将分子氮还原为氨态氮的微生物,主要生长在氮素缺乏、营养不良的环境中。【前人研究进展】杨瑞红等[8]通过对古尔班通古特沙漠南缘地区的梭梭和柽柳土壤微生物多样性的初步分析,表明梭梭和柽柳土壤中独特的迷踪菌门(Elusimicrobia)与固氮菌密切相关。章振亚等[9]通过研究崇明东滩湿地外来入侵物种互花米草根际固氮微生物多样性,揭示了互花米草与其根际固氮微生物之间的相互关系,对外来植物入侵的土壤微生物学机制研究有着重要指导意义。唐凯等[10]对浑善达克沙地土壤表层和底土固氮菌群落结构及多样性进行了研究,结果表明藻壳、地衣壳、苔藓壳及其邻近底土固氮菌群落结构和多样性存在显著差异,固氮菌群和多样性指数随着生物土壤结皮发育阶段的增加而增加。【本研究切入点】固氮微生物是一种重要的功能菌群,在土壤氮素循环中起着不可替代的作用,其群落结构组成对土壤固氮和维持氮循环平衡具有重要意义,在生态系统中有着重要地位[11]。杨鸿儒等[12]研究了3种荒漠灌木根际可培养固氮菌群及其固氮和产铁载体能力,表明残遗灌木植物的根际固氮菌在鄂尔多斯沙漠不同植物间有明显差异,并包含各种固氮菌固氮能力和高铁产生能力,可以用作植物生长促进根际细菌的重要来源。需研究塔克拉玛干沙漠固氮微生物的种类、丰富度和分布特征。【拟解决的关键问题】以塔克拉玛干沙漠耐贫瘠、耐干旱植物花花柴、苦豆子、多枝柽柳、蓼子朴根际的固氮微生物为研究对象。评估沙漠固氮微生物的固氮能力,开发利用沙漠极端环境中微生物资源,分析沙漠极端环境中植物与微生物的关系,为改善沙漠生态环境提供支持。
1"材料与方法
1.1"材 料
1.1.1"样品采集及菌悬液
2021年7月从塔克拉玛干沙漠及周边采集花花柴、多枝柽柳、蓼子朴和苦豆子植株,采样深度为10~20 cm,收集根际土。称取1 g根际土研磨,加入9 mL无菌水,采用梯度稀释法依次制成稀释度分别为10-1、10-2、10-3和10-4菌悬液,梯度稀释后涂布于Ashby无氮培养基和YMA培养基分离纯化固氮菌。
1.1.2"培养基
Ashby无氮培养基:葡萄糖10 g,NaCl 0.2 g,MgSO4·7H2O 0.2 g,CaSO4 0.2 g,KH2PO4 0.2 g,CaCO3 5 g,琼脂18 g,蒸馏水 1 L,pH 7.0~7.2。
YMA培养基:甘露醇 10 g,酵母粉 1 g,CaCl2 0.05 g,MgSO4·7H2O 0.2 g,NaCl 0.1 g,K2HPO4 0.5 g,Rh微量元素液 4 mL,蒸馏水 1 L,pH 6.8~7.0(Rh微量元素液:KMnO4 5 g,H3BO3 5 g,蒸馏水 1 L)。
1.2"方 法
1.2.1"固氮菌的分离培养
将各植物根际土稀释液涂布于Ashby 和YMA两种培养基上,每种3个重复,分离具有固氮潜力的微生物。
1.2.2"菌株种类的鉴定
采用SDS-溶菌酶法提取微生物基因组DNA,应用27F,1492R引物PCR扩增其16S rRNA基因,将测序所得序列利用NCBI中的BLAST工具进行相似度比对,根据16S rRNA基因相似度确定菌株的种类。
1.2.3"菌株固氮能力检测
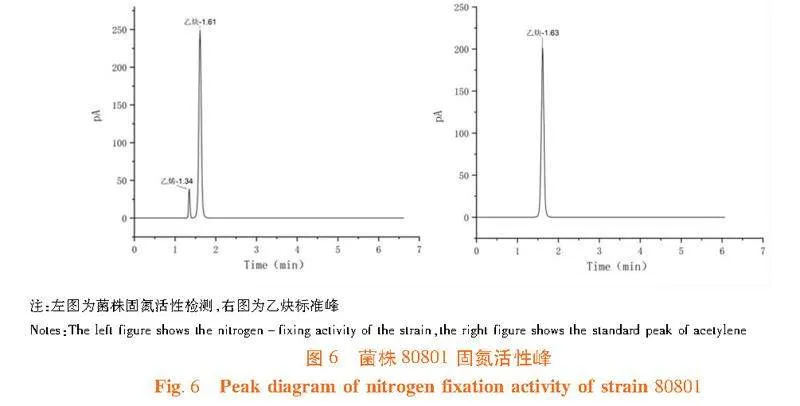
采用乙炔还原法对菌株的固氮酶活性进行检测,对其固氮能力进行评估。其原理是根据固氮酶能将乙炔催化还原为乙烯,生成的乙烯可以在低浓度下用气相色谱的氢火焰离子化检测器检测[13]。
将2 mL菌种分别接种于盛有5.0 mL Ashby无氮培养基和YMA培养基的15 mL试管中,28℃,48 h培养后,向每支试管中注入1.5 mL乙炔(纯度99.99%)气体(对照试管除外),再放置培养箱中培养48 h,然后从试管中抽取2 mL混合气体注入气相色谱仪中,测定乙炔的生成情况。通过比较乙炔峰面积和标准乙炔峰面积的差值来判断有无乙烯生成,3次重复。根据差值大小判断固氮酶活性的强弱。试验过程中的气相条件为:柱温60℃;进样口温度200℃;FID监测器温度200℃;气体流速:N2 35 mL/min,H2 60 mL/min,空气 400 mL/min。以培养物在单位时间内产生的乙烯量 C2H4 ( nmol/(mL·h) ) 表示固氮酶的活性。
固氮活性=""实际乙烯峰面积×标准乙炔含量×反应瓶容积"标准乙炔峰面积×样品量×进样量×培养时间"。
2"结果与分析
2.1"不同沙漠植物分离菌株多样性
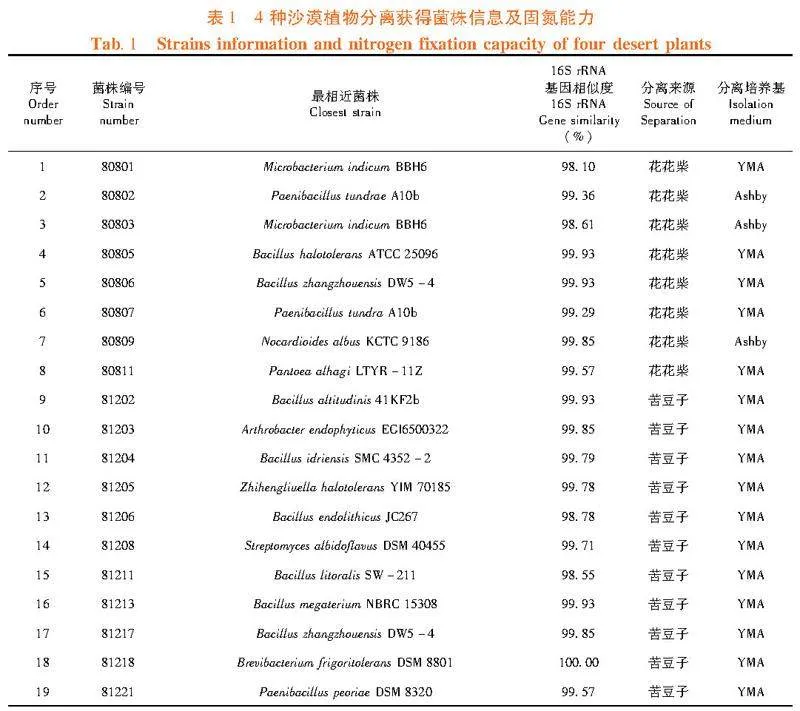
研究表明,4种沙漠植物中共分离获得36株菌,其中从苦豆子样品分离获得19株,分布于11个属;从花花柴样品分离获得8株,分布于5个属;从蓼子朴样品分离获得5株,分布于5个属;从多枝柽柳样品分离获得4株,分布于2个属。苦豆子样品中分离的菌株数量最多,蓼子朴的样品中分离得到的菌株5株,但是均分布于不同属,具有丰富的微生物多样性。图1,表1
2.2"不同培养基分离菌株多样性
研究表明,共分离获得71个菌株。合并重复菌株后共获得18个属36个菌株。其中YMA培养基分离获得28株菌分布于15个属;Ashby无氮培养基分离获得8株菌,分布于7个属。2种培养基分离获得的微生物数量差异显著,YMA培养基营养丰富,多用于分离根瘤菌,Ashby培养基不含氮元素,多用于分离自生固氮菌。表1、图2
2.3"分离菌株多样性及遗传进化
研究表明,分离获得的菌株中Bacillus数量最多(10株),其次为Pantoea和Rhizobium(各4株),Paenibacillus 3株,Microbacterium 2株,其它菌属各1株。从菌株的16S rRNA基因比对结果分析可知,TRM80801与Microbacterium indicum BBH6 16S rRNA基因相似度为98.10%;TRM80611 与Massilia timonae CCUG 45783 16S rRNA基因相似度为98.12%;分别与相似菌株构建16S rRNA基因系统发育树,2株菌疑似新种。表1,图3,图4
2.4"菌株的固氮活性检测及固氮能力
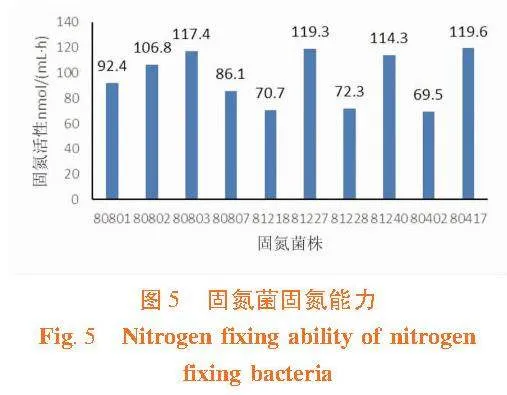
研究表明,分离获得的36株菌经固氮活性检测,有固氮活性的共10株,其中分离自苦豆子样品的有4株、分离自花花柴样品的有4株、分离自多枝柽柳样品的有2株。分离自苦豆子样品的固氮菌为Enterobacter sp.81227、Acinetobacter sp."81240、Pantoea sp."81228和Brevibacterium sp."81218;分离自花花柴样品的固氮菌株为Paenibacillus sp.80802、Microbacterium sp.80803、Microbacterium sp.80801和Paenibacillus sp."80807;分离自多枝柽柳样品的固氮菌为Rhizobium sp.80417和Rhizobium sp."80402。固氮能力最强的菌株为分离自多枝柽柳的菌株Rhizobium sp.80417。分离自蓼子朴样品的菌株未检测出固氮活性。表1,图5,图6
3"讨 论
3.1
从4种沙漠植物中分离获得的微生物种类和数量差异显著,苦豆子分离获得的菌株最多,有11个属19个种;花花柴分离获得5个属8个种,蓼子朴分离获得5个属5个种,多枝柽柳只分离获得2个属4个种。苦豆子属于豆科植物,豆科植物与根瘤菌的固氮方式是典型的共生固氮,其固氮量占生物固氮总量的65%。4种植物中苦豆子中分离获得最多的固氮菌,符合生物固氮的发生规律。目前,有关苦豆子的研究主要在生物学和生理特性、化学成分、药用价值、饲料加工及其他资源化利用途径等方面,对其固氮菌资源的研究鲜有报道[7]。
3.2
豆科植物将大气中的氮以生物固氮的方式固定到生物体内。这些氮素最终以植物凋落物或分泌物的形式在土壤中流动;而非豆科植物只能通过根系对土壤氮素的吸收来满足其生长发育需要。郭林平等[14]通过研究不同生境(自然和小区)下豆科植物疏叶骆驼刺和非豆科植物花花柴的互作对氮素固定和根际微生物的影响,结果表明,在2种生境下疏叶骆驼刺与花花柴都有氮素转移特征,并且这种转移特征在自然生境下更为明显。前期对非豆科耐盐植物花花柴的研究主要集中在耐盐机制,化学成分及药物成分分析等方面,对该植物进行的固氮菌研究甚少。蓼子朴和花花柴同属菊科植物,目前主要用于研究其化学成分和药用价值[15],对其微生物资源研究方面目前尚未见报道。桑钰等[16]以多枝柽柳和疏叶骆驼刺为研究对象,分析了干旱胁迫处理下接种丛枝菌根真菌对其混合种植根系生长状况和氮素吸收分配的影响,结果表明丛枝菌根真菌对于干旱胁迫下与疏叶骆驼刺混生的多枝柽柳幼苗的生长和氮素吸收具有明显的补偿作用。
3.3
采用气相色谱-乙炔还原法检测微生物的固氮能力,经检测10个菌株有较强的固氮活性,固氮能力较强的菌株分布在类芽孢杆菌属(Paenibacillus)、微杆菌属(Microbacterium)、肠杆菌属(Enterobacter)、不动杆菌属(Acinetobacter)和根瘤菌属(Rhizobium)。其中Microbacterium sp.80801的系统发育进化树结果显示疑似新种,16S rRNA基因相似度为98.10%,固氮能力分析结果显示该菌株具有较强的固氮活性,提示该菌株在种质资源和功能机制方面具有较大的研究前景。据报道,目前已发现20多种具有固氮活性的类芽孢杆菌[17]。近几年报道的具有固氮活性的微杆菌也逐渐增加,并在基因组DNA中检测出了nifH基因[18]。固氮菌种类多样能有效促进营养贫瘠环境中氮元素的吸收转化。氮是植物生长、发育所必需的大量元素之一。幸翀等[19]以辣椒为研究对象,利用选择性培养基分离、筛选辣椒叶际固氮细菌,结果表明从辣椒叶际共分离得到2株具有高效固氮性能的自生固氮菌,分别为不动杆菌(Acinetobacter sp.)和根瘤菌(Rhizobium sp.)。马瑞萍等[20]从青稞田土壤中进行固氮菌的分离、纯化,观察其菌落形态特征并测定各菌株的固氮酶活性,结果显示共得到自生固氮菌50株,其中13株菌具有高效固氮酶活性,分别属于假食酸菌属(Pseudacidovorax)、芽孢杆菌属(Bacillus)、红球菌属(Rhodococcus)和农杆菌属(Agrobacterium)。刘爽等[21]分析了宁夏荒漠区5个柠条林地根际土壤nif H基因丰度和固氮菌群落结构组成,结果从宁夏5个不同荒漠区柠条群落根际土壤中分离出15个固氮菌属,包括根瘤菌属(Rhizobium)、中华根瘤菌属(Sinorhizobium)、假单胞菌属(Pseudomonas)和肠杆菌属(Enterobacterium)。其中假单胞菌属为优势菌属,占代表菌株的 23.08%,另外还分离出一些不常见的固氮类群如不动杆菌属(Acinetobacter)、勒克氏菌属(Leclercia)、金黄杆菌属(Chryseobacterium)、寡养单胞菌属(Stenotrophomonas)、微杆菌属(Microbacterium)、贪噬菌属(Variovorax)和短波单胞菌属(Brevundimonas)。研究共分离获得4株根瘤菌,经检测其中2株根瘤菌具有固氮活性,分别为80402和80417。其中80402的相似菌株Rhizobium tarimense PL-41在2013年由Turdahon M等[22]从新疆塔里木盆地胡杨森林土壤中分离得到,此菌株与试验菌株80402均来自于新疆干旱区。菌株80417的相似菌株Rhizobium arenae MIM27在2017年由Zhang等从毛乌素沙漠分离获得。分离获得的有固氮活性其它3个属也在前期研究的结论中有不同程度的出现。
4"结 论
分离获得18个属的36株菌。共有10株菌具有固氮活性,分布在不动杆菌属(Acinetobacter)、短杆菌属(Brevibacterium)、肠杆菌属(Enterobacter)、微杆菌属(Microbacterium)、帕尼巴菌属(Paenibacillus)、泛菌属(Pantoea)和根瘤菌属(Rhizobium)7个属。其中分离自花花柴样品的固氮菌4株,分离自苦豆子样品的固氮菌4株,分离自多枝柽柳样品的固氮菌2株。
参考文献"(References)
[1]"陈雨晴, 席海洋, 程文举, 等.荒漠河岸林区3种典型植物群落下土壤碳氮含量特征[J].中国沙漠, 2023, 43(1): 150-159.
CHEN Yuqing, XI Haiyang, CHENG Wenju, et al.Characteristics of soil carbon and nitrogen change in three typical plant communities in desert riparian forest area[J].Journal of Desert Research, 2023, 43(1): 150-159.
[2] 曲航飞, 许疆维, 王彦芹.花花柴蜡质合成相关基因KcFAD2的克隆及转基因烟草耐高温性鉴定[J].塔里木大学学报, 2022, 34(3): 1-7.
QU Hangfei, XU Jiangwei, WANG Yanqin.Cloning of KcFAD2 gene related to wax synthesis and identification of high temperature tolerance in transgenic tobacco[J].Journal of Tarim University, 2022, 34(3): 1-7.
[3] 唐钢梁, 李向义, 林丽莎, 等.表皮环割对花花柴(Karelinia caspica)水势及光合参数的短期影响[J].中国沙漠, 2014, 34(6): 1527-1536.
TANG Gangliang, LI Xiangyi, LIN Lisha, et al.Short-term effect of phloem girdling on water potential and photosynthetic characteristics in Karelinia caspica[J].Journal of Desert Research, 2014, 34(6): 1527-1536.
[4] 刘家书, 周永萍, 施翔, 等.多枝柽柳春夏两季开花物候特征与生殖特性[J].西北植物学报, 2017, 37(9): 1839-1846.
LIU Jiashu, ZHOU Yongping, SHI Xiang, et al.Bi-seasonal flowering phenology and reproductive features of Tamarix ramosissima[J].Acta Botanica Boreali-Occidentalia Sinica, 2017, 37(9): 1839-1846.
[5] 黄雅茹, 马迎宾, 李永华, 等.不同时间尺度土壤因子与柽柳液流速率关系的差异[J].新疆农业科学, 2022, 59(7): 1697-1707.
HUANG Yaru, MA Yingbin, LI Yonghua, et al.Relationships between soil factors and sap flow of Tamarix chinensis lour.at different time scales[J].Xinjiang Agricultural Sciences, 2022, 59(7): 1697-1707.
[6] 徐玲花.塔克拉玛干沙漠微生物固氮酶基因多样性及其活性的研究[D].武汉: 中国地质大学, 2014.
XU Linghua."Study on Nitrogenase Gene Diversity and Activity of Microorganism in the Taklamakan Desert[D].Wuhan: China University of Geosciences, 2014.
[7] 张雨, 苏丹丹, 王亚男, 等.旱生植物苦豆子研究综述[J].中国野生植物资源, 2021, 40(9): 55-58.
ZHANG Yu, SU Dandan, WANG Yanan, et al.The review of xerophyte plant Sophora alopecuroides[J].Chinese Wild Plant Resources, 2021, 40(9): 55-58.
[8] 杨瑞红, 赵成义, 王新军, 等.梭梭和柽柳土壤微生物多样性初步分析[J].土壤, 2016, 48(6): 1120-1130.
YANG Ruihong, ZHAO Chengyi, WANG Xinjun, et al.Phylogenetic diversity preliminary analysis of Haloxylon ammnodendron and Tamarix ramosissima soil bacteria[J].Soils, 2016, 48(6): 1120-1130.
[9] 章振亚.崇明东滩湿地互花米草与芦苇、海三棱藨草根际固氮微生物多样性研究[D].上海: 上海师范大学, 2012.
ZHANG Zhenya.Diversity Survey in Rhizasphere of Diazotroph in the Exotic Invasive Species Spartina Alterniflora and Two Native Species(Phragmites australis and Scirpus mariqueter) in the Wetlands at Chongming Dongtan in the Yangtze River Estuary[D].Shanghai: Shanghai Normal University, 2012.
[10] 唐凯, 高晓丹, 贾丽娟, 等.浑善达克沙地生物土壤结皮及其下层土壤中固氮细菌群落结构和多样性[J].微生物学通报, 2018, 45(2): 293-301.
TANG Kai, GAO Xiaodan, JIA Lijuan, et al.Community structure and diversity of diazotrophs in biological soil crusts and soil underneath crust of Hunshandake Deserts[J].Microbiology China, 2018, 45(2): 293-301.
[11] 刘璐, 何寻阳, 杜虎, 等.喀斯特土壤固氮微生物群落与植被、土壤的关系[J].生态学报, 2017, 37(12): 4037-4044.
LIU Lu, HE Xunyang, DU Hu, et al.The relationships among nitrogen-fixing microbial communities, plant communities, and soil properties in Karst regions[J].Acta Ecologica Sinica, 2017, 37(12): 4037-4044.
[12] 杨鸿儒, 袁博, 赵霞, 等.三种荒漠灌木根际可培养固氮细菌类群及其固氮和产铁载体能力[J].微生物学通报, 2016, 43(11): 2366-2373.
YANG Hongru, YUAN Bo, ZHAO Xia, et al.Cultivable diazotrophic community in the rhizosphere of three desert shrubs and their nitrogen-fixation and siderophore-producing capabilities[J].Microbiology China, 2016, 43(11): 2366-2373.
[13] 张颖, 杨清松, 张燕英, 等.造礁石珊瑚共附生固氮微生物的固氮活性[J].生态学杂志, 2018, 37(7): 2122-2129.
ZHANG Ying, YANG Qingsong, ZHANG Yanying, et al.Nitrogen-fixation activity of the hermatypic corals associated diazotrophs[J].Chinese Journal of Ecology, 2018, 37(7): 2122-2129.
[14] 郭平林, 刘波, 张志浩, 等.疏叶骆驼刺与花花柴互作对氮素固定和根际微生物的影响[J].生态学报, 2020, 40(18): 6632-6643.
GUO Pinglin, LIU Bo, ZHANG Zhihao, et al.Effects of interaction between Alhagi sparsifolia and Karelinia caspia on nitrogen fixation and rhizosphere microorganisms[J].Acta Ecologica Sinica, 2020, 40(18): 6632-6643.
[15] 饶德, 刘王锁.蓼子朴及其利用价值的研究进展[J].青海农林科技, 2021,(2): 58-60.
RAO De, LIU Wangsuo.Research progress on Inula salsoloides ostenf and its utilization value[J].Science and Technology of Qinghai Agriculture and Forestry, 2021,(2): 58-60.
[16] 桑钰, 高文礼, 再努尔·吐尔逊, 等.干旱胁迫下AMF对多枝柽柳幼苗和疏叶骆驼刺根系生长和氮素吸收分配的影响[J].干旱区研究, 2021, 38(1): 247-256.
SANG Yu, GAO Wenli, Zainuer Tuerxun, et al.Effects of drought stress and arbuscular-mycorrhizal fungi on root growth, nitrogen absorption, and distribution of two desert riparian plant seedlings[J].Arid Zone Research, 2021, 38(1): 247-256.
[17] Grady E N, MacDonald J, Liu L D, et al.Current knowledge and perspectives of Paenibacillus: a review[J].Microbial Cell Factories, 2016, 15(1): 203.
[18] Gtari M, Ghodhbane-Gtari F, Nouioui I, et al.Phylogenetic perspectives of nitrogen-fixing Actinobacteria[J].Archives of Microbiology, 2012, 194(1): 3-11.
[19] 幸翀, 王淑珍, 王龙, 等.辣椒叶际固氮菌分离筛选及抑菌活性[J].黑龙江农业科学, 2023,(5): 62-66.
XING Chong, WANG Shuzhen, WANG Long, et al.Isolation and screening of nitrogen-fixing bacteria from leaves of pepper and antifungal activity[J].Heilongjiang Agricultural Sciences, 2023,(5): 62-66.
[20] 马瑞萍, 戴相林, 刘国一, 等.拉萨长期不同施肥青稞田土壤固氮菌分离鉴定[J].麦类作物学报, 2023, 43(4): 505-512.
MA Ruiping, DAI Xianglin, LIU Guoyi, et al.Isolation and identification of soil nitrogen-fixing bacteria in highland barley land with different long-term fertilization in Lhasa[J].Journal of Triticeae Crops, 2023, 43(4): 505-512.
[21] 刘爽, 姚佳妮, 沈聪, 等.荒漠植物柠条根际土壤nifH基因荧光定量及固氮菌多样性分析[J].生物技术通报, 2022, 38(12): 252-262.
LIU Shuang, YAO Jiani, SHEN Cong, et al.Fluorescent quantitative PCR of nifH gene and diversity analysis of nitrogen-fixing bacteria in the rhizosphere soil of Caragana spp.of desert grassland[J].Biotechnology Bulletin, 2022, 38(12): 252-262.
[22] Turdahon M, Osman G, Hamdun M, et al.Rhizobium tarimense sp.nov., isolated from soil in the ancient Khiyik River[J].International Journal of Systematic and Evolutionary Microbiology, 2013, 63(Pt_7): 2424-2429.
Isolation and nitrogen-fixing activity detection ""of bacteria from four desert plants
WANG Lijun1, SUN Beibei1, WANG Chunyan2, XIA Zhanfeng2, MA Guocai1
(1. Analysis and Testing Center, Tarim University, Aral Xinjiang 843300,China; 2. College of Life Science and Technology, Tarim University, Aral Xinjiang 843300,China)
Abstract:【Objective】 ""In order to explore the ways for plants to obtain nitrogen nutrients in the Taklimakan Desert.
【Methods】 ""the typical legume plants Sophora alopecuroides, Tamarix ramosissima, Karelinia caspica and Inula salsoloides were used as research materials.Nitrogen-fixing bacteria were isolated from plant roots using YMA and Ashby nitrogen-free medium.It provides support for the development of nitrogen-fixing bacteria resources in the Taklimakan Desert and the protection of the ecological environment in arid areas.
【Results】 ""A total of 19 strains were isolated from Sophora alopecuroides samples, which were distributed in 11 genera.8 strains were isolated from Karelinia caspica samples and distributed in 5 genera.5 strains were isolated from Inula salsoloides samples and distributed in 5 genera.4 strains were isolated from Tamarix ramosissima samples and distributed in 2 genera.28 strains of bacteria were isolated from YMA medium, distributed in 15 genera; 8 strains of bacteria were isolated from Ashby nitrogen free medium and distributed in 7 genera.Rhizobium sp.80417 from Tamarix ramosissima, Enterobacter sp.81227 and Acinetobacter sp.81240 from Sophora alopecuroides, Paenibacillus sp.80802 and Microbacterium sp.80803 from karelinia caspica had strong nitrogen fixation ability.
【Conclusion】 ""The diversity of nitrogen-fixing bacteria has promoted the supplement of nitrogen in nutrient poor environment.
Key words:""Taklimakan Desert; Sophora alopecuroides; Tamarix ramosissima; Karelinia caspia; Inula salsoloides; nitrogen-fixing microorganism
Fund projects:""Financial and Technological Projects of the Xinjiang Production and Construction Corps \"Development and application of microbial agents from the Tarim Basin for the prevention and control of major agricultural and forest diseases in Xinjiang″(2021BC009); Sub-project of the Xinjiang Comprehensive Scientific Investigation Project \"Investigation and collection of microbial germplasm resources in special environments\"(2022xjkk150307); National College Students' Innovation and Entrepreneurship Training Program \"Development of biopesticides based on the fermentation products of high inhibitory active actinomycetes from the Tarim Basin\"(202210757018)
Correspondence author:"""MA Guocai (1978-), male, from Chaoyang, Liaoning, senior experimenter, research direction: micro-area analysis, (E-mail) 18845420@qq.com.
收稿日期(Received):
2024-05-27
基金项目:
新疆生产建设兵团财政科技计划项目“塔里木盆地来源微生物防治新疆主要农林病害菌剂的开发和应用”(2021BC009);新疆综合科学考察项目子课题“特殊环境微生物种质资源调查与收集”(2022xjkk150307);国家级大学生创新创业训练计划项目“基于塔里木盆地高抑菌活性放线菌发酵产物的生物农药创制”(202210757018)
作者简介:
王丽君(1981-),女,山东聊城人,高级实验师,研究方向为微生物资源,(E-mail)1489968232@qq.com
通讯作者:
马国财(1978-),男,辽宁朝阳人,高级实验师,研究方向为微区分析,(E-mail)18845420@qq.com
