甜菜小G蛋白BvRab基因家族的全基因组鉴定及生物信息学分析
2024-02-22李海英
付 荻,刘 赫,于 冰,李海英
(黑龙江大学生命科学学院/农业微生物技术教育部工程研究中心/黑龙江省寒区植物基因与生物发酵重点实验室/黑龙江省普通高校分子生物学重点实验室,哈尔滨 150080)
0 引言
G蛋白是普遍存在于真核生物中的一类GTP(Guanosine triphosphate)结合蛋白,按照G蛋白分子量和亚基组成分为异源三聚体G蛋白、小G蛋白和几种特殊的GTP结合蛋白[1-2]。小G蛋白是真核细胞中最大的信号蛋白家族之一,作为分子开关在与GTP结合的活性形式和与GDP(Guanosine 5′-diphosphate)结合的非活性形式之间循环,分子量通常在20~30 kD[3]。所有小G蛋白组成了Ras超家族,根据不同成员间结构和功能相似性,将Ras超家族划分为Ras、Rho、Ran、Rab和Arf/Sar 5个亚家族[4]。
小G蛋白Rab作为Ras超家族中最大的亚家族,在微生物、动物和植物中广泛存在[5]。植物小G蛋白Rab由200个左右的氨基酸组成,分子量多在22~25 kD,序列同源性在30%~55%,具有保守的结构特征,即由保守的G结构域和高度可变的N端和C端组成[6-7]。有研究发现,根据小G蛋白Rab中的保守基序内的保守氨基酸序列不同及分布位置不同,将植物中小G蛋白Rab可分为A~H共8个亚家族[8]。
小G蛋白Rab活性形式是Rab与GTP结合,主要定位在膜结构上,而Rab与GDP结合转化为非活性形式,从膜结构中分离出来,主要定位在细胞质中[9-10]。当细胞内激活信号存在时,膜结合的Rab蛋白被鸟苷酸交换因子(GEF, GMP exchange factor)激活,将Rab蛋白由结合GDP的无活性形式转变为结合GTP的活性形式,随后活化的Rab蛋白通过与下游蛋白相互作用,从而启动细胞相应的生理过程;完成信号传递之后,由于Rab蛋白只有微弱的内在GTP水解酶活性,因此需要GAP(GTPase-activating protein)激活其GTP水解酶活性,加速GTP水解,促使Rab蛋白快速失活,从而使信号传递得以迅速终止[11-17]。因此小G蛋白Rab作为细胞内的“分子开关”已经成为信号转导、细胞生长和分化的重要调节因子。在植物中,小G蛋白Rab作为囊泡运输的重要调控因子,广泛分布于植物的各个器官中[18],在参与植物激素信号调节、生长发育和生物、非生物胁迫应答等方面发挥重要作用[19]。
由于小G蛋白Rab在植物中发挥重要的作用,小G蛋白Rab基因家族的全基因组鉴定及其调控机制是近些年的研究热点。已经在拟南芥(ArabidopsisthalianaL.)[3]、水稻(OryzasativaL.)[20]、棉花(Gossypiumspp L.)[11]、番茄(SolanumlycopersicumL.)中完成了小G蛋白Rab基因家族的全基因组鉴定分析。甜菜(BetavulgarisL.)是我国重要的糖料作物,我国有30%的产糖原料是甜菜,多在我国北方干旱及半干旱地区广泛种植,具有较好的耐逆能力。甜菜还可以作为饲料原料和作为能源作物进行生物产氢。由甜菜开发出的甜菜红素、甜菜碱等产品可以应用于食品、药品和化妆品等领域[21]。目前,对甜菜小G蛋白BvRab基因家族成员的鉴定和分析研究工作还未见报道。研究甜菜小G蛋白BvRab基因家族对挖掘甜菜优质基因资源,培育甜菜耐逆优质种质资源具有重要意义。
本研究利用生物信息学方法对甜菜小G蛋白BvRab基因家族进行了全基因组范围鉴定,并对甜菜小G蛋白BvRab基因家族进行理化性质、基因结构、蛋白保守基序、系统进化、染色体定位及共线性、启动子顺式作用元件和蛋白质互作预测进行了分析,有助于深入认识甜菜小G蛋白BvRab基因的结构和功能,为进一步开展甜菜小G蛋白BvRab基因家族在生长发育和耐逆功能研究领域提供候选基因和实验基础。
1 材料与方法
1.1 甜菜小G蛋白BvRab基因家族的鉴定及理化性质分析
在NCBI数据库(https://ncbi.nlm.nih.gov/)获取甜菜蛋白质组数据库,从Pfam数据库(http:/ /pfam.xfam.org/)获取Ras超家族结构域(PF00071)的HMMER文件。使用HMMER3.0(http://hmmer.org)软件对甜菜中可能的Ras超家族蛋白进行筛选,并提交到SMART网站(https://smart.embl.de/),筛选含有小G蛋白Rab家族特有Rab结构域的蛋白质,从而获得甜菜小G蛋白BvRab基因家族成员。通过在线网站ExPASy (https://web.expasy.org/protparam/)对其分子量、等电点等理化性质进行分析。
1.2 BvRab基因家族的分析
1.2.1 基因结构分析
在NCBI数据库中获取甜菜小G蛋白BvRab基因家族成员对应的基因组序列和CDS序列,将其提交至GSDS(http://GSDS.gao-lab.org/)在线软件,绘制基因家族成员外显子和内含子的分布图。
1.2.2 蛋白保守基序分析
使用Clustal X2.1(http://www.Clustal.org),对已经鉴定获得的甜菜小G蛋白BvRab基因家族成员编码的氨基酸序列进行多序列比对,绘制基因家族成员蛋白保守基序。
1.2.3 系统进化分析
使用MEGA5软件对甜菜、拟南芥两个物种小G蛋白Rab基因家族成员进行系统进化树构建,使用neighbor-joining(NJ)方法且Bootstrap数值设为1 000,其他数值为默认参数。
1.2.4 染色体定位及共线性分析
使用MG2C(http://www.mg2c.iask.in/mg2c_v2.1/)在线分析工具对甜菜小G蛋白BvRab基因家族成员在染色体上的位置进行分析标注,使用TBtools对甜菜、拟南芥、水稻及番茄中的小G蛋白Rab基因家族进行多物种共线性分析[22]。
1.2.5 启动子顺式作用元件分析
将甜菜小G蛋白BvRab基因家族转录起始位点上游的2 000 bp序列输入Plant CARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/),进行启动子顺式作用元件预测及分析。
1.2.6 蛋白互作网络预测
在plantTFDB(http://planttfdb.gao-lab.org/)下载甜菜转录因子蛋白序列。将甜菜小G蛋白BvRab基因家族成员的氨基酸序列和甜菜转录因子蛋白序列上传至STRING数据库(https://string-db.org/cgi-/input?sessionId=balp0yQK5OTf&input_page_active_form=multiple_sequences),预测甜菜小G蛋白BvRab基因家族成员与甜菜转录因子之间的相互作用,构建蛋白互作网络。
2 结果与分析
2.1 甜菜小G蛋白BvRab基因家族成员的鉴定与理化性质
通过筛选分析,在甜菜基因组中共鉴定到58个甜菜小G蛋白BvRab基因家族成员(表1)。58个基因家族成员理化性质见表1,结果表明甜菜小G蛋白BvRab的氨基酸数量在167~255,其中BvRabD2a的氨基酸数量最短(167 aa),BvRabF2c的氨基酸数量最长(255 aa);该基因家族成员有42个基因编码的蛋白等电点大于7。

表1 甜菜小G蛋白BvRab基因家族成员及其编码蛋白质的理化性质Table 1 Small GTP-binding proteins BvRab family members and their physical and chemical properties
2.2 甜菜小G蛋白BvRab基因家族的基因结构和保守基序分析
根据甜菜小G蛋白BvRab基因家族外显子、内含子结构可视化分析(图1),显示甜菜BvRab基因的外显子和内含子的数量和位置在A-H 8种不同类型中呈现明显差异,但在同一类型中的不同基因的外显子和内含子的数量和位置较为一致。

图1 甜菜小G蛋白BvRab基因家族成员基因结构Fig.1 Gene structures of small GTP-binding proteins BvRab family members
根据家族基因的蛋白保守基序分析(图2),结果显示甜菜小G蛋白BvRab基因家族共有5个蛋白保守基序,除了个别基因外,5个蛋白保守基序在甜菜小G蛋白BvRab基因家族成员中分布顺序一致,说明甜菜小G蛋白BvRab基因家族在进化上是保守的,家族成员在功能上可能具有相似性。
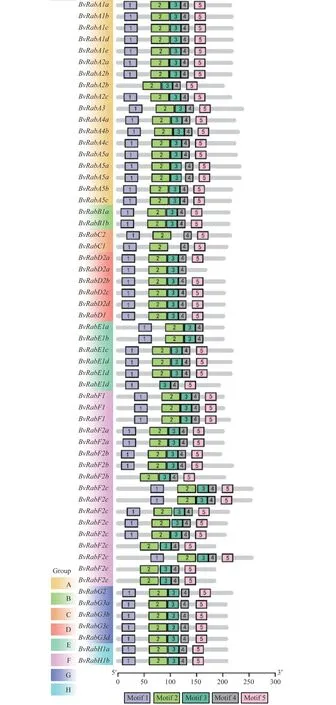
图2 甜菜小G蛋白BvRab基因家族蛋白质保守基序Fig.2 Conserved motifs of small GTP-binding proteins BvRab family members
2.3 甜菜小G蛋白BvRab基因家族蛋白的系统进化分析
将甜菜和拟南芥中小G蛋白Rab共同构建系统进化树(图3)。结果显示甜菜小G蛋白BvRab基因家族蛋白与拟南芥小G蛋白AtRab基因家族蛋白一样,均共有A-H 8个亚家族[23],甜菜小G蛋白BvRab基因家族蛋白亚家族A有18个成员,亚家族F有17个成员,亚家族D与亚家族E分别有6个成员,亚家族G有5个成员,亚家族B、C和H均只有2个成员,其成员分布情况与拟南芥小G蛋白AtRab基因家族成员分布比例情况基本一致。
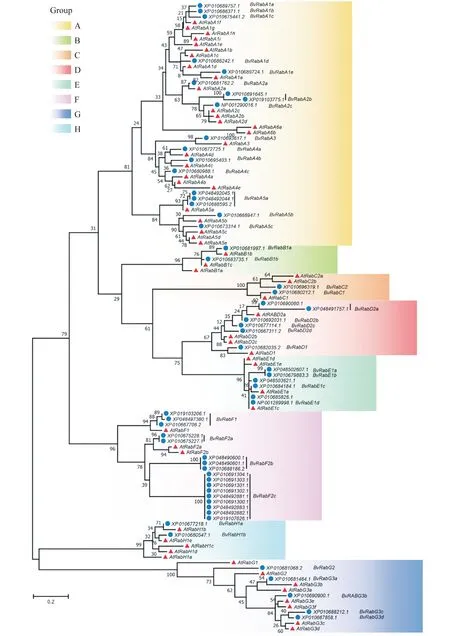
图3 甜菜和拟南芥小G蛋白Rab基因家族蛋白系统进化树分析Fig.3 Phylogenetic tree analysis of small GTP-binding proteins Rab family members in sugar beet and Arabidopsis thaliana
2.4 甜菜小G蛋白BvRab基因家族染色体定位及共线性分析
根据染色体定位结果(图4),表明58个甜菜小G蛋白BvRab基因家族成员分布于甜菜的9条染色体上,在Chr6上分布最为密集,而在Chr5上只有BvRabD2c1个家族成员分布。根据共线性分析结果(图5),可以看到拟南芥和番茄中均有20个以上的基因与甜菜小G蛋白BvRab基因家族成员基因存在共线性关系,而只有9个基因与水稻基因存在共线性关系。可能原因是甜菜与番茄、拟南芥均为双子叶植物,具有相近的亲缘关系,而与单子叶植物水稻亲缘关系较远。
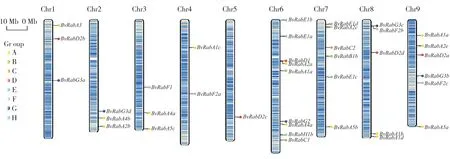
图4 甜菜小G蛋白BvRab基因家族染色体定位Fig.4 Chromosome localization of small GTP-binding proteins BvRab family members
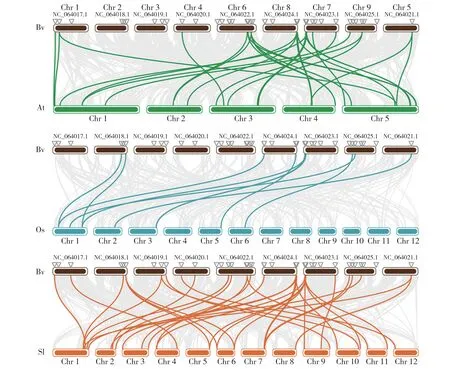
图5 甜菜与拟南芥(At)、水稻(Os)和番茄(Sl)小G蛋白 Rab基因家族的共线性分析Fig.5 Collinear analysis of small GTP-binding proteins Rab genes in sugar beet, Arabidopsis thaliana, rice and tomato
2.5 甜菜小G蛋白BvRab基因家族启动子顺式作用元件分析
启动子顺式元件分析的结果表明(图6),大部分甜菜小G蛋白BvRab基因家族成员启动子含有脱落酸应答元件(ABRE)、水杨酸应答元件(TCA-element)、生长素应答元件(TGA-element)、茉莉酸甲酯应答元件(CGTCAmotif和TGACG-motif),表明甜菜小G蛋白BvRab基因家族成员在甜菜激素信号调节中发挥重要作用。

图6 甜菜小G蛋白BvRab基因家族启动子顺式作用元件分析Fig.6 Promoter cis-acting elements analysis of small GTP-binding proteins BvRab family members
此外,少数甜菜小G蛋白BvRab基因家族成员启动子中还发现了低温应答元件(LTR)、干旱诱导元件(MBS)、厌氧诱导元件(ARE和GC-Motif)、防御和压力应答元件(TC-rich repeats),表明甜菜小G蛋白BvRab基因家族成员可能参与甜菜非生物胁迫应答调控。
2.6 甜菜小G蛋白BvRab基因家族蛋白与转录因子互作网络预测
根据甜菜小G蛋白BvRab基因家族蛋白与甜菜转录因子互作网络的结果(图7),说明不仅甜菜小G蛋白BvRab蛋白成员之间可能存在相互作用,而且甜菜小G蛋白BvRab与甜菜多个转录因子也可能存在互作关系。其中BvRabC1与转录因子BvGATA7可能存在相互作用,BvRabA4a、BvRabA4b均与转录因子BvMYB98可能存在相互作用,BvRabA3与转录因子BvHSFA-4c可能存在相互作用。
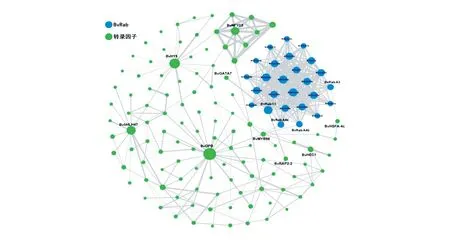
图7 甜菜小G蛋白BvRab基因家族蛋白互作网络Fig.7 Protein-protein interaction network of small GTP-binding proteins BvRab family members
3 讨论与结论
本文以甜菜小G蛋白BvRab基因家族为研究对象,对其进行了基因家族成员鉴定,并对家族成员进行了理化性质、基因结构、序列特征、系统进化、染色体定位及共线性、顺式作用元件和蛋白互作等预测。对BvRab基因家族的鉴定与分析一定程度上填补了甜菜中关于小G蛋白相关研究的空白。
从甜菜基因组中共鉴定出58个甜菜小G蛋白BvRab基因家族成员,分为A-H共8个亚家族,与已研究的其他植物中小G蛋白Rab基因家族分为8个亚家族结果相一致[24-25],说明植物中小G蛋白Rab基因家族成员的进化是相对保守的。基因结构呈现明显差异,但在同一亚家族中的不同基因具有较为一致的外显子和内含子基因结构,家族成员共有5个蛋白保守基序。家族成员不均匀的分布在甜菜的9条染色体上,其中在Chr6上的分布最为密集,而在Chr5上只有BvRabD2c一个小G蛋白Rab基因家族成员分布。在进一步的共线性进化分析中,发现甜菜小G蛋白BvRab基因家族成员与番茄、拟南芥小G蛋白AtRab基因家族亲缘关系较近,与水稻小G蛋白OsRab基因家族亲缘关系较远,这与甜菜和番茄、拟南芥同为双子叶植物有关[26]。甜菜小G蛋白BvRab基因家族成员含有多种激素应答元件,并且含有多种非生物胁迫应答元件,在杨树中也有类似发现[27],表明甜菜小G蛋白BvRab基因家族广泛参与生长发育及应答逆境的生物过程。通过对甜菜小G蛋白BvRab蛋白互作网络的预测分析可以看到甜菜小G蛋白BvRab蛋白与多种转录因子可能相互作用,其中预测到BvRabC1与转录因子BvGATA7可能相互作用,转录因子GATA参与调节植物生长发育、多种物质代谢、光响应及冷响应过程[28-30];BvRabA4a、BvRabA4b均预测到可能与转录因子BvMYB98相互作用,转录因子MYB98在被子植物胚囊细胞的营养运输中发挥作用[29];BvRabA3与转录因子BvHSFA-4c可能相互作用,转录因子HSFA-4c是植物中的热激转录因子,在植物响应热胁迫中起着至关重要的作用[31-33],说明甜菜小G蛋白BvRab基因家族蛋白在植物生长发育及逆境响应中都有可能发挥着重要作用。本研究通过对甜菜小G蛋白BvRab基因家族成员的鉴定及分析,为后续进行BvRab基因家族基因参与植物激素信号、调节生长发育及应答逆境功能方面研究提供了理论基础。
