莲子心总生物碱及总生物碱高氯酸盐对MG63细胞迁移和迁移体生成的影响
2024-02-22林立男曾建伟许仲坤黄美雅蔡良知黄云梅
林立男,熊 梅,曾建伟,周 芬,蔡 雯,许仲坤,黄美雅,蔡良知,黄云梅,3*
(1.福建中医药大学中西医结合研究院,福建 福州 350122;2.福建中医药大学药学院,福建 福州 350122;3.福建省中西医结合老年性疾病重点实验室,福建 福州 350122;4.福建中医药大学科技创新与转化中心,福建 福州 350122;5.福建中医药大学《福建中医药》杂志社,福建 福州 350122;6.福建省妇幼保健院,福建 福州 350001)
莲子心为睡莲科植物莲(Nelumbo nucifera Gaertn)成熟种子中的干燥幼叶及胚根。现代研究表明莲子心中提取的总生物碱(total alkaloids of Lianzixin,TAL)活性成分对多种肿瘤细胞增殖具有明显的抑制作用[1-3]。但TAL 溶解度小,稳定性差,将TAL 制成莲子心总生物碱高氯酸盐(total alkaloids of Lianzixin perchlorate,TALP)后可大大提高其溶解度和稳定性,但其药效是否发生变化需要实验探讨。骨肉瘤(osteosarcoma,OS)作为原发于骨组织中发病率最高的恶性肿瘤,其转移率高,治疗上存在有效治疗药物少、缺少特异性靶点等问题[4]。研究发现多种恶性肿瘤细胞在迁移过程中尾部会产生一种特殊的结构——迁移体[5],肿瘤细胞迁移体可通过影响巨噬细胞分化诱导肿瘤细胞免疫逃逸[6],抗肿瘤纳米药物可通过与迁移体结合抑制肿瘤细胞转移[7],提示迁移体可能成为肿瘤治疗的潜在靶点。但骨肉瘤细胞中是否存在迁移体,TAL 和TALP 是否抑制其迁移和迁移体产生未见报道。本研究拟应用TAL 和TALP 干预骨肉瘤MG63细胞,检测MG63 细胞增殖和迁移情况,了解其迁移过程中是否产生迁移体及药物对迁移体产生的影响,并探讨TAL 和TALP 治疗骨肉瘤的相关作用机制。
1 实验材料
1.1 实验细胞与药物 MG63 细胞购自中国科学院细胞库。莲子心药材购自福建文鑫莲业有限公司,经福建中医药大学药学院杨成梓教授鉴定为睡莲科植物莲(Nelumbo nucifera Gaertn)干燥幼叶及胚根。TAL 由1 kg 莲子心粉碎,过60 目筛,分别加70%乙醇3 L 回流提取2 次,每次1 h,合并提取液,减压浓缩,得浸膏85 g,上硅胶柱,收集氯仿-三乙胺(9∶1)的洗脱液,浓缩,干燥,得TAL 粉末。取TAL 适量,加70%~72%高氯酸溶液反应,经二氯甲烷萃取,浓缩,得TALP 粉末。
1.2 实验试剂 α-MEM 培养基(批号:G4554)、丙酮酸钠溶液(批号:G4212)、电镜固定液(批号:G1102)均购自武汉赛维尔生物技术有限公司;胎牛血清(批号:10270-106)和0.25%胰蛋白酶(批号:25200-056)均购自美国Gibco 公司;4%台盼蓝染色液(批号:BL627L)和细胞增殖-毒性检测试剂盒(批号:521942)均购自安徽白鲨生物科技有限公司;细胞三抗(上海汉恒生物科技有限公司,批号:HB-PPS-100);无菌PBS(武汉博士德生物工程有限公司,批号:PYG0021);无血清细胞冻存液(苏州新赛美生物科技有限公司,批号:C40100);纤连蛋白(北京索莱宝科技有限公司,批号:F8180);小麦胚芽凝集素(WGA,美国Life Techologies 公司,批号:W11262)。
1.3 实验仪器 自动细胞计数仪(中国睿钰生物科技有限公司,型号:Countstar tigel 53);倒置显微镜(德国Leica 公司,型号:DMI8);多功能酶标仪(美国Thermo Fisher Scientific 公司,型号:Multi-skan FC);高速冷冻离心机(上海卢湘仪离心机仪器有限公司,型号:GL-21M);激光扫描共聚焦显微镜(德国ZEISS 公司,型号:Zeiss710);透射电子显微镜(日本Hitachi 公司,型号:H7650)。
2 实验方法
2.1 细胞培养 MG63 细胞用α-MEM 完全培养基(α-MEM+10%新鲜胎牛血清+1%丙酮酸钠溶液+1%细胞三抗),在37 ℃、5%CO2培养箱中培养,3 d 传代1 次。
2.2 CCK8 法检测细胞增殖率 分别取1 mg TAL和TALP 粉末溶于10 μL DMSO,然后加入10 mL α-MEM 完全培养基,混匀,0.22 μm 过滤器过滤,得到100 μg/mL 含药培养基,再用α-MEM 完全培养基分别稀释成10、20、40、60、80 μg/mL TAL 和TALP培养液。取96 孔板4 个,按照4×103个/孔接种细胞,分为空白组、TAL 组和TALP 组,过夜细胞贴壁后,空白组加入不含药物的α-MEM 完全培养基,TAL 组和TALP 组以含10、20、40、60、80、100 μg/mL分别加入TAL 和TALP 培养液,每个浓度设置6 个复孔;24、48 h 后弃去旧培养基,每个孔加入90 μL新α-MEM 完全培养基和10 μL CCK8 溶液,于培养箱中孵育3 h,用酶标仪在450 nm 波长处测定吸光度(OD 值),计算不同浓度TAL 和TALP 培养液对细胞增殖率的影响。增殖率=(实验组OD 值/空白组OD 值)×100%。运用GraphPad prism 8 软件,以增殖率为纵坐标、剂量的对数为横坐标,绘制二者的量-效关系曲线,并求出增殖率为50%时所对应的剂量,即为细胞的半数抑制浓度(IC50)。
2.3 划痕实验 取12 孔板,每个孔接种2×105个细胞培养过夜,使其贴满每个孔底部。用200 μL的枪头垂直于孔板划线,然后弃去培养液,用PBS冲洗2 遍。空白组加入对照培养基(α-MEM 培养基+1%胎牛血清),TAL 组和TALP 组在对照培养基的基础上为避免药物对细胞活力的影响,根据CCK8实验结果,取24 h IC50的50%剂量约为50.0 μg/mL稀释成不同浓度的含药培养基来培养细胞,即TAL组和TALP 组以50.0、25.0、12.5、6.25 μg/mL 浓度分别加入TAL 和TALP 培养液,细胞培养0 、24 h 后分别拍照记录。用ImageJ 软件测量细胞间0 h 和24 h划痕面积并计算迁移率和迁移抑制率:迁移率=(0 h 划痕面积-24 h 划痕面积)/0 h 划痕面积×100%;迁移抑制率=(1-药物组迁移率/对照组迁移率)×100%。运用GraphPad prism 8 软件,以迁移抑制率为纵坐标,药物浓度的对数(logC)为横坐标,绘制二者的量-效关系曲线,求出迁移抑制率为50%时所对应的剂量,用于迁移体计数实验。
2.4 激光扫描共聚焦显微镜观察迁移体生成和生长情况
2.4.1 静态观察迁移体显微形态 在35 mm 玻底培养皿中加入5 μg/mL 纤连蛋白溶液1 mL,室温孵育1 h后吸弃;每皿种3×104个细胞,37 ℃,5% CO2培养箱培养15~20 h,用-20 ℃ 甲醇在室温固定10 min;再用PBS 轻轻荡洗3 次,每次3 min,用5.0 μg/mL WGA 染液室温孵育15 min 来标记细胞[8],用PBS 轻轻荡洗3 次,每次3 min。在激光扫描共聚焦显微镜下观察MG63 细胞迁移体的显微形态。
2.4.2 动态观察迁移体生长过程 按照“2.4.1”项下方法进行纤连蛋白铺皿并接种细胞后,加入含5.0 μg/mL WGA 的完全培养基,37 ℃,5%CO2培养箱培养15~20 h,在激光扫描共聚焦显微镜下实时观察细胞迁移体的生长过程,每隔20 min拍照1次。
2.5 迁移体的提取及其超微结构观察 取40 个150 mm 的细胞培养皿各加入5 μg/mL 纤连蛋白溶液10 mL,室温孵育1 h 后吸弃;每皿接种8×105个细胞,混匀,37 ℃,5%CO2培养箱培养15~20 h;将细胞消化后收集在50 mL 离心管中,以1 000 r/min、4 ℃离心10 min,收集上清液;以4 000 r/min、4 ℃离心20 min,收集上清液;以18 000 r/min、4 ℃离心30 min,去上清。收集到的迁移体通过电镜固定液固定、树脂包埋、超薄切片和铅-铀染色后,于透射电子显微镜下观察迁移体超微结构并拍照。
2.6 药物干预和迁移体计数 按照“2.4.1”项下方法进行纤连蛋白铺皿并接种细胞,分为空白组、TAL 组和TALP 组,空白组不加药物,TAL 组和TALP 组根据划痕实验结果,取细胞迁移抑制率约为50%时的药物浓度,即15 μg/mL TAL 培养液、20 μg/mL TALP 培养液进行干预15~20 h 后,按照“2.5”项下方法进行WGA 染色,激光扫描共聚焦显微镜下拍照,每组取12 个细胞计数,计算每个细胞迁移体的平均数量。
2.7 统计学方法 采用SPSS 24.0统计软件进行数据处理。计量资料属正态分布的以(±s)表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验,以P<0.05 为差异有统计学意义。
3 结 果
3.1 各组细胞增殖情况 与空白组比较,40、60、80、100 μg/mL TAL 干预24 h 后细胞增殖率明显下降(P<0.05),且TAL 浓度越大细胞增殖率下降越明显,见图1。20、40、60、80、100 μg/mL TAL 干预48 h 后细胞增殖率显著下降(P<0.05),且TAL 浓度越大细胞增殖率下降越明显,见图2。
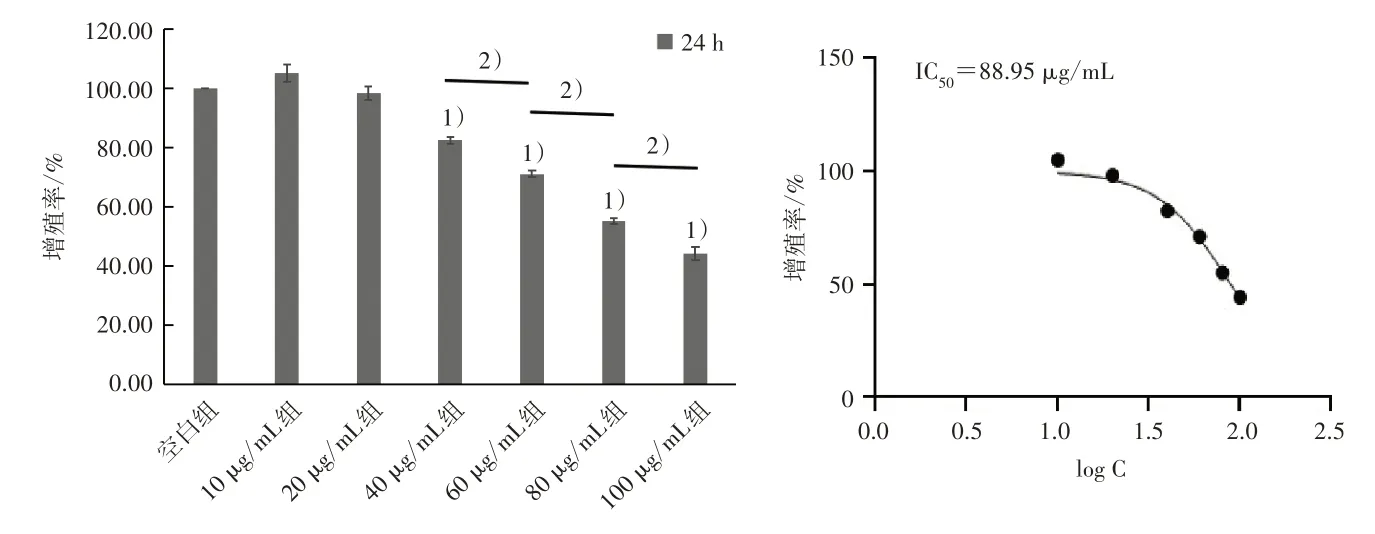
图1 TAL 干预24 h 对MG63 细胞增殖率的影响
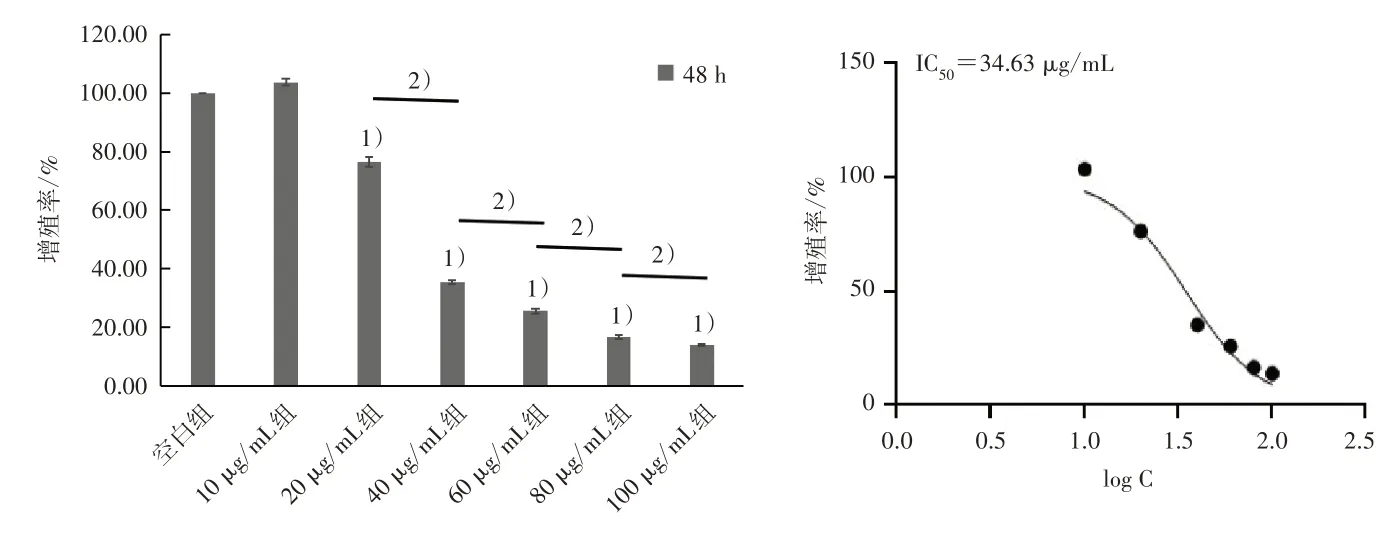
图2 TAL 干预48 h 对MG63 细胞增殖率的影响
与空白组比较,40、60、80、100 μg/mL TALP 干预24 h 和48 h 后细胞增殖率均显著下降,且TALP浓度越大细胞增殖率下降越明显,见图3 和图4。
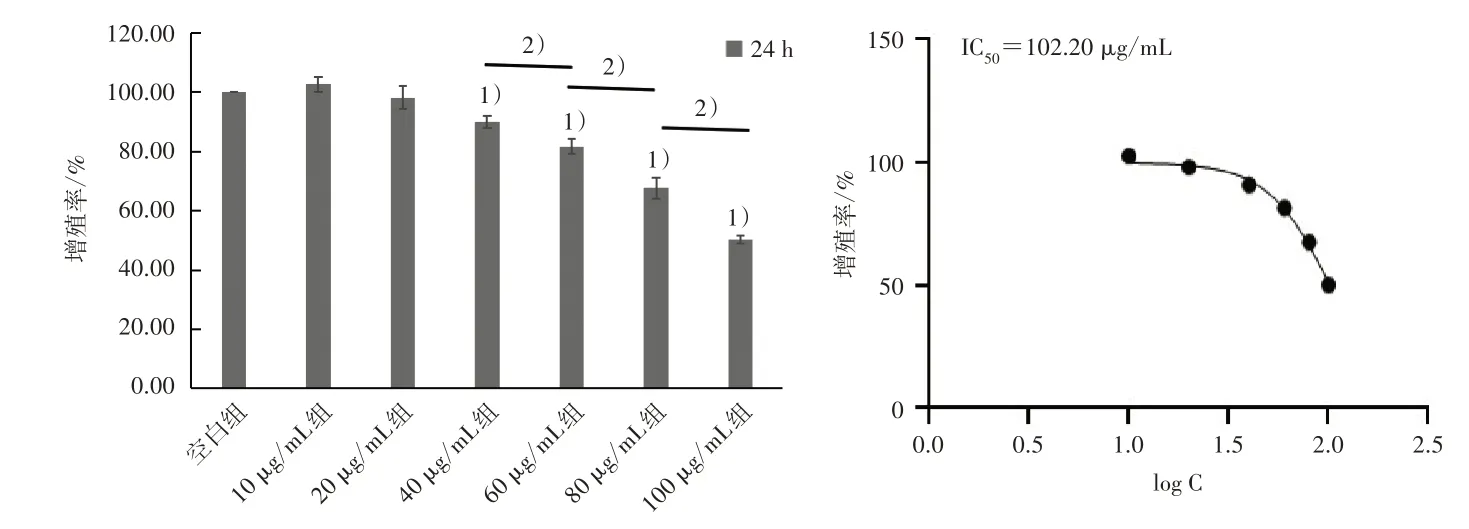
图3 TALP 干预24 h 对MG63 细胞增殖率的影响
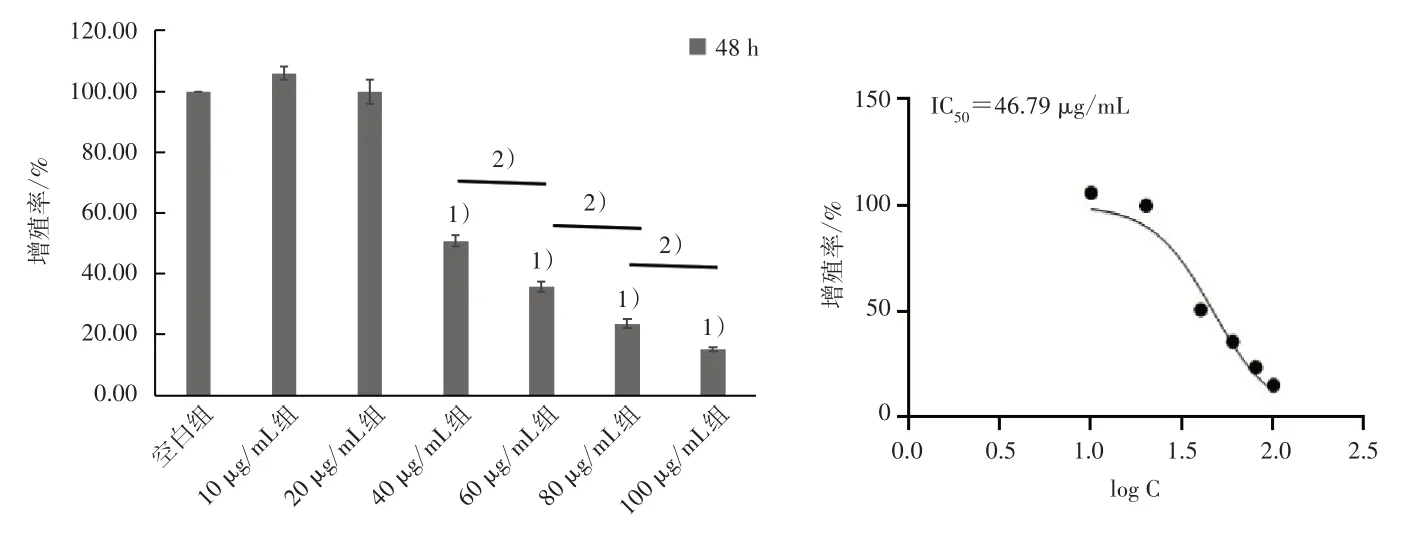
图4 TALP 干预48 h 对MG63 细胞增殖率的影响
3.2 各组细胞迁移情况 与空白组比较,TAL 和TALP 干预浓度>12.5 μg/mL 时可显著抑制细胞迁移,见图5和图6。细胞迁移抑制率为50%时TAL和TALP药物浓度分别为15.05 μg/mL和20.16 μg/mL,见图7。

图6 TAL 和TALP 干预后MG63 细胞迁移率变化
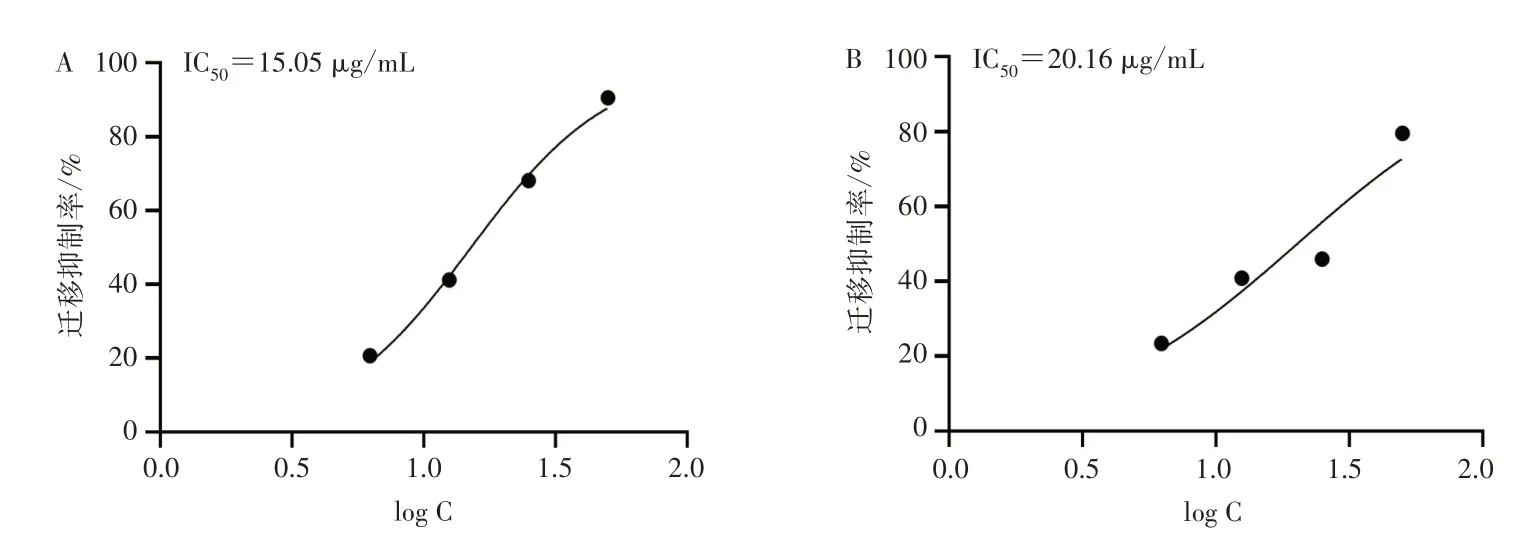
图7 药物浓度的对数与迁移抑制率量效曲线
3.3 迁移体显微形态 WGA 染色后激光共聚焦显微镜下观察可见细胞尾部有长长的细丝状结构,即为收缩丝;在收缩丝的尖端或交叉点上可见膨大的囊泡状结构,即为迁移体。见图8。

图8 MG63 细胞迁移体显微形态
3.4 迁移体生长的动态过程 通过连续观察拍摄MG63 细胞迁移,可见收缩丝末端或交叉处的囊泡从无到有、从小到大的生长过程。见图9。
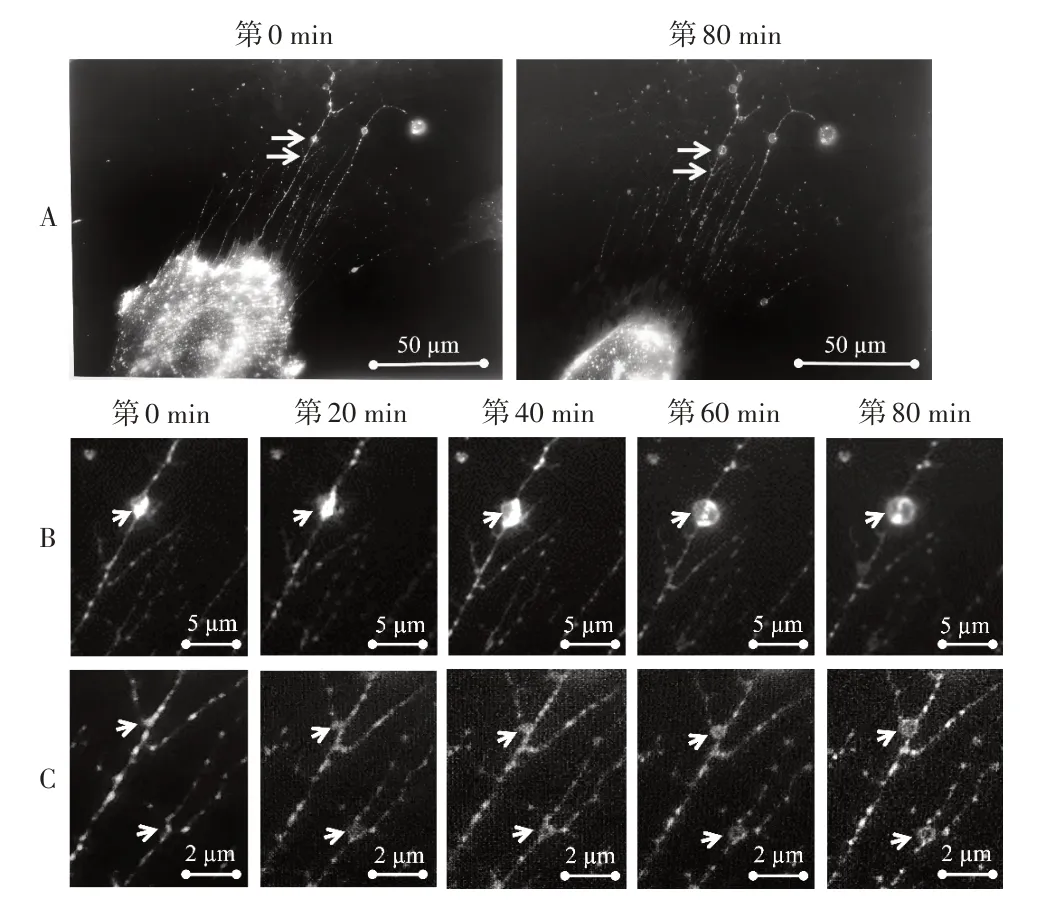
图9 激光扫描共聚焦显微镜观察迁移体生长的动态过程
3.5 迁移体超微结构 透射电镜下可见提取的迁移体为类圆形结构,直径在0.5~3.0 μm,表面为双层膜包绕,内部可见数量不等的小囊泡,整个迁移体酷似石榴状。见图10。
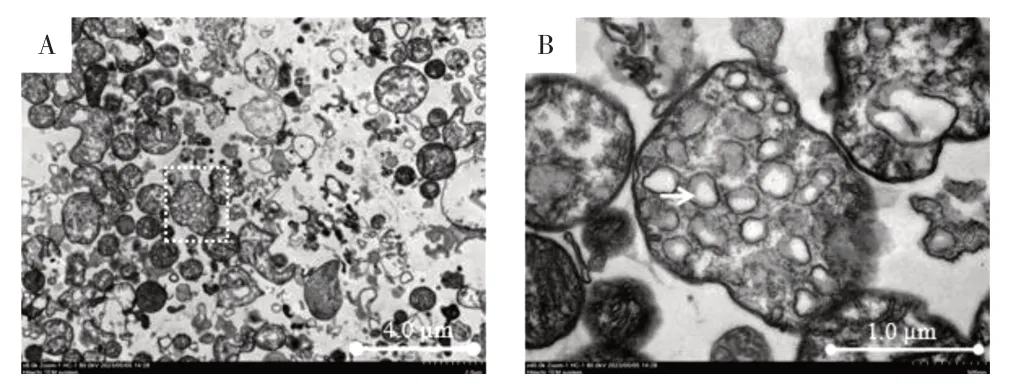
图10 透射电子显微镜下观察迁移体超微结构
3.6 迁移体数量变化 空白组细胞形态舒展,收缩丝多而长,尾部或分叉处可见较多迁移体。与空白组比较,TAL 组和TALP 组细胞都出现不同程度收缩,收缩丝比空白组短而细,迁移体较稀疏,见图11。结果显示:与空白组比较,TAL 15 μg/mL 组和TALP 20 μg/mL 组细胞平均迁移体数量显著减少(P<0.05)。见图12。
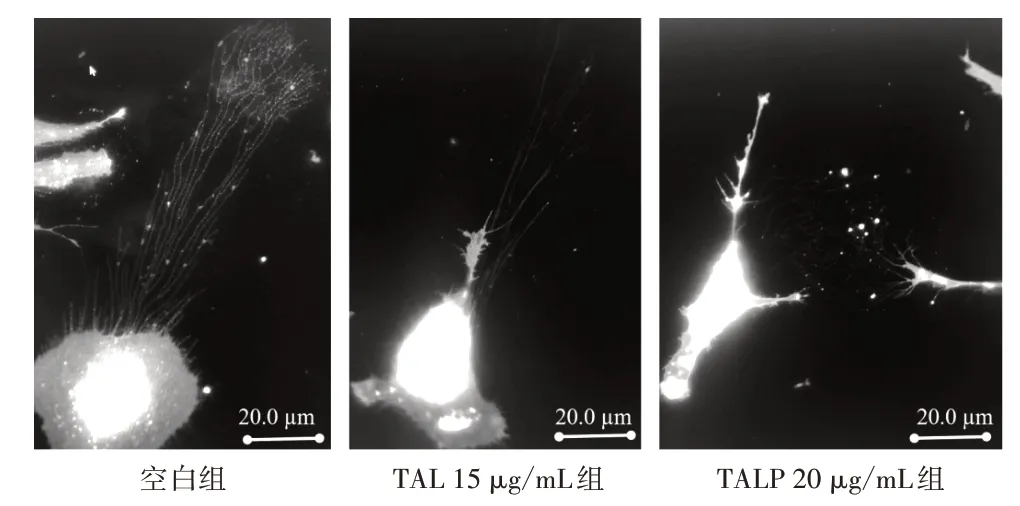
图11 TAL 和TALP 干预后细胞迁移体变化
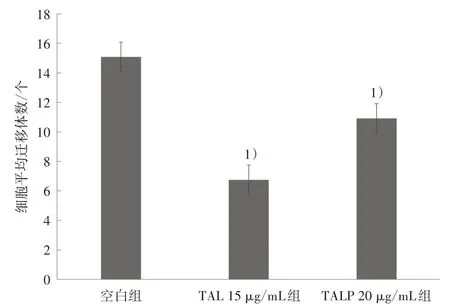
图12 TAL 和TALP 干预后细胞迁移体数量变化
4 讨 论
既往的研究表明莲心碱及其衍生物对多种肿瘤细胞有抑制作用。曾建伟等[3]研究发现TAL 对人肝癌细胞株HepG2、胃癌细胞SGC-7901、乳腺癌细胞株MCF-7和结肠癌细胞RKO有明显抑制作用。张锡宇[9]研究发现甲基莲心碱可通过激活p38 MAPK 信号通路,磷酸化p-p21Ser130 而延长p21 蛋白半衰期,导致p21 蛋白在细胞内累积进而引起细胞周期G1 期停滞,抑制成骨肉瘤细胞生长。本研究发现TAL 对人骨肉瘤细胞MG63 的增殖有显著抑制作用,TALP 对细胞的半数抑制浓度略高于TAL,但仍能显著抑制MG63 细胞增殖,抗肿瘤药效未发生本质变化。鉴于TALP 具有较高的稳定性,在实际应用中可能更有利于推广。
恶性肿瘤除了增殖快,其难以治愈的重要原因之一是肿瘤细胞极易发生转移,这与肿瘤细胞高度的迁移性能有关。为了进一步研究莲子心总生物碱是否有抗肿瘤转移的作用,我们应用划痕实验观察其对细胞迁移的影响,发现与空白组比较,TAL 和TALP 干预均可显著抑制MG63 细胞的迁移,提示TAL 和TALP 可能对骨肉瘤转移有抑制作用。
细胞迁移是细胞接收到迁移的信号或感受到某些物质的浓度梯度变化后产生的移动,由细胞前端伪足的延伸、前端伪足与细胞外基质形成新的黏附、胞体向前移动、后方黏附的释放和细胞胞体收缩组成的一系列循环过程[10]。2015 年俞立教授团队发现培养的细胞在迁移过程中,细胞的尾部会出现细长的收缩丝,且在尖端或分叉处可形成直径为0.5~3.0 μm 的囊泡,透射电子显微镜下可见这些囊泡的内部还包含数量不等的小囊泡,整个结构类似于石榴,故将其命名为“石榴样结构”。鉴于石榴样结构的形成取决于细胞迁移过程,故正式命名为“迁移体”[5]。在后续的研究中,该团队发现迁移体还广泛存在于多种体细胞和肿瘤细胞中。本研究中我们发现MG63 细胞迁移过程中细胞尾部亦产生收缩丝和膨大的囊泡结构,并观察到该囊泡在收缩丝上从无到有、从小到大的生长过程。为了进一步确认该结构的性质,我们通过梯度离心提取囊泡,在透射电子显微镜下观察到迁移体的石榴样结构,表明人骨肉瘤细胞MG63 确实在迁移过程中产生迁移体。
迁移体在细胞迁移过程中产生,并在细胞离开后可留在原处一段时间,从而保留了细胞迁移过程的时间和空间信息。同时迁移体内部包含丰富的蛋白和基因等内容物,这些内容物最终将在迁移体裂解后释放到细胞外,或随着迁移体直接被周围的细胞摄取,从而传递相应的信息。迁移体包含的时空信息以及蛋白和基因等都可能影响后续相关细胞的迁移或其他功能活动[11-12]。本研究发现TAL和TALP 干预MG63 细胞后,迁移体产生的数量显著减少,提示TAL 和TALP 可能通过抑制细胞迁移体的生成,影响后续肿瘤细胞的功能活动,从而改善骨肉瘤的预后。本研究仅对药物干预后MG63细胞迁移与迁移体形成的变化进行了初步探讨,迁移体生成的变化如何影响肿瘤生长和转移的具体机制有待进一步深入研究。
综上所述,TAL 和TALP 对骨肉瘤MG63 细胞的增殖和迁移有抑制作用;在MG63 细胞迁移时可产生迁移体,而TAL 和TALP 的干预则能够显著减少迁移体数量:因此TAL 和TALP 抑制MG63 骨肉瘤细胞的机制可能与其影响迁移体的产生有关。
