水热炭与共基质对苯酚厌氧降解的影响
2024-02-22邵钱祺张士成
邵钱祺,罗 涛,4,张士成,罗 刚,*
(1. 复旦大学 环境科学与工程系, 上海 200438; 2. 上海市有机废弃物污染控制与资源化专业技术 服务平台, 上海 200438; 3. 上海市污染控制与生态安全研究院, 上海 200092; 4. 上海建科环境技术有限公司, 上海 200032)
0 引 言
苯酚是一种有毒、致癌的芳香族化合物,广泛存在于煤气化、制药和农药、炼油等工业废水中[1],也可由腐殖酸和单宁化合物等自然芳香物质降解产生[2]。据统计,每年有超过1 000万t酚类废水排放到环境中[3],这些含有高浓度酚类物质的废水如未经适当处理直接排放,将会对生态环境和人体健康造成极大危害。
厌氧消化(Anaerobic Digestion, AD)是一种可持续、环保且经济的生物过程,目前已广泛应用于有机废水处理[4]。苯酚的厌氧降解是复杂而缓慢的过程,其稳定性取决于微生物群落、化合物的生物降解特性和化学特性[5]。一方面,苯酚向苯甲酸盐转化的过程是苯酚厌氧降解的限速步骤[6];另一方面,由于苯酚及其中间产物(如苯甲酸盐)的毒性较高[7],不利于产甲烷菌的富集,使得苯酚的乙酸发酵型产甲烷过程较为脆弱。因此,寻找合适的方法提高苯酚厌氧降解效果和产甲烷效率是关键。
在强化酚类化合物厌氧消化的研究中,生物刺激法是刺激原始微生物群落生长或生物活动以促进生物降解过程,主要包括添加营养素和其他化合物、优化工艺参数等方式[8]。投加共基质之后的厌氧消化过程也被称为共代谢,是难处理物质或有毒物质常见的厌氧强化技术,然而其对苯酚厌氧降解的影响尚不清楚。此外,先前的研究中已发现水热炭在苯酚厌氧降解中使最大产甲烷速率(Rm)提高了79.1%[9]。如果能够同时利用水热炭与共代谢,进一步强化苯酚的厌氧降解,对实现苯酚的高效处理与甲烷回收具有重要意义。
本研究将水热炭与共代谢结合,探究二者耦合能否进一步促进苯酚的厌氧消化。实验采用葡萄糖作为共基质,260 ℃水热炭作为投加的炭材料[9],将二者同时添加至苯酚厌氧消化过程中,探究其对苯酚厌氧消化影响。此外,还评估了不同葡萄糖浓度对苯酚厌氧消化的影响,并确定最佳的添加浓度。进一步通过16S rDNA高通量测序探究其中的微生物种类和丰度变化,为苯酚降解提供新思路。
1 材料与方法
1.1 试验材料
本研究所用接种污泥取自处理酒精废水的UASB反应器中的颗粒污泥,其总固体含量(Total Solids,TS)为(37.2±1.5) g/L,挥发性固体含量(Volatile Solids,VS)为(30.1±1.1) g/L,pH为7.2±0.1。苯酚(分析纯)和共基质葡萄糖(分析纯)分别购自阿拉丁试剂(上海)有限公司和国药集团化学试剂有限公司。
水热炭的制备以玉米秸秆为原料,玉米秸秆与去离子水按质量比1∶19加入1 L加压搅拌釜式反应器中,在260 ℃下以200 r/min搅拌速率持续运行0.5 h。水热反应结束后,用冷却水将反应器冷却至室温,使用真空抽滤装置分离水热炭与液相产物。随后使用四氢呋喃多次冲洗水热炭以除去其表面的生物油,并用去离子水洗去四氢呋喃。最后将水热炭置于105 ℃烘箱烘干24 h后进行研磨,并用孔径为3.0 mm的不锈钢网筛筛分。
1.2 试验装置及运行策略
为探究水热炭与葡萄糖共基质同时添加对苯酚厌氧降解的影响,并确定最适的共基质添加浓度,设置了10组批式厌氧试验,分为不加水热炭(A)与添加水热炭(B)两批,每批按相同的葡萄糖浓度梯度分为5组,葡萄糖浓度梯度设置为0、0.5、1.0、2.0、4.0 g/L。实验设计见表1。
所有试验均在118 mL血清瓶中进行,向每个反应器中加入所需量的苯酚、葡萄糖、水、水热炭和接种污泥,最终工作体积为60 mL,各条件设置3个重复实验。
1.3 分析方法
TS、VS和pH等均采用标准方法测定[10]。采用配有热导检测器的气相色谱(GC)(GC-960,中国海信),以N2作为载气,测量血清瓶中的甲烷含量[11]。挥发性脂肪酸(Volatile Fatty Acids,VFAs)和苯酚的浓度通过配备火焰离子化检测器的GC(GC-2010Plus,岛津)测量[12],色谱柱为Agilent HP-FFAP。

表1 实验设计
共代谢厌氧试验末期的微生物样品用于16S rDNA高通量测序分析。根据 E.Z.N.A. soil DNA kit (Omega Bio-tek,Norcross,GA,U.S.)说明书进行微生物群落总DNA抽提,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop2000测定DNA浓度和纯度。使用通用引物515F(5′- GTGCCAGCMGCCGCGG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对16S rRNA 基因 V4~V5区进行PCR扩增。将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrepDNAGel Extraction Kit (Axygen Biosciences,Union City,CA,USA)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用Quantus Fluorometer (Promega, USA)对回收产物进行检测、定量。使用NEXTFLEX Rapid DNA-Seq Kit进行建库。利用Illumina公司的MiseqPE300平台进行测序。Illumina测序得到的PE reads进行样本拆分后,首先根据测序质量对双端Reads进行质控和过滤,同时根据双端Reads之间的overlap关系进行拼接,获得质控拼接之后的优化数据。然后使用序列降噪方法(DADA2/Deblur等)处理优化数据,获得ASV(Amplicon Sequence Variant)代表序列和丰度信息并进一步分析。
1.4 修正的Gompertz模型
使用修正的Gompertz模型(Gompertz1,式(1))定量分析不同反应器的产甲烷过程。
(1)
式中:M(t)——时间t时的累积甲烷产量,mL;
P——最大产甲烷潜力,mL CH4;
Rm——最大产甲烷速率,mL/d;
λ——延滞期时间,d。
使用Origin 2021全局曲线拟合估计了3个参数P、Rm和λ;e值以2.718 28计,使数据和模型曲线之间的误差平方和最小。
由于共代谢实验中添加了葡萄糖作为共基质,葡萄糖基质产生的甲烷会干扰Gompertz1模型对苯酚产甲烷动力学参数的定量分析,使得葡萄糖浓度较高时,Gompertz1模型的难以拟合出苯酚产甲烷过程的参数。故在Gompertz1模型基础上提出了Gompertz2模型(式(2))。该模型有助于分离葡萄糖产甲烷过程和苯酚产甲烷过程,专用于分析共代谢实验中葡萄糖浓度较高的实验组。当葡萄糖浓度较低时,Gompertz2模型拟合效果不佳,故仍使用Gompertz1模型。
(2)
式中,M(t)——时间t时的累积甲烷产量,mL;
P1,P2——一阶段(葡萄糖)和二阶段(苯酚)的最大产甲烷潜力,mL CH4;
Rm1,Rm2——一阶段(葡萄糖)和二阶段(苯酚)的最大产甲烷速率,mL/d;
λ1,λ2——一阶段(葡萄糖)和二阶段(苯酚)的甲烷化延滞期,d。
使用Origin2021全局曲线拟合估计了所有参数,实验数据和模型曲线之间的误差平方和最小;e值以2.718 28计。
2 结果与讨论
2.1 对甲烷生成的影响
添加葡萄糖共基质对苯酚厌氧消化存在促进作用,如图1所示,相比未添加葡萄糖的对照组,A组和B组各反应器中最高累积甲烷产量分别增加了42.52%~208.89%和16.15%~157.93%。尽管最高累积甲烷产量随葡萄糖浓度增加,但A组与B组分别在葡萄糖浓度为1.0 g/L(A2、B2)和2.0 g/L(A3、B3)时达到最短苯酚甲烷化延滞期和最高产甲烷速率。该现象的产生可能是在高葡萄糖浓度下初始传质阻力较大和微生物耐受性较差所致[13]。此外,共代谢动力学模型研究[14]认为,共基质和目标污染物对关键酶的活性位点具有竞争效应,从而产生抑制作用。表2为苯酚降解过程中产甲烷动力学参数。
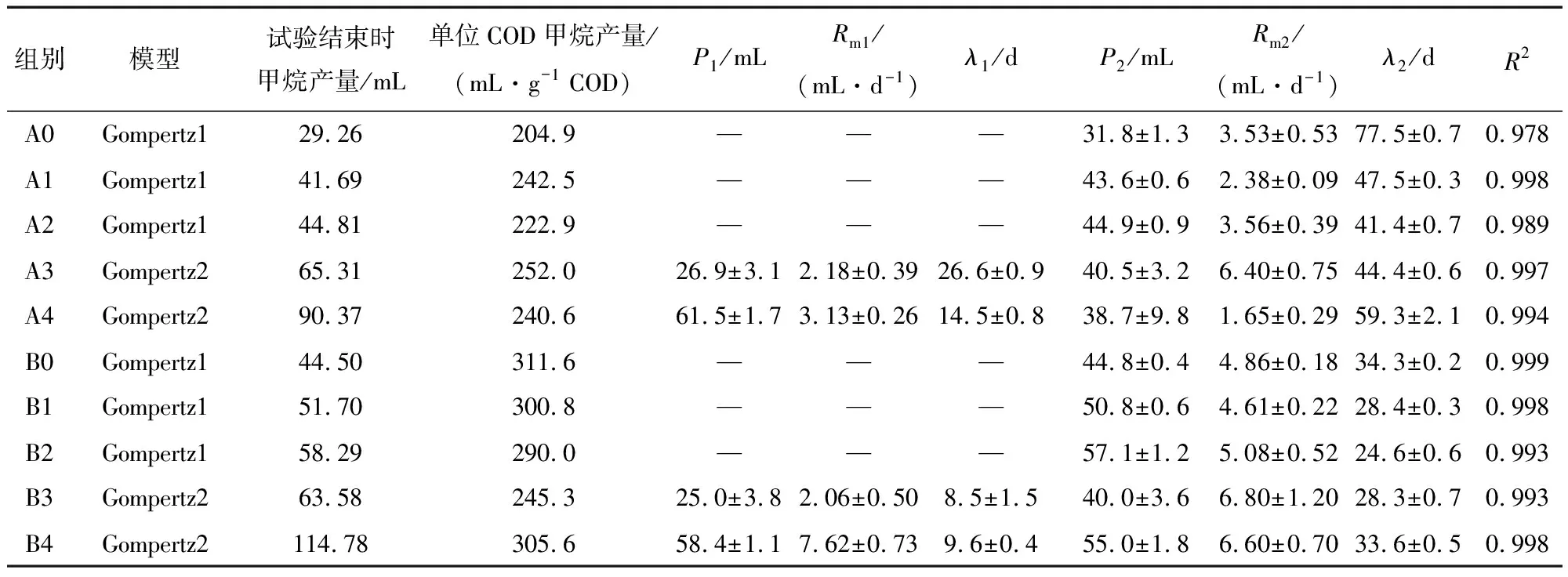
表2 甲烷生产动力学参数

图1 未添加水热炭和添加水热炭反应器中 累计甲烷产量变化Fig. 1 Cumulative methane production changes in reactors without hydrochar added and with hydrochar added
进一步分析表明,不同浓度葡萄糖均对苯酚甲烷化延滞期的存在缩短效果。A0组的延滞期长达77.5 d,但A1~A4组延滞期缩短到了41.4~59.3 d。同时,水热炭对苯酚厌氧消化产生了促进作用。在相同的葡萄糖添加量下,与A组相比,B组延滞期缩短了36.3%~55.7%。此外,在水热炭存在的情况下,较A组相比,B组中各反应器Rm分别增长了6.3%~300.0%。因此,共基质与水热炭同时添加能够进一步强化苯酚厌氧消化过程。
2.2 对苯酚降解的影响
如图2所示,添加水热炭能够显著促进苯酚的降解。水热炭的添加使苯酚被完全降解所需时间从54~90 d减少至30~42 d。该结果与先前的研究结果一致[9],可能是水热炭良好的吸附作用所致。此外,在A组观察到,当葡萄糖浓度为0~2.0 g/L时,苯酚降解速率随浓度提高而加快。然而,当葡萄糖浓度为4.0 g/L时,A4中的降解速率较A0未明显增加。同时,在B组中添加2.0 g/L葡萄糖的反应器也同样表现出了最佳的苯酚降解速率。值得注意的是,在B组中添加4.0 g/L葡萄糖的B4反应器受到高浓度共基质抑制情况并不明显,这说明水热炭能够一定程度上缓解高浓度葡萄糖的竞争抑制,从而提高苯酚厌氧降解效率。
2.3 对挥发性脂肪酸积累的影响
图3是各反应器中的VFAs变化趋势。VFAs的积累可以根据降解基质分为两个阶段,第一阶段是由葡萄糖降解主导的VFAs积累,并在18 ~24 d时进入由苯酚降解主导的VFAs积累阶段。在6 d时可以观察到,A组和B组中丁酸均为主要的VFAs组分,且其累积量随葡萄糖浓度的增加而提升。丁酸作为葡萄糖酸化的主要代谢产物[15],其大量积累可以说明底物中葡萄糖在反应初期即被大量消耗。在24 d后,A组和B组中均无丁酸,乙酸成为主要VFAs组分。先前研究表明,乙酸是苯酚厌氧降解的最终产物[16],因此可以推测苯酚在该阶段被显著降解。此外,对比不同葡萄糖浓度的反应器,添加量为0、4.0 g/L葡萄糖的反应器在苯酚降解阶段的乙酸积累量更多,且最高积累量出现的时间更晚,可能是因为这些反应器中的乙酸消耗活性较低。这一结果再次表明了高浓度共基质对苯酚厌氧消化的促进作用较低。

图3 未添加水热炭和添加水热炭反应器中VFAs浓度变化Fig. 3 VFAs concentration changes in reactors without hydrochar added and with hydrochar added
2.4 微生物多样性分析
通过α多样性能够量化分析各反应器中微生物群落的丰富度和多样性。其中,Sobs指数和Shannon指数通常分别用于反映物种丰富度和群落水平的多样性。如图4所示,总体而言,水热炭的添加使B组中各反应器中Sobs指数低于A组中相同葡萄添加量下的反应器,表明水热炭添加对微生物多样性表现出一定的负面作用,这可能是因为水热炭添加特异性富集了部分菌群。

图4 各反应器的微生物的多样性指数(R2>0.99)Fig. 4 Diversity index of microorganisms in each reactor (R2>0.99)
为了研究样本群落组成的相似性或差异性,对样本数据在ASV水平上进行了Principal Co-ordinates Analysis(PCoA),结果如图5所示。未添加水热炭的A组与加炭的B组在主坐标系上差异较大,表明水热炭对群落组成影响更为强烈。相比之下,不同共基质浓度对群落组成影响相对较小,但高浓度共基质添加的反应器(A4、B4)仍与其它组在群落组成上存在较大差异。此外,添加水热炭的B0、B1、B2、B3反应器显示出了非常小的群落组成差异,水热炭可能减轻了不同共基质浓度对群落组成的影响。
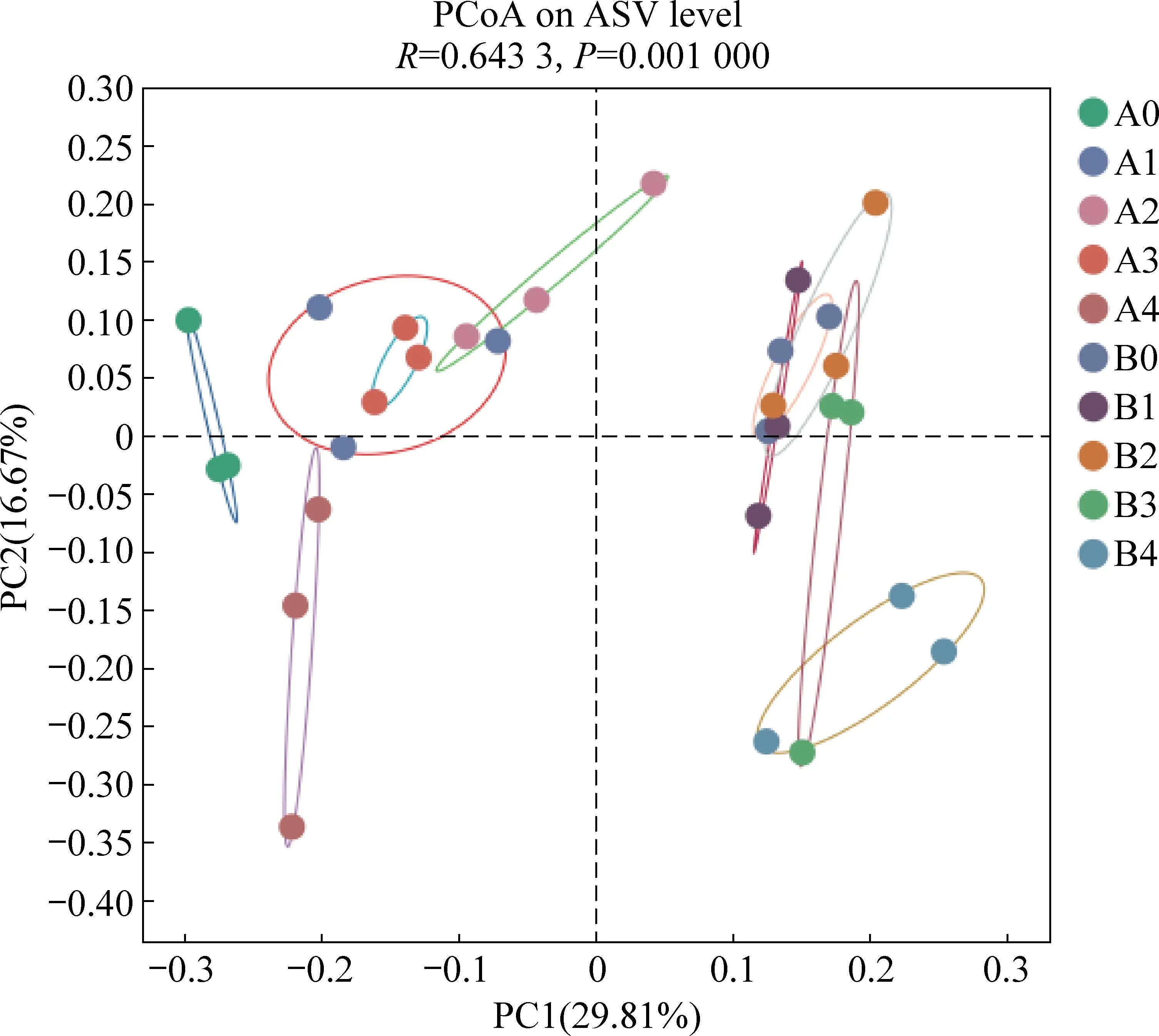
图5 各微生物群落在ASV水平的PCoA分析Fig. 5 PCoA analysis of various microbial communities on ASV level
2.5 古菌群落分析
古菌在甲烷生成的过程中至关重要,各反应器中古菌在属水平的群落组成如图6所示。其中Methanobacterium、Methanosaeta(又名Methanothrix)是最重要的两个属,两者相对丰度之和在A组达到了所有古菌的83.79%~90.02%;B组中水热炭的添加使其进一步提高至91.53%~94.92%。两种菌在B组中的显著富集可能是其微生物多样性较A组下降的原因。进一步分析发现,在A组中Methanosaeta的相对丰度先增加后减少,与苯酚厌氧消化活性趋势一致。然而,Methanobacterium的相对丰度则随共基质浓度的增加先减少后增加。Methanosaeta是一种典型的耗乙酸产甲烷菌[17],在苯酚降解过程中发挥着重要作用,是苯甲酸厌氧代谢产物的主要消耗者。Methanobacterium主要利用葡萄糖和苯酚厌氧降解过程中的副产物H2进行耗氢产甲烷[18],其相对丰度从A0的57.47%上升至A4中的67.21%;这可能是A4反应器中累积甲烷是A组中最高的反应器原因之一。相反,在B组中Methanosaeta和Methanobacterium的相对丰度随葡萄糖浓度上升分别出现先减少后增加和先增加后减少的趋势。从图3可知,A组较B组在前期水解、酸化阶段表现出的较高的乙酸累积量,可能是Methanosaeta对A组产甲烷过程影响更为明显的原因之一。A组、B组中不同共基质添加量下优势菌门丰度变化趋势的差异也反映出水热炭对苯酚厌氧降解过程微生物群落结构的显著影响。Methanobacterium能够参与直接种间电子传递(DIET)的过程[19],已有许多研究表明[20-21],碳材料的添加能够有效富集Methanobacterium从而加速VFAs的消耗,提升产甲烷效率,这也是同时添加共基质与水热炭能够进一步强化苯酚厌氧降解的另一重要因素。
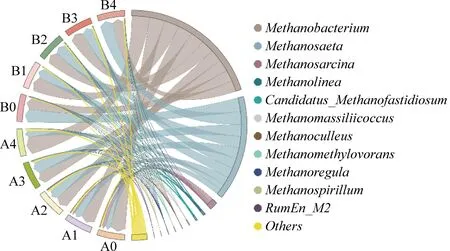
图6 古菌在属水平的群落组成Fig. 6 Community composition of archaea at genus level
2.6 细菌群落分析
图7为细菌在门水平的群落组成。细菌群落以Firmicutes、Chloroflexi、Bacteroidota和Desulfobacterota为主。
在A组中,Chloroflexi相对丰度随共基质浓度的变化趋势与苯酚厌氧消化活性相同,并在葡萄糖添加量为1.0 g/L时达到最高值14.32%,是未添加葡萄糖反应器中的2.1倍。Chloroflexi是厌氧消化过程中葡萄糖的主要消耗者,因此,其在A1~A3中的富集也是对应反应器苯酚厌氧消化性能提升的原因之一。有研究指出,Firmicutes和Bacteroidota的相对丰度之间呈显负相关[22],在A组各反应器中也呈现了相同的现象。Bacteroidota能够与产甲烷菌建立共生关系,并将葡萄糖靶向转化为乙酸和H2[23],进而促进厌氧消化的稳定运行。因此,Bacteroidota在A1~A3中相对丰度的增加可能是苯酚甲烷化延滞期和苯酚降解时间缩短的原因之一。
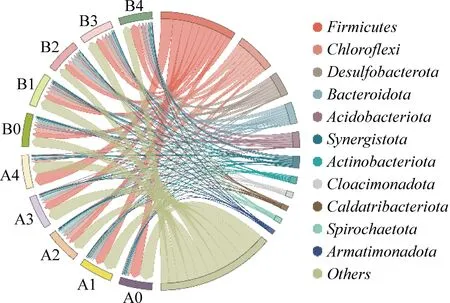
图7 细菌在门水平的群落组成Fig. 7 Community composition of bacteria at phylum level
值得注意的是,水热炭的添加显著富集了Acidobacteriota,其相对丰度从A组中的0.17%~1.51%显著增加至B组中的6.21%~10.80%,成为优势菌门。Acidobacteriota能够对包括葡萄糖在内的多种糖类物质进行降解[24],其特异性富集是促使共基质与水热炭添加提升苯酚厌氧消化性能的重要因素。
图8进一步在属水平上分析了细菌的群落组成。Syntrophus、Hydrogenispora、Pelotomaculum、DMER64、Syner-01和Aminobacterium是最主要的几种微生物。其中,Syntrophus属于Syntrophaceae科,是一种典型的苯甲酸厌氧代谢菌[25],能够通过与消耗氢/甲酸盐的微生物的合养以降解苯甲酸盐和某些脂肪酸[26]。其在B组中被显著富集,相对丰度从A组中的0.14%~0.21%上升至B组中的6.81%~18.98%。先前研究发现,Syntrophus能够产生DIET所需的导电菌毛,并可以通过DIET生长[27]。因此,水热炭可能通过促进Syntrophus与其合养产甲烷菌之间的DIET提高苯酚降解效率。此外,Syner-01也同样在B组中被观察到富集。在相同的葡萄糖浓度下,水热炭的添加使Syner-01的相对丰度最高提高了约3.02倍。Syner-01属于Synergistaceae科,在厌氧消化的互营乙酸氧化和氨基酸氧化过程中发挥着重要的作用[28]。

图8 细菌在属水平的群落组成Fig. 8 Community composition of bacteria at genus level
值得注意的是,Hydrogenispora在A4和B4中的相对丰度分别为6.50%和11.09%,是A、B组其他反应器中该属相对丰度的38.48~355.40倍和2.13~7.11倍。Hydrogenispora在高浓度葡萄糖组相对丰度较高,这可能是因为Hydrogenispora能够将葡萄糖向乙酸、乙醇和氢气等转化[29],因此在高浓度葡萄糖环境下竞争力更强。
Pelotomaculum的相对丰度则随共基质浓度的提高呈先减后增趋势。以A组为例,Pelotomaculum在A0和A4中的浓度可达8.83%和7.02%,而在A1~A3中最高仅为1.73%。在先前的研究中发现,Pelotomaculum在与耗氢甲烷菌Methanspirillumhungatei的共培养中,可利用2种或3种邻苯二甲酸酯异构体进行生长,并产生乙酸盐和甲烷等最终产物,但不能利用对羟基苯甲酸作为电子受体[30]。
同时,DMER64的相对丰度在A2、A3和B2、B3中较A、B组其他反应器显著上升。据报道,DMER64能够通过细菌属将丙酸和丁酸转化为氢[31],上述反应器内较高的丙酸和丁酸含量是促进DMER64活性的可能原因。DMER64被认为是一种潜在的互营细菌,可以与产甲烷菌建立水热炭等炭材料介导的DIET,从而提高产甲烷效率[32]。这可能也是葡萄糖浓度在1.0~2.0 g/L苯酚厌氧降解效果最佳的原因之一。
综上所述,适宜浓度的葡萄糖共基质和水热炭的添加有利于相关功能微生物的富集,从而提升苯酚厌氧降解性能。
3 总 结
本研究表明,水热炭和共基质添加均能够促进苯酚厌氧消化,且二者同时添加能进一步提升促进效果。水热炭和共基质添加使最高累积产甲烷量较对照组提高了16.15%~208.89%。同时,二者的添加还缩短了苯酚厌氧消化的延滞期,并且提高了甲烷生产的Rm,且葡萄糖共基质对苯酚厌氧消化的促进作用呈现随浓度增加先增加后减少的趋势。
对不同反应器中的微生物群落结构进行分析发现,适宜的共基质浓度和水热炭的添加能够有效富集功能微生物,强化苯酚厌氧降解性能。葡萄糖共基质的添加能够富集耗乙酸产甲烷菌Methanosaeta和Chloroflexi、Bacteroidota等细菌。水热炭的存在进一步提高了2种优势菌门Methanobacterium、Methanosaeta的丰度和,尤其是能够参与DIET过程的Methanobacterium。同时,也观察到Acidobacteriota、Syntrophus、Syner-01等细菌的显著富集。
