滋月萃降糖方介导Fetuin B-AMPK/ACC 通路对高脂诱导肥胖小鼠肝脏胰岛素抵抗的调控机制研究*
2024-02-22刘曼曼冯珍凤胡春平陈见纺沈怡华高俊凤
刘曼曼,冯珍凤,胡春平,陈见纺,沈怡华,高俊凤,严 军△
1 上海市嘉定区中医医院,上海 201899; 2 上海中医药大学研究生院,上海 201203
近年来,肥胖导致的代谢综合征发病率逐年增长[1]。肥胖是由于能量摄入大于消耗导致的一种代谢障碍状态,受到生活状态、环境、遗传等多种因素的共同影响。而胰岛素抵抗(insulin resistance,IR)是其发病的关键因素,并贯穿发病过程的始终。肝脏在全身代谢调节中发挥着至关重要的作用,肝脏IR 导致的代谢紊乱是影响机体葡萄糖和脂质代谢的关键[2]。Fetuin B 是近年来新发现的半胱氨酸蛋白酶抑制剂超家族成员之一,是一种新型的肝脏分泌蛋白,由肝脏产生分泌入血[3]。研究表明,Fetuin B增多会引起糖代谢和脂代谢异常,且Fetuin B 在体内长期积累会增加罹患IR的风险,但其在代谢中的具体作用机制尚不明确[4-5]。腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)即丝氨酸/苏氨酸激酶AMP 依赖的蛋白激酶,是一种重要的能量感应酶,是调节机体能量代谢的总开关。乙酰辅酶A 羧化酶(acetyl CoA carboxylase,ACC)是一种依赖生物素的变构羧化酶,是AMPK 的下游分子,AMPK/ACC 通路抑制可加重IR,从而加剧葡萄糖和脂质代谢紊乱。最新的一项研究表明,Fetuin B抑制胰岛素信号传导,加重心肌缺血再灌注损伤。大量研究表明,在啮齿动物中,心肌缺血再灌注损伤可通过激活AMPK/ACC通路改善心肌IR,起到保护心脏的作用[6-9]。
滋膵降糖方是上海市嘉定区中医医院内分泌科的临床经验方,相关临床研究证实滋膵降糖方可有效改善2 型糖尿病(type 2 diabetes mellitus,T2DM)患者高体质量及IR[10-11],但具体机制仍需进一步研究探索。本实验采用高脂饮食诱导建立C57BL/6J小鼠IR模型,观察其肝脏组织Fetuin B及AMPK、ACC相关表达,计算糖耐量曲线下面积(area under ROC curve,AUC)和胰岛素抵抗指数(homeostasis model assessment-estimated insulin resistance,HOMA-IR),从新的角度探讨滋膵降糖方改善IR的相关机制。
1 材料与方法
1.1 实验动物选择SPF 级健康C57BL/6J 小鼠50只,6周龄,雄性,体质量18~22 g,由北京维通利华实验动物技术有限公司提供,实验动物生产许可证号:北京百善SCXK(京)2016-0006,实验动物使用许可证号:北京SYXK(京)2017-0033。饲养条件:动物饲养于北京维通利华实验动物技术有限公司上海分公司,实验动物生产许可证号:SCXK(沪)2017-0011;实验动物使用许可证号:SYXK(沪)2017-0014。SPF 级实验动物设施IVC 系统,动物房温度(22±5)℃,相对湿度(50±10)%,明暗周期12 h∶12 h,鼠笼每日清洁消毒,所有小鼠自由饮水,自由饮食。动物饲料为60%Kcal High-Fat(DIO)Diet(美国RDI,货号:D12492)。本实验经上海中医药大学伦理会委员会批准。
1.2 实验药物滋膵降糖方组成:生黄芪20 g,山萸肉10 g,山药15 g,生地黄15 g,黄连6 g,葛根15 g,鬼箭羽10 g。上述颗粒制剂购自上海市嘉定区中医医院药剂科,批号:20190863。盐酸二甲双胍片(格华止)(中美上海施贵宝制药有限公司,国药准字H20023370)。
1.3 试剂与仪器小鼠胰岛素ELISA 试剂盒(武汉华美生物工程有限公司,批号:CSB-E05071m);RIPA 裂解液(上海碧云天生物技术公司,批号:P0013,P0033),ECL 发光剂(上海碧云天生物技术公司,批号:P0018S);BCA试剂盒[生工生物工程(上海)股份有限公司,批号:C503021];AMPKα1(批号:ab32047)、P-AMPKαT183/T172(批号:ab133448)、ACC(批号:ab45174)、P-ACCS79(批号:ab68191)Antibody均购自英国abcam公司;内参抗体GAPDH(英国abcam公司,批号:ab9485;成都正能生物技术公司,批号:AF7021);Fetuin B Antibody(成都正能生物技术公司,批号:384299);HiScript 1st Strand cDNA Synthesis Kit(南京诺唯赞生物科技技术股份有限公司,批号:R212-02)。卓越型罗氏血糖仪(上海鱼跃医疗设备公司);GL-20G-II 型高速恒温冷冻离心机(上海安亭科学仪器厂);ATPIO-650D 型超声波细胞粉碎机(南京先欧生物科技有限公司);微量移液器(日本NICHIRYO 公司);SLAN-96P 全自动医用PCR 分析系统(上海宏石医疗科技有限公司);Thermo-117123001 型酶标仪(美国赛默飞公司);GENE GNOME SYNGENE BIO IMAGING(美国Bio Tek Instruments,Inc公司)。
1.4 实验方法
1.4.1 模型制备 小鼠适应性喂养1 周后,随机选择40只小鼠进行造模,10只小鼠作为空白对照组,给予普通饲料;其余40 只给予高脂饲料建立IR模型,每周进行体质量称量记录,持续时间为8周。造模结束后,所有小鼠隔夜禁食,次日尾静脉取血行空腹注射葡萄糖耐量实验(intraperitioneal glucose tolerance trial,IPGTT),根据IPGTT实验结果及糖耐量曲线判断IR模型建立是否成功(AUC高于正常组均值的小鼠视为IR模型小鼠)[12]。
1.4.2 分组及给药 按照标准,造模成功的小鼠共32 只,采用随机数字表的方法将造模成功的小鼠分为模型组、滋膵降糖方组、二甲双胍组和联合组,每组8 只。按人标准体质量60 kg,人的每日服药量是91 g/60 kg=1.52 g/kg,根据黄继汉《药理实验中动物间和动物与人间的等效剂量换算》的药物和人的体质量剂量系数,换算为1.52×12.33/1000=0.0187416。空白对照组和模型组给予0.9%生理盐水灌胃,滋膵降糖方组给予滋膵降糖方18.741 g/kg 灌胃,二甲双胍组给予二甲双胍混悬液0.103 g/kg 灌胃,联合组给予滋膵降糖方联合二甲双胍灌胃,持续给药4周。
1.4.3 标本取材 小鼠给药4周后,隔夜禁食8 h,予戊巴比妥钠腹腔注射麻醉,眼球取血,离心,取上清,-20 ℃冰箱保存,以备后续实验;快速取出肝脏,并称质量,-80 ℃冰箱保存,以备后续实验。
1.5 观察指标
1.5.1 小鼠一般情况监测 实验过程中,每天观察并记录小鼠的毛色、饮食、饮水及二便情况、精神状态,每周定时记录小鼠体质量,直至给药结束。
1.5.2 血清胰岛素(fasting insulin,FINS) 以小鼠胰岛素酶联免疫试剂盒测定小鼠血清胰岛素浓度,严格按照试剂盒使用说明书进行操作。根据公式计算胰岛素抵抗指数HOMA-IR[13]。
1.5.3 IPGTT 给药4 周后,行IPGTT。隔夜禁食,25%葡萄糖溶液腹腔注射,于注射前(0 min),注射后30、60、120 min 时分别测定血糖水平,根据梯形公式计算AUC[14]。
1.5.4 Q-RT-PCR法检测小鼠肝脏Fetuin B-AMPK/ACC 通路mRNA 表达 取小鼠肝脏组织100 mg,加入液氮研磨后备用。使用Trizol试剂提取小鼠肝脏组织总RNA,按照HiScript 1st Strand cDNA Synthesis Kit 说明书操作,去除基因组的DNA,将总RNA 逆转录成单链cDNA,进行实时荧光定量PCR,配制PCR 反应体系,每个基因做3 个复孔和1个阴性对照,在PCR 分析仪上进行DNA 扩增,扩增反应条件为变性(95 ℃,30 s)、退火(58 ℃,30 s)、延伸(72 ℃,30 s)30个循环。以β-actin 为内参基因,校正目标基因的荧光强度。所有引物由上海东寰生物科技有限公司设计合成。见表1。
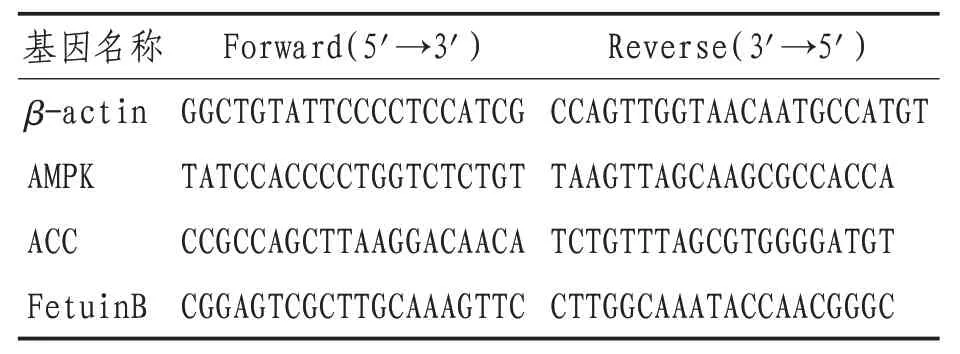
表1 q-RT-PCR引物序列
1.5.5 Western Blot法检测小鼠肝脏Fetuin BAMPK/ACC通路蛋白表达 取小鼠肝脏组织100 mg,液氮研磨后加入含有97%RIPA+1%PMSF+1%蛋白酶抑制剂+1%磷酸酶抑制剂的RIPA裂解液及相关抑制剂中,匀浆液离心,4 ℃,12 000 r/min,3 min,取上清。按照BCA 蛋白质浓度测定试剂盒完成蛋白定量;制备聚丙烯酰胺凝胶,并进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),将蛋白转移到聚偏二氟乙烯(PVDF)膜上,37 ℃下在封闭液中封闭PVDF膜1 h,洗膜,将膜放在一抗稀释液中(按说明书稀释),4 ℃冰箱孵育过夜。次日用TBST 洗膜3 次,每次15 min。将洗好的膜放入稀释好的二抗中(按说明书稀释),室温孵育1 h,用TBST 洗膜3 次,每次15 min。显影:ECL 发光试剂盒显影,用GENE GNOME 系统曝光显像,导出图片,用ImageJ 软件对条带进行灰度值分析,以GAPDH为内参蛋白,校正目的蛋白灰度值。
1.6 统计学方法采用SPSS 24.0 软件对数据进行处理,计量资料采用表示,满足正态性、方差齐性的计量资料采用单因素方差分析,组间多重比较用LSD-t检验;满足正态性,不满足方差齐性时,组间多重比较用Dunnett′s T3 检验。不满足正态性、方差齐性的计量资料用非参数的秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠体质量、肝质量及肝体比给药4 周期间,滋膵降糖方组、二甲双胍组和联合组与模型组相比小鼠体质量增加缓慢(P<0.05),滋膵降糖方组小鼠体质量(自给药第3 周开始)明显低于模型组(P<0.05);末次给药后,模型组小鼠体质量、肝脏质量和肝体比明显高于空白对照组(P<0.01);滋膵降糖方组、二甲双胍组和联合组肝脏质量和肝体比明显低于模型组(P<0.01)。见表2。
表2 各组小鼠体质量、肝质量、肝体比比较()
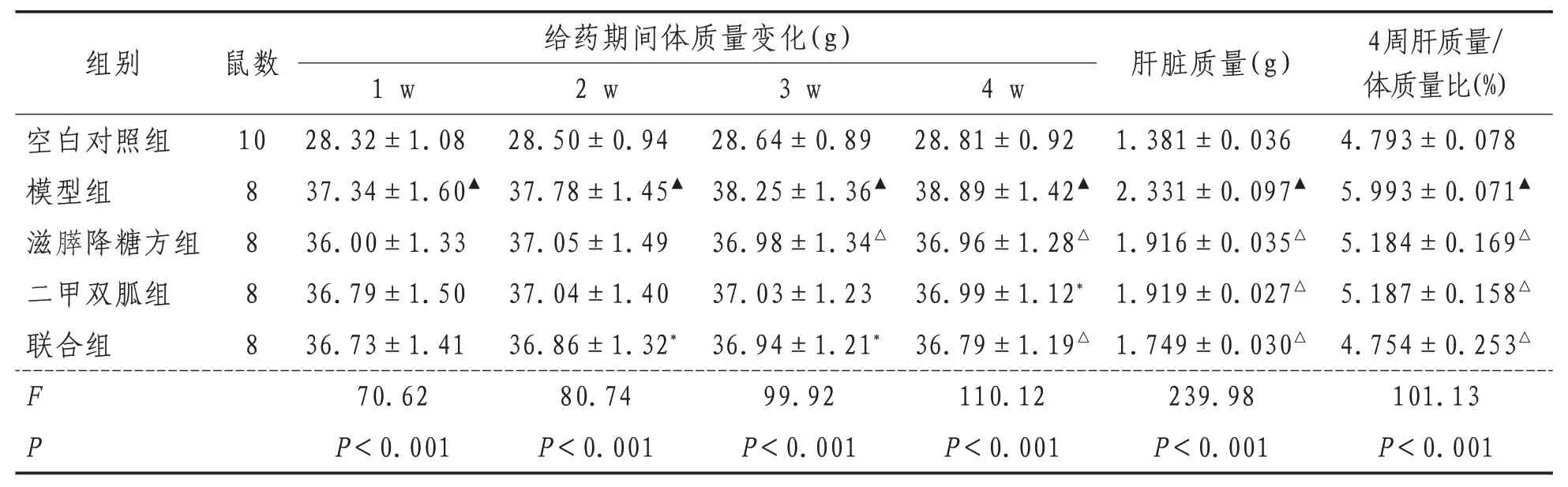
表2 各组小鼠体质量、肝质量、肝体比比较()
注:与空白对照组比较,▲表示P<0.01;与模型组比较,*表示P<0.05,△表示P<0.01
?
2.2 小鼠FINS、HOMA-IR 水平与空白对照组比较,模型组小鼠FINS、HOMA-IR显著升高(P<0.01);与模型组比较,滋膵降糖方组、二甲双胍组和联合组FINS、HOMA-IR 均明显下降(P<0.01)。见表3。
表3 各组小鼠血清FINS水平、HOMA-IR比较()
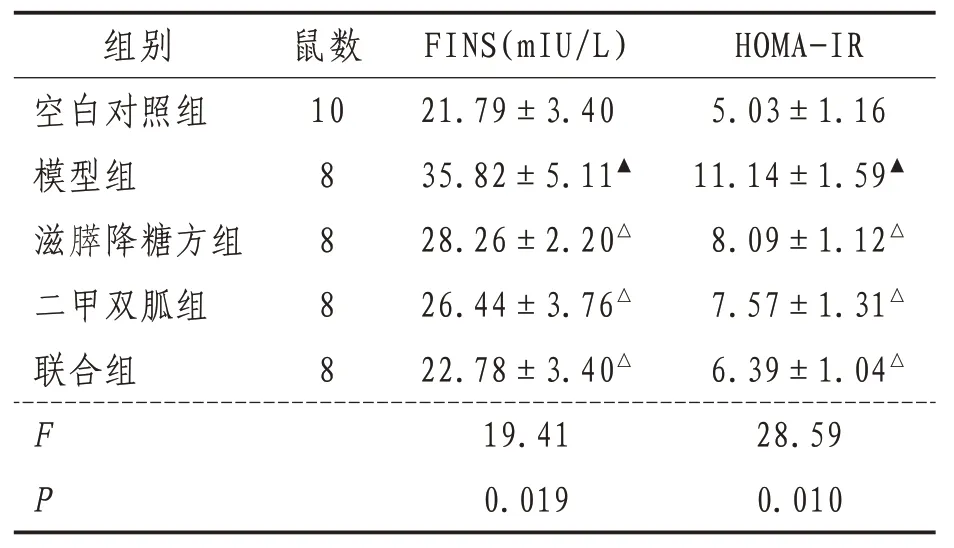
表3 各组小鼠血清FINS水平、HOMA-IR比较()
注:与空白对照组比较,▲表示P<0.01;与模型组比较,△表示P<0.01
?
2.3 小鼠IPGTT水平与空白对照组比较,模型组小鼠各个时间点的血糖值均显著升高(P<0.01),AUC 明显增大(P<0.01)。与模型组比较,联合组及二甲双胍组能显著降低0、30、60、120 min 时间点的小鼠血糖水平(P<0.05);滋膵降糖方组有效改善0、120 min 血糖(P<0.05)。与模型组比较,给药各组的AUC显著减少(P<0.05)。见表4。
表4 各组小鼠IPGTT水平比较()
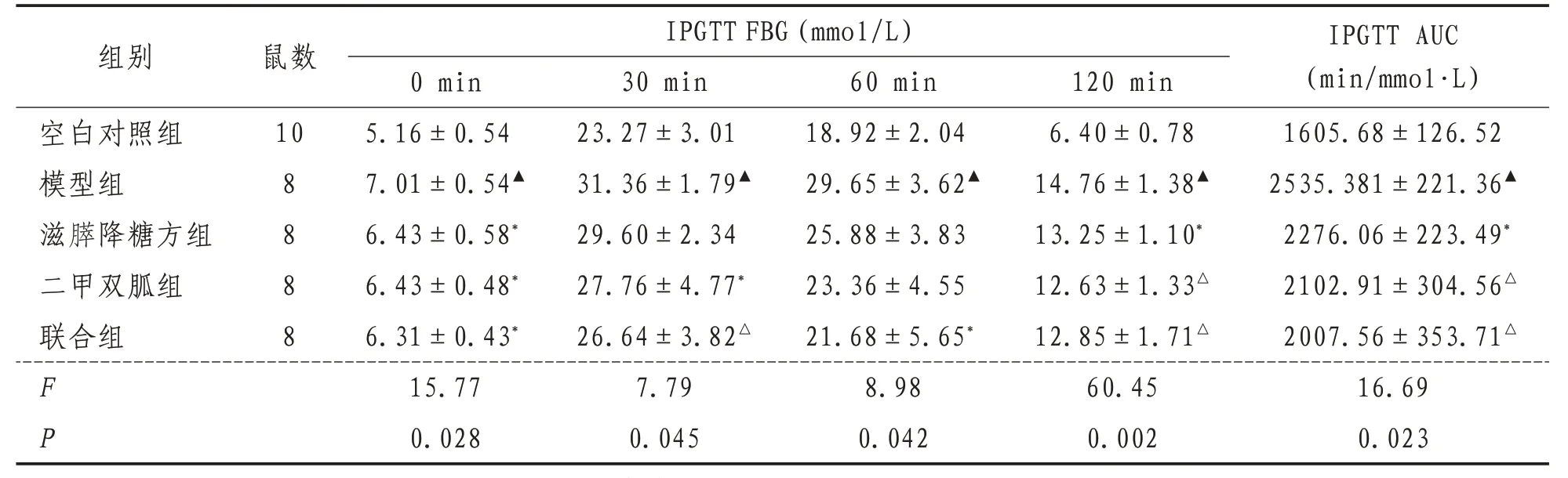
表4 各组小鼠IPGTT水平比较()
注:与空白对照组比较,▲表示P<0.01;与模型组比较,*表示P<0.05,△表示P<0.01
?
2.4 小鼠肝脏Fetuin B、AMPK、ACC mRNA 相对表达量与空白对照组比较,模型组小鼠Fetuin B,ACC mRNA表达升高(P<0.01),AMPK mRNA表达降低(P<0.01);与模型组比较,滋膵降糖方组、二甲双胍组和联合组Fetuin B、ACC mRNA表达均下降(P<0.01),AMPK mRNA 表达明显上升(P<0.01);其中联合组优于滋膵降糖方组、二甲双胍组(P<0.05),滋膵降糖方组优于二甲双胍组(P<0.05)。见表5。
表5 各组小鼠肝脏Fetuin B、AMPK、ACC的mRNA表达比较()
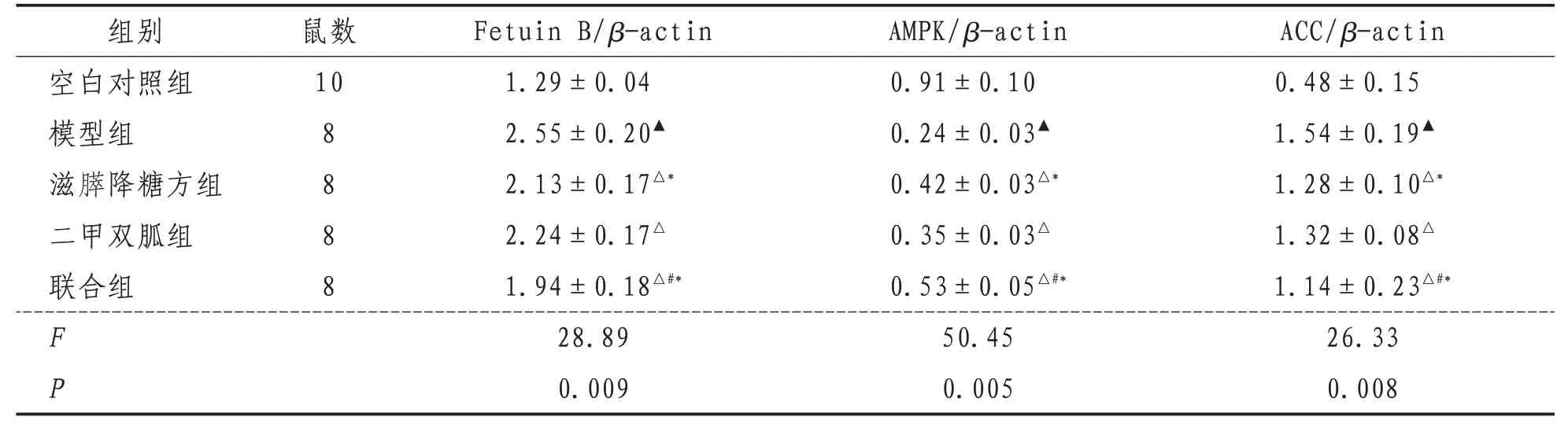
表5 各组小鼠肝脏Fetuin B、AMPK、ACC的mRNA表达比较()
注:与空白对照组比较,▲表示P<0.01;与模型组比较,△表示P<0.01;与滋膵降糖方组比较,#表示P<0.05;与二甲双胍组比较,*表示P<0.01
?
2.5 小鼠肝脏Fetuin B-AMPK/ACC 通路蛋白表达与空白对照组比较,模型组小鼠Fetuin B蛋白表达明显增加,P-AMPKαT183/T172/AMPKα1,P-ACCs79/ACC水平显著降低(P<0.01);与模型组比较,各给药组小鼠肝脏Fetuin B蛋白表达均下降,P-AMPKαT183/T172/AMPKα1、P-ACCs79/ACC水平升高(P<0.05)。组间比较,联合组下调Fetuin B蛋白表达,上调P-AMPKαT183/T172/AMPKα1、P-ACCs79/ACC水平效果优于滋膵降糖方组、二甲双胍组(P<0.05),滋膵降糖方组上述指标改善优于二甲双胍组,上调P-AMPKαT183/T172/AMPKα1水平优于二甲双胍组(P<0.05),但上调P-ACCs79/ACC水平与二甲双胍组无差异(P>0.05)。见表6、
表6 各组小鼠肝脏Fetuin B、P-AMPK/AMPK、P-ACC/ACC蛋白表达比较()

表6 各组小鼠肝脏Fetuin B、P-AMPK/AMPK、P-ACC/ACC蛋白表达比较()
注:与空白对照组比较,▲表示P<0.01;与模型组比较,△表示P<0.05;与滋膵降糖方组比较,#表示P<0.05;与二甲双胍组比较,*表示P<0.01
?
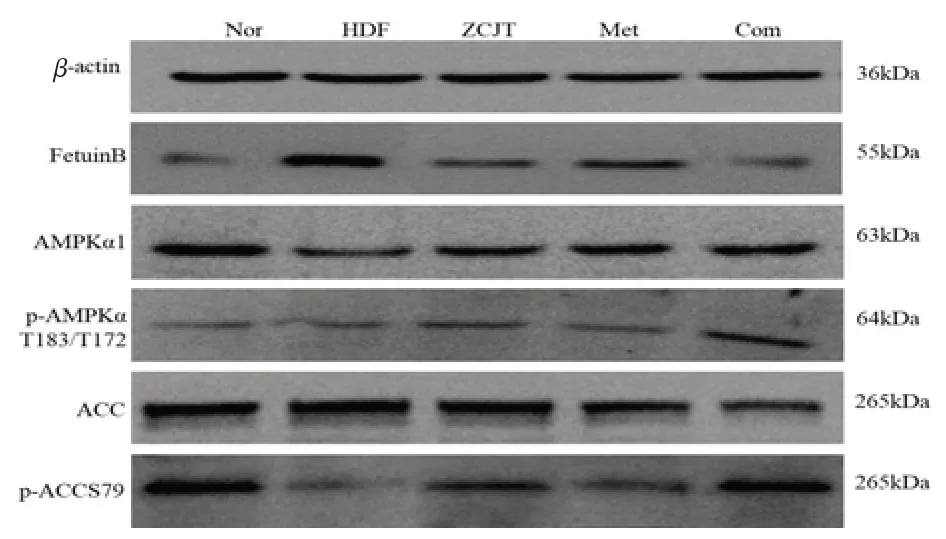
图1 各组小鼠肝脏FetuinB、P-AMPK/AMPK、P-ACC/ACC蛋白表达电泳图
3 讨论
IR 是肥胖、T2DM 等代谢性疾病发病的核心机制,肝脏是胰岛素作用的主要靶器官之一[2],由于糖代谢异常往往伴有脂代谢紊乱,IR 又会加重糖脂代谢异常,因此改善肝脏IR 是预防、控制代谢性疾病的有效机制。由于饮食结构的改变,糖尿病等代谢性疾病的临床特征已经发生了极大变化,以IR 及糖脂代谢紊乱的患者为主体人群。中医传统意义上的“三消”理论及“阴虚为本、燥热为标”的基本病机已不能完全概括其病因病机及基本的发生发展规律。若长期过食、少动,易引起食郁,继而郁久化热,耗气伤阴,加之食郁伤脾,脾运化失司,最终导致气阴两虚[15]。故基于前人理论,笔者提出了现代糖尿病代谢性疾病的核心病机为气阴两虚为本,郁热为标。并以晚清医家张锡纯名方“滋膵饮”为基础方加减创制效方“滋膵降糖方”。方中以黄芪为主药,补中益气;生地黄滋肾清热,上以润肺,协同山萸肉以封固肾关;山药善治消渴,性甘平,益肾补脾阴,止小便频数,且润肺生津止渴,与甘温偏于补脾阳之黄芪配合,一阴一阳,气阴兼顾;鬼箭羽活血通络,推陈致新,并使补益药补而不壅滞;葛根、黄连清热滋脾。全方寒温并用、补泻兼施、阴阳相济、气阴双补、标本兼治,诸药并用行健脾益气,清热养阴,活血通络之功。前期研究证实该方除可改善患者高血糖、高血脂和高体质量状态外,还可改善IR 及胰岛β细胞功能[10-11]。
Fetuin B 被证实是一种影响糖脂代谢的重要新型肝脏细胞因子,基因位于鼠16 号染色体,人3 号染色体,而该位点是糖尿病等代谢疾病的遗传基因易感位点[16-17]。RUTH等[18]研究发现,高脂饮食诱导小鼠肝原代细胞胰岛素敏感性受损,是因脂肪变性改变肝细胞的蛋白分泌,Fetuin B分泌异常增多所致。一项基于人群的临床研究发现T2DM 患者的Fetuin B 水平显著升高,与FINS、HOMA-IR 呈正相关[19]。这与研究结果一致,提示Fetuin B 在促进IR 中发挥重要作用。XING 等[6]研究表明,T2DM 小鼠敲除Fetuin B 基因后,心脏Fetuin B 水平降低,胰岛素受体底物1、丝氨酸位点磷酸化增强,心肌组织胰岛素信号传导改善,进而心肌缺血再灌注损伤得以缓解。故Fetuin B被认为是T2DMIR中的关键因子。
AMPK 是一种高度保守的蛋白激酶,是能量代谢调控中枢,作为调节糖脂代谢的关键酶,参与葡萄糖、脂肪酸的合成和氧化分解,在正常生理状态下,AMP/ATP比率上升时,AMPK就被激活,抑制消耗能量的生物合成途径,激活产生ATP的分解代谢途径,调节细胞能量代谢平衡[20]。在高血糖、高血脂的病理环境下,AMPK下调导致正常生理调节机制发生紊乱,信号通路相关蛋白调控发生改变,反而激活下游靶点ACC的活性,加重T2DM的发生。如上所述,XING等[6]研究发现,在T2DM小鼠心肌缺血再灌注损伤模型中伴随Fetuin B水平增加,心肌IR加重。而众所周知,心肌缺血再灌注损伤中,能量代谢AMPK/ACC 通路发挥关键作用。因此推测Fetuin B是调控AMPK/ACC 通路的关键上游靶点,影响机体糖脂代谢。体内Fetuin B 含量增加会抑制AMPK 磷酸化,因AMPK活性降低进一步抑制ACC磷酸化,导致ACC活性增强,抑制脂肪酸氧化,刺激脂质沉积,降低胰岛素敏感性,加剧IR,加重T2DM的进展。本实验结果中,高脂饮食诱导肥胖小鼠HDF较Nor组肝脏Fetuin B、ACC在mRNA和蛋白水平均显著升高,AMPK 则明显降低,肝脏脂肪变性与葡萄糖代谢紊乱加重,证实了以上推测。同时,肥胖小鼠给予滋膵降糖方干预后,Fetuin B mRNA 和蛋白表达下降,刺激AMPK 活化,抑制ACC 活性,加快脂肪酸氧化和糖酵解,改善IR,我们认为可能与其清热、助脾运化散精功能密切相关,而这正与糖尿病中医发病机制一致。
本研究初步阐明了滋膵降糖方可能通过介导Fetuin B-AMPK/ACC 通路对肝脏IR 进行调控,但由于时间限制,仅进行了体内表型研究,下一步研究将结合体外细胞研究进一步验证。
