地中海弧菌117-T6的溶藻活性
2024-02-22史含梦戴应芬徐梦雅
史含梦, 洪 帆, 戴应芬, 徐梦雅, 杨 锐
(1. 宁波大学,浙江省海洋生物工程重点实验室,浙江 宁波,315211;2. 宁波大学海洋学院,浙江 宁波,315211)
溶藻细菌(algae-lysing bacteria)是可以通过直接或间接方式抑制藻类生长或杀死藻类、溶解藻细胞的细菌的统称[1]。1942年有研究发现,寄生多囊粘菌(Polyangiumparasiticum)能杀死刚毛藻(Cladophoraspp.),首次报道了细菌溶藻现象[2]。随后关于细菌溶藻的报道陆续增多。现已报道的溶藻细菌有黏细菌属(Myxobacter)、噬纤维菌属(Cytophaga)、假单胞菌属(Pseudomonas)、鞘氨醇单胞菌属(Phingomonas)、假交替单胞菌属(Pseudoalteromonas)、弧菌属(Vibrio)和芽孢杆菌属(Bacillus)等[3-4]。
许多海洋致病菌都具有溶藻特性。李杰等[5]在绿斑病紫菜的藻体中发现海洋假交替单胞菌(P.marina)具有较强的胞外酶活性,可杀死藻细胞。黄林彬等[6]发现科贝特氏菌属(Cobetia)可侵入坛紫菜(Porphyra haitanensis)藻细胞并释放内毒素而杀死紫菜细胞,引起红烂病[7]。Wang等[8]发现海洋弧菌DHQ25可分泌胞外蛋白来抑制和杀死赤潮藻。Jeong等[9]研究发现,海洋芽孢杆菌SY-1菌株分泌的多肽类物质(bacillamide)对多环旋沟藻有特异性的杀灭作用。Guo等[10]证实了气单胞菌菌株GLY-2107可通过分泌热稳定性的胞外化合物来杀死铜绿微囊藻(Microcystis aeruginosa)。Li等[11]报道从患病的海带藻体上分离出的假交替单胞杆菌SM0524可分泌藻酸盐裂解酶,使海带病烂。可见,溶藻细菌的作用方式多样,且机制复杂。
紫菜丝状体黄斑病是紫菜贝壳丝状体育苗期间高发的严重疾病,能够导致贝壳出现黄斑,最后白化,造成育苗失败[12]。地中海弧菌(V. mediterranei) 117-T6(Vm117-T6)被证实是该病的一种致病菌,可以破坏紫菜丝状体细胞的内膜系统,导致细胞空胞化[13]。我们发现,Vm117-T6同样也能感染紫菜叶状体以及赤潮异弯藻等其他藻类,造成细胞解体,是一株广谱性的溶藻细菌。本实验拟观察Vm117-T6对赤潮异弯藻(Heterosigma akashiwo)、颗石藻(Pleurochrysis carterae)、叉鞭金藻(Dirateria inornata)和东海原甲藻(Prorocentrum donghaiense)的溶藻作用,探究其溶藻物质的特性,为解析菌株的溶藻机制提供证据。
1 材料与方法
1.1 实验材料培养
实验所用赤潮异湾藻(NMBjah045)、颗石藻、叉鞭金藻和东海原甲藻均由浙江省海洋生物工程重点实验室藻种库提供。
将经0.22 μm孔径滤膜过滤后的海水,每1 L中添加1 mL宁大3号母液[12]作为培养基。将藻种按1.0×103CFU/mL的密度按照1∶5(体积比)的比例,接种至培养液中,于培养箱中培养3~4 d,每日摇瓶2次。于20 °C,光照强度36 μmol photons m−2s−1,光暗周期12 L∶12 D条件下将微藻培养至指数生长期。调整藻液浓度至1.0×106CFU/mL,备用。
1.2 Vm 117-T6的培养
紫菜丝状体黄斑病病原菌Vm117-T6保存于浙江省海洋生物工程重点实验室。保藏菌株室温解冻后接种至NaCl浓度为1%的胰蛋白胨大豆肉汤(TSB,青岛海博生物技术有限公司)液体培养基中,28 °C,110 r/min,活化培养12 h。菌株扩增与培养条件相同。
1.3 Vm 117-T6感染实验
取活化的Vm117-T6,2775×g离心5 min,去除培养基后,在灭菌的富N/P的营养海水(0.0008%P-H2PO4,0.002% N-NO3)中重新悬浮。调整菌体密度约1.0×107CFU/mL。
将菌体按1∶10(体积比)接种于指数生长中期的赤潮异湾藻、颗石藻、叉鞭金藻和东海原甲藻等藻液中,每组设置3个平行。感染72 h后测定藻体中叶绿素a含量,并计算其溶藻率。取适量藻液,7104×g离心5 min,弃上清液,加入等体积95%乙醇,4 °C静置24 h,7104×g离心5 min,取上清液于649 nm和665 nm下测定其OD值。Ca=13.95×OD665−6.88×OD649。式中,Ca为叶绿素a的质量浓度。
溶藻率的测定∶I(%)=(1−Ct/C0)×100%。式中,I为溶藻效率;Ct和C0分别为感染时间为t时和0时对照的叶绿素a浓度。
1.4 Vm 117-T6对不同碳源的降解作用
分别以果胶、卡拉胶、纤维素和几丁质作为唯一碳源制备选择培养基。将浸有Vm117-T6的滤纸片贴附在特定的选择培养基上,28 °C培养48 h。培养基用碘液染色5 min后,无菌水清洗染液,测量菌落周围透明圈的大小,以判断Vm117-T6降解不同碳源的能力。
1.5 Vm 117-T6胞内物、胞外物和菌体的溶藻效果
胞内物制备参照已有文献[14],以1∶100(体积比)的比例将Vm117-T6接种于NaCl浓度为1%的TSB培养基中,28 °C,110 r/min培养48 h后,4 °C,11180×g离心30 min,收集菌体,加入灭菌的富N/P营养海水(0.0008% P-H2PO4,0.002% N-NO3)重悬浮。低温下,超声细胞粉碎机破碎20 min,将破碎液11180×g离心5 min,取上清液,4 °C保存备用。
胞外物制备参照已有研究[9],将200 μLVm117-T6涂布于铺有无菌玻璃纸,NaCl浓度为1%的大豆酪蛋白琼脂培养基(TSA,青岛海博生物技术有限公司)上,28 °C培养48 h。随后,加入2 mL富含N、P的无菌营养海水(0.0008% PH2PO4,0.002% N-NO3),清洗菌苔。4 °C,11180×g离心30 min。上清液经0.22 μm的微孔滤膜过滤,4 °C保存备用。
菌体制备以1∶100(体积比)的比例将Vm117-T6接种至NaCl浓度为1%的TSB培养基中,110 r/min,28 °C培养12 h,备用。
Vm 117-T6胞外物、胞内物、菌体溶藻效果测定将上述处理所得溶藻物质以1∶10(体积比)的比例接入100 mL指数生长中期的赤潮异弯藻藻液中,24 h后测定其叶绿素a含量并计算其溶藻率。叶绿素a含量及其溶藻率的计算方法同“Vm117-T6感染实验”。
1.6 感染赤潮异弯藻显微观察
将制备好的Vm117-T6的胞外物与菌体按照1∶10(体积比)的比例接入100 mL指数生长中期的赤潮异弯藻藻液中,感染条件为20 °C,光照强度36 μmol photons m−2s−1,光周期为12 L∶12 D,培养40、80和120 min时取藻细胞于光学显微镜下观察。
1.7 不同处理下Vm 117-T6胞外提取物对溶藻率的影响
Vm117-T6胞外物乙醇处理取Vm117-T6胞外物溶藻组分100 mL,加入3倍体积无水乙醇,常温下静置10 min,1776×g离心20 min,分别收集上清液和沉淀。上清液于65 °C真空旋蒸浓缩至100 mL,重复3次。用少量蒸馏水溶解残留固体,得到溶解相。将收集的沉淀用蒸馏水溶解后合并,去除残留乙醇,得到沉淀相。无菌水定容至100 mL。
Vm 117-T6胞外物有机溶剂萃取取Vm117-T6胞外物溶藻组分100 mL,用2倍体积石油醚或乙酸乙酯静置萃取24 h,分别收集水相和有机相。水相经65 °C真空蒸发掉残留有机溶剂。有机相于65 °C真空蒸发干燥,用少量蒸馏水溶解残留固体。无菌水定容至100 mL。
Vm 117-T6胞外物活性炭吸附取Vm117-T6胞外物溶藻组分100 mL,加入适量活性炭粉后,经过1776×g离心,过滤,将处理后的组分用无菌水定容至100 mL。
Vm 117-T6胞外物高温处理取“Vm117-T6胞内物、胞外物和菌体的溶藻效果”中胞外物溶藻组分100 mL,100 °C水浴20 min,冷却至室温,0.22 μm的滤膜过滤,无菌水定容至100 mL。
Vm 117-T6胞外物不同组分溶藻率的测定将上述处理所得溶藻物质以1∶10(体积比)的比例接入100 mL指数生长中期的赤潮异弯藻藻液中,24 h后测定其叶绿素a含量并计算其溶藻率。叶绿素a含量及其溶藻率的计算方法同“Vm117-T6感染实验”。
1.8 Vm 117-T6不同条件下差异蛋白的分离与分析
对常规条件、最佳生长条件与易感条件下菌株的差异蛋白进行分析。将Vm117-T6于3种条件培∶ A(易感条件下)为30 °C、pH 6.0、盐度20;B(常规条件)为26 °C、pH 6.0、盐度20;C(最佳生长条件[12])为30 °C、pH 7.0、盐度20。培养条件同“Vm117-T6的培养”。参照“Vm117-T6胞内物、胞外物和菌体的溶藻效果”的方法制备不同生长条件下菌体的胞外物与胞内物。
利用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离菌株蛋白质,切割目的片段经胰蛋白酶消化后进行液相色谱质谱联用仪(Liquid Chromatograph Mass Spectromete,LC-MS)分析[15],蛋白鉴定工作由上海鹿明生物科技有限公司协作完成。制备C18膜填充柱;将挥发干的多肽样品重新溶解于Nano-HPLC Buffer A中;对多肽样品进行活化、平衡、固肽、脱盐,后更换新的EP管,用40 μL Nano-HPLC Buffer B洗脱多肽样品,并将脱盐后的多肽样品挥干。
将多肽样品重新溶解于Nano-HPLC Buffer A中。采用Nano-HPLC液相系统(EASY-nLC1200,Thermo Inc.,美国),色谱柱使用Trap column(RPC18, 100 μm×20 mm, Thermo Inc.,美国)和Analysis column(RP-C18, 75 μm×150 mm, Thermo Inc.,美国)进行分离。酶解产物经毛细管高效液相色谱分离后用Q-Exactive质谱仪(Thermo Scientific,美国)进行全扫描(full scan)分析。
结果按照如下所示参数进行搜库分析,Software∶ProteomeDiscover 2.4;Database∶地中海弧菌-uniprot-Vibrio+organism_mediterranei.fasta;MS1 tolerance∶10 ppm;MS2 tolerance∶0.02 Da;Missed cleavage∶2;Static modification∶Carbamidomethyl (C);Dynamic modification∶Acetyl (Protein N-term)、Deamidated (NQ)、Oxidation (M)。
1.9 统计方法
实验数据采用Excel 2020和Origin 2020软件进行作图分析,并采用SPSS 26.0 软件进行单因素方差分析(One-Way ANOVA)或双因素方差分析(Two-Way ANOVA),使用Tukey多重比较检验来确定各处理间的差异显著性。数据以平均值±标准差(mean ± SD)表示,P<0.05表示显著差异,P<0.01表示差异极显著。
2 结果
2.1 Vm 117-T6对不同微藻的溶藻作用
Vm117-T6感染72 h后溶藻率显示,该菌株具有广谱且较强的溶藻活性,对东海原甲藻的溶藻率高达93.5%、对赤潮异弯藻、颗石藻和叉边金藻的溶藻率分别达到了88.5%、62.3%和73%(图1)。
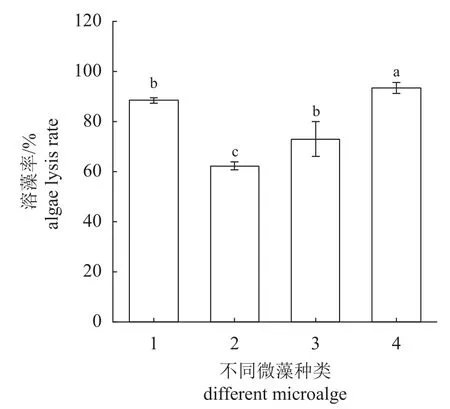
图1 Vm 117-T6感染不同微藻72 h的溶藻率1.赤潮异弯藻,2.颗石藻,3.叉鞭金藻,4.东海原甲藻Fig. 1 Algae-lysis rate of Vm 117-T6 infection on different microalgae for 72 h1. H. akashiwo,2. P. carterae,3. D. inornata,4. P. donghaiense
2.2 Vm 117-T6对不同微藻叶绿素含量的影响
Vm117-T6感染72 h后,不同微藻的叶绿素a的含量始终显著低于对照组(P<0.05,图2)。不同藻类对Vm117-T6的敏感程度也有所差异。处理72 h后,赤潮异弯藻和东海原甲藻的叶绿素a含量较对照组分别下降7.71和14.34倍;而颗石藻与叉鞭金藻的叶绿素a含量较对照组分别下降1.65和2.67倍。

图2 Vm 117-T6感染72 h对不同微藻叶绿素a含量的影响(a)赤潮异弯藻,(b)颗石藻,(c)叉鞭金藻,(d)东海原甲藻;对照. 未经感染的微藻,Vm 117-T6. 感染Vm 117-T6的微藻;“*” 表示同一时间点不同处理之间差异显著(P<0.05),“**” 表示同一时间点不同处理之间差异极显著(P<0.01)。Fig. 2 Effect of 72 h Vm 117-T6 infection on the chlorophyll a content of different microalgae(a) H. akashiwo, (b) P. carterae, (c) D. inornata, (d) P. donghaiense; control. uninfected microalgae, Vm 117-T6. uninfected microalgae; "*" means the difference between different treatments is significant(P<0.05), “**” means the difference between different treatments is extremely significant(P<0.01).
本研究所用微藻均为从东海赤潮中分离获得的形成赤潮水华的种类。鉴于上述实验结果,考虑到赤潮异湾藻无细胞壁,便于更好地观察细胞变化,因此,后续实验选取赤潮异弯藻为对象,用于评估Vm117-T6的溶藻特性。
2.3 Vm 117-T6对不同碳源的降解能力
果胶、卡拉胶、纤维素和几丁质均为藻类细胞壁的重要组分,以其作为唯一碳源来培养Vm117-T6,发现菌株仅在卡拉胶固体培养基上形成明显的透明水解圈(图3),而对其他几种物质无显著效果。这说明Vm117-T6具有特异性降解卡拉胶的能力,不能分解果胶、纤维素和几丁质。

图3 Vm 117-T6在卡拉胶固体培养基上的水解圈Fig. 3 Hydrolysis zone of Vm 117-T6 on carrageenan solid medium
2.4 Vm 117-T6胞外物、胞内物和菌体的溶藻效果
对Vm117-T6的胞内物、胞外物及菌体进行溶藻效果比较。处理24 h后,胞内物、胞外物与菌体的溶藻率分别为38.23% ± 3.76%、41.84% ±2.05%和37.89% ± 3.63%(图4-a),三者之间无显著性差异(P>0.05)。添加Vm117-T6胞外物的赤潮异湾藻的叶绿素a含量从(52.64 ± 0.98) mg/L降低至(26.14 ± 0.94) mg/L(图4-b),差异极显著(P<0.01),而胞内物和菌体亦显著降低了赤潮异弯藻的叶绿素a的含量(P<0.05)。结果显示,Vm117-T6及其胞内物与胞外物均对赤潮异弯藻有显著抑制作用。

图4 Vm 117-T6胞内物、胞外物及菌体作用24 h对赤潮异弯藻的溶藻率的影响1.Ck,2.胞内物,3.胞外物,4.菌体。Fig. 4 Alginolytic effect of different microalgae-lysing components of Vm 117-T6 on H. akashiwo for 24 h1. Ck, 2. intracellular enzyme 9 (IS), 3. extracellular substance (ES), 4. bacteria (BAT).
2.5 Vm 117-T6胞外物及菌体对赤潮异弯藻细胞形态的影响
Vm117-T6胞外物对赤潮异弯藻细胞形态的影响结果显示,感染0 min的赤潮异弯藻细胞呈圆形,细胞结构完整、紧密,游动迅速(图版-1,5)。胞外物感染40 min后,藻细胞的泳动能力减弱、细胞逐渐膨胀变圆、细胞质中开始出现空腔(图版-2)。此时,藻细胞边缘完整;胞外物感染80 min,藻细胞内空腔不断增大,内含物的颜色逐渐变淡(图版-3)。胞外物感染120 min,藻细胞破裂,细胞质组分呈颗粒状分散在培养液中(图版-4)。
Vm117-T6菌体对赤潮异弯藻细胞形态的影响结果显示。整体而言,菌体感染导致藻体活性降低更为严重,在感染40和80 min,藻细胞的结构较胞外物感染组更为松散,感染120 min时,赤潮异弯藻的细胞内容物分散成不规则的透明颗粒,其中嵌有细菌菌体(图版-5~8),表明菌体感染会对赤潮异弯藻造成更严重的损伤。
2.6 Vm 117-T6胞外物不同处理对赤潮异湾藻的溶藻效果
对Vm117-T6胞外物进行不同处理,并检测其产物的溶藻活性。结果显示,作用24 h后,与未经处理的胞外物溶藻率(41.84% ± 2.05%)相比、石油醚水相、碳吸附和高温处理样本的都检测到较高溶藻率,分别为44.77%±2.39%、41.83%±1.91%和41.90%±1.79%,四者之间无显著性差异(P>0.05)(图5)。乙酸乙酯水相、乙醇溶解相与沉淀相的溶藻率分别为32.64%±1.56%、22.77%±2.56%、35.67%±2.79%,显著低于未处理的胞外物溶藻活性(P<0.05),但此三者之间差异不显著(P>0.05)。胞外物的石油醚相或者乙酸乙酯相的溶藻率均为负值,与正常培养的藻类无显著性差异(P>0.05),表示此二者不具溶藻活性。由此可知,Vm117-T6胞外溶藻物的特性∶易溶于水,不溶于石油醚和乙酸乙酯,具较强极性;耐高温,不易被活性炭吸附,乙醇处理会降低溶藻活性。
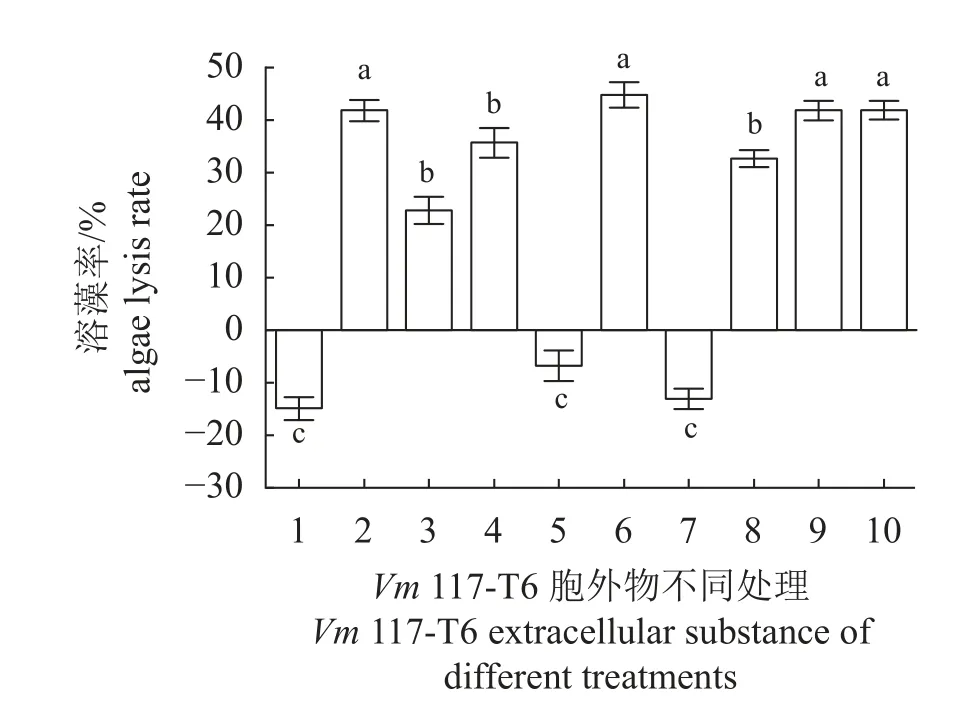
图5 Vm 117-T6 胞外物不同处理产物作用24 h对赤潮异弯藻溶藻率的影响1. Ck,2. 胞外物,3. 乙醇溶解相,4. 乙醇沉淀相,5. 石油醚相,6. 石油醚水相,7. 乙酸乙酯相,8. 乙酸乙酯水相,9. 碳吸附,10.高温。Fig. 5 Effects of different treatment products of Vm 117-T6 extracellular substance on the algae lysis rate of H. akashiwo in 24 h1. Ck, 2. extracellular substance, 3. ethanol dissolution phase, 4. ethanol precipitation phase, 5. upper layer of petroleum ether, 6. lower layer of petroleum ether, 7. upper layer of ethyl acetate, 8. lower layer of ethyl acetate, 9. carbon adsorption, 10. high temperature.
2.7 Vm 117-T6不同条件下差异蛋白的分析
分析易感条件与常规条件下Vm117-T6胞内物和胞外物的蛋白差异,结果发现分子量为37和40 ku的蛋白质条带变化最显著(图6)。这些蛋白条带均注释到地中海弧菌OX,而且其中含有较多分泌蛋白结合蛋白(表1),如ABC转运蛋白的结合蛋白,外膜蛋白TolC、OmpA,Ⅱ型及VI型分泌系统的结合蛋白。除RTX toxin蛋白外,胞外蛋白中未发现与已知溶藻物质相关的蛋白质和肽段。

表1 Vm 117-T6溶藻蛋白鉴定结果分析Tab. 1 Identification and protein annotation of lysing proteins in pathogenic Vm 117-T6
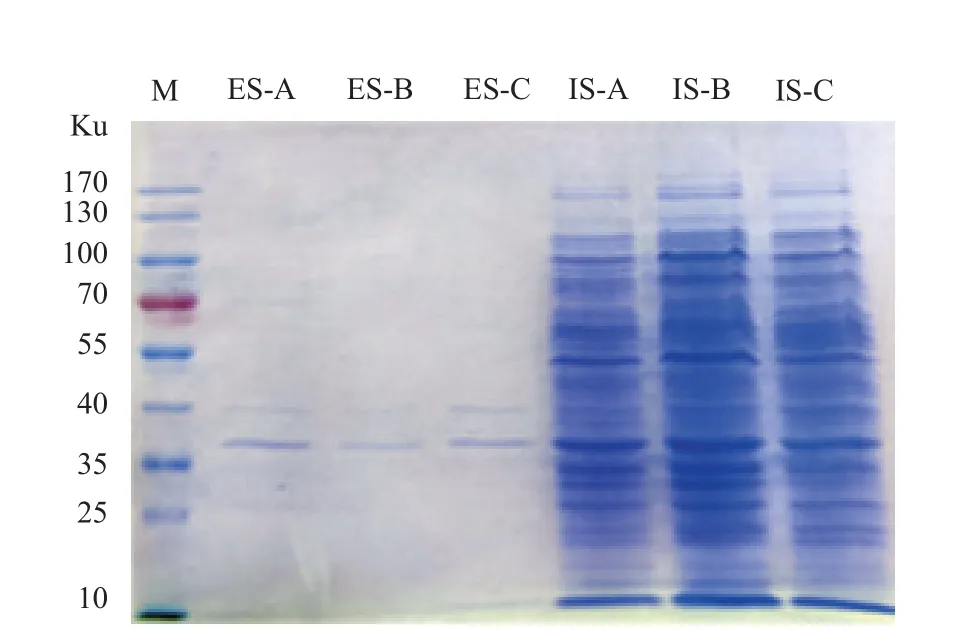
图6 Vm 117-T6胞内物和胞外物蛋白电泳图谱M. 蛋白质分子量标准;ES (extracellular substance)为Vm 117-T6胞外物,IS (intracellular substance)为Vm 117-T6胞内物;ES-A和ISA的培养条件为30 °C、pH 6.0、盐度20,ES-B和IS-B的培养条件为26 °C、pH 6.0、盐度20,ES-C和IS-C的培养条件为30 °C、pH 7.0、盐度20。Fig. 6 Vm 117-T6 intracellular and extracellular protein electrophoresis patternM. marker 170; ES (extracellular substance), Vm 117-T6 extracellular substance, IS (intracellular substance), Vm 117-T6 intracellular substance; culture conditions of ES-A and IS-A are 30 °C, pH 6.0, salinity 20, culture conditions of ES-B and IS-B are 26 °C, pH 6.0, salinity 20,culture conditions of ES-C and IS-C are 30 °C, pH 7.0, salinity 20.
综上,我们推测Vm117-T6的溶藻毒力因子中应含有极性内毒素类物质,此外,与毒性因子转运、分泌以及细胞黏附相关的转运蛋白等蛋白质在其毒力作用中也发挥了重要功能。这说明多种溶藻机制参与了Vm117-T6的溶藻过程。
3 讨论
细菌可以通过直接溶藻、间接溶藻、或是通过营养竞争的方式使藻细胞死亡[16]。直接溶藻,即细菌直接接触藻体进行攻击,甚至侵入藻细胞内部,杀死藻细胞[17]。Li等[18]从福建厦门水域分离得到了一株几丁质单胞菌属细菌(Chitinimonas prasineLY03),其可通过鞭毛黏附在假微型海链藻(Thalassiosira pseudonana)的藻细胞上,产生几丁质酶降解藻细胞壁,最终导致藻细胞死亡。果胶、卡拉胶、纤维素和几丁质是藻类细胞壁的重要成分。部分溶藻细菌的溶藻活性与果胶酶[19]、β-葡萄糖苷酶、几丁质酶[20]、纤维素酶[21]等有关。在本研究中,Vm117-T6可降解卡拉胶,但不能降解果胶、纤维素和几丁质等物质。由于卡拉胶并非本研究的几种微藻细胞壁的主要成分[22],因此,推测Vm117-T6对本研究中几种微藻的溶解作用并非作用于这些藻类的细胞壁。
间接溶藻作用是近年来文献报道最多的细菌溶藻方式。细菌通过分泌胞外溶藻化合物来攻击藻类细胞[16]。本研究中Vm117-T6的胞外溶藻化合物表现出较强的水溶性、耐高温、不易被活性炭吸附且被乙醇部分沉淀的特性。这表明Vm117-T6的胞外溶藻物质中可能含有极性内毒素类物质。目前已报道的溶藻细菌可能分泌灵菌红素、鼠李糖脂、生物表面活性物质和抗生素等来抑制藻细胞生长或者杀死藻细胞[9,18,23]。Wang等[24]发现鼠李糖脂可降低藻细胞活性,改变藻体形状,长时间处理会导致藻类产生白色絮状沉淀[25]。这与本研究中Vm117-T6对赤潮异弯藻的作用相似。Vm117-T6的胞外溶藻物质具体为何,仍需进一步查证。
藻体形态显示,菌体感染会比胞外物感染造成藻细胞更大的损伤,因此,菌株的毒力除了胞外物质还应该包括其他毒力因子的参与。本研究中,Vm117-T6 在易感条件下差异最大的蛋白质主要为ABC转运蛋白、外膜蛋白以及少量RTX toxin。这些蛋白或多肽是许多致病菌的毒力因子,也是很多细菌溶藻的重要手段。目前已报道的溶藻蛋白一般为分子量约为10 ku的小分子分泌蛋白[26-28]。Banin等[28]发现一种使珊瑚褪色的施罗氏弧菌(V. shilonii),能分泌多肽降低共生虫黄藻细胞内的pH,从而阻碍藻细胞的光合作用。该细菌后被证实为地中海弧菌的同物异名[29]。郑宁宁[26]于丛毛单胞科(Comamondaceae)细菌WR11溶藻过程中发现,其外膜蛋白、ABC转运蛋白、Ⅱ型分泌系统蛋白表达显著高于突变株M20。海洋杀藻细菌(Hahellasp. KA22)分泌的灵菌红素可诱导活性氧(ROS)产生,通过特定的ABC转运蛋白刺激藻细胞,使其光合系统紊乱,达到杀死藻细胞的目的[30]。ABC转运蛋白作为重要的跨膜转运蛋白,以主动转运和单向转运的方式实现多种分子的跨膜运输[31]。

图版 Vm 117-T6胞外物和菌体感染对赤潮异湾藻细胞形态的影响1.胞外物感染0 min,2.胞外物感染40 min,3.胞外物感染80 min,4.胞外物感染120 min,5.菌体感染0 min,6.菌体感染40 min,7.菌体感染80 min,8.菌体感染120 min。Plate Vm 117-T6 extracellular and bacterial infection of H. akashiwo1. extracellular substance infection for 0 min, 2. extracellular substance infection for 40 min, 3. extracellular substance infection for 80 min, 4. extracellular substance infection for 120 min, 5. bacterial infection for 0 min, 6. bacterial infection for 40 min, 7. bacterial infection for 80 min, 8. bacterial infection 120 min.
TolC蛋白在很多革兰氏阴性菌中参与了毒力因子的分泌[32],通过调节病原菌的环境刺激耐受能力,增强其定殖活性,从而对病原菌进行致病力调控[33]。RTX toxin是一种重要的毒力因子,在众多致病革兰氏阴性菌的细胞活性中起重要作用[34]。吴寒华等[35]在新型海杆菌(Marinobacter)菌株YWL01的基因组中不仅检测到LuxR同系物、RTX毒素同系物,同时也检测到了编码外膜蛋白TolC的基因。在Vm117-T6的胞外蛋白中也检测到外膜蛋白TolC和RTX toxin等序列。同时,在Vm117-T6胞外物的蛋白组分中存在革兰氏阴性菌中介导细菌杀伤作用的Ⅵ型分泌系统[36]的结合蛋白以及与参与细菌定殖宿主的过程,与细菌运动性、黏附性、以及毒力相关的外膜蛋白OmpA[37]和鞭毛蛋白Flagellin OS。
综上,Vm117-T6是一株广谱的活性较强的溶藻细菌,其毒力作用物中含有水溶性强且热稳定的内毒素类物质,且转运蛋白、外膜蛋白以及与细菌定植相关的蛋白可能也在其毒力中发挥重要作用。推测多种溶藻机制参与该菌株的溶藻过程。该菌株的胞外分泌物中含有极性性强且热稳定的溶藻物质,可能是其感染性强[12-13]、传播速度快的重要原因。
自2000年以来,我国近海大规模赤潮不断出现,并呈现出多样化、小型化和有害化的演变趋势,对沿海地区社会经济发展和生态系统健康构成严重威胁[38]。有研究发现,在赤潮生消的过程中,细菌、病毒等海洋微生物的丰度会发生较大变化,从侧面验证了赤潮的消亡很大程度上与细菌有着密切的关系[2,39]。溶藻细菌作为水生生态系统中种群结构和功能的重要组分,对维持藻的生物量平衡具有非常重要的作用[16,40]。本研究中,Vm117-T6对赤潮异弯藻、东海原甲藻、叉边金藻和颗石藻等微藻均具有溶藻活性,也从另一个方面显示该菌株生态功能的多样性。是否能够将该菌株开发成抑制赤潮的安全性功能菌株值得进一步探究。
(作者声明本文无实际或潜在的利益冲突)
