草鱼TAB2与TAK1蛋白互作鉴定及其对两种抗菌肽基因表达的影响
2024-02-22杨文飞郭佳静赵文平李槿年
杨文飞, 郭佳静, 赵文平, 李槿年
(安徽农业大学动物科技学院,安徽 合肥 230036)
转化生长因子-β激活激酶1(transforming growth factor-β-activated kinase-1, TAK1)是一种丝氨酸/苏氨酸蛋白激酶[1]。TAK1结合蛋白家族(TAK1 binding proteins, TABs)包含TAB1、TAB2和TAB3等3个成员[2]。在哺乳动物中已探明TAK1与TAB2的相互作用(简称互作)能够激活NF-κB和MAPK信号通路,进而通过调控抗菌肽(antimicrobial peptides, AMPs)、细胞因子和趋化因子等免疫分子表达参与宿主抗菌免疫过程[3]。目前,草鱼(Ctenopharyngodon idella)[4-5]、点带石斑鱼(Epinephelus coioides)[6]和大黄鱼(Larimichthys crocea)[7-8]等多种硬骨鱼类的tak1和tabs基因均被克隆鉴定,且已有报道大黄鱼TAB2与TAK1存在互作关系[8]。生物信息学分析显示,草鱼TAB2(CiTAB2)和TAK1(CiTAK1) 与大黄鱼相应蛋白的氨基酸同源性分别为73.9%和92.8%,且具有相似的结构域,推测CiTAB2与CiTAK1可能存在互作关系,但仍需验证。
拟态弧菌(Vibrio mimicus) 是引起鱼类弧菌病的常见病原菌[9-11]。由于国内尚无商品化的渔用拟态弧菌疫苗,行业内主要使用抗生素类药物防治拟态弧菌所致的鱼类弧菌病。然而,抗生素类药物的频繁使用,不仅增加细菌产生耐药性,导致抗菌疗效甚微,而且造成水环境污染、药物残留及水产品安全等问题。因此,亟需探索有效防治鱼类弧菌病的新方法。
抗菌肽(antimicrobial peptides, AMPs)是生物体经诱导产生的具有广谱抗菌活性和免疫调节作用的一类小分子多肽[12]。因其具有广谱抗菌、作用机理独特、低耐药和低致敏等特点,AMPs被认为是最有前景的抗生素替代品。迄今为止,抗菌肽数据库(http://aps.unmc.edu/AP/)中收录的鱼源AMPs已达100余种。其中,β-防御素1(β-defensin1)和铁调素 (hepatic bactericidal proteins, hepcidin)是2种富含半胱氨酸,且具有广谱抗菌活性的抗菌肽[13-14]。
我们前期研究中用Cihepcidin和Ciβ-defensin-1的重组真核表达质粒转染鲤上皮瘤细胞系(epithelima popuasum cuprini, EPC)细胞,采用平板涂布法检测并发现转染后48 h的细胞培养上清液对拟态弧菌生长具有抑制作用。但是,CiTAB2-CiTAK1互作能否促进这2种抗菌肽表达仍不清楚。对此,本研究以CiTAB2与CiTAK1为研究对象,分析Citab2与Citak1对拟态弧菌感染的响应,在细胞水平鉴定这2种蛋白是否存在共定位与互作关系,检测CiTAB2-CiTAK1互作对抗菌肽基因Cihepcidin和Ciβ-defensin1表达的影响,以期为从蛋白互作调控抗菌肽表达的角度防治鱼类弧菌病提供新策略。
1 材料与方法
1.1 实验材料
实验用鱼健康草鱼[体重(100 ± 5)g]购自合肥市高新技术农业园。恒温(26 °C)循环水养殖系统暂养2周,每天定时光照12 h并按其体重的3%早、晚各投喂1次饲料。本研究获得了安徽农业大学实验动物管理和使用伦理委员会批准(2019036),实验过程中操作人员严格遵守安徽农业大学伦理规范,并按照安徽农业大学伦理委员会制定的规章制度执行。
实验菌株、细胞和载体拟态弧菌菌株04-14由本实验室从患病草鱼体内分离鉴定并保存[15];草鱼肾细胞系(Ctenopharyngodon idellakidney,CIK)和人胚肾上皮细胞系(human embryonic kidney 293T, HEK293T)均由本实验室保存;大肠杆菌DH5α(Escherichia coliDH5α)感受态细胞购于北京擎科新业生物技术有限公司;真核表达载体pEGFP-N1、pCMV-Myc和pmCherry-N1由中国农业科学院上海兽医研究所刘光清研究团队惠赠。
主要试剂胎牛血清(FBS)、MEM和DMEM细胞培养液均为美国Gibco公司产品;SanPrep柱式DNA胶回收试剂盒、TRIzol试剂、FastKing RT Kit (With gDNase)反转录试剂盒和SuperReal PreMix Plus荧光定量试剂盒购自天根生物科技(北京)有限公司;BCA蛋白浓度测定试剂盒、Lipofectamine 3000、RIPA裂解液和特超敏ECL化学发光试剂盒购自上海碧云天生物技术股份有限公司;Anti-Myc免疫磁珠购自上海翎因生物科技有限公司;Myc-Tag鼠源单克隆抗体、GFPTag鼠源单克隆抗体、pEGFP -Tag鼠源单克隆抗体购自Abways technology。
1.2 拟态弧菌感染后组织中Citab2与Citak1的表达模式分析
实验用草鱼随机分为感染组和对照组,经浓度为100 mg/L的MS-222麻醉后,分别腹腔注射0.2 mL浓度为1×109CFU/mL的拟态弧菌菌株04-14菌液和0.2 mL无菌生理盐水。分别于注射后24、48和72 h从各组采集3尾实验鱼的免疫相关组织(脾脏、头肾、肝脏、鳃和肠)。用TRIzol试剂提取组织总RNA,按照FastKing RT Kit (With gDNase)反转录试剂盒说明书合成cDNA作为实时荧光定量PCR(quantitative real-time PCR,qPCR)检测用模板。
根据Citab2与Citak1序列设计特异性引物,选择β-actin作为参考基因 (表1),qPCR检测拟态弧菌感染后上述靶基因在免疫相关组织中的相对表达量。qPCR反应体系∶2×SGExceel UltralSYBR Mixture 10 μL,cDNA模板100 ng,上下游引物各0.5 μL,RNase free ddH2O补足至20 μL。反应条件∶95 °C 预变性3 min、95 °C 20 s,58 °C 20 s,72 °C 25 s,共计40个循环。每个样品3个技术重复,使用2−△△CT法[16]计算目的基因mRNA相对表达水平,分析感染后其表达模式。

表1 本研究所用引物的序列信息Tab. 1 Primers and their sequences used in this study
1.3 重组真核表达质粒的构建
为了在细胞水平探究CiTAB2与CiTAK1的共定位、互作及其对抗菌肽基因表达的影响,需首先构建4种重组真核表达质粒(pmCherry-N1-Citab2、pCMV-Myc-Citab2、pEGFP-N1-Citab2和pEGFP-N1-Citak1)。构建步骤∶根据真核表达载体、Citab2和Citak1的序列特征设计3对含有酶切位点的特异性引物(表1),以草鱼头肾组织cDNA为模板,PCR扩增Citab2和Citak1。将回收纯化的PCR产物与空载体依次进行双酶切、酶连及转化DH5α感受态细胞。取转化后的感受态细胞涂布于含100 μg/mL 氨苄西林(Amp)的LB培养基,37 °C培养至长出菌落,随机挑取3个菌落进行扩大培养后,抽提质粒进行PCR和双酶切鉴定,以鉴定重组真核表达质粒是否构建成功。
1.4 CiTAB2与CiTAK1的细胞共定位分析
将生长状态良好且密度为2×105个/孔的HEK 293T和CIK细胞分别接种至24孔细胞培养板,用DMEM或MEM完全培养液于37 °C (HEK293T细胞)或28 °C(CIK细胞)、5% CO2条件下培养至50%汇合度后,弃去孔内培养液,更换为不含血清与双抗的细胞培养液,使用Lipofectamine 3000脂质体转染试剂将重组真核表达质粒pEGFP-N1-Citak1与pmCherry-N1-Citab2共同转染至HEK293T和CIK细胞中。转染体系∶1 μg质粒(1∶1,质量比)、1.5 μL转染试剂和50 μL不含血清与双抗的细胞培养液。转染后48 h,弃去细胞孔内培养液,磷酸盐缓冲溶液(PBS)洗涤3次,用4% 多聚甲醛室温固定细胞15 min,PBS洗涤3次,再用DAPI染核12 min,PBS洗涤3次,荧光倒置显微镜下观察CiTAB2与CiTAK1在细胞中共定位情况。
1.5 蛋白质免疫共沉淀实验
利用免疫共沉淀实验(Co-Immunoprecipitation, Co-IP)与Western blot (WB)鉴定CiTAB2与CiTAK1在HEK293T细胞中是否存在互作。将HEK293T细胞接种6孔细胞培养板,2×106个/孔,用DMEM完全培养液于37 °C、5 % CO2条件下培养12 h。待细胞汇合度达到85%时,用Lipofectamine 3000将重组真核表达质粒pCMV-Myc-Citab2与pEGFP-N1-Citak1共同转染HEK293T细胞中,同时设置pCMV-Myc-Citab2与pEGFPN1以及pEGFP-N1-Citak1与pCMV-Myc共转染对照组。转染体系∶2 μg质粒、5 μL转染试剂和250 μL不含血清与双抗的MEM培养液。转染后48 h,弃去孔内培养液,用预冷的PBS洗涤3次,再加入500 μL含有1‰苯甲基磺酰氟的RIPA裂解液,于冰上裂解细胞10 min, 4 °C,10000 r/min离心5 min,收集上清液。其中一部分细胞裂解上清液保存至−80 °C用作阳性对照(Input组),另一部分用于下一步Co-IP。
吸取20 μL Anti-Myc免疫磁珠至EP管,用预冷的TBST在磁力架上洗涤3次。将200 μL各共转组细胞裂解上清液加入洗涤后的免疫磁珠中,置于翻转混合仪上,4 °C条件下混合12 h,再用TBST洗涤3次,收集Co-IP后的蛋白复合物样品(IP组)。Input组和IP组蛋白样品经12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)后,转移至PVDF膜,分别以1∶1000稀释的Myc-Tag和GFP-Tag鼠源单克隆抗体为一抗,1∶10000稀释的HRP标记羊抗鼠IgG为二抗进行WB检测,特超敏ECL试剂盒显影。
1.6 CiTAB2-CiTAK1互作对抗菌肽Cihepcidin和Ciβ-defensin1mRNA表达的影响
CIK细胞培养与转染体系同“CiTAB2与CiTAK1蛋白的细胞共定位分析”。将pEGFP-N1-Citak1与pEGFP-N1-Citab2分别单转和共转CIK细胞,同时做转染空载体pEGFP-N1对照。分别于转染后24、36和48 h收集细胞样品,TRIzol法提取细胞总RNA,并反转录为成cDNA,使用Cihepcidin和Ciβ-defensin1特异性引物(表1),qPCR检测2种抗菌肽基因在CIK细胞中的mRNA表达水平,qPCR反应体系与条件同“拟态弧菌感染后组织中Citab2与Citak1的表达模式分析”。
1.7 数据分析
使用SPSS 18.0软件和2−△△CT方法计算拟态弧菌感染后草鱼免疫相关组织中Citab2与Citak1,以及共同转染Citab2与Citak1后CIK细胞中Cihepcidin和Ciβ-defensin1的mRNA相对表达量,并进单因素方差分析及多重比较,0.01 <P< 0.05表示差异显著,P< 0.01表示差异极显著。
2 结果
2.1 拟态弧菌感染后组织中Citab2与Citak1的表达模式
拟态弧菌感染后草鱼免疫相关组织中的Citab2与Citak1时空表达模式结果显示,感染后24 h脾脏与头肾中Citab2mRNA表达水平即达到峰值,分别为对照组的2.816倍和15.4倍(P<0.01),随后2个检测时间点略有下降,但仍显著高于未感染对照组(P< 0.05)。与未感染对照组相比,肝脏组织中Citab2 mRNA表达水平在感染后24 h无显著变化(P> 0.05),随后2个检测时间点则显著上调(P< 0.01);肠和鳃组织中Citab2 mRNA表达水平分别在感染后24和48 h显著上调(P<0.01),而在其余检测时间点无显著变化(P> 0.05)。各免疫相关组织中Citak1mRNA表达模式是一致的,均表现为在感染后24 h显著上调(P< 0.01),随后两个检测时间点则显著下调(P< 0.01)(图1)。实验表明CiTAB2和CiTAK1具有响应拟态弧菌感染并诱导机体免疫应答的潜能。
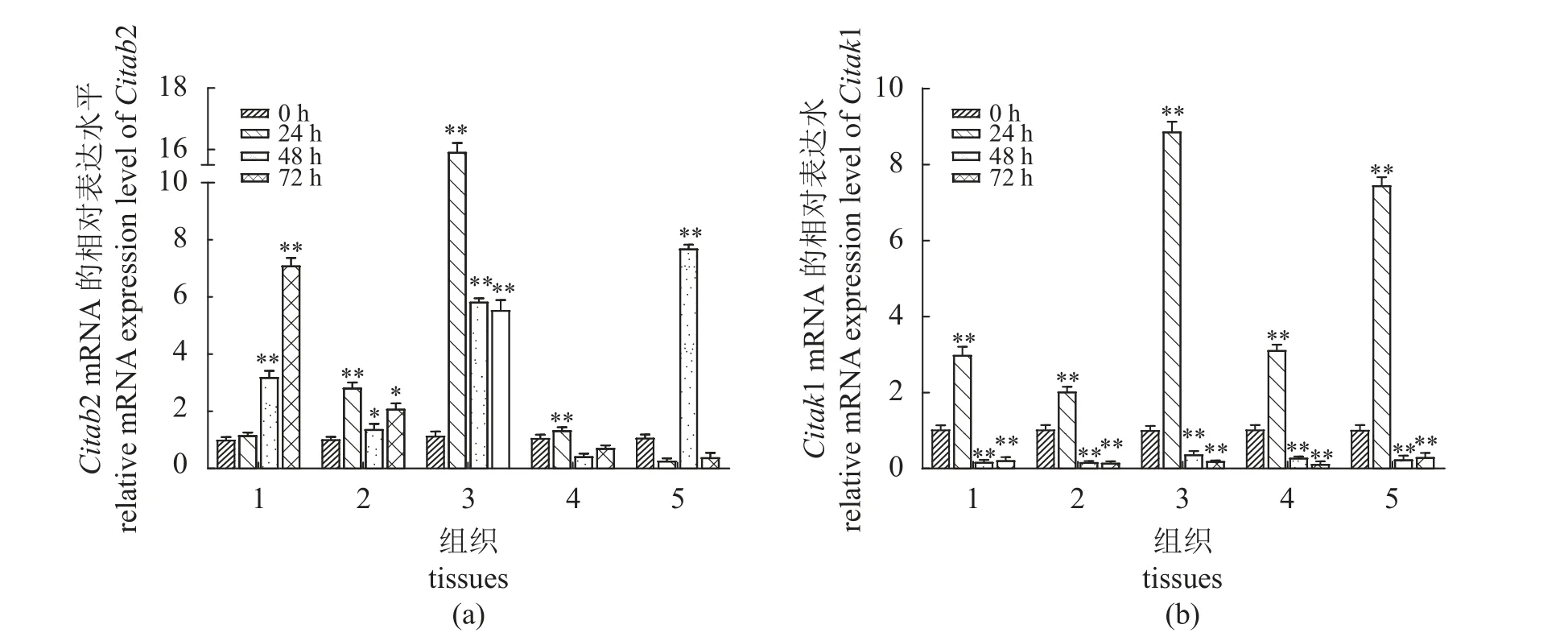
图1 拟态弧菌感染后不同时间Citab2 (a)和Citak1(b)在草鱼免疫相关组织中的相对表达水平变化1. 肝脏,2. 脾脏,3. 头肾,4. 肠,5. 鳃;*表示差异显著(P<0.05),**表示差异极显著 (P<0.01);误差线表示标准误差 (n=3)。Fig. 1 The fold changes of Citab2 (a) and Citak1 (b) in immune-related tissues of C. idella at different time after V. mimicus infection1. liver, 2. spleen, 3. head kidney, 4. intestine, 5. gill; single asterisks and double asterisks denote significant differences (P<0.05) and extremely significant differences (P<0.01); respectively, error bar is shown as the standard error (n=3).
2.2 4种重组真核表达质粒的PCR与双酶切验证结果
采用酶切酶连方法构建4种重组真核表达质粒pEGFP-N1-Citab2、pEGFP-N1-Citak1、pmCherry-N1-Citab2和pCMV-Myc-Citab2,并进行质粒PCR和双酶切验证。结果显示,以质粒DNA为模板扩增到目的基因Citab2(图2,泳道2、6和10,2178 bp)或Citak1(图2泳道14,1626 bp);双酶切反应后均获得2条DNA条带,大小分别与空载体(pEGFP-N1/4715 bp、pCMV-Myc/3770 bp及pmCherry-N1/4707 bp)和目的基因(Citab2/2178 bp 或Citak1/1626 bp)大小一致(图2泳道4、8、13和16),说明上述4种重组真核表达质粒构建成功。

图2 重组质粒pEGFP-N1-Citab2(a), pCMV-Myc-Citab2(b), pmCherry-N1-Citab2(c)和pEGFP-N1-Citak1(d)的PCR与双酶切验证M. 标准物质10000; 1、5和9. ddH2O阴性对照;2. pEGFP-N1-Citab2的PCR产物;3. pEGFP-N1-Citab2;4. pEGFP-N1-Citab2的双酶切产物;6. pCMV-Myc-Citab2的PCR产物;7. pCMV-Myc-Citab2;8. pCMV-Myc-Citab2的双酶切产物; 10. pmCherry-N1-Citab2的PCR产物;11. pmCherry-N1的双酶切;12. pmCherry-N1-Citab2;13. pm-Cherry-N1-Citab2的双酶切; 14. pEGFP-N1-Citak1的PCR产物;15. pEGFP-N1-Citak1;16. pEGFP-N1-Citak1的双酶切。Fig. 2 PCR and double enzyme digestion verification of recombinant plasmid pEGFP-N1-Citab2 (a), pCMV-Myc-Citab2 (b), pmCherry-N1-Citab2 (c) and pEGFP-C1-Citak1 (d)M. DL 10000; 1, 5and 9. ddH2O negative control; 2. PCR product of pEGFP-N1-Citab2; 3. pEGFP-N1-Citab2; 4. double enzyme digestion of pEGFPN1-Citab2; 6. PCR product of pCMV-Myc-Citab2; 7. pCMV-Myc-Citab2; 8. double enzyme digestion of pCMV-Myc-Citab; 10. PCR product of pmCherry-N1-Citab2; 11. double enzyme digestion of pmCherry-N1; 12. pmCherry-N1-Citab2; 13. double enzyme digestion of pm-Cherry-N1-Citab2; 14.PCR product of pEGFP-N1-Citak1; 15. pEGFP-N1-Citak1; 16. double enzyme digestion of pEGFP-N1-Citak1.
2.3 CiTAB2与CiTAK1在细胞中的共定位
将重组真核表达质粒pmCherry-N1-Citab2和pEGEP-N1-Citak1分别共同转染HEK293T和CIK细胞。共转48 h后,倒置荧光显微镜下观察到DAPI染色后的细胞核呈蓝色,融合蛋白EGFPN1-Citak1和mCherry-N1-Citab2在2种细胞的胞质中均有表达,分别发出绿色和红色荧光,使得融合图中阳性细胞胞质中发出黄色荧光,(图版)。结果显示,CiTAB2与CiTAK1在HEK293T和CIK细胞的胞质中存在共定位,同时推测二者在细胞内可能有相互作用。

图版 CiTAK1与CiTAB2在HEK293T和CIK细胞中的共定位1~3. HEK293T细胞,4~6. CIK细胞;3和6. 分别为1和2及4和5的合并图,箭头指示CiTAB2与CiTAK1共定位在胞质中(黄色)。Plate Co-localization of CiTAK1 and CiTAB2 in HEK293T and CIK cells1-3. HEK293T cells, 4-6 CIK cells; 3,6. merged image of 1 and 2, as well as 4 and 5, arrows indicate the co-localization of CiTAK1 and CiTAB2 in the cytoplasm (yellow).
2.4 CiTAB2与CiTAK1互作的鉴定结果
将真核表达质粒pCMV-Myc-Citab2与pEGFP-N1-Citak1、pCMV-Myc-Citab2与pEGFP-N1以及pEGFP-N1-Citak1与pCMV-Myc分别共转染293T细胞。转染后48 h,以带有Anti-Myc抗体的免疫磁珠与各共转组细胞裂解液样品进行Co-IP,再分别用抗Myc和EGFP标签抗体对蛋白复合物进行WB检测。结果显示,用Myc抗体进行的WB检测结果中,在Input组共转pCMV-Myc-Citab2与pEGFP-N1-Citak1以及pCMV-Myc-Citab2与pEGFP-N1的细胞裂解液样品中均检测到Myc-CiTAB2蛋白条带(85.6 ku),说明共转后pCMV-Myc-Citab2在细胞中得到表达;在IP组共转pCMV-Myc-Citab2与pEGFP-C1-Citak1以及pCMV-Myc-Citab2与pEGFP-N1的蛋白复合物中也均检测到Myc-Citab2蛋白条带,表明带Myc标签的CiTAB2蛋白被成功捕获。由于Myc标签蛋白本身很小(约3.0 ku),共转pCMV-Myc与pEGFP-C1-Citak1的蛋白复合物中未检测到该标签蛋白条带 (图3)。

图3 CiTAB2 与CiTAK1在HEK293T细胞内的相互作用Fig. 3 Protein interaction between CiTAB2 and CiTAK1 in HEK293T cells
用EGFP抗体进行的WB检测结果中,在Input组共转pEGFP-N1-Citak1与pCMV-Myc-Citab2以及pEGFP-N1-Citak1与pCMV-Myc的细胞裂解液样品中均检测到EGFP-N1-Citak1蛋白条带(89.5 ku),共转pCMV-Myc-Citab2与pEGFP-N1的细胞裂解液中检测到大小约为26.9 ku的EGFP标签蛋白条带,说明带有EGFP标签的CiTAK1表达载体表达正常。在IP组,仅从共转pEGFPN1-Citak1与pCMV-Myc-Citab2的IP产物中检测到CiTAK1融合蛋白条带(89.5 ku),从而证明在细胞内CiTAB2与CiTAK1能够相互作用 (图3)。
2.5 CiTAB2-CiTAK1互作对Cihepcidin与Ciβ-defensin1 mRNA表达的影响
采用qPCR方法检测共同过表达CiTAB2与CiTAK1对Cihepcidin与Ciβ-defensin1 mRNA表达水平的影响。结果显示,相对于空载体转染组,共转组中2种抗菌肽基因mRNA水平在各检测时间点均显著上调(P< 0.01)(图4);2个单转组中CihepcidinmRNA水平在转染后24 h均无显著变化(P> 0.05),36 h均显著上调(P< 0.01),48 h仍显著上调(单转CiTAK1,P< 0.01)或回降到对照水平(单转CiTAB2,P> 0.05) (图4-a);2个单转组中Ciβ-defensin1 mRNA水平在转染后24 h显著下调(单转CiTAK1,P< 0.01)或无显著变化(单转CiTAB2,P> 0.05),随后均显著上调(P< 0.01)(图4-b)。进一步分析发现,共转组中2种抗菌肽基因mRNA表达水平在各检测时间点均显著高于2个单转组(P< 0.05或0.01)。结果表明,CiTAB2-CiTAK1互作能促进这2种抗菌肽基因的表达。
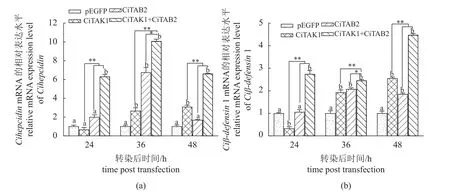
图4 CiTAB2-CiTAK1互作对两种抗菌肽基因mRNA表达的影响(a) pEGFP-C1-Ciatk1或/与pEGFP-C1-Citab2单转或共转后不同时间点CIK细胞中Cihepcidin mRNA的相对表达量;(b) pEGFP-C1-Citak1或/与pEGFP-C1-Citab2单转或共转CIK细胞后不同时间点Ciβ-defensin1 mRNA的相对表达量; 不同小写字母表示同一时间点下重组质粒转染组与空质粒转染组间的显著差异(P<0.05或0.01),星号表示同一时间点下共转组与单转组间的显著(*P<0.05)或极显著差异 (**P<0.01),误差线表示标准误差 (n=3)。Fig. 4 Effects of CiTAB2-CiTAK1 interaction on the mRNA expression of two antimicrobial peptides genes(a) relative mRNA expression of Cihepcidin at different time points in the CIK cells single-transfected or co-transfected with plasmids pEGFP-C1-Citak1or/and pEGFP-C1-Citab2; (b) relative mRNA expression of Ciβ-defensin1 at different time points in the CIK cells single-transfected or co-transfected with plasmids pEGFP-C1-Citak1or/and pEGFP-C1-Citab2. Different lowercase letters indicate significant differences between recombinant plasmid-transfected and empty plasmid-transfected groups at the same test time point (P < 0.05 or 0.01). Single asterisks and double asterisks denote significant differences (P<0.05) and extremely significant differences (P<0.01) between single-transfected and co-transfected groups at the same test time point,respectively. Error bar is shown as the standard error (n=3).
3 讨论
信使RNA(mRNA)是联系DNA与蛋白质之间的桥梁,特定基因的mRNA表达量能够反映该基因的表达丰度。因此,检测病原微生物感染后体内某种基因的mRNA水平变化,可作为判断该基因是否参与感染或抗感染过程的重要指标。Zhao等[4-5]用多子小瓜虫(Ichthyophthirius multifiliis)人工感染草鱼,qPCR检测并发现腮、脾脏、头肾和皮肤中CiTAB2与CiTAK1基因均上调,但其时空表达模式并不完全一致。本研究也得到类似结果,拟态弧菌感染能显著提高Citab2与Citak1在草鱼免疫相关组织中的mRNA表达水平,其中Citab2在各检测组织中的时空表达模式不同,Citak1在各检测组织中均呈现为感染后24 h显著上调,随后显著下调。此外, 拟态弧菌感染后抗菌肽hepcidin和β-defensin1的mRNA表达水平在肝脏、头肾和鳃等组织中也显著上调。上述结果表明,CiTAB2和CiTAK1具有响应拟态弧菌感染并诱导机体免疫应答的潜能,同时也启发我们进一步探究CiTAB2与CiTAK1是否有相互作用及其互作对抗菌肽表达的影响。
蛋白质之间的相互作用(简称蛋白互作)是指2种或2种以上的蛋白质分子通过非共价键形成蛋白质复合体的过程[19]。研究蛋白互作的技术或方法较多,其中免疫共沉淀(Co-IP)是利用抗原与抗体特异性结合原理鉴定活细胞内蛋白互作的理想方法[20]。Wang 等[8]使用protein A/G磁珠通过免疫共沉淀方法证实大黄鱼(Larimichthys crocea) TAK1与TAB2可以相互作用,并上调NF-κB表达。本实验以带有Anti-Myc抗体的免疫磁珠和3组共转染样品(pCMV-Myc-Citab2与pEGFP-N1-Citak1、pCMV-Myc-Citab2与pEGFP-N1、pEGFP-N1-Citak1与pCMV-Myc)的细胞裂解液孵育后分别进行Co-IP,所得的蛋白质复合物再用抗Myc和EGFP标签抗体进行WB鉴定,结果表明CiTAB2与CiTAK1在HEK293T细胞内存在互作。同时,CiTAB2与CiTAK1在HEK293T与CIK细胞中均共定位在胞质部位,进一步佐证了Co-IP的实验结果。人胚肾上皮细胞系HEK293T具有生长繁殖速度快、外源基因转染效率高及蛋白表达水平高等优势[21],而外源基因在鱼类细胞系CIK、EPC和FHM中的转染效率均很低、目的蛋白表达量少,导致免疫共沉淀下来的互作蛋白很少,难以检测出来。因此,本研究中选择HEK293T作为细胞模型在细胞水平鉴定草鱼TAB2与TAK1的互作关系。
蛋白互作参与细胞内大部分生化反应进程,在细胞信号转导、基因表达调控及细胞迁移等方面发挥着重要作用[22]。为了探讨CiTAB2-CiTAK1互作对2种抗菌肽基因Cihepcidin与Ciβ-defensin1表达的影响,研究中将过表达质粒pEGFP-N1-Citak1与pEGFP-N1-Citab2单转或共转CIK细胞,检测转染后不同时间内源性Cihepcidin与Ciβdefensin1 mRNA表达情况。结果显示,相对于空载体转染组与单转组,共转组中2种抗菌肽基因mRNA表达水平在各检测时间点均显著上调,表明CiTAB2-CiTAK1互作能够促进抗菌肽Cihepcidin和Ciβ-defensin1的转录表达。研究中同时发现单转pEGFP-N1-Citak1或pEGFP-N1-Citab2后36 h也能显著上调上述2种抗菌肽基因的mRNA表达水平,其原因可能是过表达的CiTAK1或CiTAB2与内源性CiTAB2或CiTAK1发生了相互作用,进而调控抗菌肽表达。然而CiTAB2-CiTAK1互作调控抗菌肽表达的细胞信号通路机制仍需深入研究。
综上所述,本研究证实草鱼TAB2与TAK1存在细胞内共定位与相互作用关系,且两者互作能够促进抗拟态弧菌抗菌肽Cihepcidin和Ciβdefensin1的转录表达。研究结果从蛋白互作调控抗菌肽表达的角度为防治鱼类弧菌病提供新策略。
(作者声明本文无实际或潜在的利益冲突)
