不同地区桃树根际土壤微生物群落结构及多样性分析
2024-02-21徐海忠薛彦华丁洪发戚恒瑞李天昊毛伟健程凡升
徐海忠,薛彦华,丁洪发,戚恒瑞,李天昊,毛伟健*,程凡升*
(1.青岛农业大学食品科学与工程学院,山东 青岛 266109;2.山东天同食品有限公司,山东 临沂 276000)
人类活动引起的全球变化包括大气二氧化碳浓度升高、气候变暖、降水变化、干旱和大气氮沉降增加,是全球范围内生物多样性丧失的主要因素[1]。土壤微生物在维持地下生态系统的功能方面发挥着至关重要的作用[2-4]。相较于传统土壤物理与化学指标,土壤微生物指标优势在于对土壤环境变化具有较高的敏感性[5],可以对土壤健康进行综合评价,是评价土壤健康的理想指示生物[6]。土壤的理化性质可以影响土壤微生物群落的特征[7]。鲍佳书等[8]运用高通量测序分析了3 个不同品种甘薯根际土壤细菌的多样性,发现土壤含水率、电导率、总氮与Chao1、ACE、Shannon 和Sobs 指数呈负相关,说明含水率、电导率、总氮影响土壤微生物群落从而影响甘薯的生长发育。邢佳丽等[9]研究发现,土壤pH 值是影响细菌群落最大的环境因子。而关于土壤理化性质与桃树根际微生物群落的关系研究较少。
桃,蔷薇科杏属,是我国重要的落叶果树,营养价值高,风味宜人,深受消费者喜爱。根系作为吸收水分、养分和氧气的重要器官,是植物生长的基础。根系管理是果树栽培管理的核心,合理的根系管理是实现优质高产的关键[10]。临沂市是农业大市,气候条件适宜桃树生产,是全国果品重点产区之一。据统计,临沂市桃产量自2000 年开始一直为全国地级市第一位,2009 年被中国果品流通协会授予中国桃业第一市的称号。其中蒙阴、沂水、费县为桃生产大县[11]。目前,有关临沂地区桃树根际土壤微生物多样性的研究尚无报道。为促进桃树的生长发育和桃果实的品质提升,本试验对临沂不同地区桃树根际细菌进行了高通量测序,了解不同桃树根际土壤细菌的群落结构、物种组成的差异,为临沂桃产业发展提供依据。
1 材料与方法
1.1 试验地概况
试验地(118.35°E、35.05°N)位于山东省临沂市沂水县、汤头镇、李官镇,气候为暖温带季风大陆型气候,四季分明,雨量充沛,气侯温和,全年平均气温14.1 ℃,最高气温36.5 ℃,最低气温-11.1 ℃,年降水量849 mm,全年无霜期200 d 以上。
1.2 试验设计
1 月10 日进行土壤样品采集,采用5 点取样法,每个地区设置3 个采样点,去除地表0~5 cm 的土壤,取树根地表附近的土壤,剔除碎石和植物残根等杂物,3 个采样点土壤混匀后运用四分法取样取500 g 土装入无菌袋,带回实验室。土壤样本去除根系、碎叶和石块后,过2 mm的筛子,分成两部分。一部分土壤样品保存在-80 ℃进行DNA 提取,用于分析土壤微生物群落多样性;另一部分土壤风干,进行理化分析。1、2 和3 号土壤样本编号分别为LG(李官)、TT(汤头)和YS(沂水)。
1.3 土壤理化指标测定
土壤pH 采用pH 计测定,土壤水分含量采用重量分析法测定,电导率采用电导率仪测定[12],速效磷含量采用NaHCO3萃取比色法测定[13],速效钾含量采用原子吸收分光光度计法测定[14]。
1.4 土壤微生物群落测定
采用土壤DNA 试剂盒提取土壤细菌总DNA。利用1%琼脂糖凝胶电泳检测提取的总DNA 质量,然后将DNA 送至北京百迈客生物科技有限公司进行16S rRNA基因测序。
1.5 数据分析
使用SPSS 26.0 对土壤理化性质所测结果进行分析。参考Bokulich 等[15]的方法使用Trimmomatic 0.33、Cutadapt 1.9.1、USEARCH 10、UCHIME 8.1、USEARCH 10.0、QIIME 等软件进行土壤微生物群落分析。参考Desantis 等[16]对比数据库Silva.138、微生物基因组数据库(IMG,Integrated Microbial Genomes)计算Alpha 多样性指数(ACE、Chao1、Shannon 和Simpson),对门和属水平的群落结构分析,以确定各样品群落组成及预测整个群落的COG 通路情况。
2 结果与分析
2.1 测序数据初步分析
通过对9 份取自临沂汤头、李官、沂水三个地区桃园桃树根土壤样品微生物16S rRNA 基因高通量测序分析,共得到693 380 条有效序列,经过滤、去除嵌合体后,得到425 267 条优质序列。其中样品LG-1 号样品获得最多的序列为58 546 条,LG-3 号样品获得序列最少为39 973 条。统计各样品中相应长度范围内的序列数,发现序列长度主要集中在400~450 bp。
如图1 所示,在维恩图中,每种颜色代表不同的组,重叠段的编号表示组间共享的OTU 数量。

图1 土壤样品特征Venn 图Fig.1 Venn diagram of soil sample characteristics
测序结果显示,LG 组包含1 049 个OTU,TT 组包含1 666 个OTU,YS 组包含1 460 个OTU。三组共享165 个OTU;LG 和TT 两组共享417 个OTU,LG 和YS 两组共享267 个OTU,TT 和YS 两组共享367 个OTU;LG 组独有890 个OTU,TT 组独有1 047 个OTU,YS 组独有991个OTU。
2.2 Alpha 多样性分析
Alpha 多样性由Chao1 与Shannon 指数共同表示,箱线图可以直观地反映组间物种多样性差异是否显著。在OTU 水平上对细菌群落进行分类并计算Alpha 多样性,根据T 检验计算细菌群落组间差异性,结果如图2所示。两指数均证明,TT 组土壤细菌群落Alpha 多样性显著高于LG 组和YS 组(P<0.01)。数值方面,TT 组Chao1 指数集中于800~970,Shannon 指数集中于9.0~9.4;LG 组Chao1 指数集中于620~740,Shannon 指数集中于8.5 ~8.7。YS 组Chao1 指数集中于670 ~760,Shannon 指数集中于8.9~9。物种丰富度(Chao1)、均匀度(Shannon 指数)和观察到的物种多样性分析表明,三个地区的土壤样品细菌种群分布大致相同,且丰富度上存在差异。
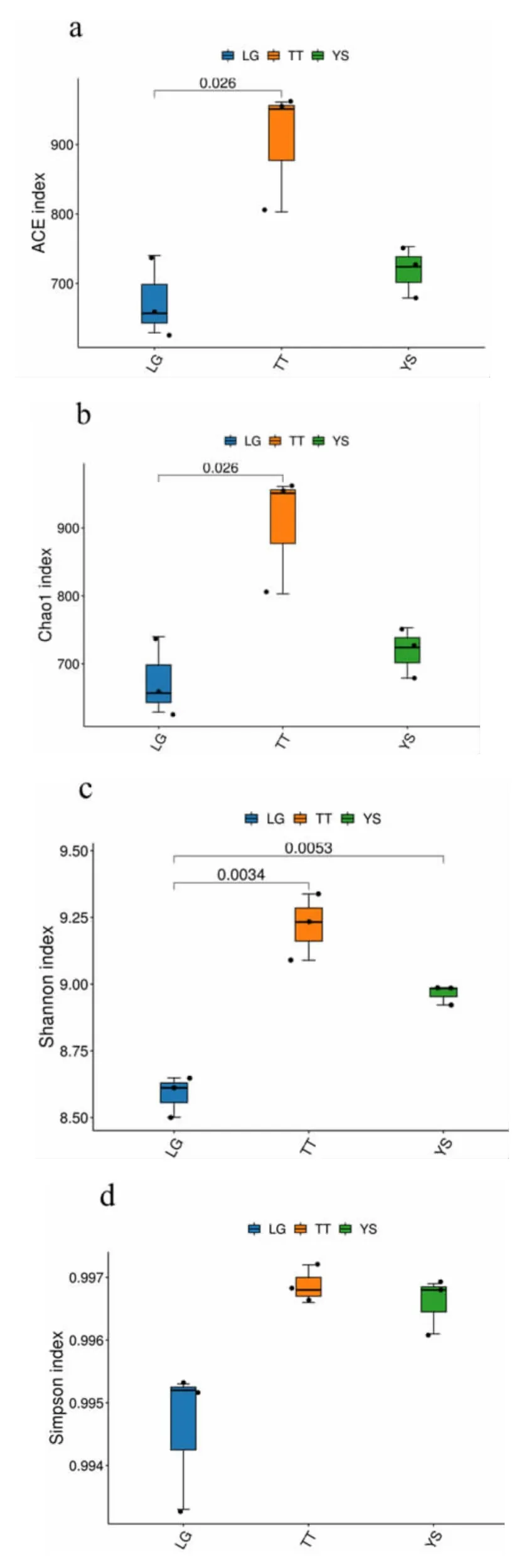
图2 Alpha 多样性指数组间差异箱线图Fig.2 Boxplot of Alpha diversity index differences between groups
在Alpha 多样性指数组间差异分析中,香农指数是评价样品中微生物多样性的指标之一。如图3 所示,土壤样品的细菌香农指数趋于平稳,表明增加土壤细菌的测序量,其样品细菌的多样性已经不再变化。稀疏曲线趋于达到饱和平台,表明样本的微生物群足够大,可以在97%的相似性阈值下估计表型丰富度和微生物群落多样性。如图4 显示,TT 的土样比另外两组土样具有更陡峭的斜率,说明TT 的土样具有更大的遗传丰富度。
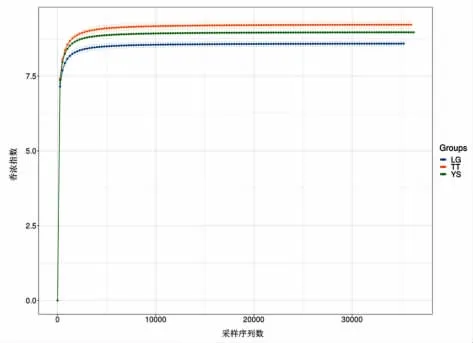
图3 土壤样品香农指数曲线Fig.3 Shannon index curve of soil sample
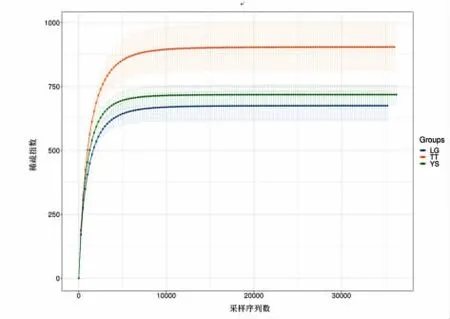
图4 土壤样品稀释性曲线Fig.4 Dilution curve of soil sample
物种相对丰度累积曲线图反映样本数量与注释到的物种数量之间的关系。如图5 所示,在一定范围内,随着样本量的加大,红色累积曲线急剧上升,表示群落中有大量新物种被发现,最后曲线趋于平缓,此时土壤中的物种并不会随样本量的增加而显著增多;绿色共有量曲线表现为下降,表示样本中新发现的共有物种在逐渐减少,当曲线趋于平缓,表示土壤中的共有物种趋于饱和。
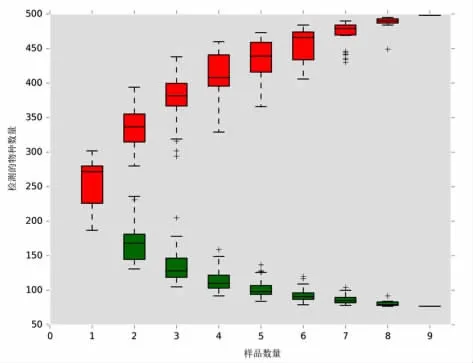
图5 土壤样品等级丰度曲线Fig.5 Grade abundance curve of soil samples
2.3 土壤细菌群落结构分析
根据土壤微生物基因组DNA 序列分类学分析结果,三个地区共包含4 175 个OTU。物种分类显示细菌种类隶属于25 门54 纲145 目272 科497 属577 种(图6)。
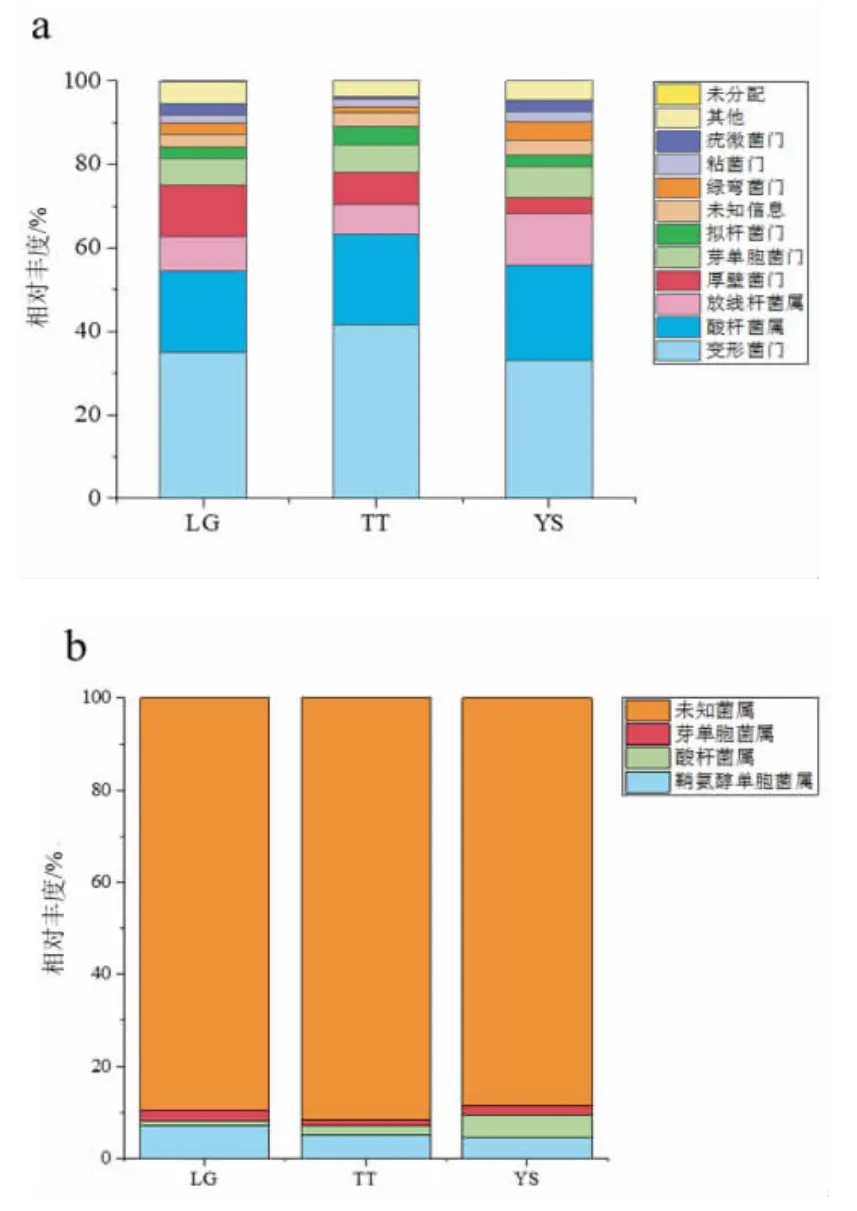
图6 土壤样品物种分布图Fig.6 Species distribution map of soil samples
在门水平上,将土壤细菌测得序列鉴定为疣微菌门(Verrucomicrobia)、粘菌门(Myxcoccota)、绿弯菌门(Chloroflexi)、拟杆菌(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)、厚壁菌门(Firmicutes)、线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、变形菌门(Proteobateria)等。其余为相对丰度小于1%的微生物群落。三个不同地区样本都以变形菌门为主,LG、TT、YS 样本平均相对丰度为35.04%、41.46%和33.12%。样本门水平细菌集中分布于变形菌门、线菌门与酸杆菌门中,这3个门平均相对丰度之和占总数的60%以上。从不同地区看,主要优势菌群基本保持稳定,但相对丰度具有一定差异。
在属水平上,鞘氨醇单胞菌属(Sphingomonas)、芽单胞菌属(Gemmatimonas)与酸杆菌属(RB41)是桃根际土壤微生物中最主要的属。在LG、TT、YS 三个土壤样品中含量分别为10.47%、8.31%和11.55%。遗憾的是,基于数据度silva.138 的注释结果中,本研究中LG、TT 与YS 三组样本中分别有78.93%、79.86%与81.74%的样本未分类到属。然而,3 组样品中前3 个属的微生物组成相同,各属的丰富度存在差异。
2.4 Beta 多样性分析
Beta 多样性分析用于分析时间、空间尺度上的物种组成变化。从属水平对各样品进行主成分分析,结果如图7 所示,PC1 的贡献率为49.69%,PC2 的贡献率为30.58%。LG 组、TT 组和YS 组在PCA 图上明显分开,表明不同地区的桃根际土壤微生物群落结构存在明显差异,尤其是TT 地区微生物多样性高于LG 和YS 地区。LG 组组内距离较大,说明这两个样本的组内差异较大,原因是该地区土壤环境较复杂,菌属分布不均匀所致。在同一地区样本中,细菌群落表现出聚集性。而不同地区细菌群落结构差异显著。
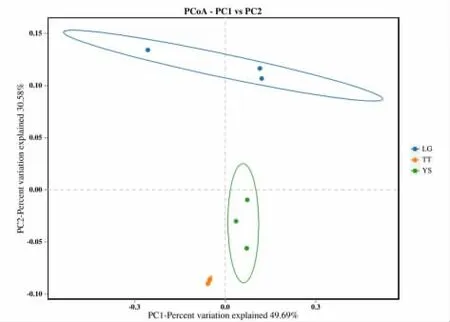
图7 不同地区土壤微生物主成分分析结果Fig.7 Principal component analysis results of soil microorganisms in different regions
2.5 土壤细菌功能基因预测分析
基于COG 数据库,对临沂不同地区土壤中获得的非冗余基因集进行了基因功能预测。COG 功能分类统计中(图8)可以看出样本中土壤细菌功能基因主要集中于新陈代谢、遗传信息、细胞信号传导等方面。LG 组中参与氨基酸转运代谢、碳水化合物转运代谢、转录、无机离子转运代谢等功能基因相对丰度显著高于YS 组。而YS 组中能量生成和转换细胞周期控制、细胞分裂和染色体分裂、细胞壁/膜/被膜的生物合成相关功能基因相对丰度显著低于LG 组。相较于TT 组,LG 和YS 组的遗传信息功能基因的表达更为显著,总体而言三个地区的土壤细菌功能基因的表达上大致相同,在不同基因相对丰富度上有所差异。
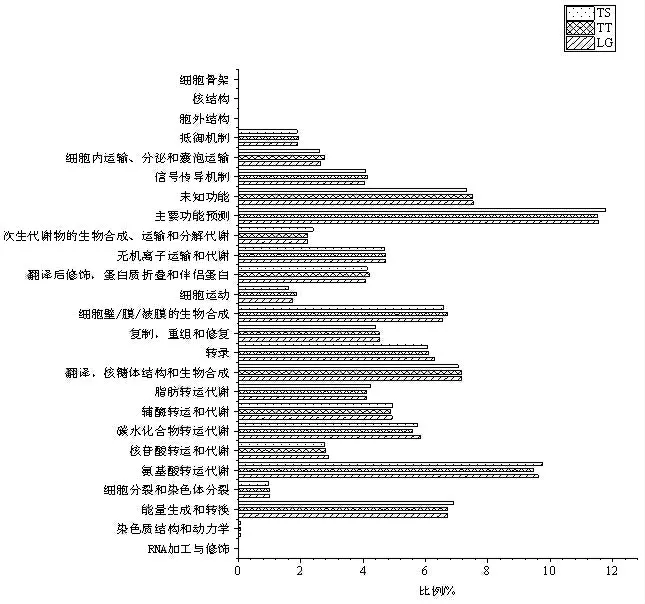
图8 COG 功能分类统计图Fig.8 COG functional classification statistical chart
2.6 土壤理化性质和微生物群落的关系分析
研究证明微生物群落构建过程与土壤理化性质存在密切关系[17]。由表1 可知,土壤电导率与Chao1、ACE、Shannon 指数呈正相关,而与Simposon 指数呈负相关,速效磷、有机质与Chao1、ACE、Shannon、Simposon 指数呈负相关,pH 和速效钾与Chao1、ACE、Shannon、Simposon 指数呈正相关,土壤pH 和速效钾与Chao1 和ACE 指数显著相关。

表1 土壤细菌多样性与其理化性质之间的相关性Table 1 The correlations between soil community diversity indexes and soil chemical factors
3 讨论
根系是植物和土壤之间的纽带。健康的土壤环境可以促进根系的发育,进而促进植物的生长[18]。土壤细菌的多样性和组成因土壤管理历史而异[19]。不同桃树根际土壤的细菌群落的测序结果差异明显,其中李官地区1 号样品获得最多的序列为58 546 条,三个地区样品获得的序列长度主要集中在400~450 bp,其中李官地区获得较多的有效序列。
Shannon 指数及Simpson 指数共同表明汤头地区土样具有的细菌群落多样性最高。ACE 指数与Chao1 指数都表明汤头地区土样具有的细菌群落丰富度最高。PCA分析显示不同地区的桃根际土壤微生物群落结构存在明显差异,TT 地区微生物多样性高于LG 和YS 地区。
War 等[20]和Zhang 等[21]认为,不同植物物种或同一物种不同基因型间由于根系分泌物不同,会导致出现不同的微生物群落结构。根据土壤微生物基因组DNA 序列分类学分析结果,三个地区共包含4 175 个OTU。物种分类显示细菌种类隶属于25 门54 纲145 目272 科497 属577 种。对不同桃根际土壤分析表明,列出了细菌所属的门和属不同分类水平上的优势类群及其相对丰度。多数细菌为变形菌门。变形菌门是细菌中主要的门,这与Jangid 等[22]和刘欣等[23]对农田作物土壤细菌的研究结果基本一致。变形菌门适应能力强,是自然界最普遍的菌门。Fierer 等[24]认为,在土壤中变形菌门能够参与有机质转化和土壤结构形成,可以有效促进桃树的生长,对桃树生长及桃果实品质有益。结果显示,根际土壤细菌在门水平上的分类信息比较明确,而在属水平上尚未明确的分类较多,这可能与测序序列长度、测序期间和比对的数据库有关[25]。
基于COG 数据库,对临沂不同地区土壤细菌进行了基因功能预测,COG 功能分类统计中可以看出样本中土壤细菌功能基因以新陈代谢、遗传信息、细胞信号传导为主。这些细菌的代谢过程能够把一些不能利用的物质分解为植物可以吸收利用的物质,有助于植物的生长发育,提高桃树果实品质[26]。
土壤因子对微生物群落组成和多样性有一定的影响,其中土壤pH 是影响细菌群落最大的土壤环境因子。Oehl 等[27]研究指出,酸性土壤细菌多样性最低,中性土壤细菌多样性最高。速效磷与细菌多样性呈负相关,Zhao等[28]研究表示,土壤pH 值与细菌呈正相关,土壤速效磷的含量与细菌存在负相关关系,与本研究结果一致。然而,土壤有机质理化性质对土壤微生物群落的影响复杂,目前还没得出一致的结论。
4 结论
16S rRNA 测序结果表明,变形菌门(Proteobectria)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria)4 个菌门是细菌绝对优势菌门,临沂不同地区桃树根际土壤样品中细菌群落组成和结构均存在一定差异,细菌丰富度和多样性为汤头最高,其次是沂水,李官最低。细菌群落中线菌门和变形菌门是绝对优势菌门。土壤细菌功能基因表达以新陈代谢、遗传信息、细胞信号传导为主,三个地区的土壤细菌功能基因种类上大致相同,在不同基因表达丰度上有所差异。适宜的土壤养分、良好的土壤微生物环境是桃树生长良好的条件。因此,改善土壤理化性质,保证土壤养分平衡,是当前促进桃子高产、优质的有效措施。
