田菁纳豆多酚提取工艺优化及其抗氧化活性
2024-02-21殷凯欣梁宝静王家林赵忠祥
殷凯欣,梁宝静,王家林,赵忠祥
(青岛科技大学,山东青岛 266042)
植物多酚是一种次生代谢产物,在天然植物中含量丰富、分布广泛[1],属于多羟基酚类,根据所含苯酚环的数量和结构可以分为黄酮类、木脂素类、酚酸类和芪类四大类[2],具有活跃的化学性质和多种生物活性。研究表明植物多酚具有较好的抗氧化活性,可以通过螯合金属离子、清除自由基、抑制氧化酶活性发挥抗氧化作用,也可以通过保护机体内源性抗氧化酶实现间接抗氧化[3⁃4]。此外,植物多酚类物质还具有抑制食品中腐败微生物的生长、阻碍多种食源性病原体的繁殖、抑制肿瘤中的细胞生长、降低癌症风险[5]、降低血小板活性和低密度脂蛋白胆固醇水平、降低心血管疾病死亡风险[6]、促进肠道益生菌生长、调节肠道微生物菌群[7]、调节机体脂肪代谢、抑制脂肪细胞的增殖和分化、诱导其凋亡、刺激机体产热以加速能量消耗、减肥降脂[8]等功能。植物多酚提取物常作为天然的防腐剂用于果蔬[9]、肉类及肉制品[10]、水产品[11]的保鲜,且在医疗和保健、化工等领域都有广泛的应用。
田菁(Sesbaniacannabina)是一种一年生多用途豆科植物,存在茎瘤和根瘤两种结瘤方式,具有极强的耐旱、耐涝、耐盐碱[12]、耐贫瘠、抗病虫害和固氮能力,适应性强且作为夏季绿肥在土壤改良方面得到了广泛的应用[13]。田菁种子中含有丰富的营养物质,其中含量最多的是蛋白质,含量为30%~40%[14],还含有大量的多酚类活性物质以及铜、铁、锰、锌等微量元素[15]。
田菁纳豆是以田菁为原料,由纳豆芽孢杆菌在适宜条件下发酵制成的纳豆制品。在发酵过程中,田菁中复杂的大分子蛋白质分解成小分子的氨基酸和多肽,同时部分缩合单宁也会释放出来,纳豆成熟后会产生纳豆激酶,增加了游离多酚的含量,提高了田菁的营养价值,也拓宽了田菁的应用范围。目前关于田菁多酚的报道较少,本研究以田菁纳豆为材料,乙醇为溶剂浸提多酚,进而确定田菁纳豆多酚的最佳提取工艺,以期为后续的深入研究提供一定的理论依据,为田菁的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
田菁:山东省农业科学院黄河三角洲现代农业研究院试验田;纳豆芽孢杆菌:青岛科技大学生物工程实验室保藏菌种。
没食子酸(纯度≥99%):天津市科密欧化学试剂有限公司;福林酚(分析纯):北京普西唐生物科技有限公司;2,2′⁃联氨⁃双(3⁃乙基苯并噻唑啉⁃6⁃磺酸)二铵盐[2,2′⁃azino⁃bis(3⁃ethylbenzothiazoline⁃6⁃sulfonic acid)diammonium salt,ABTS](纯度98%)、2,4,6⁃三吡啶基三嗪(纯度99%),L⁃抗坏血酸(VC、纯度>99%):上海麦克林生化科技有限公司;1,1⁃二苯基⁃2⁃苦基肼(1,1⁃diphenyl⁃2⁃picryl⁃hydrazyl radical,DPPH)(纯度98%):上海源叶生物科技有限公司。
1.2 仪器与设备
恒温水浴锅(XT5202⁃D31⁃RO5C):杭州雪中炭恒温技术有限公司;离心机(LG10⁃2.4A):北京京立离心机有限公司;真空冷冻干燥机(FD⁃1A⁃50):上海比朗仪器制造有限公司;超净工作台(SW⁃CJ⁃1FD):上海博迅实业有限公司医疗设备厂;紫外可见分光光度计(T6):北京普析通用仪器有限责任公司。
1.3 试验方法
1.3.1 田菁纳豆的制备及处理
30 g 田菁→除杂、洗净、浸泡→121 ℃灭菌30 min→3%接种量接种纳豆芽孢杆菌→37 ℃恒温培养24 h→4 ℃后熟24 h→冻干磨粉→4 ℃密封冷藏。
1.3.2 没食子酸标准曲线的绘制
配制没食子酸工作液,浓度分别为10、20、30、40、50 µg/mL。分别吸取1 mL 不同浓度的没食子酸工作液,加入2 mL 福林酚试剂,摇匀,避光静置6 min,再加入10% 碳酸钠溶液4 mL,去离子水定容至10 mL,混匀,避光静置1 h。以试剂空白为参照,于765 nm 波长下测定其吸光度。以没食子酸质量浓度为横坐标,以吸光度为纵坐标,绘制标准曲线[16]。
1.3.3 田菁纳豆多酚提取量的计算
准确称取1 g 田菁纳豆冻干粉,在不同乙醇浓度、料液比、提取温度、提取时间下浸提田菁纳豆中的多酚,5 000 r/min 离心10 min,离心2 次,得到田菁纳豆多酚提取液[17]。将田菁纳豆多酚提取液稀释25 倍作为待测液备用,取1 mL 上述待测液于试管中,按照1.3.2 的方法比色,于765 nm 下测定其吸光度,根据没食子酸标准曲线换算出相应的浓度,田菁纳豆多酚提取量(D,mg/g)按以下公式计算。
式中:C为根据标准曲线求得的田菁纳豆多酚质量浓度,µg/mL;V为田菁纳豆多酚粗提液体积,mL;N为稀释倍数;M为田菁纳豆冻干粉质量,g。
1.3.4 单因素试验
1.3.4.1 乙醇浓度对田菁纳豆多酚提取量的影响
固定料液比1∶15(g/mL)、温度60 ℃的条件下提取80 min,乙醇浓度取10%、20%、30%、40%、50%、60%,平行3 次,考察乙醇浓度对多酚提取量的影响[17]。
1.3.4.2 提取温度对田菁纳豆多酚提取量的影响
固定料液比1∶15(g/mL)、乙醇浓度30% 的条件下提取80 min,提取温度取30、40、50、60、70、80 ℃,每组平行3 次,考察提取温度对多酚提取量的影响。
1.3.4.3 提取时间对田菁纳豆多酚提取量的影响
固定乙醇浓度30%、料液比1∶15(g/mL)、温度60 ℃,提取时间取60、70、80、90、100、110 min,每组平行3 次,考察提取时间对多酚提取量的影响。
1.3.4.4 料液比对田菁纳豆多酚提取量的影响
固定乙醇浓度30%、温度60 ℃的条件下提取80 min,料液比取1∶5、1∶10、1∶15、1∶20、1∶25、1∶30(g/mL),每组平行3 次,考察料液比对多酚提取量的影响。
1.3.5 响应面试验
由单因素试验选出对多酚提取量影响较大的3 个因素,将上述3 个因素作为自变量,以田菁纳豆多酚提取量为响应值,进行三因素三水平的响应面试验,进一步优化田菁纳豆多酚提取条件,响应面因素及水平见表1。

表1 响应面因素及水平Table 1 Factors and levels of response surface methodology
1.3.6 田菁纳豆多酚抗氧化能力的测定
以VC为阳性对照,参考舒旭晨等[18]的方法,测定田菁纳豆多酚的羟自由基清除率。参考孙晓波等[19]的方法,测定田菁纳豆多酚清除DPPH 自由基的能力。参考杨亚超等[20]的方法,研究田菁纳豆多酚对ABTS+自由基的清除作用。参考张清月等[21]的方法,测定田菁纳豆多酚对铁离子的还原能力。
1.4 数据处理
采用Excel 进行数据的处理和分析,Design Expert 10 和Origin 2018 进行作图。
2 结果与分析
2.1 没食子酸标准曲线
没食子酸标准曲线如图1所示。
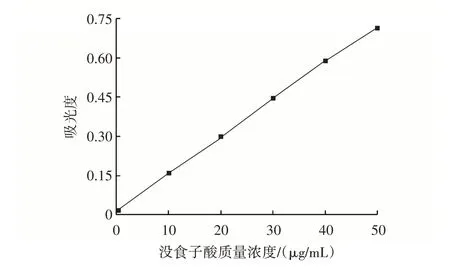
图1 没食子酸标准曲线Fig.1 Standard cure of gallic acid
由图1 可知,根据试验数据得到没食子酸标准曲线的回归方程为y=0.014 1x+0.018 7,y为吸光度,x为没食子酸质量浓度,R2=0.999 5,表明在所选质量浓度范围内线性关系表现良好,可用于田菁纳豆多酚提取量的测定。
2.2 单因素试验
2.2.1 乙醇浓度对田菁纳豆多酚提取量的影响
乙醇浓度对田菁纳豆多酚提取量的影响结果如图2所示。
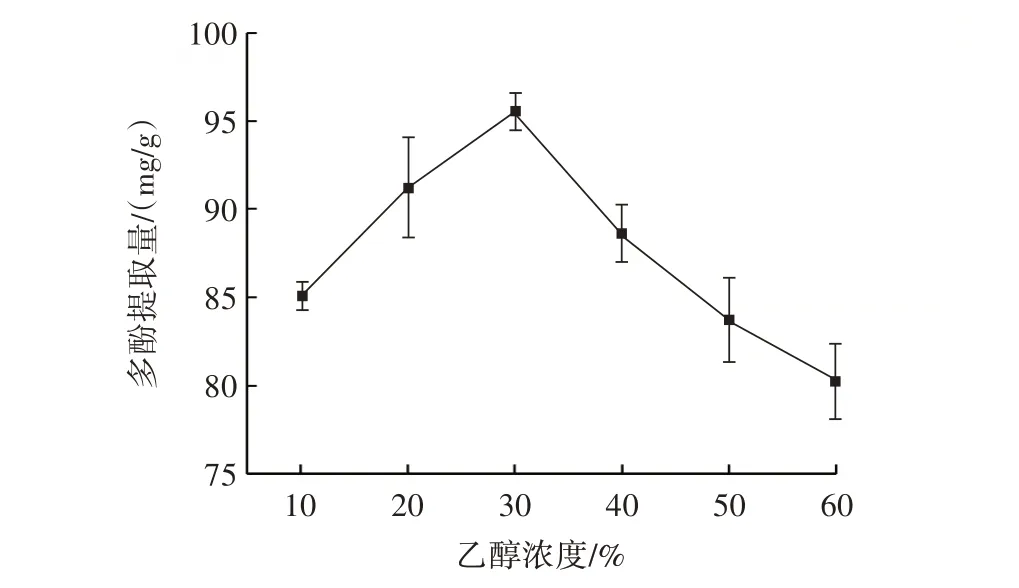
图2 乙醇浓度对田菁纳豆多酚提取量的影响Fig.2 Effect of ethanol concentration on amount of polyphenols extracted from Sesbania natto
由图2 可知,随乙醇浓度增大,田菁纳豆多酚提取量先增大后减小。乙醇浓度在10%~30% 时,多酚提取量不断升高,当乙醇浓度为30% 时,多酚提取量达到峰值,乙醇浓度超过30% 时,多酚提取量骤降。可能原因是乙醇浓度低时,水相比例较大,水溶性杂质溶出较多而抑制多酚类物质的溶出;乙醇浓度为30%时溶液的极性和田菁纳豆多酚的极性相近,易于溶出;乙醇浓度高时,溶剂极性降低,体系中的醇溶性杂质或脂溶性杂质更易浸出,此外,蛋白质也会变性,结合型多酚被破坏,多酚溶出减少从而多酚提取量随之降低[22]。综上,将响应面试验中乙醇浓度定为20%、30%、40%。
2.2.2 提取温度对田菁纳豆多酚提取量的影响
提取温度对田菁纳豆多酚提取量的影响结果如图3所示。

图3 提取温度对田菁纳豆多酚提取量的影响Fig.3 Effect of extraction temperature on amount of polyphenols extracted from Sesbania natto
由图3 可知,当提取温度升高,田菁纳豆多酚提取量随之增大,这可能是由于适度升温,分子间运动加快,更利于多酚的溶出,提取温度达到60 ℃时,多酚提取量最高,继续升温,多酚提取量反而下降。温度过高,多酚化学结构遭到破坏,出现分解、氧化等反应。同时提取温度高,溶剂中乙醇会挥发,其他杂质也会溶出,因此多酚提取量减小[23]。选择提取温度50、60、70 ℃进行响应面优化试验。
2.2.3 提取时间对田菁纳豆多酚提取量的影响
提取时间对田菁纳豆多酚提取量的影响结果如图4所示。
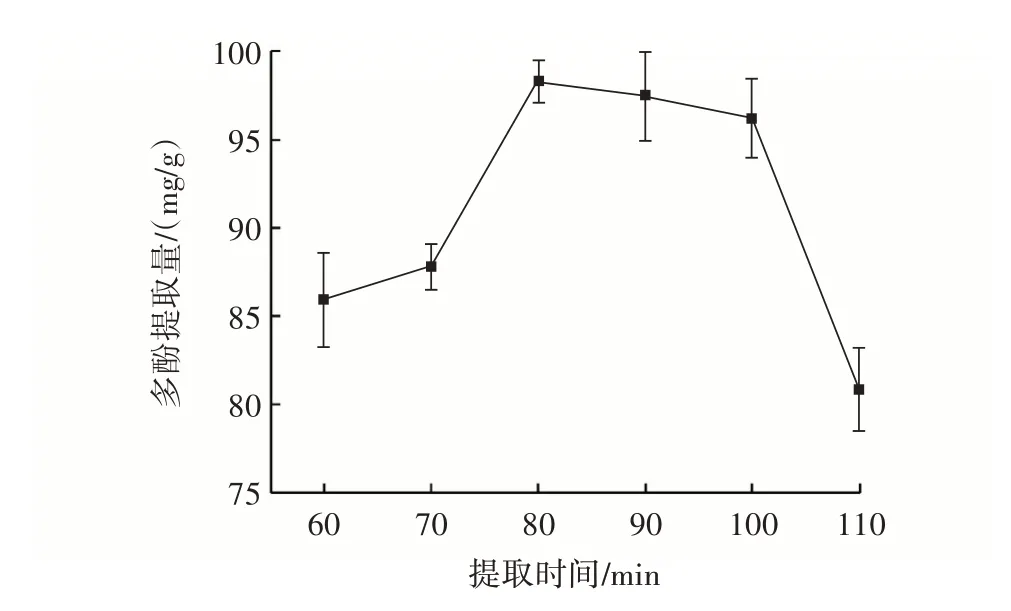
图4 提取时间对田菁纳豆多酚提取量的影响Fig.4 Effect of extraction time on amount of polyphenols ex⁃tracted from Sesbania natto
由图4 可知,当提取时间少于80 min 时,溶剂与提取物充分接触,表现为多酚提取量逐渐增大。当继续延长提取时间,多酚提取量减小。提取时间超过100 min时,多酚提取量骤减,可能是因为提取时间过长,田菁纳豆中的多酚与空气接触发生氧化分解。因此选择提取时间70、80、90 min 作为响应面分析的3 个水平。
2.2.4 料液比对田菁纳豆多酚提取量的影响
料液比对田菁纳豆多酚提取量的影响结果如图5所示。
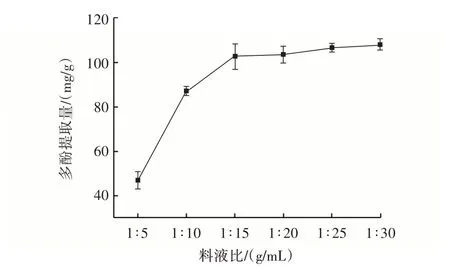
图5 料液比对田菁纳豆多酚提取量的影响Fig.5 Effect of material⁃to⁃liquid ratio on amount of polyphenols extracted from Sesbania natto
由图5 可知,随溶剂添加量增加,田菁纳豆的多酚提取量先增大,在料液比1∶15(g/mL)后趋于平缓,这可能是因为溶剂添加量增加导致细胞内外浓度差增大,利于多酚的溶出,继续增大溶剂添加量,田菁纳豆中大多数多酚类物质已全部溶出,趋于饱和状态,多酚提取量也不会继续增大,因此确定最佳料液比为1∶15(g/mL)。
2.3 响应面优化试验结果与分析
2.3.1 响应面试验设计与结果
响应面试验设计方案及方差分析结果见表2、表3。
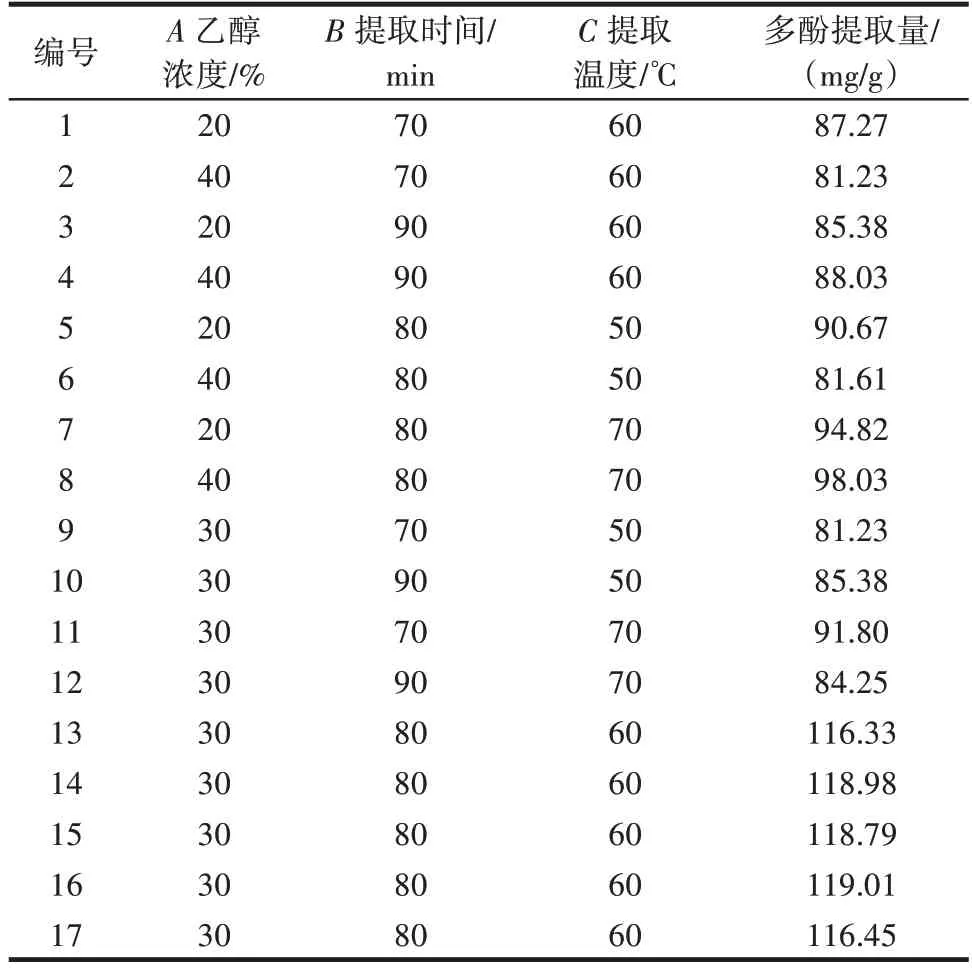
表2 响应面优化试验方案及结果Table 2 Experimental scheme and results of response surface op⁃timization
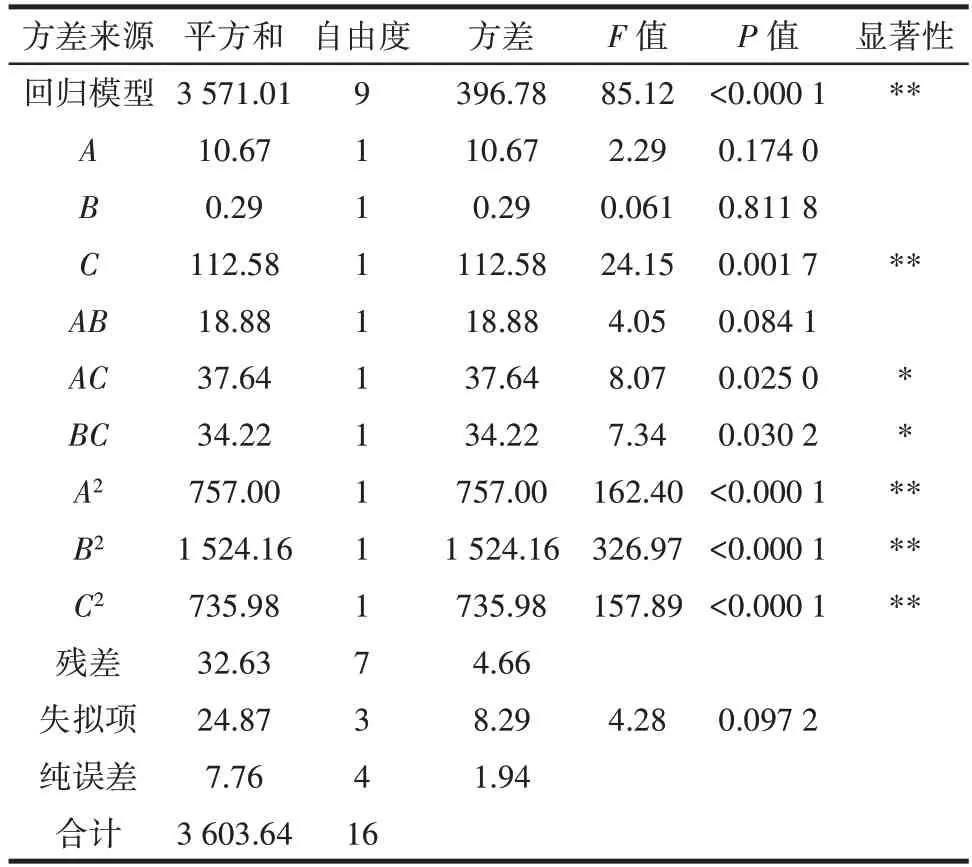
表3 响应面试验结果方差分析Table 3 Variance of response surface experimental results
根据表2 数据,可获得多元回归方程Y= 117.91-1.15A+0.19B+3.75C+2.17AB+3.07AC-2.92BC-13.41A2-19.03B2-13.22C2。利用Design Expert 10 软件对结果进行分析,结果见表3。
由表3 可知,模型的失拟项P>0.05,说明该模型拟合度较好。AC、BC对多酚提取量影响显著(P<0.05),C、A2、B2、C2对多酚提取量的影响极显著(P<0.01),3 个因素对田菁纳豆多酚提取量的影响顺序为提取温度>乙醇浓度>提取时间。
2.3.2 各因素交互作用分析
各因素交互作用对田菁纳豆多酚提取量的影响见图6~图8。
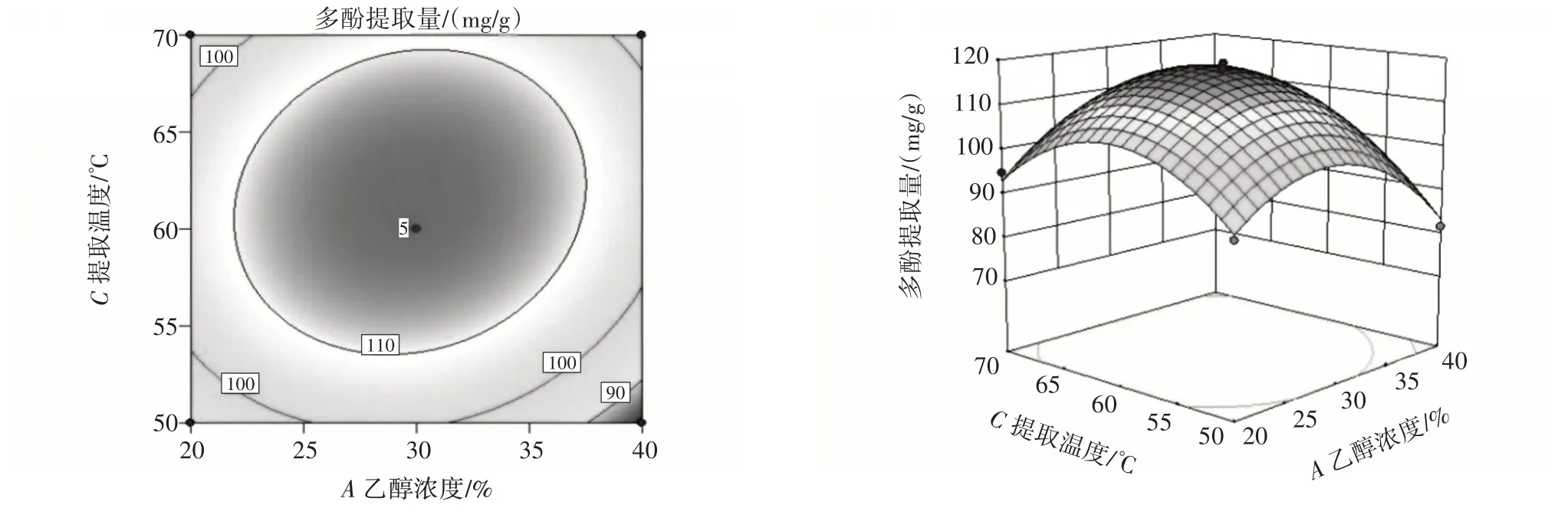
图7 乙醇浓度和提取温度交互作用对田菁纳豆多酚提取量的影响Fig.7 Effect of interaction between ethanol concentration and extraction temperature on amount of polyphenols extracted from Sesbania natto
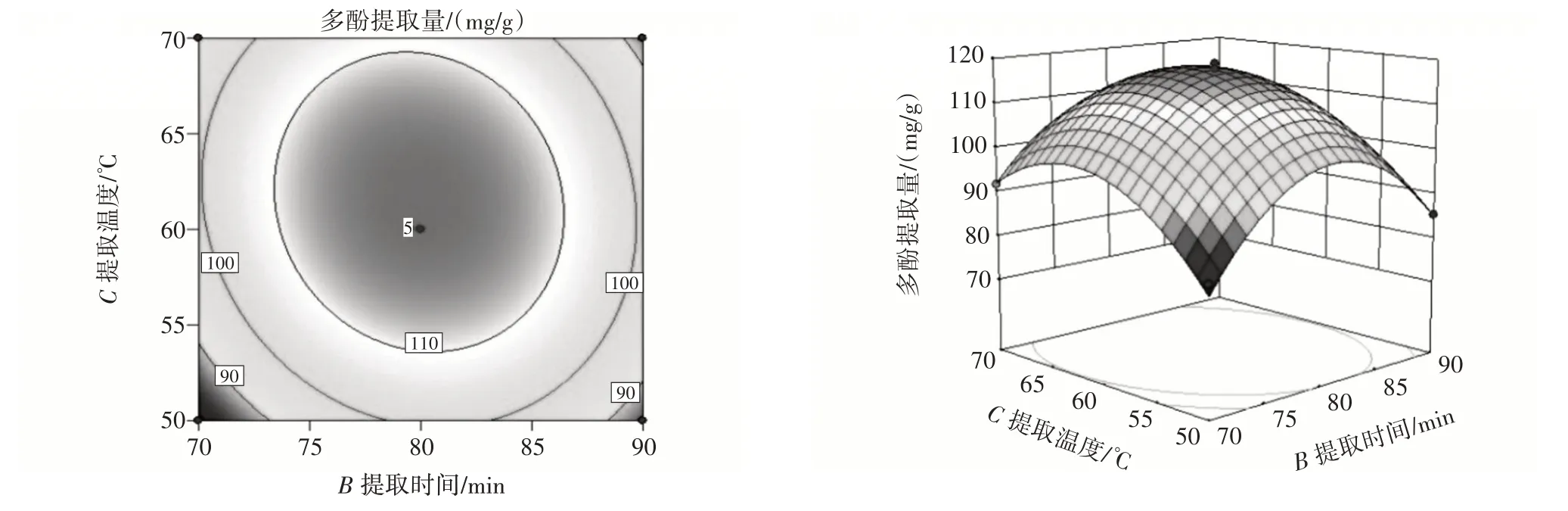
图8 提取时间和提取温度交互作用对田菁纳豆多酚提取量的影响Fig.8 Effect of interaction between extraction time and extraction temperature on amount of polyphenols extracted from Sesbania natto
由图6~图8 可知,响应曲面陡峭,表明乙醇浓度和提取温度、提取时间和提取温度交互作用对田菁纳豆多酚提取量影响显著,各响应曲面都有最高点,说明在试验范围内多酚提取量都有最大值。这与方差分析结果一致。
2.3.3 验证试验
经过响应面分析,田菁纳豆多酚提取的最佳工艺条件为乙醇浓度29.72%、提取时间79.93 min、提取温度61.39 ℃,在此条件下,田菁纳豆多酚提取量是118.19 mg/g。综合考虑实际的操作条件,确定最佳条件:乙醇浓度30%,提取时间80 min,提取温度61 ℃,经过3 次平行,试验结果显示田菁纳豆多酚提取量为119.24 mg/g,与理论值相差不大,表明模型可行。
2.4 田菁纳豆多酚抗氧化能力分析
2.4.1 羟自由基清除能力的测定结果田菁纳豆多酚和VC的羟自由基清除率如图9所示。
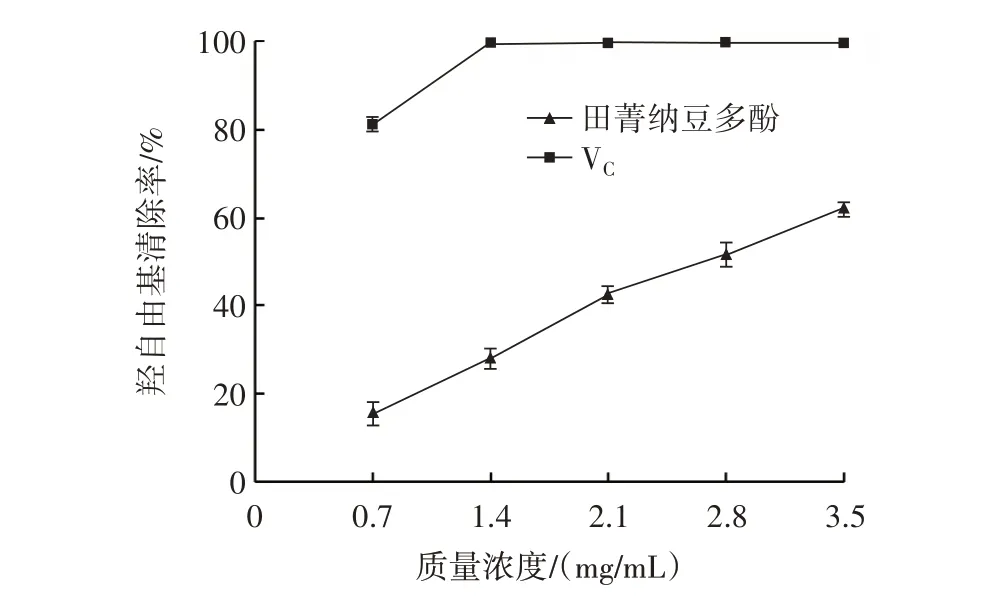
图9 田菁纳豆多酚和VC 的羟自由基清除率Fig.9 Hydroxyl radical scavenging rate of polyphenols extracted from Sesbania natto and VC
由图9 可知,随着质量浓度的增大,田菁纳豆多酚对羟自由基的清除率呈现上升趋势,说明田菁纳豆多酚质量浓度与清除率具有一定的线性关系,而VC表现为先上升后趋于平稳,且VC清除羟自由基的能力高于田菁纳豆多酚。当质量浓度为3.5 mg/mL 时,田菁纳豆多酚和VC对羟自由基的清除率均达到最大值,分别是62.18%、99.83%,田菁纳豆多酚对羟自由基具有一定的清除能力。
2.4.2 DPPH 自由基清除能力的测定结果
田菁纳豆多酚和VC的DPPH 自由基清除率如图10所示。
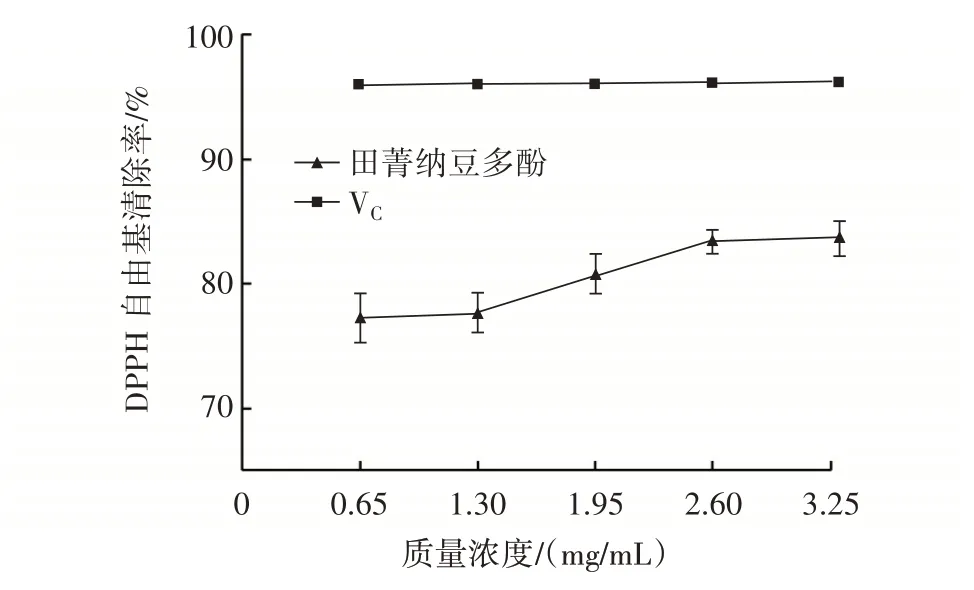
图10 田菁纳豆多酚和VC 的DPPH 自由基清除率Fig.10 DPPH free radical scavenging rate of polyphenols ex⁃tracted from Sesbania natto and VC
由图10 可知,田菁纳豆多酚质量浓度为1.30~2.60 mg/mL 时,田菁纳豆多酚的DPPH 自由基清除率随浓度的增大而增大,VC在试验质量浓度内对DPPH自由基的清除能力较稳定,VC清除DPPH 自由基的能力优于田菁纳豆多酚。田菁纳豆多酚、VC对DPPH 自由基的最大清除率分别为83.70%、96.26%。综上,田菁纳豆多酚具有一定的DPPH 自由基清除能力。
2.4.3 铁离子还原能力的测定结果
田菁纳豆多酚和VC对铁离子的还原能力如图11所示。
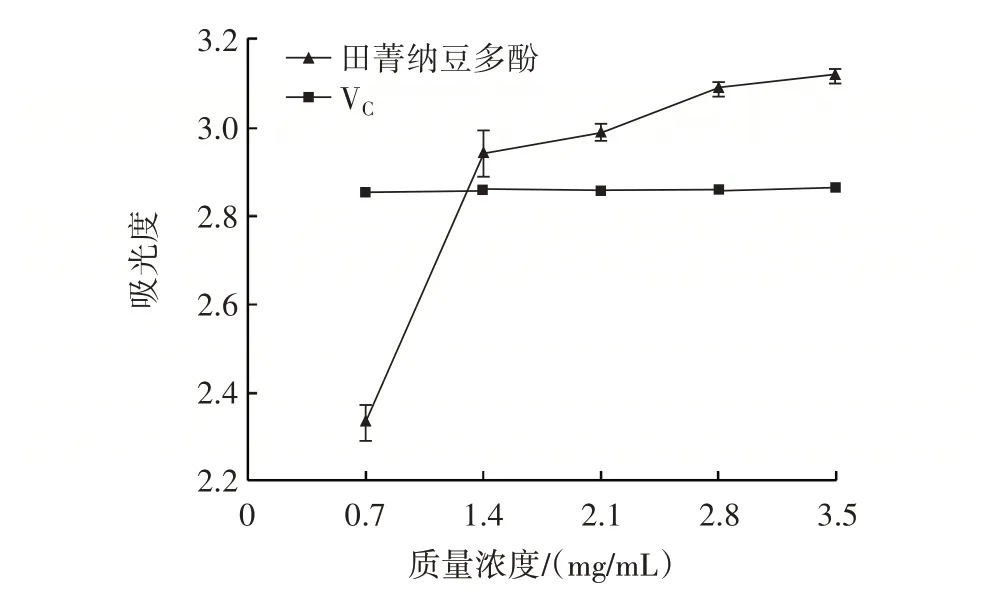
图11 田菁纳豆多酚和VC 对铁离子的还原能力Fig.11 Reducing ability of polyphenols extracted from Sesbania natto and VC to ferric ions
由图11 可知,在0.7 mg/mL 质量浓度下,VC对于铁离子的还原能力高于田菁纳豆多酚,质量浓度在1.4~3.5 mg/mL 时,田菁纳豆多酚对铁离子的还原能力一直强于VC,说明高质量浓度下,田菁纳豆多酚具有良好的铁离子还原能力。田菁纳豆多酚、VC对铁离子的最大还原力分别为3.12、2.87。
2.4.4 ABTS+自由基清除能力的测定结果
田菁纳豆多酚和VC的ABTS+自由基清除率如图12所示。

图12 田菁纳豆多酚和VC 的ABTS+自由基清除率Fig.12 ABTS+free radical scavenging rate of polyphenols ex⁃tracted from Sesbania natto and VC
由图12 可知,随着样液体积的增大,多酚浓度逐渐增大,ABTS+自由基清除率也增大,且浓度与清除率呈正相关关系,田菁纳豆多酚、VC对ABTS+自由基的最大清除率分别是53.47%、99.89%,表明田菁纳豆多酚具有一定的ABTS+自由基清除能力。
3 结论
采用乙醇溶剂浸提田菁纳豆中的多酚,通过响应面法优化田菁纳豆多酚的提取工艺,得到最佳提取条件:乙醇浓度30%,提取时间80 min,提取温度61 ℃,料液比1∶15(g/mL)。在最佳提取工艺条件下,田菁纳豆多酚提取量为119.24 mg/g。田菁纳豆多酚对羟自由基、DPPH 自由基和ABTS+自由基具有一定的清除能力,对铁离子的还原能力较强,表明田菁纳豆多酚有望成为一种天然抗氧化剂。本研究为田菁的相关研究提供数据支持,有助于田菁种子的开发利用。
