产β⁃葡萄糖苷酶植物乳植杆菌c4⁃3发酵豆浆的营养评价和代谢分析
2024-02-21鲍捷代艺伟陈映羲梁会朋林心萍张素芳
鲍捷,代艺伟,陈映羲,梁会朋,林心萍,张素芳*
(1.大连工业大学国家海洋食品工程技术研究中心,辽宁大连 116034;2.大连工业大学食品学院,辽宁大连 116034)
大豆作为世界重要粮食作物,富含多种营养和人体所需物质,包括蛋白质、油脂[1⁃2]、维生素[3]常见物质,以及异黄酮、酚类[2,4]、萜类[5]等次生代谢产物。大豆中天然存在的异黄酮多为糖苷型异黄酮(soybean isofla⁃vone glycoside,SIG),人体吸收利用率较差,其可通过肠道微生物产生的β⁃葡萄糖苷酶水解为配基型异黄酮(soybean isoflavone aglycones,SIA),能够被人体更好地吸收利用[6]。有许多研究已经证明,通过添加产β⁃葡萄糖苷酶的微生物对豆浆进行发酵,可以提高豆浆中配基型异黄酮的含量[7]。此外,微生物发酵作为传统加工工艺,在实际发酵体系中,因为微生物产生的酶系复杂,会有多种代谢产物生成,对营养提升和有害物质的代谢有着极佳处理效果,为发酵食品提供更高价值。
为了研究产β⁃葡萄糖苷酶的菌株在发酵豆浆时菌株的代谢行为和豆浆营养成分的变化,本文选取一株前期筛选到的产β⁃葡萄糖苷酶的植物乳植杆菌c4⁃3发酵豆浆,测定发酵前后豆浆中大豆异黄酮种类和含量;并进行非靶向代谢组学分析,利用液相色谱四极杆串联飞行时间质谱仪(liquid chromatograph⁃quadru⁃pole⁃time of flight,LC⁃QTOF),通过主成分分析(princi⁃pal component analysis,PCA)、正交偏最小二乘判别分析(orthogonal projections to latent structures⁃discriminant analysis,OPLS⁃DA)等方法,分析发酵前后豆浆中SIG 的代谢,并确定主要代谢通路。同时,解析植物乳植杆菌c4⁃3发酵豆浆中除异黄酮外,其他营养物质或有害物质的含量变化,以整体评价植物乳植杆菌c4⁃3 代谢行为。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
产β⁃葡萄糖苷酶的植物乳植杆菌c4⁃3(Lactiplan⁃tibacillusplantarumc4⁃3):大连工业大学中国海洋食品研发中心;大豆:市售;MRS 肉汤培养基、琼脂粉:青岛高科技工业园海博生物技术有限公司;甲醇(色谱纯)、乙腈(色谱纯)、甲酸(色谱纯)、大豆苷元(≥98%)、大豆苷、金雀异黄酮(≥98%)、染料木素:上海麦克林生化科技有限公司;甲醇(色谱纯):斯百全化学(上海)有限公司;L⁃2⁃氯苯丙氨酸(≥98%):上海阿拉丁生化科技股份有限公司;冰乙酸(色谱纯):生工生物工程(上海)股份有限公司。
1.1.2 仪器与设备
pH 计(多参数测试仪S400⁃B):梅特勒⁃托利多仪器(上海)有限公司;高效液相色谱仪(Agilent 1260 In⁃finity)、Acquity UPLC HSS T3 色谱柱(1.8µm,2.1 mm×100 mm):安捷伦(美国)科技有限公司;超高效液相色谱仪(ACQUITY UPLC I⁃Class)、高分辨质谱仪(UPLC Xevo G2⁃XS QTOF):沃特世科技有限公司。
1.2 方法
1.2.1 发酵豆浆的制备
挑取植物乳植杆菌c4⁃3 单菌落接种于MRS 液体培养基,培养至OD600=0.6。取200 g 已浸泡10 h 的大豆,加水至1 000 mL,豆浆机研磨破碎后,采用60 目筛过滤豆浆,121 ℃灭菌15 min,分装于50 mL 离心管中,每管分装5 mL。按照1%接种量,将活化好的菌株接种于豆浆,37 ℃、200 r/min 培养12 h,得到发酵豆浆。
1.2.2 发酵豆浆的产酸速率测定
在豆浆发酵2、4、6、8、10、12 h 时,分别用pH 计和酸碱滴定法测量pH 值和滴定酸度,表征产酸速率。
1.2.3 发酵豆浆异黄酮含量测定
取15 mL 发酵豆浆在-80 ℃预冻12 h,再冻干72 h。参考Rostagno 等[8]的方法提取异黄酮,取0.5 g 冻干豆浆,加入15 mL 50%乙醇溶液,超声2 h 后,8 000 r/min离心30 min,取上清液,0.22µm 滤膜过滤。
参考Wu 等[9]的高效液相色谱法测定异黄酮含量。选取常见的4 种异黄酮进行测定,包括属于SIG 的大豆苷和染料木素,以及属于SIA 的金雀异黄酮和大豆苷元。通过添加内标确定出峰时间,并根据标品所得回归方程换算样品中4 种异黄酮含量。
1.2.4 发酵豆浆的可溶性蛋白含量测定
参考吴成[10]的方法,绘制可溶性蛋白标准曲线,得到标准曲线y=2.114x+0.560 7(R2=0.999),并根据标准曲线计算豆浆中可溶蛋白含量。
1.2.5 发酵豆浆氨基态氮含量测定
参考徐鑫等[11]的方法测定发酵豆浆的氨基态氮含量。取发酵豆浆1.25 mL,定容于25 mL 容量瓶,测量用去离子水作空白对照,甲醛滴定法测定发酵豆浆的氨基态氮含量,记录使用NaOH 标准溶液的体积,氨基态氮含量计算公式如下。
式中:X为氨基态氮含量,g/100 mL;V为样品滴定消耗氢氧化钠体积,mL;V0为空白样品消耗氢氧化钠体积,mL;N为NaOH 标准溶液浓度,0.1 mol/L;0.014为氮的毫克当量。
1.2.6 发酵豆浆的持水力测定
参考Wang 等[12]的方法测定发酵豆浆持水力,计算公式如下。
式中:W为发酵豆浆持水力,%;W1为离心后样品的质量,g;W2为离心前样品的质量,g。
1.2.7 发酵豆浆的抗氧化能力测定
抗氧化能力的测定采用1,1⁃二苯基⁃2⁃三硝基苯肼(1,1⁃diphenyl⁃2⁃picrylhydrazyl,DPPH)法和2,2⁃联氮⁃二(3⁃乙基⁃苯并噻唑⁃6⁃磺酸)二铵盐[2′⁃azinobis⁃(3⁃ethylbenzthiazoline⁃6⁃sulphonate),ABTS]法测定。
1.2.7.1 DPPH 自由基清除率的测定
分别取2 mL 发酵后的豆浆,在10 000 r/min 条件下离心10 min。取1 mL 离心上清液,超纯水稀释4 倍,参考郑茵[13]的方法测定DPPH 自由基清除率,计算公式如下。
式中:Y为DPPH 自由基清除率,%;Ai为1 mL DPPH+1 mL 样品的吸光度;Aj为1 mL 蒸馏水+1 mL 样品的吸光度;Ac为1 mL DPPH+1 mL 蒸馏水的吸光度。
1.2.7.2 ABTS+自由基清除率的测定
分别取2 mL 豆浆,在10 000 r/min 条件下离心10 min,取1 mL 离心上清液,超纯水稀释10 倍,参考郑茵[13]的方法测定ABTS+自由基清除率,计算公式如下。
式中:N为ABTS+自由基清除率,%;AS为样品的吸光度;AC为对照品的吸光度。
1.2.8 发酵豆浆的总酚含量测定
参考李颖等[14]的方法,绘制没食子酸标准曲线,得到y=0.250 5x-0.202,并根据标曲计算发酵豆浆中的总酚含量。
1.2.9 发酵豆浆代谢组测定
选用L⁃2⁃氯苯丙氨酸作为内标,参考Dunn 等[15]、Want 等[16]的方法并稍作修改。量取100 µL 发酵豆浆,加入500 µL 含有内标的提取液,涡旋混匀30 s。之后置于冰水浴下超声10 min。采用超高效液相色谱串联高分辨质谱仪测定,进样体积为1 µL,其余条件参考Wang 等[17]的方法。
1.3 数据处理
1)β⁃葡萄糖苷酶及大豆异黄酮的数据分析使用Origin 2019b 软件。GraphPad Prism 9.0.0.121 软件用于分析差异以计算p值。采用生物学重复进行,所有试验完成3 个平行,数据以平均值±标准差表示。使用单因素方差分析和邓肯多范围检验确定平均值的显著差异。2)代谢组学试验使用UHPLC/QTOF⁃MS 进行原始数据导出及收集。3)代谢组学数据预处理:将数据导入Progenesis QI 软件做峰提取、峰对齐等数据处理操作,计算峰强度,精确质量和保留时间,基于Progen⁃esis QI 软件在线METLIN 数据库、公共数据库以及百迈客自建库进行鉴定,同时进行理论碎片识别,母离子质量数偏差100 ppm、碎片离子质量数偏差50 ppm 以内[17]。4)将编辑后的代谢组数据矩阵导入软件,进行多元统计分析处理,相关软件见表1。
表1 数据分析软件Table 1 Data analysis software
5)寻找差异性表达代谢物:结合单变量统计分析和多元统计分析的方法,并根据数据特性从多角度分析,最终准确挖掘差异代谢物。基于OPLS⁃DA 结果,使用R2Y 和Q2 两个参数用来评价模型的预测能力,获得的多变量分析OPLS⁃DA 模型的变量重要性投影(variable importance in projection,VIP),VIP>1 且p<0.05 的化合物进行统计学分析。6)通路分析:将这些潜在生物标记物输入KEGG 数据库(http://www.kegg.com/)进行匹配,运用通路富集分析并计算富集因子,寻找显著性代谢通路。
2 结果与分析
2.1 发酵豆浆产酸及异黄酮变化
发酵豆浆产酸及异黄酮变化见图1。
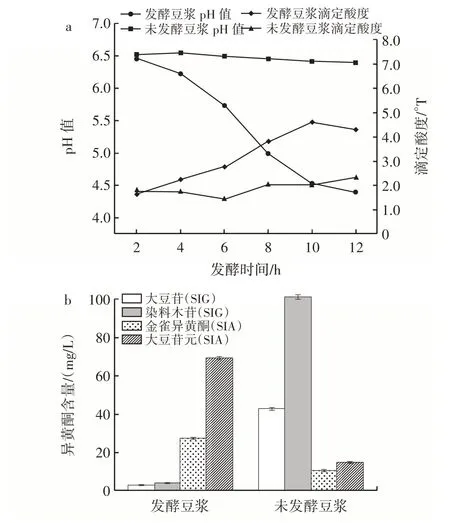
图1 发酵豆浆产酸及异黄酮变化Fig.1 Changes in acid production and isoflavones in fermented soymilk
由图1a 可知,在产酸方面,未发酵豆浆在12 h内,pH 值与滴定酸度基本不变,pH 值保持在6.5 左右,滴定酸度保持在2.0°T 左右。发酵后pH 值明显降低,在发酵12 h 时降至4.4;滴定酸度明显升高,在发酵10 h 时增加至4.6°T,不过在10~12 h 时略有下降,下降至4.3°T。pH 值的降低与滴定酸度的升高,是因为菌株在发酵豆浆时产生大量有机酸,且随着时间延长,含量逐渐增加。但发酵后期滴定酸度的下降,是因为随着发酵时间延长,乳酸菌活力降低、产酸速率降低,有机酸被代谢。
由图1b 可知,在异黄酮含量变化方面,豆浆经植物乳植杆菌c4⁃3 发酵后SIG(大豆苷、染料木素)的含量明显下降,大豆苷含量从41.86 mg/L 减少至2.10 mg/L,转化率为94.98%;染料木苷含量从100.35 mg/L 减少至3.17 mg/L,转化率为96.84%。SIA(大豆苷元、金雀异黄酮)含量明显上升,金雀异黄酮从9.68 mg/L 增加至26.61 mg/L;大豆苷元从13.93 mg/L 增加至68.43 mg/L。这是因为植物乳植杆菌c4⁃3 在发酵时能够产生β⁃葡萄糖苷酶,能够将发酵豆浆中的SIG 水解为SIA。Das等[7]发现鼠李糖乳杆菌也可将发酵豆浆中的SIG 转化为SIA,其中大豆苷转化率为55.43%,染料木苷转化率为72.30%;Feng 等[18]采用植物乳植杆菌处理豆浆,发现处理后的豆浆大豆苷转化率为64.58%,染料木苷转化率为74.43%,低于本研究的植物乳植杆菌c4⁃3。
2.2 豆浆发酵后理化性质变化
豆浆发酵后理化性质变化见表2。

表2 豆浆发酵前后理化性质Table 2 Physical and chemical properties of soymilk before and after fermentation
由表2 可知,豆浆发酵后可溶性蛋白含量显著下降,影响可溶性蛋白含量的因素包括蛋白质的变性和蛋白的水解。氨基态氮是判断蛋白水解度的重要指标。氨基态氮含量在发酵前后无显著差异,说明可溶性蛋白含量的下降不是蛋白水解导致的。
持水力是决定发酵豆浆品质的重要指标,影响发酵豆浆持水力的因素包括发酵豆浆的氨基酸组成、蛋白质构象、类型和数量、发酵产酸量、发酵代谢物等。随着豆浆发酵,酸大量积累,大豆蛋白变性,发生沉淀,可溶蛋白的含量显著减少,持水力显著增加。
豆浆发酵前后总酚含量和抗氧化活性无显著变化,总黄酮含量减少,这与Asmaa 等[19]的研究结果类似。目前关于发酵前后豆浆抗氧化活性的变化结论有两种,一些研究发现豆浆发酵后总酚含量、总黄酮含量、抗氧化能力均增加,并认为大豆的抗氧化活性大多与酚类物质呈正相关[20];而一些研究发现,发酵后黄酮、总酚含量降低,抗氧化能力依旧显著增加[21]。这是因为大豆中的多酚类抗氧化剂主要有异黄酮、绿原酸异构体、咖啡酸和阿魏酸,这些化合物主要以糖苷的形式出现。而抗氧化能力与抗氧化物质羟基化程度和羟基位置有关[22],SIA 的抗氧化活性高于SIG。因此,本文虽因微生物生物转化导致总黄酮减少,但因为SIA含量升高,抗氧化活性并未发生显著变化。
2.3 代谢组分析
将植物乳植杆菌c4⁃3发酵豆浆与未发酵豆浆进行PCA 分析和OPLS⁃DA 分析,结果见图2。
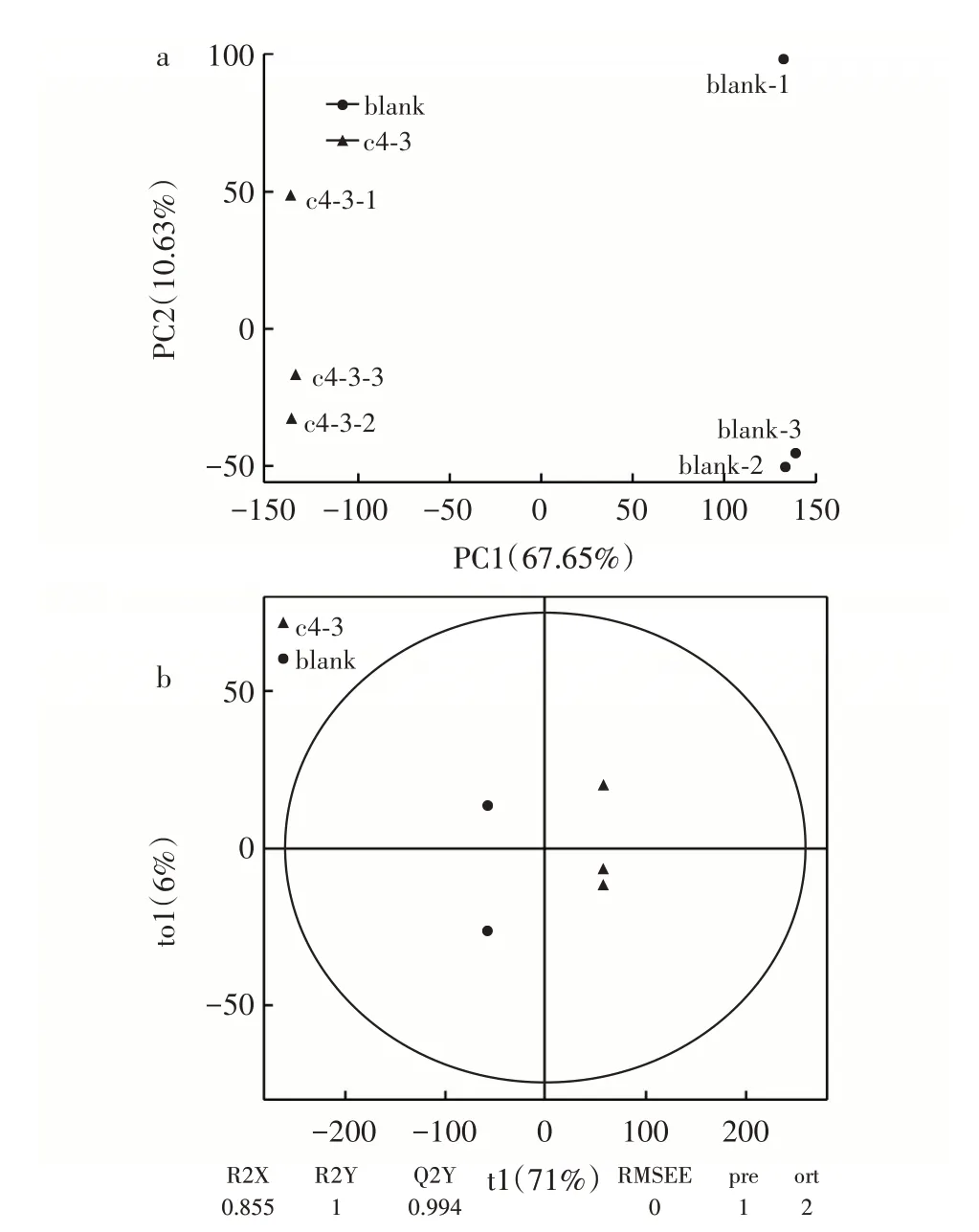
图2 发酵豆浆PCA 及OPLS⁃DA 分析Fig.2 Principal component analysis and orthogonal partial least squares⁃discriminant analysis of fermented soymilk
R2Y 和Q2Y 越接近于1 时表示模型越稳定可靠,由图2 可知,所建模型均可靠。
2.4 代谢差异物分析
为进一步讨论豆浆发酵前后代谢组的差异,利用clusterProfiler 选用超几何检验的方法对差异代谢物京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)的注释结果进行富集分析,富集后选取通路中注释到差异代谢物最多的前20条代谢通路,绘制富集柱形图。计算20 条通路上的富集因子,绘制差异代谢物KEGG 富集因子气泡图,其中富集因子越大,表示差异代谢物在该通路的富集显著性越可靠。根据富集因子确定5条主要代谢途径,并绘制差异代谢物KEGG 富集网络图,具体结果见图3~图4。豆浆发酵前后代谢物变化见表3。
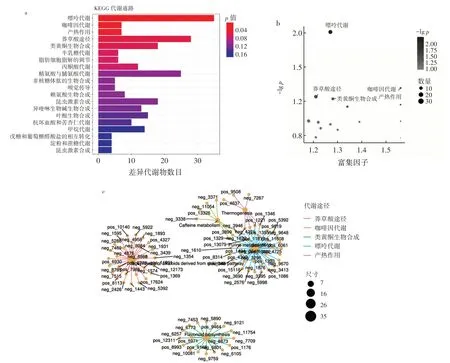
图3 豆浆发酵前后差异代谢物分析Fig.3 Differential metabolites in soymilk before and after fermentation
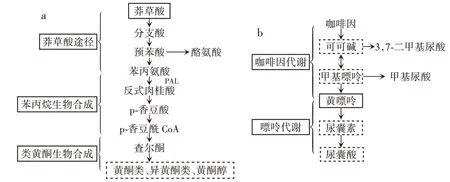
图4 发酵豆浆主要代谢途径Fig.4 Main metabolic pathway of fermented soymilk
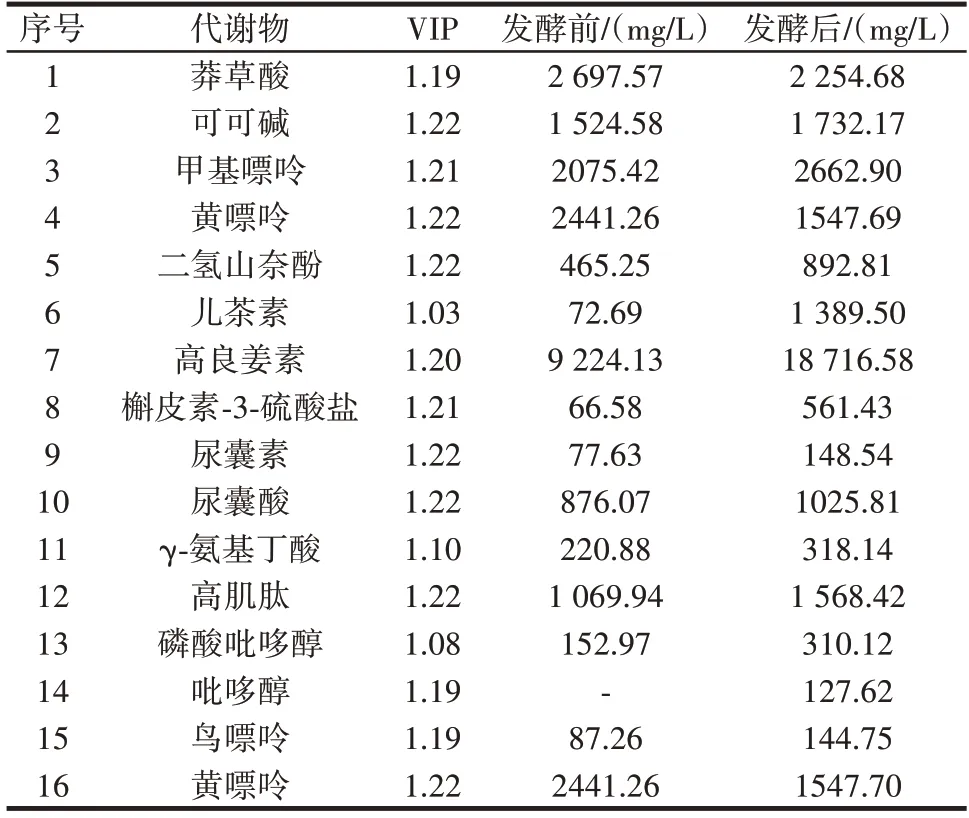
表3 豆浆发酵前后代谢物变化Table 3 Changes of metabolite in soymilk before and after fer⁃mentation
莽草酸代谢途径广泛存在于植物、真菌和微生物中,主要用于合成芳香化合物,为许多代谢途径提供前体物质,与类黄酮生物合成有关。由表3 可知,豆浆经过发酵,莽草酸含量由2 697.57 mg/L 减少至2 254.68 mg/L。这可能是发酵时微生物产生复杂酶系,使莽草酸转变为分支酸,之后经预苯酸进一步生成苯丙氨酸和酪氨酸。苯丙氨酸脱氨后可形成肉桂酸,进而转化为咖啡酸和查尔酮类物质,再通过类黄酮生物合成途径生成黄酮类物质。
许银彪等[23]对莽草酸途径代谢节点进行挖掘,证明其与酪氨酸的合成有关,在发酵时添加5 g/L 莽草酸,可将菌株HGPA 与HGPAK 的酪氨酸合成量从1 200 mg/L,分别提升至1 311 mg/L 和1 490 mg/L。张妍等[24]在用乳酸菌发酵玉米汁时,同样发现苯丙类化合物和黄酮类化合物发生了变化。咖啡因代谢与嘌呤代谢有关,咖啡因在酶的作用下可转化为可可碱,豆浆中可可碱含量在发酵后从1 524.58 mg/L 增加至1 732.17 mg/L;可可碱可进一步转化为甲基嘌呤,豆浆中甲基嘌呤含量在发酵后从2 075.42 mg/L 增加至2 662.90 mg/L;最终甲基嘌呤生成黄嘌呤,进入嘌呤代谢。豆浆发酵后黄嘌呤的前体物质均上升,但黄嘌呤含量反而下降,含量从2 441.26 mg/L 减少至1 547.69 mg/L,这可能是植物乳植杆菌c4⁃3 在发酵时产生有关嘌呤降解的酶所致(图4b)。
2.5 发酵豆浆营养物质分析
根据OPLS⁃DA 得分图,取VIP>1 且p<0.05 的化合物作为差异代谢物,从营养方面考虑,选取与黄酮、氨基酸、嘌呤、维生素有关的差异代谢物进行分析,并与数据库比对,作为潜在生物标记物,并参考KEGG Pathway map 绘制代谢通路图,具体结果见图5。
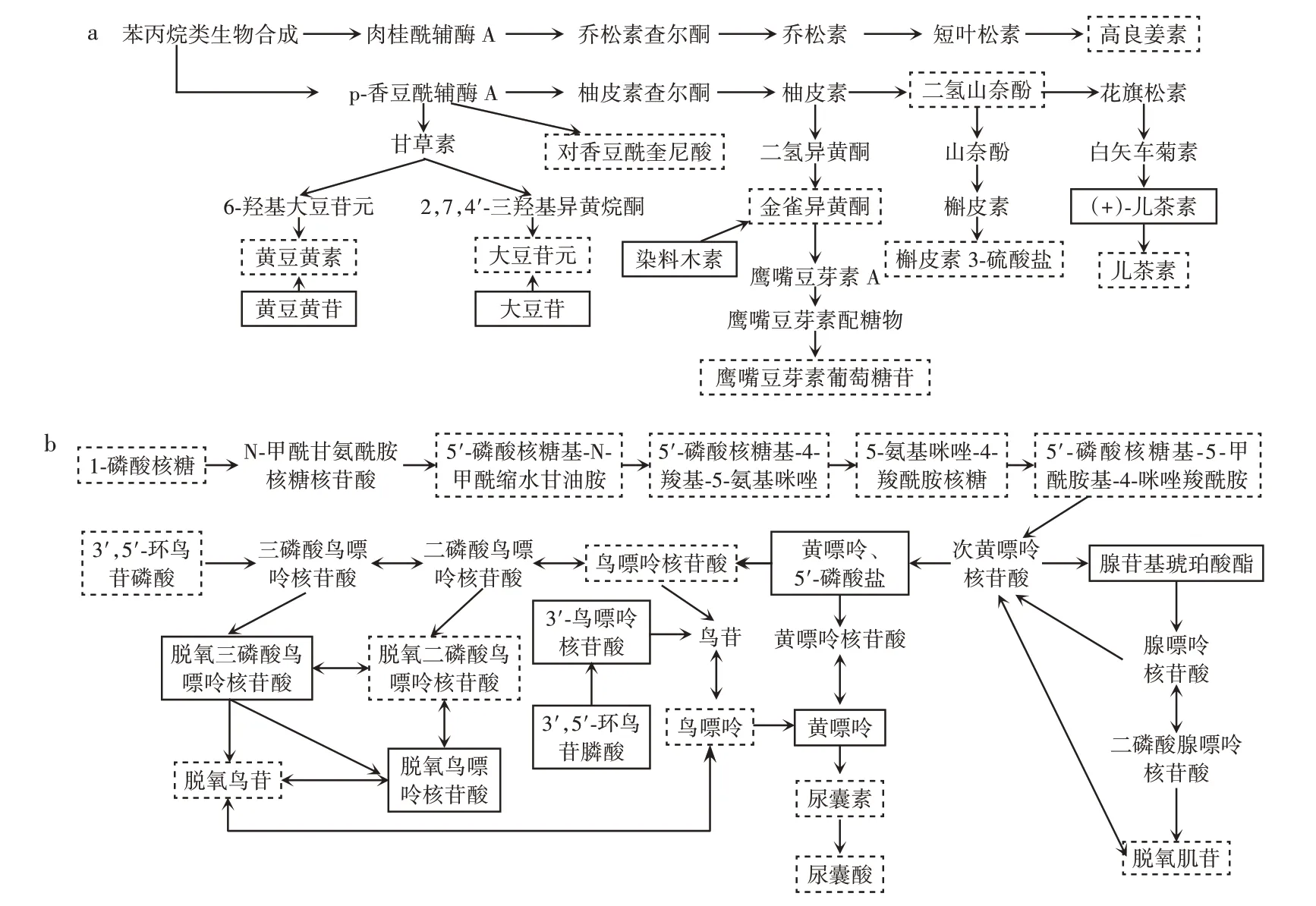
图5 植物乳植杆菌c4⁃3发酵豆浆代谢Fig.5 Metabolism of soymilk fermented with Lactiplantibacillus plantarum c4⁃3
由图5a 可知,植物乳植杆菌c4⁃3发酵豆浆与未发酵豆浆相比,在β⁃葡萄糖苷酶的影响下,儿茶素的含量从72.69 mg/L 增加至1 389.50 mg/L。此外,通路上一些代谢差异物的含量变化,可能不是β⁃葡萄糖苷酶作用的结果,如高良姜素的含量从9 224.13 mg/L 增加至18 716.58 mg/L;槲皮素⁃3⁃硫酸盐和二氢山奈酚分别从66.58、465.25 mg/L 增加至561.43、892.81 mg/L。
嘌呤的代谢可以总结为两个关键步骤,首先是次黄嘌呤核苷酸(inosine monophosphate,IMP)的合成,合成的IMP 不会在细胞内堆积,会迅速进行下一步转换,转换为腺嘌呤核苷酸(adenosine monophosphate,AMP)和鸟嘌呤核苷酸(guanosine monophosphate,GMP)。AMP 和GMP 进一步反应,变为大豆中含量较高的4 种嘌呤。在人体内,4 种嘌呤会代谢为尿酸,危害人体健康。豆浆发酵后,IMP 合成通路上的中间物质均有升高,但4 种嘌呤总量反而减少了836.08 mg/L,且嘌呤代谢产物尿囊素和尿囊酸的含量增加,分别从77.63 mg/L和876.07 mg/L 变为148.54 mg/L 和1 025.81 mg/L。这或许是因为植物乳植杆菌c4⁃3 能够产生尿酸氧化酶,在尿酸氧化酶的作用下尿酸能够分解成尿囊素,尿囊素进一步水解生成尿囊酸(图5b)。与尿酸不同,尿囊素和尿囊酸在水中溶解度高,很容易排除出。谷巍等[25]也发现能够产尿酸氧化酶的乳酸菌,并将其应用于畜牧业。
发酵豆浆有关氨基酸代谢主要涉及18 种氨基酸代谢变化,这些代谢离不开酶的产生,说明植物乳植杆菌c4⁃3 在发酵豆浆时产生了复杂的酶系。在有关氨基酸代谢的差异通路中,发现γ⁃氨基丁酸(γ⁃aminobu⁃tyric acid,GABA)和高肌肽(homocarnosine)的存在。其中,γ⁃氨基丁酸从220.88 mg/L 上升至318.14 mg/L,而高肌肽从1 069.94 mg/L 上升至1 568.42 mg/L。γ⁃氨基丁酸是哺乳动物中枢神经系统中的重要抑制性神经递质,在自然界中分布广泛,且微生物是目前γ⁃氨基丁酸的主要来源。谷氨酸脱羧酶(glutamate decarbox⁃ylase,GAD)是γ⁃氨基丁酸合成的关键酶,Liu 等[26]发现了几株高产γ⁃氨基丁酸的乳酸菌,并研究在不同条件下,谷氨酸脱羧酶对γ⁃氨基丁酸转化率的影响。高肌肽是γ⁃氨基丁酸和组氨酸的二肽,具有抗惊厥作用,还可以抗氧化、抗炎、防止DNA 损伤和抑制晚期糖基化的终产物形成[27]。
除了对上述比较完整的代谢通路进行关注外,还发现磷酸吡哆醇(pyridoxine phosphate)、吡哆醇(pyri⁃doxal)的含量明显增加,分别从152.97 mg/L 和无信号峰增加至310.12 mg/L 和127.62 mg/L,这两种物质都是维生素B6(vitamin B6)的存在形式。维生素B6在医疗健康领域有极大贡献,如预防骨质疏松、预防心血管疾病等[28]。当蛋白质摄入量较高时,维生素B6的需求量可能会增加,这是因为维生素B6是人体内某些辅酶的组成成分,参与多种代谢反应,尤其与氨基酸代谢有密切关系[29]。例如在γ⁃氨基丁酸生产中,维生素B6会作为辅酶,发挥重要作用[30]。
3 结论
本文对植物乳植杆菌c4⁃3发酵豆浆的产酸速率、基础理化性质、发酵前后异黄酮组分及含量变化、其它营养成分进行分析,发现经豆浆发酵后pH 值明显下降,在发酵12 h 时降至4.4;滴定酸度明显升高,在发酵10 h 时达到峰值4.6°T,这主要是由发酵产生的乳酸所致,有助于豆浆的储存。在植物乳植杆菌c4⁃3 作用下,发酵豆浆中的SIG 被大量转化,其中大豆苷转化率为94.98%,染料木素转化率为96.84%;SIA 含量明显增加,金雀异黄酮含量提升了1.75 倍,大豆苷元含量提升了3.91 倍,说明植物乳植杆菌c4⁃3 产生的β⁃葡萄糖苷酶能够有效水解SIG,使其转化为人体吸收利用率更好的SIA。
通过对植物乳植杆菌c4⁃3发酵豆浆的非靶向代谢组学分析发现,发酵涉及5 条主要代谢通路,分别为莽草酸途径、咖啡因代谢、类黄酮生物合成、嘌呤代谢和产热作用。豆浆发酵后不止异黄酮含量发生变化,γ⁃氨基丁酸的含量也上调了44.03%,儿茶素、磷酸吡哆醇的含量分别上调了18.12 倍和1.03 倍。且植物乳植杆菌c4⁃3 在发酵时可能产生了有关嘌呤代谢的酶系,在嘌呤前体物增加的情况下,嘌呤总量反而减少了33.07%,主要是代谢生成了尿囊素和尿囊酸,这将降低因嘌呤摄入过多发生痛风的风险。
上述研究结果表明,植物乳植杆菌c4⁃3 是发酵豆浆的优良菌株,能够有效提升豆浆的营养。本研究对发酵豆浆的生产具有重要理论与实践意义,也为植物乳植杆菌c4⁃3 的后续开发利用奠定了基础。
