钙离子在牙釉质矿化中的作用
2024-02-21李颖坤董志恒高玉光
李颖坤 董志恒 高玉光
滨州医学院附属医院口腔科 山东 滨州 256603
在牙釉质发育过程中,矿物质的大量流动对整个牙釉质的矿化过程起着至关重要的作用[1]。Ca2+的动态平衡是保持细胞正常结构和功能的前提与基础,Ca2+作为细胞内重要的第二信使分子,参与细胞内许多重要的生理过程,包括牙釉质蛋白表达的调节[2]。牙釉质的基本结构是羟基磷灰石晶体,是脊椎动物中迄今发现的钙化程度最高的结构[3-5],其含有约60%质量的钙,由此可见,Ca2+是牙釉质的关键和必需成分。牙釉质覆盖于牙冠表面[6-7],是人体最坚硬、矿化程度最高的组织[8-9],对牙齿正常行使咀嚼功能和保护内部组织具有重要意义。牙釉质主要由无机物质(96%)构成,其中包括羟基磷灰石晶体和少量的氟磷灰石,还有钠、钾、镁的碳酸盐等化学成分。正常的牙釉质发育分为分泌期和成熟期两个阶段。牙釉质的形成完全由成釉细胞的外胚层上皮细胞协调,分泌期的特点是组织的体积增大,矿化有限。而成熟期则相反,因为牙釉质晶体的宽度随着离子迁移的增加而增大。牙胚是牙齿发育的始基,由成釉器、牙乳头和牙囊三部分组成。成釉器来源于口腔外胚层,形成牙釉质。成釉器的发育分为蕾状期、帽状期和钟状期三个阶段,当牙胚发育至钟状期晚期时,与牙乳头临近的内釉上皮(the internal enamel epithelium,IEE)在相邻牙乳头间充质的作用下,分化为成秞细胞(ameloblast),即未来分泌形成牙釉质的细胞,并开始分泌釉质基质蛋白,这标志着牙釉质的发育正式启动[10]。成釉细胞是一种高度特化的多功能细胞,直接参与牙釉质基质的产生、吸收和降解[11],牙釉质的发生包括釉质基质形成和矿化两个步骤,由成釉细胞调控。分泌性成釉细胞介导远端分泌过程,并启动釉质基质蛋白分泌。在发育过程中,釉质最早形成的区域是牙尖,即咀嚼(磨牙)牙齿的牙尖表面,而釉质的最后发育阶段发生在基部。因此,釉质是向外和向下形成的。在分泌期结束后,分泌性成釉细胞将转变为成熟期细胞,而不是致力于合成和分泌釉基质蛋白,它们主要参与离子运输。在成熟阶段,许多Ca2+处理蛋白和Ca2+相关物质随着矿物质的摄取和晶体生长的加速而上调。因此,Ca2+是牙釉质的关键和必需成分。Ca2+转运的中断可能会导致牙釉质不全矿化或矿化不良,从而导致牙釉质疾病的发生。
Ca2+是人体中含量较高的元素,也是人体的必需元素之一,其中大部分Ca2+以羟基磷灰石晶体的形式存在于牙齿和骨骼中[12]。Ca2+参与细胞内许多重要生理过程,其作为细胞内第二信使分子,不仅参与了细胞增殖、分化、运动、肌肉收缩、激素分泌、糖原代谢及神经元兴奋等生理活动[10],还调节基因和蛋白的表达、分泌、代谢和凋亡。牙釉质中的钙含量高达95%~96%。在牙釉质发育的成熟阶段,许多Ca2+相关蛋白随着矿物质的摄取和晶体形成的增加而表达上调。因此,Ca2+不仅参与牙釉质矿化,还是釉质发育矿化过程中不可或缺的重要离子。
1 牙釉质矿化
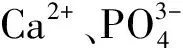
2 Ca2+在牙釉质矿化中的作用
在生物界中,生物矿化主要由晶体中的Ca2+调节。Ca2+通道作为这一过程的内在调节剂,促进了细胞内Ca2+在时间和空间上的紧密调节[12]。对人类牙釉质元素组成的分析表明,按重量计,钙占矿物质含量的约37%,釉质中发现的其他元素包括钠、镁和钾,这些元素的含量均小于1%[3,17]。这些元素从血液循环中穿过成釉细胞形成的上皮屏障到达所形成的釉质羟基磷灰石晶体。放射性标记研究表明,45Ca和32P都可以快速(几分钟内)从血液循环中进入牙釉质[18-19]。在成熟期,这些元素的含量都会增加,许多Ca2+相关蛋白也随着矿物质的摄取和晶体生长的加速而上调[12,20]。另外,Ca2+作为一种第二信使,在胚胎发育中调节许多生理过程,其中就包括调节牙釉质蛋白的表达。Ca2+在人体中大部分(99%)以羟基磷灰石晶体的形式存在于骨骼中。Ca2+代谢由肾重吸收、肠吸收和骨代谢介导,这些代谢受甲状旁腺激素、1,25-二羟维生素D[1,25(OH)2D]和Ca2+自身的动态调节。骨组织是一个动态系统,骨沉积和骨吸收交替进行,从而可以随时解决短期内的Ca2+缺乏。甲状旁腺激素的活性变化使Ca2+从骨骼中释放,导致血浆中的Ca2+水平升高。当Ca2+浓度过高时,通过降钙素的刺激将其去除,然后储存在骨骼中。尽管牙釉质的Ca2+水平高于骨骼,但由于牙釉质不会重塑,因此,在牙釉质晶格中捕获的Ca2+不能像在骨骼中那样动态地“释放”到系统中。
哺乳期母鼠低钙膳食会导致幼鼠低钙血症,造成幼鼠的牙釉质矿化不良[21]。而在饮食中10 d添加Ca2+后,这种牙釉质矿化缺陷可以得到纠正[22]。这表明,低钙血症会导致成釉细胞层形成囊肿样结构,并造成牙釉质蛋白异常定位。甲状腺切除术不会影响大鼠的牙釉质,但甲状旁腺切除术导致的低钙血症会严重影响大鼠牙釉质的矿化。这表明,Ca2+的缺乏或不足可能会造成牙釉质矿化不良或不完全,从而导致牙釉质疾病的发生[22]。这证明了低钙血症与牙釉质缺陷的相关性,进一步证明Ca2+是牙釉质矿化的关键和必需成分。
3 Ca2+通过多种途径影响牙釉质矿化
3.1 Ca2+通过SOCE通道调节牙釉质矿化 钙库操纵性钙离子内流(store-operated calcium entry,SOCE)是介导胞外Ca2+进入细胞内的重要通道之一,其中最具功能性的SOCE通道是Ca2+释放激活的Ca2+CRAC通道,具有高度的Ca2+选择性[2,23]。成釉细胞中的Ca2+摄取是一个被动过程,由胞外到胞内的Ca2+浓度梯度递进[24],然后通过质膜Ca2+-ATPase(PMCA)从细胞质中去除Ca2+。操控储存的Ca2+进入SOCE通道是Ca2+的主要进入途径,尤其是在成熟期成釉细胞中,并且在某种程度上,在分泌期成釉细胞中这也是最主要的途径[25-26]。 CRAC通道是由钙释放激活钙通道调节分子亚基组成的,钙释放激活钙通道调节分子亚单位属于构成CRAC通道核心的一个小家族的完整质膜蛋白,其最具特征的家族成员是位于细胞膜上的钙释放激活钙通道蛋白1(calcium release-activated calcium channel protein 1,CRCM1/ORAI1),但ORAI2和ORAI3也可能在某些组织中导致SOCE。CRAC通道由位于内质网膜上的两种蛋白质激活,即基质相互作用分子(stromal interaction molecule 1,STIM1)及其同系物STIM2,它们检测内质网中的Ca2+浓度,并在内质网Ca2+持续进入而导致Ca2+耗尽时与ORAI蛋白结合[2,27]。釉质细胞中大量Ca2+的摄取由储存的Ca2+进入SOCE通道来调节。STIM1和STIM2是Ca2+传感器,具有Ca2+结合域。当内质网Ca2+浓度降低时,STIM1蛋白发生构象变化,导致其与ORAI蛋白发生相互作用,从而允许Ca2+持续进入[28,23]。哺乳动物ORAI蛋白共有三种,ORAI1-3,它们都作为膜通道孔发挥作用[29]。STIM1和STIM2作为Ca2+传感器以及三种ORAI蛋白作为功能性膜孔的作用相似,已知STIM1和ORAI1基因突变会导致疾病[30]。这些CRAC通道缺陷疾病包括一系列的功能障碍,主要是功能缺失突变中的免疫缺陷[31],从而导致釉质发育不全和外胚层发育不良[32]。为了支持CRAC通道在釉质形成中的作用,有药理学方法证明,通过使用多种ORAI抑制剂(Synta-66、BTP-2、2-APB),在毒胡萝卜素(钙泵抑制剂)刺激的细胞中,Ca2+浓度显著降低。在小鼠STIM1和STIM2基因双重缺失的研究中,该小鼠模型出现严重的釉质低矿化,其大体标本的牙齿表型与人类釉质发育不全表型相似[33]。
3.2 Ca2+通过Cav1.2通道调节牙釉质矿化 L型电压门控CaV1.2通道编码电压依赖性钙通道的α-1亚基[34]。CaV1.2是心脏L型钙通道,对心脏的收缩和舒张有重要作用[35]。Ca2+进入通道是提供细胞Ca2+信号的关键,此过程由传感机制控制,包括内质网中的膜电压、表面受体和Ca2+传感器STIM蛋白,这些转导过程的协调运作是控制细胞功能的关键。STIM蛋白是一种动态的内质网Ca2+传感器,当内质网缺乏Ca2+时,STIM蛋白聚集,然后迅速转移到内质网质膜连接处,在那里它们与高Ca2+选择性的PM通道ORAI家族相互作用并激活Ca2+传导通道。STIM蛋白介导电压激活CaV1.2通道的抑制控制,该作用独立于ORAI通道功能或胞浆Ca2+变化的调控,并由STIM1对CaV1.2a1亚基的直接作用介导。因此,STIM1对ORAI和CaV1.2通道进行循环控制,这表明,受体诱导的Ca2+储存耗竭与电压激活的Ca2+信号控制之间存在迄今未知的潜在交叉调节联系[36]。CaV1.2通道的功能突变会导致持续的Ca2+内流,造成称为Timothy综合征的多器官功能障碍,Timothy综合征患者常出现牙齿异常,包括牙齿变小和牙釉质异常,这可能是由于牙釉质细胞膜电位的失调和由此产生的Ca2+超载造成的,但迄今为止尚未对此进行深入研究[12]。值得注意的是,在血管平滑肌细胞中,STIM1在同样包含ORAI通道的局部ER/质膜连接处与CaV1.2相互作用,从而控制CaV1.2通道中的Ca2+信号,然而这种相互作用机制在牙釉质细胞中是否存在与运作尚不清楚[12]。
3.3 Ca2+通过TRP通道调节牙釉质矿化 瞬时受体电位(TRP)通道与牙釉质有关[12]。瞬时受体电位melastatin 7(TRPM7)是一种结合离子通道和内在激酶结构域的蛋白,能够通过孔传导血管素或通过其激酶结构域磷酸化下游蛋白来调节细胞功能[37]。TRPM7是调节许多二价金属离子包括Mg2+和Ca2+稳态的重要渗透性离子通道[38-39]。有研究发现,尽管TRPM7本身不是一个通过储存来操作的离子通道,但其活性与SOCE通道密切相关,TRPM7通过激酶结构域的活性调节STIM1[37,40],改变通过SOCE通道进入Ca2+的效力,从而参与调节Ca2+稳态,其促进调节作用由蛋白的激酶结构域介导。TRPM7可通过维持静息状态下细胞内Ca2+储存的状态,有助于维持Ca2+稳态,这种作用由TRPM7的离子通道结构域介导。TRPM7通道活性是维持细胞内Ca2+储存含量所必需的,TRPM7激酶磷酸化,从而调节STIM蛋白和或其他SOCE成分[37]。此外,TRP通道有助于诱导储存的Ca2+进入并在血管平滑肌细胞中高度表达,在动脉平滑肌细胞中,由VP激活并由TRP通道介导的大的非选择性电流不受储存耗尽或显性Orai1-E106A突变体或组成性活性STIM1-D76A突变体表达的影响,这证明STIM蛋白或Ca2+储存在TRP通道功能中的作用[41]。TRPM7 c端激酶结构域的纯合缺失具有胚胎致死性[42],但杂合小鼠可用于研究牙釉质中的TRPM7,这种小鼠表现出严重的釉质矿化不良和骨骼异常,其釉质中Ca2+含量较低,Mg2+含量较高[12,43]。
4 小结
Ca2+作为重要的细胞内第二信使,参与细胞的多种生理和病理过程,促进了细胞内Ca2+在时间和空间上的紧密调节。本文通过对Ca2+影响牙釉质矿化的三种途径做一综述,更加说明了Ca2+与牙釉质矿化的发生发展密切相关。通过对Ca2+参与牙釉质矿化过程的作用机理的研究,可以进一步了解牙釉质矿化不良的发生机制,从而对牙釉质矿化相关疾病采取一些新的干预措施、治疗方法,达到预防和治疗疾病的目的。
