紫苜蓿提取物抵抗光损伤的作用及其机理研究
2024-02-21黄芳周利丹卢伊娜
黄芳 周利丹 卢伊娜




[摘要]目的:通过多种评价方法,探究紫苜蓿提取物(Medicago Sativa extract,MS)抵抗光损伤的作用及其机理。方法:通过体外清除ABTS自由基模型,高频蓝光(High-energy visible light,HEVL)照射角质形成细胞(HaCaT)产生ROS自由基模型,紫外线照射HaCaT后细胞活力、产生前列腺素E2(Prostaglandin E2,PGE2)和基质金属蛋白酶1(Matrix metalloproteinase 1,MMP-1)模型及HEVL诱导的人体皮肤损伤模型来验证MS的抗光损伤功效。结果:MS具有良好的抗氧化能力,其清除ABTS自由基的IC50为0.048%,质量分数为0.25%~0.5%的MS可显著减少HEVL照射下的HaCaT细胞中ROS活性氧的产生,质量分数为0.1%~0.3%的MS剂量依赖性地增加紫外线辐照损伤模型中细胞存活率,并降低PGE2和MMP-1的表达量。在HEVL诱导的人体皮肤损伤模型中,质量分数为0.5%~5%的MS能明显降低皮肤红斑的形成,增加皮肤亮度,减少黑色素的生成。结论:MS作为一种植物来源的抗光损伤型原料,可应用于舒缓、修护及抗皱类功效宣称的产品中。
[关键词]紫苜蓿提取物;光损伤;抗氧化;高频蓝光;紫外线;抗皱
[中图分类号]R285 [文献标志码]A [文章编号]1008-6455(2024)01-0058-05
Mechanism of the Medicago Sativa Extract Against Ultraviolet and Blue Light Induced Photodamage
HUANG Fang,ZHOU Lidan,LU Yina
(JAKA BIOTECH Co.,LTD.,Shanghai 200241,China)
Abstract: Objective To explore the effect and mechanism of Medicago Sativa extract (MS) against light damage through various evaluation methods. Methods The ABTS free radical detection model was built in vitro, the ROS free radical detection model was produced by high energy visible light (HEVL) irradiation on keratinocytes (HaCaT), the cell viability, production of prostaglandin E2 (PGE2) and matrix metalloproteinase-1 (MMP-1) models after UV irradiation on HaCaT, and the human skin injury model induced by HEVL were used to verify the efficacy of MS. Results MS had a good antioxidant capacity. The IC50 of MS scavenging ABTS free radicals was 0.048%. MS with a mass fraction of 0.25%-0.5% could significantly reduce ROS production in HaCaT cells exposed to HEVL. MS with a mass fraction of 0.1%-0.3% increased the cell survival rate in UV irradiation injury model in a dose-dependent manner, and decreased the expression of prostaglandin E2 (PGE2) and matrix metalloproteinase-1 (MMP-1). In the human skin injury model induced by HEVL, MS with a mass fraction of 0.5%-5% can significantly reduce the formation of skin erythema, increase skin brightness and reduce the formation of melanin. Conclusion As a kind of anti photodamage raw material from plants, MS can be used in the products claimed to have soothing, repairing and anti wrinkle effects.
Key words: Medicago Sativa extract; photodamage; antioxidant; high-energy visible light; ultraviolet; anti-wrinkle
太陽光谱主要由紫外线(UV)、可见光和红外线组成[1]。皮肤是接受阳光辐射最多的器官,阳光慢性暴露会引起皮肤慢性光损伤。而UV和部分可见光是造成皮肤光损伤、老化甚至皮肤癌的最主要诱因[2]。UV按波长可分为UVC、UVB和UVA,能够到达地球表面的UV由95%的UVA(320~400 nm)以及5%的UVB(280~320 nm)组成[3]。UVB主要影响表皮层,导致晒伤细胞的产生,UVA可同时到达表皮层和真皮层,引发光损伤和光老化[3]。皮肤细胞在接受UVB或UVA照射之后,细胞产生损伤,合成并分泌多种细胞因子,如PGE2、白介素、MMP-1等,导致细胞活力下降、细胞应激反应增多、胶原蛋白降解等,进而造成皮肤光损伤、光老化[4-7]。可见光中则以波长范围为(400~500 nm)的蓝光能量最高,对人体伤害最大[8],其中HEVL对皮肤的影响最大,高剂量的HEVL作用于皮肤,诱导大量的活性氧(Reactive oxygen species,ROS)产生,激活细胞应激反应,诱发皮肤红斑反应和色素沉着,同时加速皮肤衰老、松弛等[9-10]。
紫苜蓿,主要生长于西藏、新疆等高海拔、高日照地区,富含蛋白质、黄酮类成分,一般作为牧草使用,较少有文献报道其抵抗光损伤的作用。本研究将干紫苜蓿剪碎后通过特定的工艺进行提取,富集黄酮成分,获得紫苜蓿提取物(MS),于HEVL、UVB、UVA诱导的细胞或皮肤模型中验证其作用机理和临床效果,为其在光防护中的应用提供依据。
1 材料和方法
1.1 主要试剂和仪器:紫苜蓿,收购自西藏拉萨;人角质形成细胞(HaCaT),北纳创联(苏州)有限公司;DMEM培养基、胎牛血清(FBS)、青霉素-链霉素(PS),美国Gibco公司;中性红染液、抗坏血酸、ROS染色试剂盒,美国Sigma公司;PGE2、MMP-1检测试剂盒,欣博盛生物科技有限公司;ABTS试剂盒,碧云天生物科技有限公司;DAPI封片劑,美国abcam公司。多功能酶标仪,瑞士Tecan公司;中波紫外线治疗仪、长波紫外线治疗仪、红蓝光治疗仪,希格玛高技术有限公司;正置荧光显微镜,德国Leica公司;皮肤亮度测试探头、黑色素和红色素测试探头,德国CK公司;VISIA,美国Canfield公司。
1.2 实验方法
1.2.1 MS制备及细胞毒性检测:紫苜蓿切段后90℃水提2 h,加入聚酰胺吸附,再加入70% 1,3-丁二醇解吸附,滤液絮凝、过滤后即得,总黄酮含量为2.5%,并使用分光光度计检测MS在紫外波段和可见光波段的光吸收作用。将HaCaT细胞以2×105个/孔接种至96孔板中,每孔100 μl。次日,使用DMEM完全培养基梯度稀释MS,使浓度为终浓度的2倍,每孔100 μl加入孔板中,正常对照组每孔加100 μl完全培养基,每组设置至少3个复孔,于37℃、5% CO2恒温培养箱继续孵育24 h后,使用中性红染色法检测细胞活力。
1.2.2 ABTS自由基清除检测:取ABTS溶液、氧化剂溶液按比例混匀,室温避光静置12~16 h,使用去离子水稀释50倍[11]。将维生素C(VC)、MS配制成8个不同浓度点,于96孔板上依次加入20 μl测试样品、180 μl ABTS工作液,混匀后室温孵育10 min,于酶标仪405 nm处检测吸光度值(A)。空白对照为样品溶液,阴性对照为ABTS溶液,按以下公式计算抑制率,并分析半数抑制浓度(IC50)。抑制率(%)=(A阴性对照-A样品)/A阴性对照×100%。
1.2.3 HEVL诱导细胞ROS检测:将HaCaT细胞以1×105个/孔接种至预先铺设爬片的24孔板中,培养过夜。细胞板更换培养基,加入或不加入0.25%、0.5%(wt)的MS,然后将含样品的培养板置于蓝光辐照仪正下方10 cm的距离,蓝光照射10 min,总剂量为72 J/cm2[12-13]。37℃、5% CO2恒温培养箱继续孵育18 h后,PBS清洗细胞,在暗处每孔加入200μl ROS染液(内含荧光探针DCFH-DA),培养箱中染色1 h,洗涤并封片后置于正置荧光显微镜下拍照(200×)。
1.2.4 UV诱导细胞光损伤检测:HaCaT细胞以2.5×104个/孔铺于96孔板中,过夜培养后,加入或不加入不同浓度的MS预处理2 h,分别采用UVB(585 mJ/cm2)或UVA照射(65 J/cm2)后,继续培养24 h。采用中性红染色法检测细胞活力[14],计算公式如下:细胞活力(%)=OD 540样品/OD 540阴性对照×100%。收集细胞培养上清液,ELISA法检测PGE2和MMP-1表达量[15]。按以下公式计算抑制率:抑制率(%)=(表达量模型-表达量样品)/表达量模型×100%。
1.2.5 HEVL刺激皮肤损伤检测:选择正常健康受试者15人,其中男5人、女10人,平均年龄约26岁。清洗手臂内侧后,于恒温恒湿室[温度(20±2)℃,相对湿度30%~60%]干燥平衡20~30 min。标记6个1 cm×1 cm的受试区域,分别随机涂抹0.5%、1%、2%、5%浓度的MS样品、基质对照20 μl。待干燥后,使用蓝光波段照射7 min,总剂量30 J/cm2。照射后,立即采用CL400、MX18探头分别检测皮肤ITA°值、黑色素含量(Melanin)、血红素含量(Erythem),并于VISIA上拍照记录,分析红区程度,计算变化率[16-17]。公式如下:变化率(%)=(检测值各组辐照蓝光后/检测值各组对应正常组–1)×100%。
1.3 统计学分析:采用GraphPad Prism 5软件对数据进行作图和统计分析,采用t检验计算组间显著性差异,P<0.05表示差异有统计学意义,P<0.01表示差异有显著统计学意义,P<0.001表示差异有极显著统计学意义。
2 结果
2.1 MS的光吸收作用及细胞毒性考查:结果显示,MS在紫外线中的UVB(280~320 nm)及UVA(320~400 nm)波段具有较明显的吸收峰,在可见光波段中的蓝光波段(400~500 nm)具有较弱的吸收作用,见图1A。将MS添加至HaCaT细胞中,进行细胞毒性检测,结果显示0.5% MS细胞活力为80.67%,即后续细胞试验中的MS使用浓度均在0.5%及以下,见图1B。
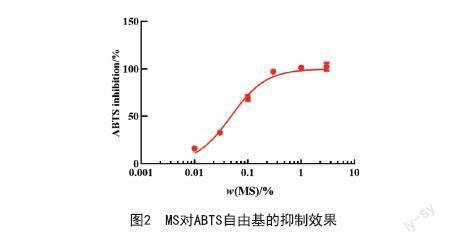
2.2 MS对ABTS自由基的清除作用:预实验时设置溶剂(1,3-丁二醇)对照组对ABTS自由基的清除率无影响。阳性对照VC的IC50为2.665 μg/ml,MS的IC50为0.048%。质量分数为0.1%的MS抑制率为69.8%,0.3%抑制率达到97.5%(见图2),且与阴性对照相比差异有极显著统计学意义(P<0.001)。
2.3 MS对蓝光诱导下ROS的作用:图3为HEVL诱导下ROS产生量对应的荧光图片,检测原理为ROS能与定位于细胞质的荧光传感器发生反应,产生荧光产物(λex=490/λem=520 nm),该荧光产物与ROS含量成正比。与阴性对照(normal)相比,72 J/cm2 HEVL照射HaCaT细胞后,绿色荧光显著增强,说明细胞内产生了较多ROS。而0.25%、0.5%质量分数的MS同步处理细胞时,绿色荧光强度显著下降,0.25%浓度下即与阴性对照类似,且细胞形态无明显变化。
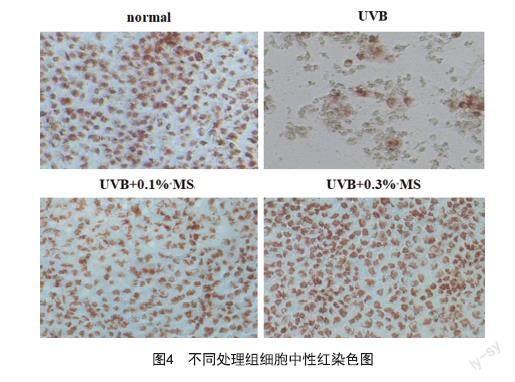
2.4 MS对UV诱导下细胞损伤的作用:先对UVB照射HaCaT细胞结果进行分析,结果显示,与normal组相比,高剂量的UVB处理下,细胞活力下降至23.8%,细胞数量明显减少,质量分数为0.1%和0.3%的MS与UVB共同处理细胞后,细胞活力分别提升至44.5%及82.3%(见图4、图5A);再检测培养上清中的PGE2可知,UVB辐照后,PGE2表达量从1 705.4 pg/ml上升至42 161.7 pg/ml,添加质量分数为0.1%和0.3%的MS与UVB共同处理细胞后,PGE2表达量分别下降至9 989.8及1 529.9 pg/ml,抑制率最大达到96.4%。说明UVB可造成细胞损伤,影响细胞活力和细胞因子表达量(见图5B)。再对UVA照射HaCaT细胞进行分析,結果显示,与normal组相比,UVA处理下,细胞活力下降至29.8%,细胞数量明显减少,0.1%~0.3%的MS与UVA共同处理细胞后,细胞活力最大可提升至65.4%(见图6A);PGE2表达量从UVA处理前的1 139.0 pg/ml上升至11 314.1 pg/ml,0.1%~0.3%的MS与UVA共同处理细胞后,PGE2表达量最大可下降至672.5 pg/ml,下降率最大达到94.1%(见图6B);MMP-1表达量从UVA处理前的1 789.2 pg/ml上升至12 185.9 pg/ml,0.1%~0.3%的MS与UVA共同处理细胞后,MMP-1表达量最大可下降至142.8 pg/ml,下降率最大达到98.8%(见图6C)。
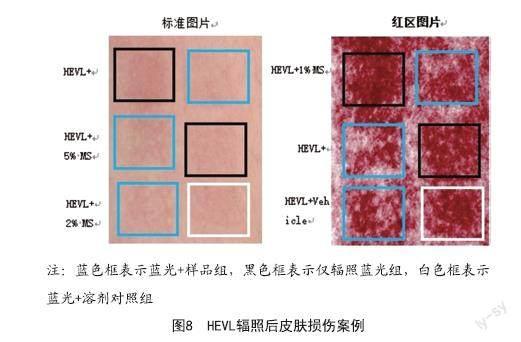
2.5 MS对蓝光诱导人体皮肤损伤的作用:预实验时设置溶剂(1,3-丁二醇)对照组,溶剂对照组对结果无影响。36 J/cm2的HEVL照射皮肤,可立即降低皮肤ITA°值、升高皮肤黑色素和红色素值,造成肉眼可见的皮肤变黑、变红。而0.5%~5%的MS处理下,ITA°值呈现剂量依赖性上升,Melanin和Erythem变化率均呈现下降,在5%浓度时最大变化率较HEVL模型组可分别达到90.3%、-87.1%和-80.4%(见图7)。1例典型受试者的VISIA拍照标准图和红区图见图8。
3 讨论
阳光照射对皮肤的不良影响是众所周知的,太阳发射广谱电磁辐射(EMR),能够到达地球表面的电磁辐射主要由UVB(290~320 nm)、UVA(320~400 nm)、VL(400~700 nm)和红外(700 nm~1 mm)辐射组成[3]。到达地球表面的阳光中,紫外线约占5%,可见光占50%,其中可见光中的蓝光占可见光的75%,红外线约占阳光的45%[18]。
日光中以紫外线辐射对人体皮肤的损伤作用最为严重,也研究得最为广泛[18]。UV作用于细胞,会导致细胞损伤,细胞活力下降、细胞因子分泌量增加等负面影响[14-15]。UVB能穿过表皮到达真皮层上部,导致皮肤氧化应激增加,炎症反应激活,DNA损伤积累等效应,使皮肤产生红斑及色素沉着[19]。UVA穿透能力则更强,能到达真皮层底部,并且与UVB造成的急性损伤相比,UVA对慢性光损伤(如皮肤过早老化、多态光疹、免疫调节和皮肤癌)影响更为深远[20]。最近,越来越多的证据表明,能量较低的辐射,如可见光和红外辐射,也可能影响皮肤生理。尽管可见光中的HEVL的辐射强度不如紫外线,但由于HEVL光子的丰度更高,穿透皮肤的能力强于UVA,能到达皮下组织,因此HEVL对皮肤仍可产生相关的消极影响,如发生光转导和氧化应激等变化,产生ROS等氧自由基,也可导致皮肤黑化,产生红斑、色素沉着和光老化现象[18]。
综上所述,紫外线及HEVL辐射通过造成皮肤细胞DNA损伤、一系列氧化应激反应的产生,炎症反应的激活等反应而使皮肤表现出红斑、水肿、蜕皮、色素沉着及光老化等现象。MS富含黄酮,可通过清除自由基、抗氧化、提升细胞活力、减少细胞因子合成来发挥光防护作用,能通过抵抗紫外线、高频蓝光等光辐射对细胞或皮肤造成的即时损伤反应或长期光老化反应,可应用于舒缓、修护及抗皱类功效宣称的产品中。
[参考文献]
[1]Meyer T,Stockfleth E.Light and skin[J].Curr Probl Dermatol,2021,55:53-61.
[2]Furukawa J Y,Martinez R M,Morocho-Jácome A L,et al.Skin impacts from exposure to ultraviolet,visible,infrared,and artificial lights-a review[J].J Cosmet Laser Ther,2021,23(1-2):1-7.
[3]Mohania D,Chandel S,Kumar P,et al.Ultraviolet radiations: skin defense-damage mechanism [J].Adv Exp Med Biol,2017,996:71-87.
[4]Gu Y,Han J,Jiang C,et al.Biomarkers,oxidative stress and autophagy in skin aging[J].Ageing Res Rev,2020,59:101036.
[5]Tang Z,Tong X,Huang J,et al.Research progress of keratinocyte-programmed cell death in UV-induced Skin photodamage[J].Photodermatol Photoimmunol Photomed,2021,37(5):442-448.
[6]李鹏琴,张桂云,李雪,等.皮肤光老化的研究进展[J].中国美容医学,2020,29(5):174-177.
[7]Jung Y A,Lee J Y,Lee P,et al.Inhibition of solar UV-induced matrix metalloproteinase (MMP)-1 expression by non-enzymatic softening cherry blossom (Prunus yedoensis) extract[J].Plants (Basel),2021,10(5):1016.
[8]Schütz R.Blue light and the skin[J].Curr Probl Dermatol,2021,55:354-373.
[9]Coats J G,Maktabi B,Abou-Dahech M S,et al.Blue light protection, part Ⅱ-Ingredients and performance testing methods[J].J Cosmet Dermatol,2021,20(3):718-723.
[10]Suitthimeathegorn O,Yang C,Ma Y,et al.Direct and indirect effects of blue light exposure on skin: a review of published literature[J].Skin Pharmacol Physiol,2022,35(6):305-318.
[11]Wołosiak R,Drużyńska B,Derewiaka D,et al.Verification of the conditions for determination of antioxidant activity by ABTS and DPPH assays-a practical approach[J].Molecules,2021,27(1):50.
[12]Park J Y,Park S H,Oh S W,et al.Yellow chaste weed and its components,apigenin and galangin,affect proliferation and oxidative stress in blue light-irradiated HaCaT cells[J].Nutrients,2022,14(6): 1217.
[13]Jang Y A,Kim B A.Protective effect of spirulina-derived c-phycocyanin against ultraviolet B-induced damage in HaCaT cells[J].Medicina (Kaunas),2021,57(3):273.
[14]Jaisin Y,Ratanachamnong P,Wongsawatkul O,et al.Antioxidant and anti-inflammatory effects of piperine on UV-B-irradiated human HaCaT keratinocyte cells[J].Life Sci,2020,263:118607.
[15]Karadeniz F,Oh J H,Kim H R,et al.Camellioside A,isolated from Camellia japonica flowers, attenuates UVA-induced production of MMP-1 in HaCaT keratinocytes via suppression of MAPK activation[J].Exp Ther Med,2021,21(1):16.
[16]Campiche R,Curpen S J,Lutchmanen-Kolanthan V,et al.Pigmentation effects of blue light irradiation on skin and how to protect against them[J].Int J Cosmet Sci,2020,42(4):399-406.
[17]Campiche R,Curpen S J,Lutchmanen-Kolanthan V,et al.Pigmentation effects of blue light irradiation on skin and how to protect against them[J].Int J Cosmet Sci,2020,42(4):399-406.
[18]Schütz R.Blue light and the skin[J].Curr Probl Dermatol,2021,55:354-373.
[19]Cavinato M,Waltenberger B,Baraldo G,et al.Plant extracts and natural compounds used against UVB-induced photoaging[J].Biogerontology,2017,18(4):499-516.
[20]Battie C,Jitsukawa S,Bernerd F,et al.New insights in photoaging,UVA induced damage and skin types[J].Exp Dermatol,2014,23 Suppl 1:7-12.
[收稿日期]2022-10-31
本文引用格式:黃芳,周利丹,卢伊娜.紫苜蓿提取物抵抗光损伤的作用及其机理研究[J].中国美容医学,2024,33(1):58-62.
