自噬相关基因微管相关蛋白1A/1B轻链3B在结肠癌中的表达及临床意义
2024-02-20吴跃锐梁明超吴建萍
高 松,吴跃锐,梁明超,吴建萍
(暨南大学附属顺德医院普外一科,广东 佛山 528305)
结肠癌是世界范围内的高发性恶性肿瘤,每年造成近700 000人死亡[1]。随着三阶梯诊疗程序的普及和完善,结肠癌的治疗不再局限于放疗和化疗,还追求精准疗法以延长患者生命、改善预后。因此,逐渐成熟的靶向治疗为其提供了思路,但新的治疗急需治疗结肠癌的靶点。自噬是肿瘤关系非常密切的肿瘤特征之一,其为寻找合适的治疗靶点提供了方向[2]。自噬途径是细胞通过回收受损的细胞蛋白质、细胞器和其他细胞成分来保持细胞稳态并应对压力的过程[3-5]。在癌症的背景下,自噬是一种双刃剑,取决于致癌背景和肿瘤发生的阶段。由于细胞损伤和对能量的高需求,与正常细胞相比,癌细胞对自噬的依赖性更高。致癌酪氨酸激酶(OncTKs) 和受体酪氨酸激酶(RTKs) 激活通过激活 PI3K/AKT/mTORC1 和 RAS/MAPK 信号通路导致自噬调节。酪氨酸激酶(TKs) 和 RTKs 的靶向抑制最近被认为是癌症治疗,但耐药性和癌症复发仍然是酪氨酸激酶抑制剂(TKI) 的主要限制[6-7]。因此,调节自噬通路可能是治疗癌症的一种有前途的策略。微管相关蛋白1A/1B轻链3B(MAP1LC3B)是调节自噬活性和鉴定自噬水平的关键基因,是自噬体模型的标志,其水平的高低反映了细胞自噬活性的强弱[8],但MAP1LC3B在结肠癌中的作用尚不清楚。因此,本研究将探讨MAP1LC3B活性与结肠癌临床病理的相关性。
1 资料与方法
1.1一般资料:采用回顾性研究方法,选取2018年1月~2020年6月暨南大学附属顺德医院确诊和在本院手术切除的结肠癌组织40例,并取癌旁组织20例为对照组,通过实时定量聚合酶链反应(qRT-PCR)收集和分析新鲜配对组织。所有病例均经本院病理科确诊。男21例,女19例,Ⅰ期1例,Ⅱ期4例,Ⅲ期3例,Ⅴ期32例,患者年龄40~90岁,平均(61.22±8.11)岁。本研究经医院伦理委员会批准。
1.2生物信息学分析:THE HUMAN PROTEINATLAS在线工具(https://www.proteinatlas.org/) 评估结肠癌肿瘤中MAP1LC3B 的 mRNA 和蛋白水平。此外,通过GEPIA(Gene Expression Profiling) 提供的在线工具交互分析(http://gepia.cancerpku.cn/) 和 UACLAN(http://ualcan.path.uab.edu/) 获得在线工具用于确定MAP1LC3B 表达和TCGA 队列中患者的临床病理要素以及MAP1LC3B表达的生存曲线。
1.3免疫组化方法:组织标本利用10% 中性福尔马林固定,石蜡包埋。切片脱蜡和水化后,通过3% 过氧化氢抑制内源性过氧化物酶活性,PBS冲洗三次后,将组织与兔抗人MAP1LC3B(1∶100;Santa Cruz,CA) 在 4℃下孵育过夜,经PBS缓冲液冲洗3次,5 min/次,再与抗兔 IgG 辣根过氧化物酶(1∶100;Dako,Glostrup,Denmark) 在室温下孵育1 h,使用 3,3'-二氨基联苯胺显示。苏木精复染后,观察切片。结果判断:MAP1LC3B定位于细胞浆或细胞核,随机选取10个高倍镜视野,每个视野观察100个细胞,采用半定量评分方法。
1.4Western印迹:使用组织匀浆器将肿瘤组织捣碎在一起,加入裂解缓冲液提取总蛋白(Solarbio,R0010)。14 000 r/min离心 15 min,取上清液,利用BCA蛋白进行蛋白定量。定量好的上清与上样缓冲液混合并100 ℃加热变性10 min。采用标准的Western分析蛋白质表达[9]。抗 MAP1LC3B 抗体(1∶500稀释,A-AO1709a,艾美捷,武汉,中国)被使用。等效的蛋白质负荷是使用小鼠抗体抗β-肌动蛋白(β-actin,1∶50 000稀释,ZSGB-BIO,TA-09,北京,中国)。
1.5统计学方法:采用SPSS21.0软件进行χ2检验,t检验和单因素方差分析。对 Kaplan-Meier 分析进行对数秩检验以估计患者的生存时间。单变量和多变量 Cox应用回归分析来衡量 MAP1LC3B 表达和其他临床参数在预后方面的值,P<0.05 为差异具有统计学意义。
2 结果
2.1结肠癌组织中MAP1LC3B的表达:TCGA和THE HUMAN PROTEINATLAS数据库结果显示,MAP1LC3B在结肠癌组织和癌旁组织中表达无显著差异(P>0.05),但本院样本免疫组化结果表明,MAP1LC3B在结肠癌组织中的表达阳性率为72.50%(29/40),明显高于癌旁组织组[40.00%(8/20)],差异具有统计学意义(χ2=6.332,P=0.001),见图1。
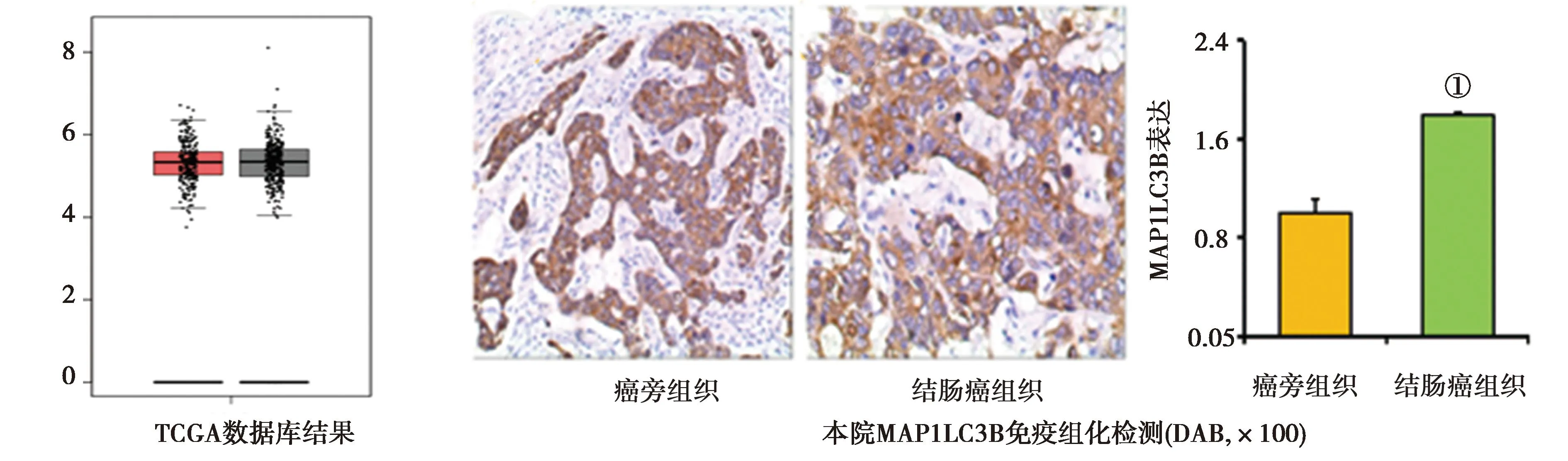
图1 结肠癌组织中MAP1LC3B的表达
2.2MAP1LC3B的表达与结肠癌临床病理参数的关系:TCGA和THE HUMAN PROTEINATLAS数据库结果显示,MAP1LC3B的表达水平与结肠癌的分期和转移未见显著差异(P>0.05),见图2;但在本院40例MAP1LC3B阳性组中,21例(72.41%)合并肝转移(P=0.001),且患者的TNM分期多为Ⅴ期患者,占79.31%(23例),与MAP1LC3B阴性组差异具有统计学意义(P=0.001),但MAP1LC3B的表达与结肠癌组织的分化程度(P=0.056)和淋巴结转移情况(P=0.265)未见统计学相关,见表1。
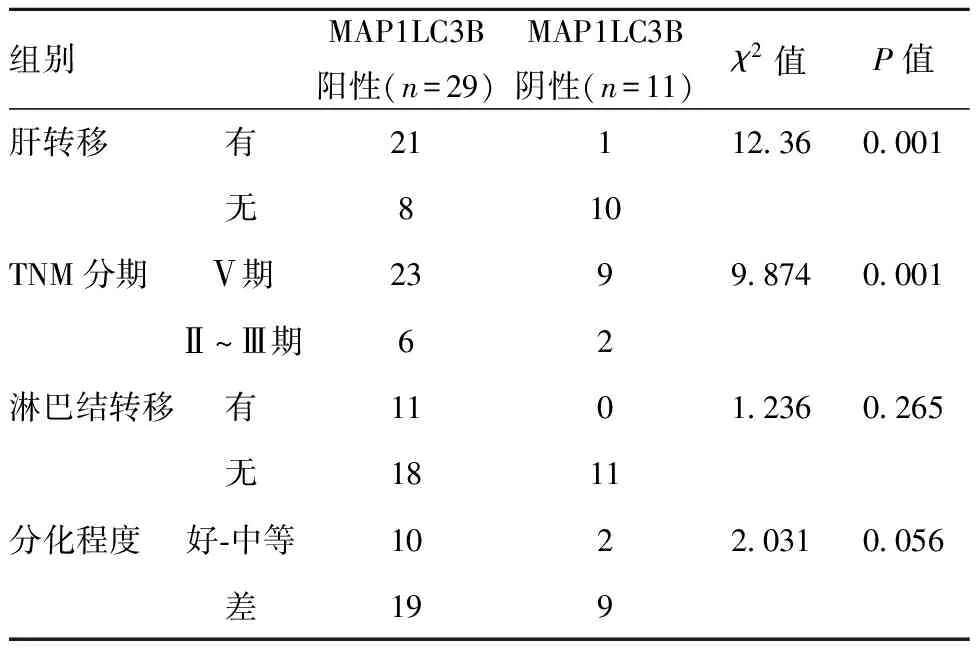
表1 MAP1LC3B表达与临床病理特征的关系(n)
2.3MAP1LC3B高表达与结肠癌患者免疫的关系:数据库分析结果显示,MAP1LC3B机体免疫细胞中表达水平较高,且在NK细胞、中性粒细胞、T细胞、B细胞等免疫细胞中,MAP1LC3B表达水平与CD8+ T细胞的功能最为密切(P=0.013),见图3。

注:A:MAP1LC3B在结肠癌患者免疫细胞中的表达情况;B: MAP1LC3B表达与结肠癌患者免疫细胞功能的关系
2.4MAP1LC3B的表达与预后的关系:TCGA和THE HUMAN PROTEINATLAS数据库结果显示,与MAP1LC3B的低表达MAP1LC3B患者相比,高表达患者生存时间明显缩短(P=0.048),见图4。

图4 MAP1LC3B的表达与预后的关系
3 讨论
自噬泛指溶酶体(酵母中为液泡)介导的细胞质降解过程。自噬体与溶酶体融合形成autolysosome,期间自噬体的内膜被溶酶体酶降解,二者的内容物合为一体,自噬体中的“货物”也被降解,产物(氨基酸、脂肪酸等)被输送到胞浆中,供细胞重新利用,而残渣或被排出细胞外或滞留在胞浆中[10]。研究发现,自噬的生物进化过程是高度保守的,无论是在酵母还是人体中,其自噬的相关基因有高度同源性。尽管自噬在癌症发展中还有其他争议,但是目前已经成为令人感兴趣的靶向治疗目标[11]。自噬通路和许多蛋白质均存在相关性,其中MAP1LC3B是最常见的信号蛋白,自噬系统的缺陷会导致肿瘤在不同器官中发生[12]。研究证实,MAP1LC3B参与了自噬体的形成,在自噬体的形成过程和半融合的过程中均发挥了重要的作用[13]。MAP1LC3B可以组合自噬体膜的Atg8p,参与肿瘤相关基因转录后的修饰,因此,其与恶性肿瘤中发生发展过程有密切的关系[14]。
本研究结果表明 MAP1LC3B 与结肠癌预后不良有关。这与以往的认知有所偏差,提示需要更多的数据来进一步分析MAP1LC3B在结肠癌中的作用。本结果表明,结肠癌组织中存在有较强的自噬活性,是结肠癌疾病进展的重要相关蛋白。本研究进一步根据MAP1LC3B蛋白的表达进行了二次分组,提示自噬活性可能参与了结肠癌的发生发展。特别是在淋巴结转移和肝转移组中,MAP1LC3B蛋白的表达存在显著性差异,同样提示自噬活性启动了细胞的部分缺失,有可能助力了的病情的进展以及患者出现淋巴结的转移[15-16]。
机体免疫在抵抗肿瘤的过程中发挥重要作用。自噬调节效应T细胞激活过程中的能量代谢。有研究发现,在携带 CD2Cre 转基因的小鼠中,Gimap6 基因在 T 和 B 细胞谱系中被删除,外周CD4+和 CD8+T 细胞减少了50%~70%,其中MAP1LC3B 水平升高,特别是脂化 LC3-Ⅱ形式和 SQSTM1 的 S405 磷酸化,提示MAP1LC3B 诱导的自噬紊乱抑制了效应T细胞的激活[17]。为进一步分析MAP1LC3B加速结肠癌死亡的机制,通过GEPIA数据库分析发现,MAP1LC3B机体免疫细胞中表达水平较高,且在NK细胞、中性粒细胞、T细胞、B细胞等免疫细胞中,MAP1LC3B表达水平与CD8+ T细胞的功能最为显著(P=0.013)。这表明MAP1LC3B可能通过调控自噬抑制了CD8+ T细胞表达,从而加剧免疫相关基因的紊乱,导致了免疫细胞功能的损害,导致肿瘤的免疫逃逸。
综上,研究已经证实 MAP1LC3B 的表达水平是结肠癌发生和发展的重要因素。MAP1LC3B 可能是一个结肠癌患者的新型转移和预后生物标志物。在未来,将在体内和体外进行MAP1LC3B的实验进一步研究 MAP1LC3B 在结肠癌中的作用,以通过更积极的治疗改善提高患者的生存率。然而,它的P值接近 0.05,这可能归因于使用的少量组织样本。由于参与之前工作的患者数量有限,有必要基于大样本调查进一步确定 MAP1LC3B 是否可以作结肠癌患者总生存期的预测因子。
