慢性乙型肝炎患者血清HBV RNA水平与核苷(酸)类似物治疗时间的关系
2024-02-19范雪莉詹爱琴田丽艳
范雪莉,詹爱琴,安 轶,田丽艳
1 石河子大学医学院,新疆 石河子 832000
2 石河子大学医学院第一附属医院感染科,新疆 石河子 832000
3 中国医科大学第一临床学院,沈阳 110001
慢性乙型肝炎(CHB)是由HBV 入侵人体所引起的一类以肝脏慢性炎症为主并可导致多种肝脏相关并发症的一种传染性疾病[1-2]。目前长期核苷(酸)类似物(NAs)治疗是抗HBV 治疗的主要方案[1]。CHB 患者治愈的金标准是清除肝组织中的共价闭合环状DNA(cccDNA)[3],然而NAs 是通过持续的病毒学抑制来减少肝脏相关结局K 的风险,无法彻底清除肝细胞核内的cccDNA[4-5],因此,即使检测不到HBsAg 的存在,达到“功能性治愈”的标准,一旦停药,仍有HBV 再激活的风险[1],这也是CHB 患者肝炎迁延不愈的原因所在。所以,在CHB 患者的治疗过程中,准确评估感染肝细胞中cccDNA 的转录活性,对于如何以及何时调整CHB 患者的治疗方案具有重要作用。肝细胞中cccDNA 的检测因其有创性而难以普及[6],传统的HBsAg、HBeAg 及HBV DNA 检测可以在一定程度上反映cccDNA 的状态,是目前乙型肝炎患者诊断与疗效判断的主要指标,而近年来的多项研究发现当病毒的逆转录、DNA 复制水平受到抑制时,患者血清中的乙型肝炎前基因组RNA(pgRNA)水平可以与传统检测指标的结果相互补充反映患者体内的病毒水平[7]。HBV pgRNA 是cccDNA 的直接转录产物,2015 年之后陆续有研究发现血清中所发现的HBV RNA 是存在于病毒样衣壳内,由细胞核中未逆转录成HBV DNA 的pgRNA 被病毒外包膜包裹后从被感染的肝细胞内释放至患者的外周血中。pgRNA 由cccDNA 直接转录而来,且不受NAs 作用机制的影响,因此被认为是肝细胞内HBV复制和治疗反应的新型生物标志物,能作为客观评价抗病毒疗效及判定合适的停药时机的反应预测标记[8-15]。本研究通过检测临床确诊的CHB 患者的血清HBV RNA 水平,分析其与NAs 抗病毒治疗时间及HBV DNA、HBsAg 的关系,为临床判断CHB 患者抗病毒疗效提供一定的数据支持。
1 资料与方法
1.1 研究对象 纳入2022年2月—2022年7 月就诊于石河子大学医学院第一附属医院的300 例CHB 患者为研究对象。纳入标准:(1)CHB 诊断符合我国《慢性乙型肝炎防治指南(2019年版)》[1]中的诊断标准;(2)具有完整的病史资料;(3)年龄>18岁,无性别限制,均为汉族。排除标准:(1)合并有其他病毒性肝炎或人类免疫缺陷病毒感染者;(2)自身免疫性肝炎、酒精性肝病、药物性肝病或其他原因导致的严重肝损伤者;(3)合并有肝癌或其他系统恶性肿瘤患者;(4)妊娠或儿童;(5)伴有严重心、肺、肾等脏器损害者。
1.2 研究方法
1.2.1 临床资料收集 收集患者的病史资料,包括性别、年龄,血清HBV RNA、HBV DNA、HBsAg、HBeAg、ALT、AST、抗病毒药物及治疗时间等。
1.2.2 血清HBV RNA水平检测 采集患者静脉血5 mL,-20 ℃保存,采用同步扩增检测方法,使用HBV SAT检测试剂盒(上海仁度生物科技有限公司),按照核酸检测试剂盒使用说明书进行检测。检测分为核酸捕获和实时荧光核酸恒温扩增检测两部分,其中提取、扩增、检测及样本最终RNA 结果计算全部由AutoSAT 全自动核酸检测系统自动完成。该试剂盒最低检测下限为100拷贝/mL,检测范围102~108拷贝/mL,>108拷贝/mL高于检测上限。
1.2.3 血清HBV DNA、HBsAg、HBeAg、ALT、AST 水平检测 分别采用相应试剂盒或程序进行检测,由本院医学实验室专职检测人员完成。
1.3 统计学方法 使用软件SPSS 26.0 及GraphPad Prism 8 对数据进行分析处理。计量资料以M(P25~P75)表示,两组间比较采用Mann-WhitneyU检验,多组间比较采用Kruskal-WallisH检验,进一步两两比较采用Bonferroni 校正法;计数资料组间比较用χ2检验。采用Spearman 相关分析比较各指标间相关程度。P<0.05 为差异具有统计学意义。
2 结果
2.1 一般资料 300 例CHB 患者中HBeAg 阳性55 例(18.3%),HBeAg阴性245例(81.7%)。HBeAg阳性组与HBeAg 阴性组患者的年龄及血清HBV RNA、HBV DNA、HBsAg、ALT、AST 水平分布差异均有统计意义(P值均<0.05)(表1)。
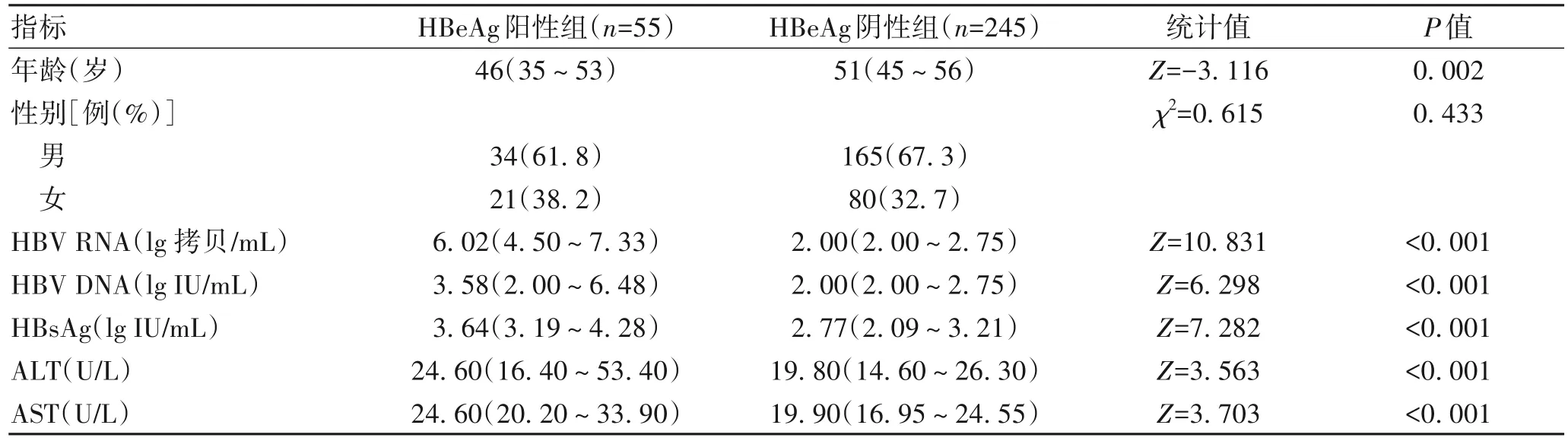
表1 一般资料比较Table 1 Comparison of general data
2.2 不同的抗病毒药物对各指标的影响 经治患者共227 例,其中使用恩替卡韦抗病毒治疗者180 例,使用替诺福韦者46例,联合使用恩替卡韦及替诺福韦抗病毒治疗者1 例,不同治疗药物的HBV DNA、HBV RNA 检出率与HBV DNA、HBV RNA、HBsAg 水平分布情况均无统计学意义(P值均>0.05)(表2)。
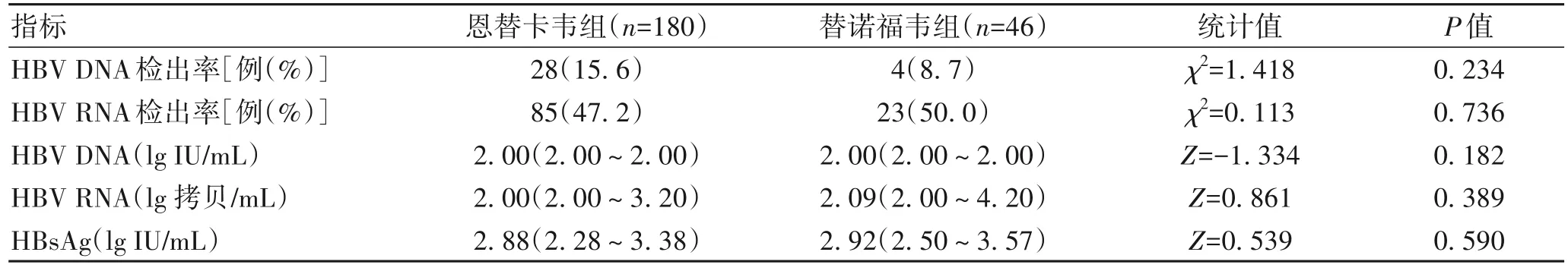
表2 不同的抗病毒药物对各指标的影响Table 2 Effects of different antiviral drugs on various indicators
2.3 抗病毒治疗时间不同分组各指标差异及相关性未治疗组、治疗时间≤1 年组、治疗时间>1 年组间HBV RNA、HBV DNA、HBsAg水平分布均具有统计学差异(P值均<0.05),进一步两两比较,其中未治疗组与治疗时间≤1 年组仅有DNA 水平分布情况有统计学差异(P<0.05);未治疗组与治疗时间>1 年组HBV RNA、HBV DNA 水平分布有统计学差异(P值均<0.05);治疗时间≤1年与治疗时间>1 年组中HBV RNA、HBV DNA、HBsAg 水平分布情况均有统计学差异(P值均<0.05)(表3)。相关性分析显示,抗病毒治疗时间与HBV RNA、HBsAg水平呈极弱负相关(r值分别为-0.247、-0.138,P值均<0.05),与HBV DNA水平呈强负相关(r=-0.771,P<0.001)。
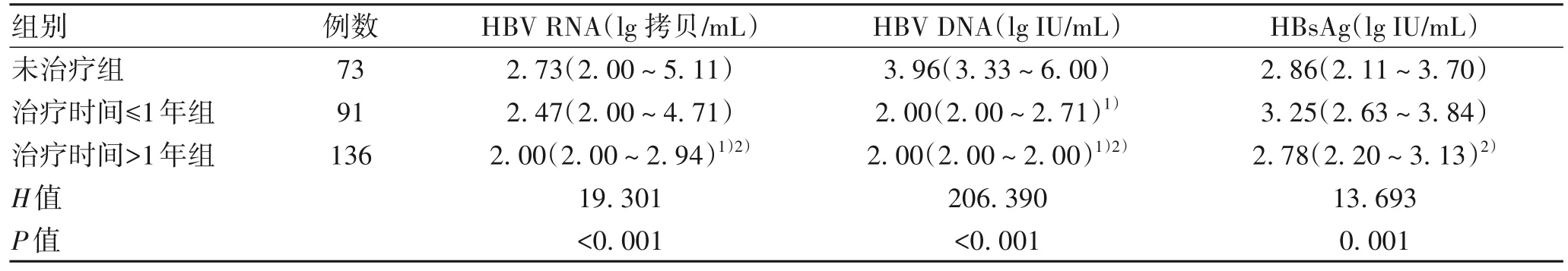
表3 抗病毒治疗时间不同HBV RNA、HBV DNA、HBsAg水平差异Table 3 Differences in HBV RNA,HBV DNA,and HBsAg levels at different times of antiviral treatment
2.4 血清HBV RNA 与HBV DNA、HBsAg 水平的相关性血清HBV RNA 与HBV DNA、HBsAg 水平呈低度相关(r值分别为0.360、0.442,P值均<0.001)(图1);进一步分层分析,在未治疗组中,HBV RNA 与HBV DNA 水平呈强正相关(r=0.752,P<0.001),与HBsAg 水平呈中度正相关(r=0.559,P<0.001);在治疗时间≤1 年组中,HBV RNA 与HBV DNA、HBsAg 水平呈低度正相关(r值分别为0.396、0.388,P值均<0.001);在治疗时间>1 年组中,HBV RNA 与HBsAg 水平呈低度正相关(r=0.352,P<0.001),与HBV DNA水平无相关性(P=0.253)。

图1 HBV RNA与HBV DNA、HBsAg的相关性Figure 1 Correlation of HBV RNA with HBV DNA and HBsAg
2.5 经治患者抗病毒的应答情况与血清HBV RNA 的关系 血清HBV DNA 阳性者共105 例,HBV DNA 阴性者共195 例,在HBV DNA 阴性者中HBV RNA 阳性者占比44.1%(86/195)。而在经治患者中,HBV DNA 阴性者195 例,HBV DNA 阳性者32 例,其中,治疗时间≤1 年的患者,在HBV DNA 阴性者中HBV RNA 阳性者占比55.6%(35/63);治疗时间>1年的患者,在HBV DNA阴性者中HBV RNA 阳性者占比38.6%(51/132),两组比较差异有统计学意义(χ²=4.952,P=0.026)。
3 讨论
CHB 患者需要长期治疗且反复发作的根本原因是肝细胞中的cccDNA 难以被完全清除[16-17],这是患者体内所有病毒RNA 来源的初始模板。HBsAg 在CHB 患者的治疗过程中可以用来提示cccDNA 的活性,但是因为cccDNA 与整合的HBV 基因组皆是HBsAg 的来源,所以缺乏足够的准确性。而pgRNA理论上仅来源于cccDNA,其未启动逆转录过程,被病毒外包膜包裹后以病毒颗粒的形式被释放至血清中,因此目前有研究认为pgRNA 是较传统的病毒学检测指标能更好地反映cccDNA 转录活性的潜在临床标志物,可以用于监测目前抗病毒治疗的反应[8,18-19]。而鲁凤民等[10]也提出应将血清HBV RNA 和HBV DNA 水平皆低于检测下限作为新的病毒学应答标准。本研究分析发现,使用不同的NAs 治疗对于血清HBV RNA、HBV DNA的检出率及HBV RNA、HBV DNA载量和HBsAg 的浓度没有明显的影响,提示不同NAs 的疗效相似。而HBeAg 阳性组年龄小于HBeAg 阴性组,这与彭亚梦等[20]的研究结果相似,提示HBeAg阴转与年龄有关。同时HBeAg 阳性组中患者血清HBV RNA、HBV DNA、HBsAg水平皆显著高于HBeAg阴性组,提示HBeAg阳性患者cccDNA转录活性高于HBeAg阴性患者。
本研究相关性分析结果显示,血清HBV RNA 与HBV DNA、HBsAg 水平呈低度相关(HBV DNA:r=0.360,HBsAg:r=0.442,P值均<0.001),根据患者抗病毒治疗时间不同将患者分为3组,分层分析显示HBV RNA与HBV DNA、HBsAg 水平的相关性随着治疗时间的延长逐渐下降,这与王成康等[21]的研究结果相同。虽然血清HBV RNA 水平变化与抗病毒治疗时间仅呈极弱负相关(r=-0.247,P<0.05),但是血清HBV RNA 与HBV DNA 水平变化趋势一致,比较发现未治疗组HBV RNA、HBV DNA水平显著高于治疗时间>1 年组、治疗时间≤1 年组HBV RNA、HBV DNA 水平显著高于治疗时间>1 年组,虽然未治疗组与治疗时间≤1年组HBV RNA 水平分布情况无明显差异,但总体来看抗病毒治疗的疗程越长,HBV RNA、HBV DNA 水平越低,与其他学者[22-23]的研究结果相似,不同结果可能与患者个体差异有关。而在HBV DNA 阴性患者中,仍有40.4%的患者外周血中可以检测到HBV RNA存在,与其他研究[24]结果一致,且HBV RNA阳性者在HBV DNA 阴性者中的占比随着治疗时间的延长而明显降低,研究[8]表明HBV RNA 下降水平与HBV DNA 下降水平并不一致,HBV RNA 水平下降远慢于HBV DNA水平,这提示当患者出现病毒学应答后,可以根据患者HBV RNA 水平评估抗病毒疗效及cccDNA 的活性。而HBsAg 水平并不完全遵循这一规律,这在一定程度上反映了HBsAg 水平不能准确地反映CHB 患者体内病毒复制情况。
综上所述,血清HBV RNA水平或许可以与HBV DNA、HBsAg 水平等指标共同监测CHB 患者抗病毒治疗的效果,尤其在未治疗患者中反映病毒复制水平方面的准确性较高,在HBV DNA 水平低于检测下限时可以弥补无法快速、准确检测病毒学水平的空缺。
伦理学声明:本研究方案于2023 年1 月28 日经由石河子大学医学院第一附属医院伦理委员会审批,批号为KJX2022-074-01。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:范雪莉负责收集数据,资料分析,撰写论文,拟定写作思路及修改论文;詹爱琴参与修改论文及最后定稿;安轶、田丽艳负责收集数据,资料分析。
