隐丹参酮通过调节TGF-β/Smad通路改善高氧诱导肺损伤的纤维化过程
2024-02-18马萌萌包天平曹林霞李靖燕余冰睿田兆方
马萌萌,包天平,曹林霞,李靖燕,余冰睿,田兆方
南京医科大学附属淮安第一医院新生儿科,淮安市小儿呼吸诊疗重点实验室,江苏 淮安 223300
支气管肺发育不良(bronchopulmonary dysplasia,BPD)是早产儿常见的一种慢性呼吸系统疾病,在出生胎龄<29周的新生儿中发病率高达45%[1-2]。BPD的发病机制目前仍未明确,其主要的病理学特点包括肺泡破坏、纤维化、微血管发育异常以及气道损害[3],其中肺纤维化是BPD 的主要病理特征。在高氧诱导的BPD 模型中,肺泡的发育、修复和再生受到成纤维细胞的影响,从而导致细胞外基质(extracellular matrix,ECM)的重塑及纤维化的发展,导致肺部纤维化进一步加重[4]。目前,对于这种长期存在的慢性呼吸道疾病,既不能预防也不能有效治疗,因此寻找BPD的特效药十分重要。
隐丹参酮(cryptotanshinone,CTS)是从传统中药丹参中提取的一种活性成分,其生物学活性丰富,具有抗炎[5]、抗纤维化[6]、抗肿瘤[7]及神经保护[8]等作用。近期研究表明,CTS 可以通过逆转上皮间充质转化[9]、抑制Smad及STAT3通路[10]来改善博来霉素诱导的肺纤维化,但在高氧诱导的肺损伤纤维化中,尚无相关报道,本研究利用高氧诱导新生鼠BPD 模型及体外人胚肺成纤维细胞培养模型,旨在探讨CTS在高氧引致的肺纤维化中的作用及机制。
1 材料和方法
1.1 材料
CTS(纯度≥98%,批号HY-NO174,MCE 公司,美国);α-SMA、TGF-β1、Smad2、p-Smad2、Smad3(Abcam 公 司,英 国);p-Smad3(批号9520T,CST公司,美国);GAPDH(批号6004-1-ig,武汉三鹰Proteintech 公司);Ham’s F-12K 培养基(批号A211013,上海BasalMedia公司);RIPA裂解液、蛋白酶抑制剂、磷酸酶抑制剂、ECL 发光液(苏州新赛美生物科技有限公司);逆转录试剂盒、聚合酶链反应试剂盒、CCK-8 溶液(批号分别为PE5402、PC5902、PC001,南京Proteinbio公司)。
CY-12c 型测氧仪(杭州佳长电子科技有限公司);LightCyclePCR 仪(Roche 公司,美国);酶标仪(BioTek公司,美国);电泳仪、凝胶成像仪(BIO-RAD公司,美国)。
人胚肺成纤维细胞(HFL-1)购于无锡欣润生物科技有限公司,培养于含10%胎牛血清的Ham’s F-12K 培养基中,置于含5%CO2的37 ℃恒温培养箱中。SD 大鼠[生产许可证编号SCXK(京)2019-0010]饲养于南京医科大学附属淮安第一医院,选取12周龄的SD大鼠按雄雌比例1∶3进行合笼,待所有孕鼠自然分娩后选取24 h 内雄性SD 大鼠用。本研究已获得南京医科大学附属淮安一院伦理委员会批准(伦理编号:DW-P-2023-001-10)。
1.2 方法
1.2.1 动物分组与造模
新生SD雄性大鼠随机分为5组,每组8只,分别为空气组、高氧组、CTS 低剂量组(7.5 mg/kg)、CTS中剂量组(15 mg/kg)及CTS 高剂量组(30 mg/kg)。高氧组及CTS 干预组连续吸入95%O27 d,空气组置于室内环境(21%O2)中7 d。每日8:30—9:30开箱操作,CTS溶于DMSO中进行腹腔注射,高氧组及空气组同时注射等量的DMSO。氧浓度分析仪连续监测箱内氧气浓度,并放置钠石灰吸收老鼠呼出的CO2,哺乳鼠每日在高氧和空气环境之间交换,以防止母鼠不耐受高氧出现死亡情况。7 d后对全部鼠实施安乐死,立即取左肺上叶用4%多聚甲醛固定供)苏木精-伊红(hematoxylin-eosin,HE)和马松(Masson)染色实验用,剩余肺组织置于-80 ℃冰箱中待测。
1.2.2 肺组织病理学检测
左肺上叶用4%多聚甲醛固定过夜后包埋在蜡块中,切成4 μm厚的连续切片,之后在室温条件下进行HE染色以及Masson染色。根据HE染色情况,每张切片随机选取6个视野,取平均值计算辐射肺泡状计数(radical alveolar counts,RAC),并根据Masson染色结果参考文献[11-12]进行纤维化评分。
1.2.3 RT-qPCR
提取肺组织总RNA 后,使用逆转录试剂盒逆转录为cDNA,按照聚合酶链反应试剂盒说明加入2×SYBR qPCR Mix 12.5 μL、cDNA 1 μL、前引物(10 μmol/L)0.5 μL 和后引物(10 μmol/L)0.5 μL,最后ddH2O定容至25 μL后在实时荧光定量PCR仪器上进行PCR 扩增。引物序列为:TGF-β1 F:5′-CCTGGACACACAGTACAGCA-3′;TGF-β1 R:5′-CCACGTAGTAGACGATGGGC-3′;α-SMA F:5′-CATCCGACCTTGCTAACGGA-3′;α-SMA R:5′-CCACATACATGGCAGGGACA-3′。
1.2.4 HFL-1细胞分组及处理
取对数生长期的HFL-1 细胞分为3 组,即空气组、高氧组及CTS干预组,均匀铺于6孔板,细胞饥饿12 h后干预组予CTS 10 μmol/L处理,高氧及空气组加入等量的溶剂DMSO,随后高氧组及CTS干预组置于95%O2、5%CO2、37 ℃恒温培养箱中培养24 h。
1.2.5 CCK-8测定HFL-1细胞活力
HFL-1细胞以5×104个/mL的密度均匀铺于96孔板,并在培养箱中培养过夜,将不同浓度溶于DMSO的CTS(0、2.5、5.0、10.0 μmol/L)处理细胞24 h,之后每孔加入10 μL 的CCK-8 溶液继续孵育2 h,使用酶标仪在450 nm处测量每个孔的吸光度值,每孔设4个复孔取平均值,重复实验3次。
1.2.6 Western blot
提取各组新生SD 鼠肺组织及HFL-1 细胞的总蛋白,使用BCA法测定总浓度,然后在SDS-PAGE凝胶电泳中分离蛋白质样品并湿转到PVDF 膜上,之后脱脂牛奶溶液封闭1 h 后与以下一抗4 ℃孵育过夜:α-SMA(1∶1 000)、TGF-β1(1∶1 000)、Smad2(1∶500)、p-Smad2(1∶2 000)、Smad3(1∶1 000)、p-Smad3(1∶1 000)、GAPDH(1∶2 000)。TBST 洗膜后与二抗室温孵育1 h,最后使用超强发光液在凝胶成像系统进行曝光Image J 软件定量分析。
1.3 统计学方法
所有数据采用统计软件SPSS 27.0进行分析,计量资料以均数±标准差()表示,采用单因素方差分析比较各组数据,LSD-t检验进行两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 CTS对新生SD大鼠肺组织病理学影响
HE染色显示高氧组较空气组肺泡结构紊乱,肺泡形态变大,数目减少,RAC值下降(P<0.05);不同剂量的CTS干预后肺泡形态好转,RAC值也较高氧组明显上升(P<0.05,图1)。
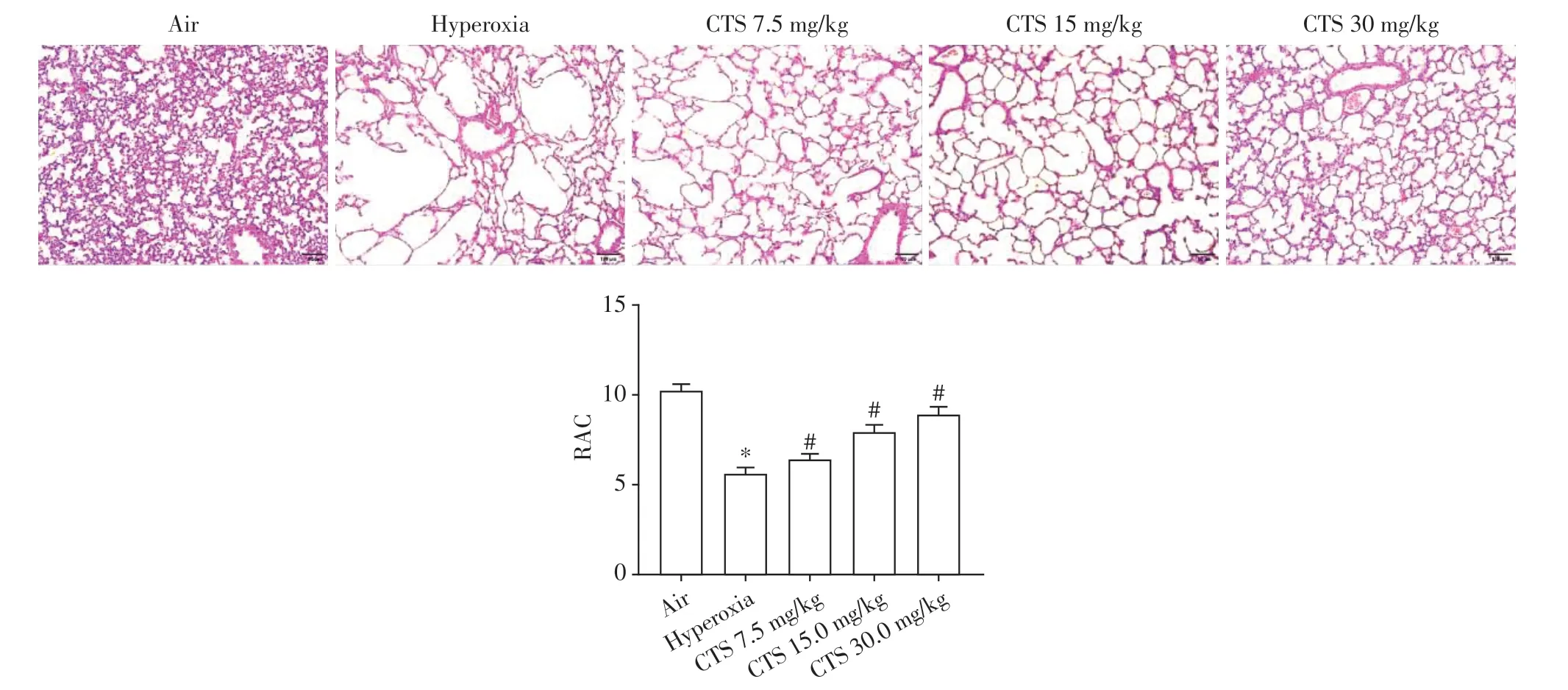
图1 SD新生大鼠肺组织HE染色(×100)Figure 1 HE staining of lung tissue from neonatal SD rats(×100)
Masson 染色结果显示,与空气对照组相比,高氧组胶原纤维含量明显上升,肺泡排列不规则,肺泡间隔增厚。CTS 干预后纤维化评分较高氧组降低,其中高剂量的CTS 效果最好(P<0.05,图2)。
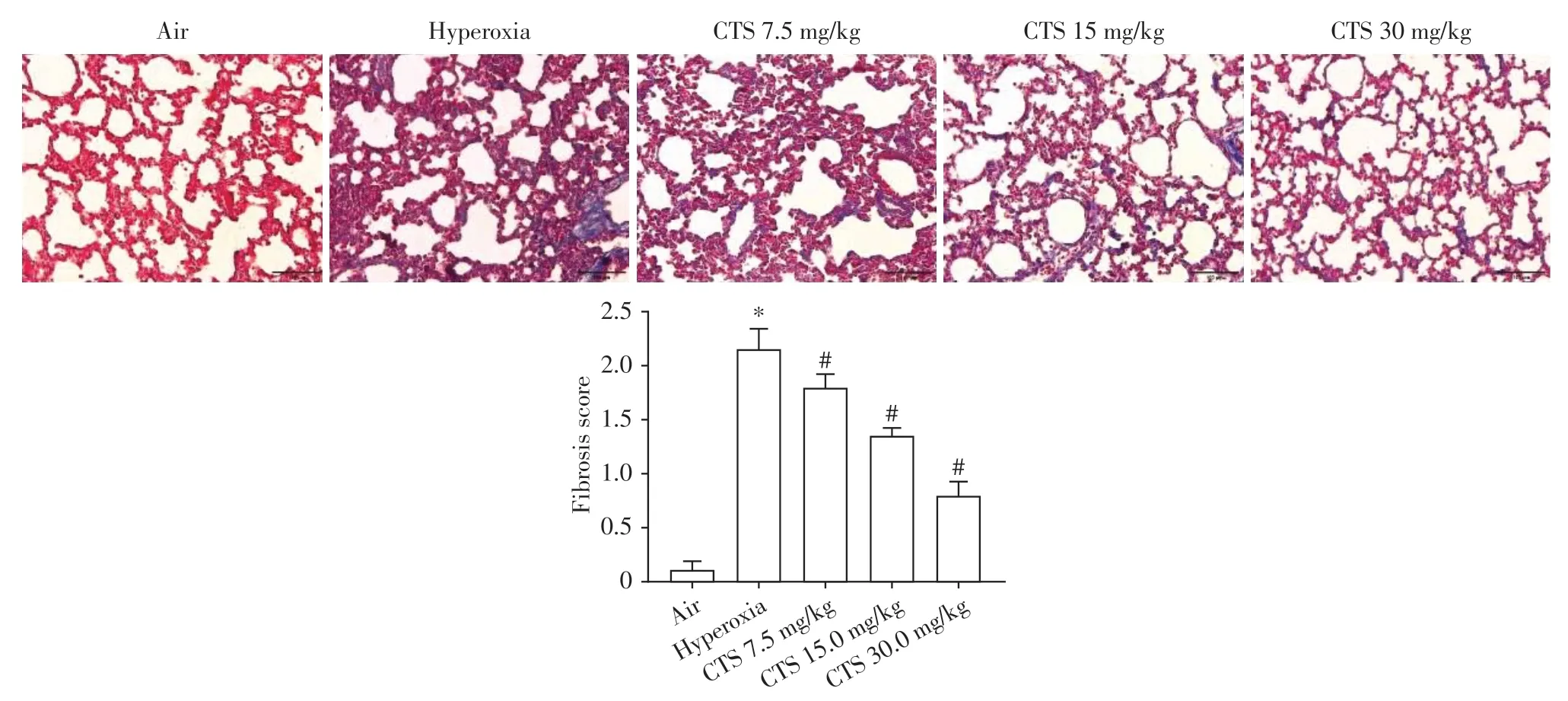
图2 SD新生大鼠肺组织Masson染色(×200)Figure 2 Masson staining of lung tissue from neonatal SD rat(×200)
2.2 CTS 对SD 新生大鼠肺组织中TGF-β1 及α-SMA mRNA水平影响
模型组SD 新生大鼠肺中TGF-β1(图3A)及α-SMA(图3B)的mRNA表达水平较空气组明显升高,不同剂量的CTS 干预后逐渐好转,较高氧组明显下降(P<0.05)。
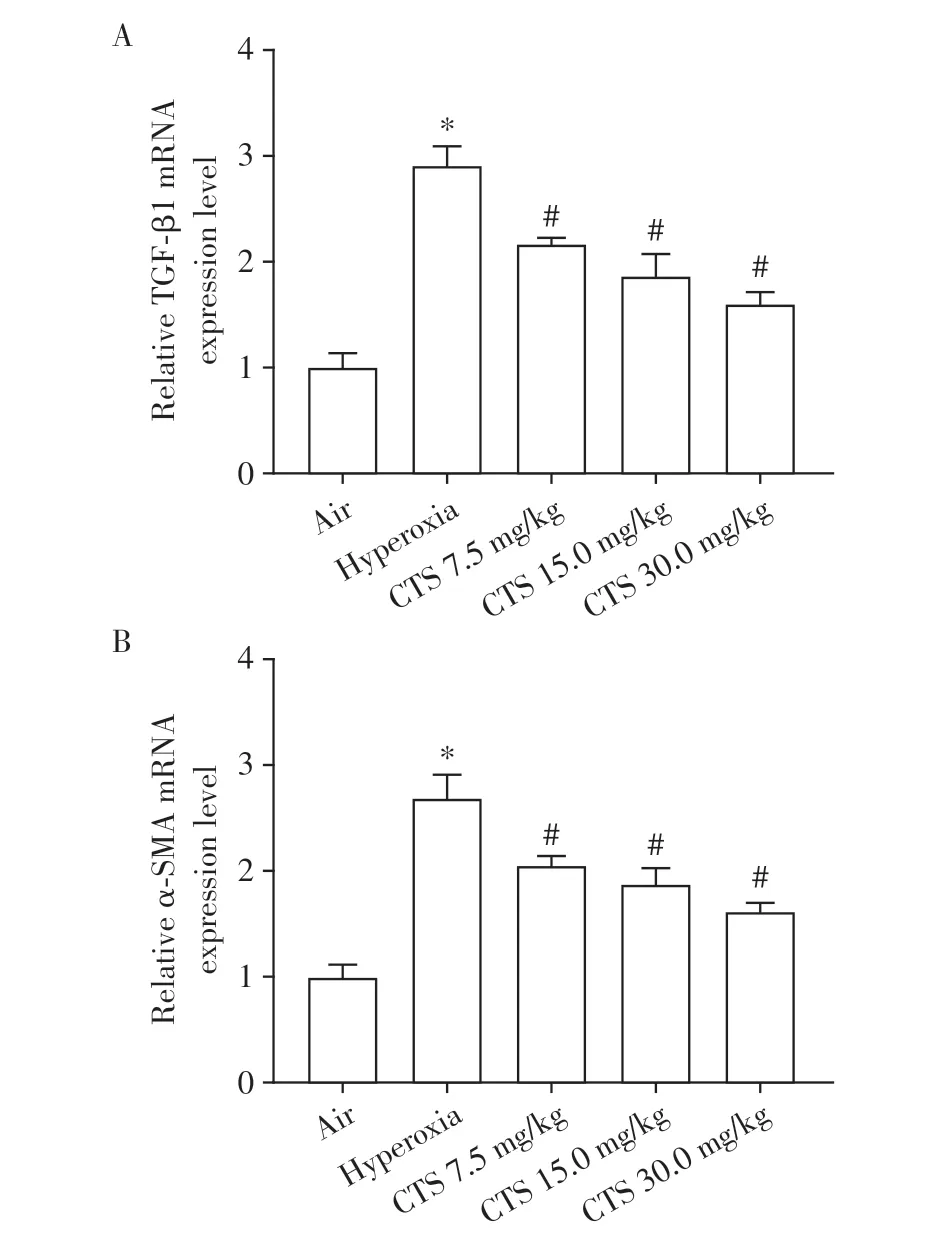
图3 各组新生SD 大鼠肺组织中TGF-β1 及α-SMA 的mRNA 表达水平Figure 3 mRNA expression levels of TGF-β1 and α-SMA in neonatal SD rats lung tissue in each group
2.3 CTS 对SD 新生大鼠肺组织中Smad2/3 通路蛋白表达的影响
Western blot 检测结果显示高氧暴露后,模型组的p-Smad2/Smad2 蛋白水平较空气对照组明显升高(P<0.05,图4A、B),p-Smad3/Smad3 在高氧组明显上升(P<0.05,图4A、C),p-Smad2/Smad2及p-Smad3/Smad3比值在CTS处理后呈剂量依赖方式降低(P<0.05)。
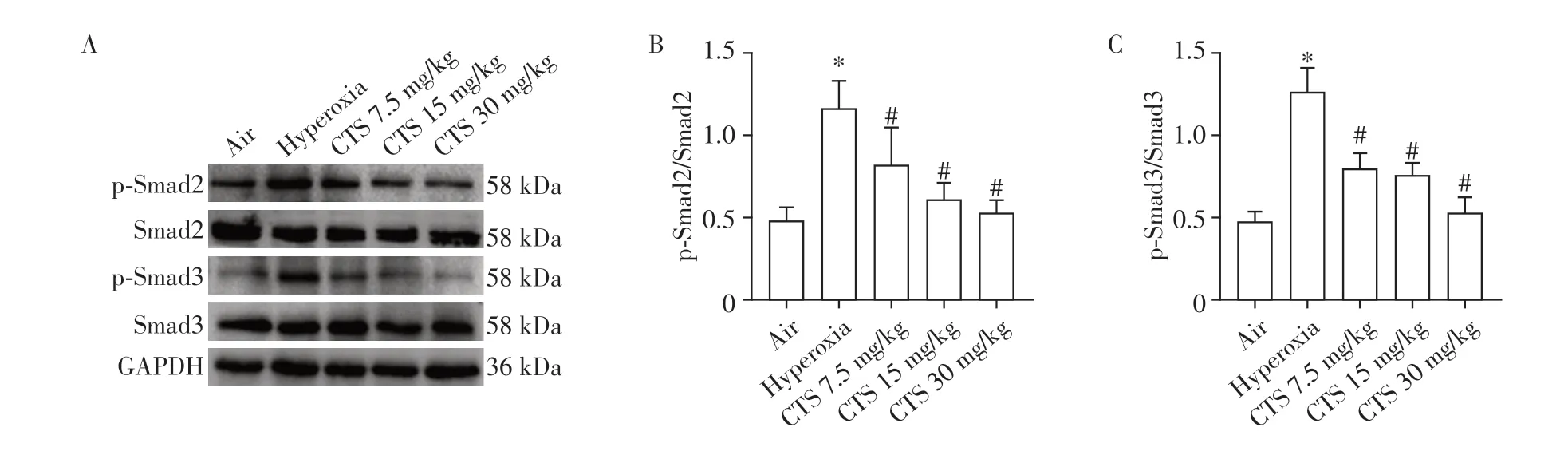
图4 新生SD大鼠肺组织Smad2/3通路蛋白表达情况Figure 4 Smad2/3 pathway protein expression in lung tissue of neonatal SD rats
2.4 CTS对体外HFL-1增殖活力的影响
体外研究中,首先用不同浓度CTS(2.5、5.0、10.0 mmol/L)处理HFL-1细胞后,细胞的增殖活力均在95%以上,其中CTS 10.0 μmol/L 以内各组与对照组无统计学差异(P>0.05,图5A),提示10 μmol/L浓度以内的CTS不影响细胞增殖,故选用10 μmol/L的CTS 用于后续实验。在高氧条件下,细胞增殖活力受到影响,高氧组较空气组下降,但CTS处理后可以提高细胞活力(P<0.05,图5B)。
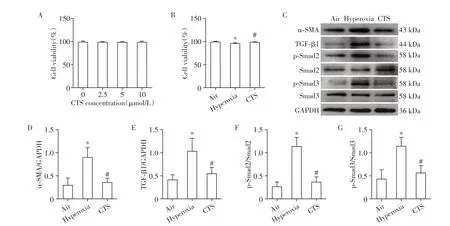
图5 CTS通过激活TGF-β/Smad信号通路降低高氧下HFL-1细胞的α-SMA水平,提高HFL-1细胞活力Figure 5 CTS reduced α-SMA levels by activating TGF-β/Smad signalling pathway and improved viability of HFL-1 cells
2.5 CTS 对HFL-1 细胞α-SMA 及TGF-β/Smad 通路蛋白表达的影响
体外实验中,高氧诱导HFL-1细胞后,细胞内的α-SMA 表达明显上升,在CTS 处理后表达下降(P<0.05,图5C、D)。在TGF-β1/Smad 通路蛋白表达中,高氧组与空气组相比,TGF-β1及Smad2/3磷酸化蛋白含量上升,CTS组较高氧组明显下降(P<0.05,图5C,E~G)。
3 讨论
BPD 不仅是一种局部的肺部疾病,也是一种全身性疾病,对患儿成年以后的健康和生活质量具有一定影响[13-15],随着目前医疗水平的提高,BPD的生存率虽然提高了,但不幸的是其发生率仍然居高不下[16],且目前仍然没有特效治疗药物,因此BPD 在新生儿呼吸系统疾病中一直备受关注。CTS是一种从传统中药丹参中提取的一种天然化合物,其生物学活性丰富,在多种疾病中具有潜在的治疗价值[17],本研究主要探索CTS 在BPD 相关纤维化中是否发挥作用。
纤维化作为BPD 的主要病理特征在BPD 的发展中占据重要地位,在肺部发育中,成纤维细胞可维持肺泡和支气管的完整性,但在高氧诱导之后会发生显著的形态学变化[18-19],可进一步分化为肌成纤维细胞,使得肺泡上皮-间充质信号转导被破坏,不能正常维持上皮细胞的生长和分化,导致肺部出现异常修复并最终出现纤维化[20-21]。目前,高氧在BPD 发展中的作用已在实验模型和临床试验中得到证实,高氧诱导的BPD实验动物模型已经被广泛运用[22],本研究通过高氧BPD模型发现,CTS改善了BPD 模型新生大鼠的肺部病理情况,特别是纤维化现象,体内外结果均显示纤维化标志物α-SMA的水平降低,提示CTS 可改善高氧诱导的肺纤维化从而起到肺部保护作用。
生长因子TGF-β被认为是肺发育异常的主要调节因子,通过TGF-β/Smad2/3 的典型信号转导调节早期肺发育[23-24],该通路与异常肺泡化关系密切,TGF-β1还可诱导成纤维细胞迁移、肌成纤维细胞的增殖和分化以及ECM的沉积[25],目前TGF-β靶基因越来越被认为是BPD 的致病因素[26]。TGF-β1 启动了成纤维细胞向肌成纤维细胞的转化,并导致标志性蛋白α-SMA的显著增加[27],这表明抑制纤维化细胞因子TGF-β1 和靶向TGF-β信号通路是BPD 中纤维化治疗的潜在策略。本研究结果显示CTS可以降低高氧后肺组织及HFL-1中的TGF-β1水平,同时降低下游Smad2/3 的磷酸化表达含量,表明CTS 可能通过TGF-β1/Smad 通路在BPD 模型中发挥抗纤维化的作用。
综上所述,CTS 对高氧诱导肺损伤的BPD 模型具有保护作用,降低纤维化标志物α-SMA 的水平,其机制可能与TGF-β1/Smad 通路有关,具体上下游的机制有待进一步研究。
