活化α7乙酰胆碱受体促进LPS刺激的人牙髓干细胞牙/骨向分化
2024-02-18李梦圆王宇萌徐青清卞成玥张光东
李梦圆,王宇萌,徐青清,关 卓,卞成玥,江 飞,张光东
南京医科大学附属口腔医院综合诊疗科,江苏省口腔疾病研究重点实验室,口腔医学转化研究中心,江苏 南京 210029
牙髓炎是口腔常见疾病之一,目前治疗牙髓炎的主流方法是摘除病变牙髓组织,行根管治疗,但失去牙髓的患牙丧失滋养、感觉、防御、形成功能,会出现牙冠变色、脆而易折、继发龋风险增加[1]。然而,临床上难以获得自体健康牙髓组织分离牙髓干细胞(dental pulp stem cell,DPSC),再通过组织工程策略再生牙髓组织。因此,如何利用病变牙髓组织中DPSC原位促进牙髓组织再生成为研究热点。由于牙髓组织具有较强抗感染及抵抗外界刺激等多种作用[2],DPSC在病变牙髓组织中依然可以存活并保留一定的再生能力,如何通过干预手段有效诱导这类再生功能受损的DPSC成牙本质细胞向分化成为该热点的具体研究方向。
钙离子(calcium ion,Ca2+)与DPSC成牙本质细胞向分化、促进牙体硬组织的再生有密切联系。据报道,促进细胞Ca2+内流,可激活一系列牙/骨向分化相关信号转导通路,诱导DPSC 的成牙本质向分化[3]。改变牙髓炎组织中DPSC的再生潜能,使之通过向成牙本质细胞分化,参与牙髓-牙本质复合体再生[4]。α7乙酰胆碱受体(alpha 7 nicotinic acetylcholine receptor,α7-nAChR)是一种烟碱乙酰胆碱受体,广泛存在于神经元和非神经元细胞中,在牙髓细胞中表达。它是由5 个α7 单体组成的同型五聚体,在胆碱能抗炎通路中发挥重要作用[5]。α7-nAChR 是胆碱能抗炎通路的重要组成部分,α7-nAChR 激动剂PNU-282987 能够抑制肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)和白介素-1β(interleukin-1 beta,IL-1β)等多种促炎因子的分泌[6]。同时,该受体表现出对Ca2+的高选择性渗透性,从而对细胞内Ca2+水平进行调控[7]。研究指出,α7-nAChR 参与牙体硬组织形成的初始阶段,可能与该受体对钙的高渗透性相关[8]。此外,α7-nAChR在新形成的软骨内和骨髓骨化骨基质中表达强烈[9],证明其与成骨之间的独特联系。研究表明,α7-nAChR 抑制剂MLA会抑制细胞内Ca2+的瞬变,可以使激动剂引起的Ca2+内流快速衰减,同时抑制细胞内Ca2+震荡的频率[10]。而该受体的激动剂PNU-282987,通过增加α7-nAChR 通道的开启时间来加强Ca2+内流作用[11]。因此,本研究认为,活化α7-nAChR,诱导Ca2+内流,能够促进再生功能受损的DPSC成牙本质细胞向分化。
目前已有许多关于α7-nAChR在炎症治疗中的研究,但是与牙髓炎状态下DPSC成牙本质细胞向分化的研究未有报道。本研究拟通过分离培养DPSC,大肠杆菌脂多糖(lipopolysaccharide,LPS)刺激DPSC模拟牙髓炎中再生功能受损的DPSC。通过α7-nAChR激动剂PNU-282987,活化该受体,验证活化α7-nAChR是否可以促进胞外Ca2+内流增加,诱导炎症刺激下DPSC 牙/骨向分化发挥的作用,为研制新型盖髓剂用于临床活髓保存治疗提供助益。
1 材料和方法
1.1 材料
PNU-282987(MCE 公司,美国),LPS(Sigma 公司,美国),基础培养基α-MEM(Gibco 公司,美国),胎牛血清(fetal bovine serum,FBS,Gibco 公司,美国),磷酸盐缓冲液(phosphate buffer solution,PBS,Hyclone公司,美国),青霉素-链霉素(Gibco公司,美国),胰蛋白酶(Gibco 公司,美国),Ⅰ型胶原酶(Sigma 公司,美国),SDS-PAGE 凝胶试剂盒(上海碧云天),蛋白Marker(Fermentas 公司,美国),RUNX2 抗体、DSPP 抗体、OSX 抗体、OPN 抗体、COL-I 抗体、ALP 抗体、抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(Abcam 公司,美国),CCK-8试剂盒(Dojindo公司,日本),碱性磷酸酶染色试剂盒(上海碧云天),碱性磷酸酶(alkaline phosphatase,ALP)检测试剂盒(南京建成公司),RNA 提取试剂盒(无锡Bioteke),酶标仪ELx800(Bio-Tek instruments Inc公司,美国),微孔板分光光度计(MD公司,美国),茜素红染液(Sigma公司,美国),化学发光凝胶成像系统(GE公司,美国),流式细胞仪(BD公司,美国),ABI7500 real-time PCR系统(ABI公司,美国)等。
本研究经南京医科大学附属江苏省口腔医院伦理委员会审核并批准(PJ2022-064-001)。
1.2 方法
1.2.1 DPSC原代培养
选取本院口腔颌面外科根尖未发育完成的健康的第三磨牙。用含有1%青霉素-链霉素的PBS冲洗,无菌条件下取出牙髓,超净台内在200 μL α-MEM中剪碎,加入500 μL 3 mg/mL Ⅰ型胶原酶和200 μL 4 mg/mL 胰酶,在37 ℃、5% CO2条件下孵育消化20 min。加入完全培养基,即含有10%FBS的α-MEM终止消化。牙髓组织块悬液在1 000 r/min 离心5 min后,接种于培养瓶中,于37 ℃、5%CO2孵箱中培养,每3 d换液。当细胞达到80%融合时,胰蛋白酶消化传代。本实验采用生长状态良好的第3代DPSC。
1.2.2 DPSC的表面标志物鉴定
将DPSC用胰蛋白酶消化,经过离心重悬后,稀释细胞,置于EP管内。各管中分别加入荧光标记抗体CD90、CD73、CD105、CD34、CD146,空白对照组仅余细胞悬液。4 ℃条件下避光孵育1 h,1 000 r/min离心5 min,弃上清,PBS漂洗,重悬,使用流式细胞仪检测。
1.2.3 CCK-8实验
以2 000 个/孔的密度在96 孔板中铺DPSC。用CCK-8试剂检测PNU-282987和Ca2+对DPSC增殖的影响。PNU-282987 的浓度梯度为0、0.1、1.0、10.0、25.0、50.0、100.0 μmol/L,CaCl2的浓度梯度为0、0.5、1.0、2.0、4.0、8.0 mmol/L,每个浓度梯度设置3 个复孔。用CCK-8试剂于第0、1、3、5、7天,37 ℃5%CO2条件下孵育2 h,450 nm波长下测定吸光度。
1.2.4 ALP染色及ALP活性测定
将DPSC 置于含10 mmol/L β-甘油酸磷酸钠、50 μmol/L磷酸抗坏血酸和10 nmol/L地塞米松的完全培养基即成骨诱导培养基中培养,加入所需浓度的药物后,每2~3 d换液,直至第7天。4%的多聚甲醛固定30 min,ALP染色试剂盒配制染色液,在37 ℃下染色5~30 min,ddH2O 终止,扫描仪及显微镜观察。与此类似,成骨诱导培养7 d 后,用含1%蛋白酶抑制剂PMSF 的RIPA 裂解液裂解DPSC,提取细胞内蛋白,配制检测液,520 nm波长处测定吸光度。
1.2.5 RT-qPCR
DPSC用LPS诱导后,分为对照组、PNU-282987、CaCl2、PNU-282987+CaCl24组。细胞培养7 d后,根据说明书用RNA提取试剂盒提取各组总RNA,然后使用PCR 仪进行检测,引物序列见表1。以人GAPDH 为内参,采用2-ΔΔct方法进行数据分析,比较各组间基因表达情况。

表1 RT-qPCR使用引物序列Table 1 Primer sequences in RT-qPCR
1.2.6 免疫印迹分析
DPSC用LPS诱导后,分为对照组、PNU-282987、CaCl2、PNU-282987+CaCl24 组,用含有相应药物的成骨诱导液培养7 d 后,用1%PMSF 的RIPA 裂解细胞,超声振荡后,10 000 r/min 4 ℃下离心15 min,提取细胞总蛋白。制备10%分离胶、4%浓缩胶、电泳缓冲液和转膜液。每个泳道加入等量蛋白,60 V恒压电泳用于浓缩胶,90 V恒压电泳用于分离胶。转膜前用甲醇浸泡PVDF膜30 s,使其活化,将膜对准盖上胶,放入电转仪,300 mA恒流电转。含5%脱脂奶粉的TBST缓冲液在摇床上缓振摇2 h封闭,再将膜封入1∶1 000稀释好的一抗,4 ℃冰箱过夜。次日,洗膜后将膜放入配制好的二抗(1∶2 500),室温下慢摇1 h。最后,对膜进行曝光成像,Image J软件定量分析。
1.2.7 茜素红染色和氯代十六烷基吡啶(cetylpyridinium chloride,CPC)定量
DPSC用LPS诱导后,分为对照组、PNU-282987、CaCl2、PNU-282987+CaCl2组,加入含相应浓度药物的矿化诱导液,2~3 d 进行1 次换液,培养2 周后,PBS 洗3次,4%多聚甲醛固定30 min;加入茜素红染色液,室温孵育10~30 min,ddH2O 洗,在扫描仪及显微镜下采集图片。在茜素红染色的孔板内,将配制的10%CPC 加入孔板中溶解钙结节,置于摇床上孵育1 h,酶标仪测定595 nm各孔的吸光度。
1.2.8 Fura-2 AM测定DPSC内Ca2+浓度
用PBS 将Fura-2 AM 稀释成5 μmol/L 的工作液,去培养基,使用缓冲液洗涤细胞3 次;将Fura-2 AM工作液加入细胞;在37 ℃培养箱孵育30~60 min,用PBS洗3次除去Fura-2 AM工作液,分别加入PNU-282987、CaCl2、PNU-282987+CaCl2,激光共聚焦显微镜下观察。
1.3 统计学方法
实验均重复3 次。运用GraphPad Prism8 统计软件对数据进行统计分析,不同组间的差异使用t检验或单因素方差分析。对于两组以上的比较,使用Tukey’s 或Dunnett’s 事后检验的单因素方差分析(ANOVA)。P<0.05 为差异有统计学意义。
2 结果
2.1 DPSC的分离与培养
取年轻恒牙的牙髓,酶消化法提取原代细胞,在3 d 后观察到贴壁细胞从组织块中爬出(图1A),传代后的第1代细胞呈长梭形排列(图1B)。
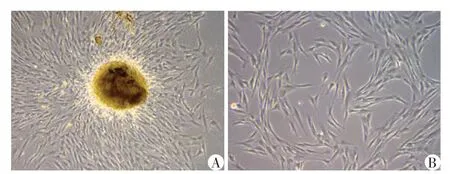
图1 DPSC的细胞形态(×100)Figure 1 Morphology of DPSC(×100)
2.2 DPSC的鉴定
流式细胞术结果显示,DPSC 表达间充质干细胞标志物CD73、CD90、CD146、CD105(99.9%、99.9%、57.2%、99.9%),而造血干细胞标志物CD34表达阴性(0.13%,图2),证明成功提取DPSC。
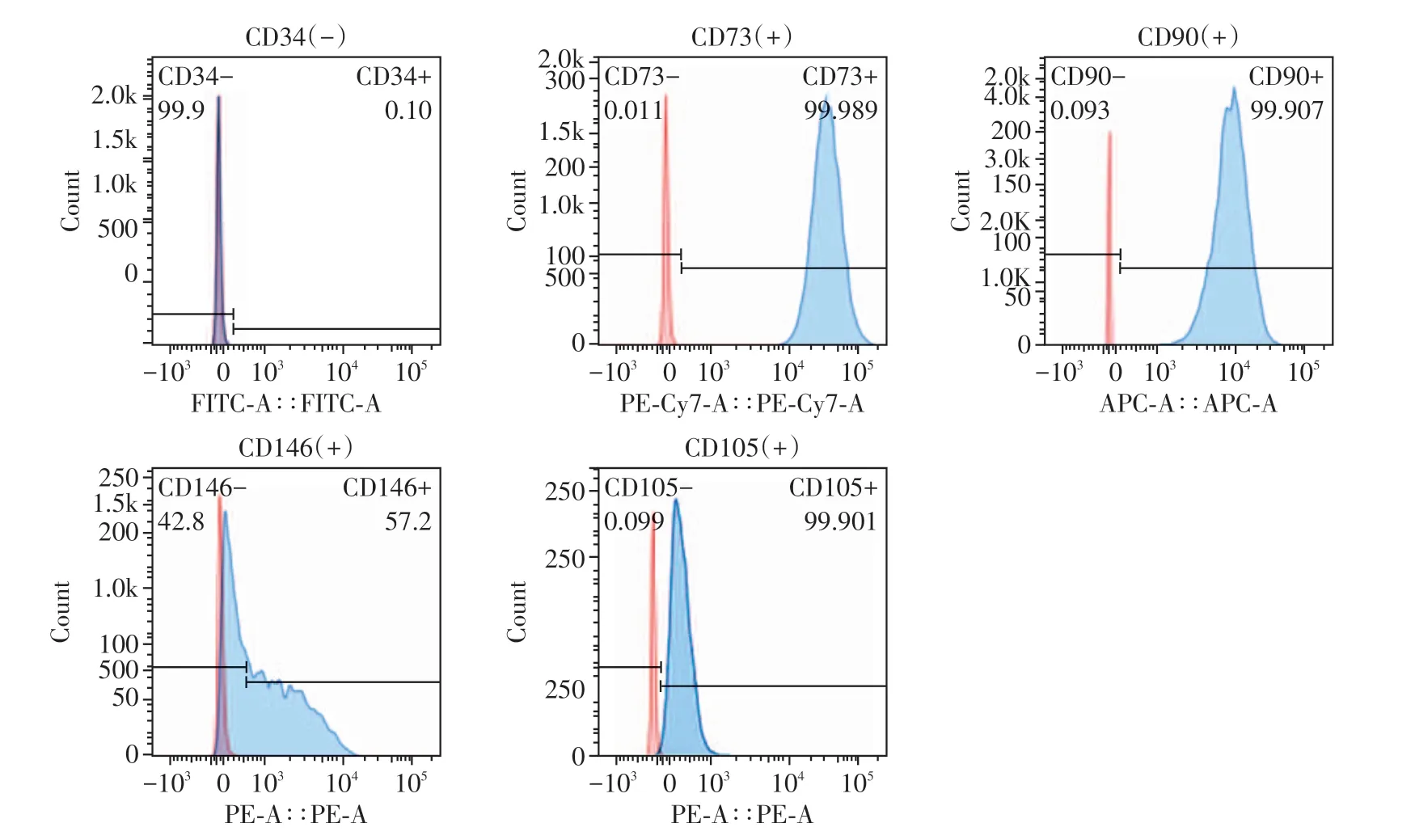
图2 DPSC表面抗原鉴定结果Figure 2 Surface antigen identification results of DPSC
2.3 CCK-8检测DPSC增殖
CCK-8 结果显示,当PNU-282987 浓度低于10 μmol/L(图3A),CaCl2浓度低于2 mmol/L对DPSC细胞增殖无影响(图3B)。
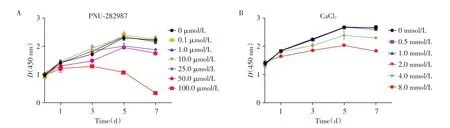
图3 CCK-8检测不同浓度下PNU-282987(A)和Ca2+(B)对DPSC增殖的影响Figure 3 The effects of different concentration of PNU-282987(A)and Ca2+(B)on the proliferation of DPSC as detected by the CCK-8
2.4 筛选PNU-282987的最佳矿化诱导浓度
调整浓度梯度后,在DPSC中分别加入10 μg/mL LPS,ALP 染色(图4A)和ALP 活性(图4B)实验证明,筛选出在此条件下PNU-282987 促进DPSC ALP表达的最佳浓度为10 μmol/L。
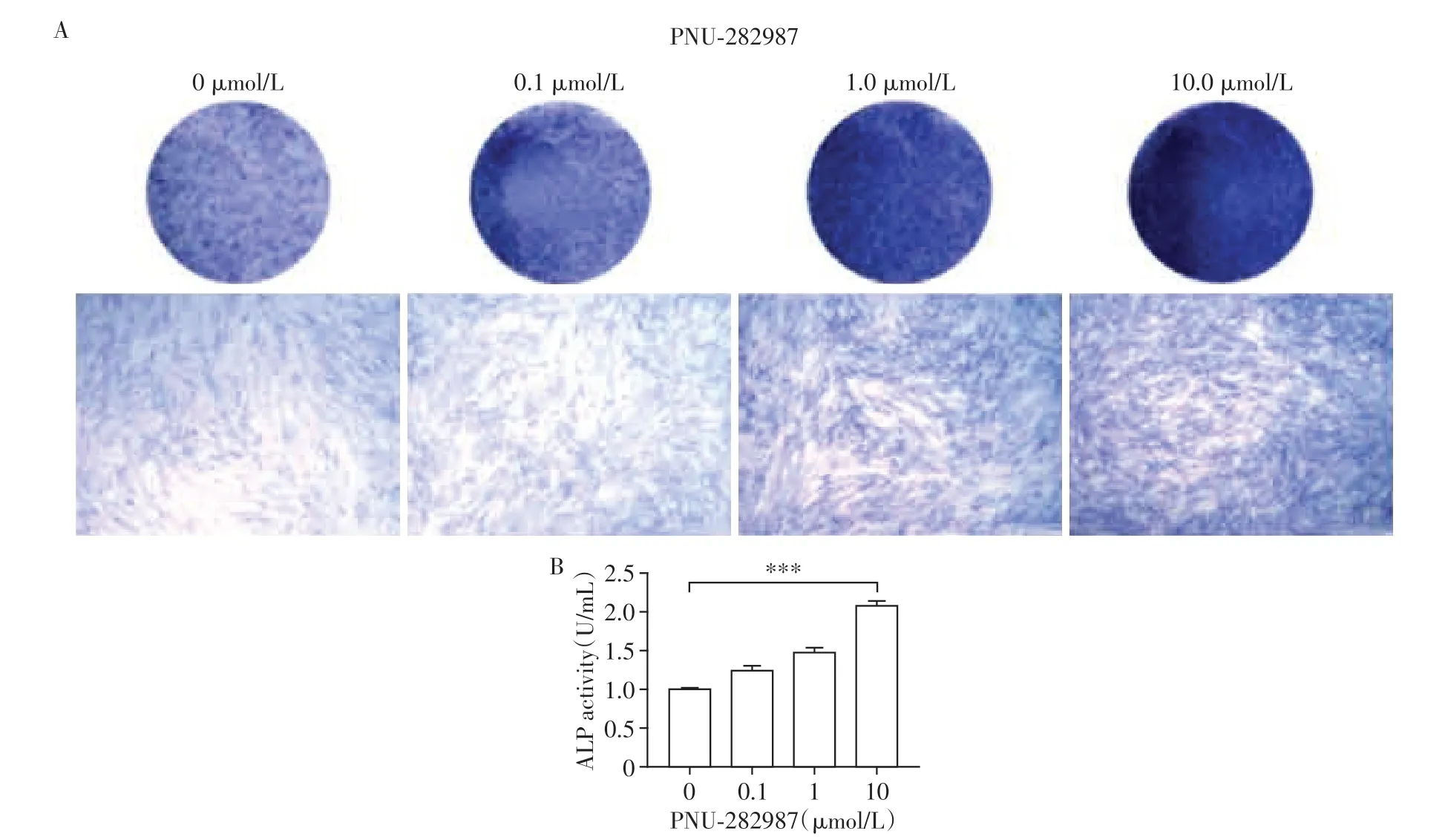
图4 不同浓度PNU-282987作用于LPS刺激的DPSC时ALP表达的变化(×40)Figure 4 Changes of ALP expression in DPSC stimulated by LPS treated with different concentrations of PNU-282987(×40)
2.5 活化α7-nAChR 联合Ca2+对炎症环境下DPSC牙/骨向分化相关蛋白表达的影响
Western blot检测成骨诱导后炎症的DPSC各组细胞中与成牙本质分化和成骨分化相关的蛋白(COL-I、DSPP、OPN、ALP、RUNX2、OSX)的表达。结果显示,与对照组相比,PNU-282987、CaCl2、PNU-282987+CaCl2组相关蛋白COL-I、DSPP、OPN、ALP、RUNX2、OSX表达均升高,其中PNU-282987和CaCl2联合后促进牙/骨向分化的效果提高最显著(图5)。
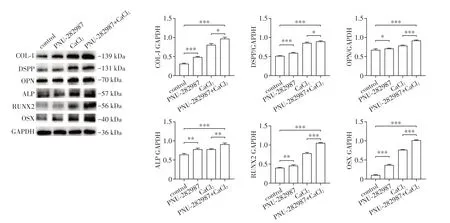
图5 活化α7-nAChR联合Ca2+对LPS刺激的DPSC牙/骨向分化相关蛋白表达的影响Figure 5 Effects ofactivation of α7-nAChR combined with Ca2+on the expression of odontogenic/osteogenic related proteins in DPSCs stimulated by LPS
2.6 活化α7-nAChR 联合Ca2+对炎症环境下DPSC牙/骨向分化相关基因表达的影响
RT-qPCR检测成骨诱导后炎症的DPSC各组细胞中与成牙本质分化和成骨分化相关的基因(COL-I、DSPP、OPN、ALP、RUNX2、OSX)的表达。结果显示,与对照组相比,PNU-282987、CaCl2和PNU-282987+CaCl2组牙/骨向分化相关基因表达升高,其中PNU-282987+CaCl2最高(图6)。

图6 活化α7-nAChR联合Ca2+对炎症环境下DPSC牙/骨向分化相关基因表达的影响Figure 6 Effects of activation of α7-nAChR combined with Ca2+ on the expression of odontogenic/osteogenic related genes in DPSC under inflammatory conditions
2.7 活化α7-nAChR 联合Ca2+对炎症环境下DPSC矿化基质形成能力的影响
茜素红染色结果显示,PNU-282987+CaCl2组、PNU-282987 组、Ca2+染色程度均较对照组深,且PNU-282987+CaCl2组染色最深,矿化结节更明显。10%CPC定量检测Ca2+含量结果与染色结果一致(图7)。

图7 活化α7-nAChR联合Ca2+对炎症环境下DPSC矿化基质形成能力的影响(×40)Figure 7 Effect of activationof α7-nAChR combined with Ca2+ on the mineralization matrix formation capacity of DPSC under inflammatory conditions(×40)
2.8 活化α7-nAChR 联合细胞外Ca2+促进细胞内钙离子浓度增高
本研究加入PNU-282987、CaCl2以及PNU-282987+CaCl2到炎症DPSC后,细胞内Ca2+荧光信号的变化。在一定的时间范围内,PNU-282987组及细胞外Ca2+组荧光强度增加,Ca2+内流增多,二者联合后,Ca2+内流最明显(图8)。
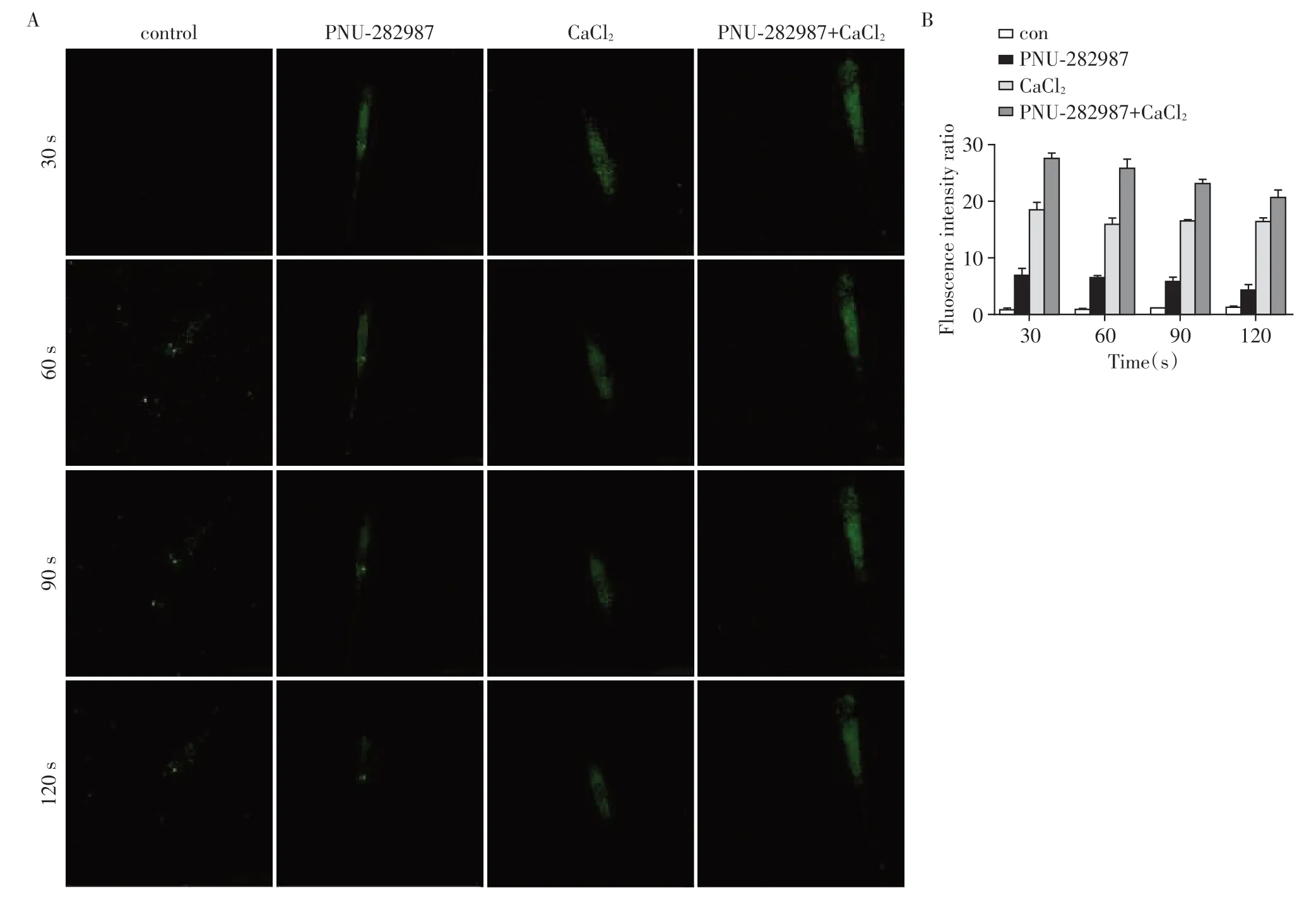
图8 PNU-282987及细胞外Ca2+对细胞内Ca2+浓度的影响(×400)Figure 8 Effects of PNU-282987 and extracellular Ca2+on intracellular Ca2+concentration(×400)
3 讨论
LPS 是革兰氏阴性菌外膜的成分,广泛用于体外实验中模拟炎症环境刺激DPSC,获得分化功能受损的DPSC 炎症反应[12]。已有研究证明,大肠杆菌来源的LPS显著减少了DPSC中的矿化物质沉积,降低了DPSC 的功能分化[13],因此本研究参考文献中实验结果,选择10 μg/mL 大肠杆菌来源LPS,构建DPSC的体外炎症模型。
α7-nAChR 是一种神经递质受体,广泛存在于各种非神经组织中,Wang 等[14]研究发现DPSC 表达α7-nAChR,且炎症牙髓组织α7-nAChR 的mRNA和蛋白水平明显较正常牙髓组织高。研究表明,非神经元胆碱能系统表达α7-nAchR在成骨细胞对炎症反应中发挥积极作用,且α7-nAchR 缺失可能会导致小鼠软骨退化[15]。同时研究指出,活化α7-nAChR有助于成骨进程,其激动剂处理后,细胞内Ca2+增加,矿化进程加快[16]。这些研究表明了α7-nAChR在DPSC中表达,并在牙/骨向分化过程中发挥重要作用。PNU-282987 是一种α7-nAChR 的激动剂,可以使α7-nAChR 通道打开时间增加,但不影响其蛋白和mRNA表达,同时细胞内Ca2+增多,激活了钙调蛋白(calmodulin,CaM)-钙调蛋白依赖性蛋白激酶Ⅱ(calcium/calmodulin-dependent protein kinase Ⅱ,CaMKⅡ)信号通路,从而改善细胞内Ca2+流动状态,使牙/骨向分化基因表达增加[17]。同时,研究显示α7-nAChR 的活化能够抑制炎症小体激活,降低炎症因子分泌[18],也能缓解慢性炎症性疾病的症状,促进细胞功能恢复[19],由此可见,PNU-282987促进DPSCs 牙/骨向分化的另一可能原因为抑制了LPS 对DPSC 炎症因子分泌的影响,促进DPSC 的功能恢复。本研究通过ALP 染色、ALP 活性、Western blot、RT-qPCR 及茜素红实验证实了PNU-282987 可以通过活化α7-nAChR使细胞ALP表达及牙/骨向分化相关基因和蛋白,PNU-282987 是否存在抗炎、促进成骨的双重作用仍需进一步探究。
当牙髓发生暴露时,直接盖髓后保留牙髓活力无疑是最好的选择。最理想的盖髓剂应具有生物相容性、抗菌性、机械强度、封闭性并刺激硬组织屏障的产生、促进组织修复。目前最常用的盖髓剂多含有Ca2+,其为钙元素在化合物中的存在形式,能够维持正常细胞膜电位及细胞正常电传导。研究表明,细胞外Ca2+水平升高导致DPSC通过细胞外信号调节蛋白激酶A 系统增加成纤维细胞生长因子表达,这种机制有助于设计牙本质的再生疗法[20]。而当细胞外液Ca2+浓度较高,而细胞内Ca2+浓度较低时,细胞膜Ca2+通道开放,细胞外Ca2+内流,使细胞内Ca2+浓度升高。研究发现,细胞内Ca2+的增加,能够促进DPSC 的成牙细胞分化,这可能是开发牙髓修复有效保守治疗的潜在靶点[21]。依此结论,提高细胞外Ca2+浓度,同时找到促进Ca2+内流的策略可以更好地促进DPSC成牙本质细胞向分化,α7-nAChR作为调控细胞内Ca2+流的关键分子,活化该受体或可成为实践这一策略的有效途径。
本研究证明了PNU-282987 联合Ca2+发挥出较其单独使用更大的潜力,促进了DPSC 牙/骨向分化相关标志物mRNA 和蛋白的表达(COL-I/COL-I、DSPP/DSPP、OPN/OPN、ALP/ALP、RUNX2/RUNX2、OSX/OSX),上述标志物中,COL-I是成骨细胞细胞外基质形成的指标,可实现蛋白质结合;DSPP可启动细胞外基质结构成分实现Ca2+结合,促进牙本质基质胶原蛋白的初始矿化;OPN是实现骨和牙本质矿化能力的主要非胶原蛋白;ALP为早期成骨标志,ALP的定量检测可以反映成骨细胞的分化水平;RUNX2表达于创伤愈合早期,是成骨过程中的重要转录因子;OSX对于成骨细胞的成熟以及膜内和软骨内骨化至关重要[22-23]。综上,通过检测上述牙/骨向分化的相关指标,说明PNU-282987及细胞外Ca2+可以促进DPSC的牙/骨向分化能力。Fura-2 AM检测提示其分子机制可能为PNU-282987活化α7-nAChR,使Ca2+从细胞外流入细胞增多,增加了成牙本质细胞分化标志基因的表达,促进了DPSC的成牙本质细胞分化和矿化。
研究表明,细胞外Ca2+可能一定程度上增强α7-nAChR的作用,增强表现为通道打开频率的增加以及打开的平均持续时间的增加,从而增加细胞兴奋性并增加细胞内Ca2+[24],Ca2+在细胞信号转导方面具有积极作用,本研究用PNU-282987 活化α7-nAChR同时促进Ca2+内流,达到了更佳的促进牙/骨向分化效果。同时有研究发现,Ca2+浓度≥10 mmol/L 会导致大量的受体通道阻滞,本研究所用的浓度为2 mmol/L,远低于此浓度[25]。也有研究证实,尼古丁激活α7-nAChR会增加血管平滑肌细胞内Ca2+,启动矿化进程,导致钙化形成,RUNX2、OSX和OPN表达明显增加[16],与本研究的结果类似。
本研究结果初步证实通过PNU-282987 活化α7-nAChR 促进Ca2+流入细胞,使细胞内Ca2+增加,诱导炎症环境下DPSC 成牙本质向分化,为有效恢复感染牙髓组织再生功能和牙体组织再生提供新的策略和实验依据。
