负载仙茅苷的3D打印复合支架促进血管化和成骨效应的研究
2024-02-18袁秀琛范世杰段伟豪谭亚东吴璟斌周瑞凯翁益平
袁秀琛,范世杰,段伟豪,谭亚东,吴璟斌,周瑞凯,翁益平*
1蚌埠医学院研究生院,安徽 蚌埠 233030;2南京医科大学附属常州市第二人民医院骨科,南京医科大学常州医学中心,江苏 常州 213003
骨缺损通常是由骨肿瘤切除、感染、创伤、病理性骨折或其他因素所导致,长期以来一直是骨科医生面临的严峻挑战[1]。自体骨移植物是治疗骨缺损的金标准,但免疫排斥和感染的风险、有限的供体资源以及大量的时间和金钱成本在很大程度上限制了这种治疗方法的临床应用[2]。因此,亟需新的治疗方法来解决这些问题,改善临床骨缺损患者的预后。随着骨组织工程(bone tissue engineering,BTE)的发展,人们正在研究制造一种理想的具有高负载能力和高生物相容性的复合支架,使其能够作为指导骨组织再生的模板[3]。
羟基磷灰石(hydroxyapatite,HA)是一种生物活性陶瓷,其成分类似于人体骨骼,却因存在明显的高脆性而使应用受到限制[4]。明胶(gelatin,GEL)主要从动物组织中提取,如骨骼、肌腱和韧带等。单一的GEL存在快速降解和机械性能较差,需要通过结合其他材料来制备具有多种生物活性的复合支架[5]。海藻酸钠(sodium alginate,SA)是一种天然的阴离子多糖,SA通过与钙离子交联后具有独特的凝胶特性,可用作骨重建的支架或细胞载体,目前在生物工程领域内得到广泛应用[6]。聚己内酯(polycaprolactone,PCL)可以为药物提供一个稳定的载体,从而有助于支架的结构完整性以及药物的缓慢释放[7]。仙茅苷(curculigoside,CUR)是一种天然酚类糖苷化合物,具有多种生物活性,如抗氧化、抗骨质疏松、抗癌活性以及促进成骨细胞增殖的能力,其生物学效应已在体外和体内实验中得到验证[8-11]。本研究采用乳液/溶剂蒸发法将CUR与PCL微球(polycaprolactone microsphere,PM)结合,成功制备出负载仙茅苷的聚己内酯微球,即CUR-PM[12]。接着,在借助3D生物打印技术成功构建由HA、GEL和SA 组合的淮复合(hydroxyapatite gelatin sodium alginate,HGS)支架的基础上,制备了负载CUR-PM的复合支架(hydroxyapatite gelatin sodium alginate acrculigoside,HGSC),并对支架的理化性质进行了全面的表征。最后,通过一系列体外实验,初步评估了支架的生物安全性以及HGSC在促进成骨和血管化方面的潜力。这一尝试旨在探究传统中草药与骨组织工程相结合,从而为骨缺损修复提供具有前景的治疗策略的可行性。
1 材料和方法
1.1 材料
HA、SA、GEL 和聚乙烯醇(上海阿拉丁公司);CUR(上海源叶公司);多聚甲醛、二甲基亚砜、无水氯化钙和二氯甲烷(默克公司,德国),3D 生物打印机(regenHU,瑞士);离心机(Sigma 公司,德国);扫描电镜(日立S3400N,日本);万能力学测试仪(镇江太阳科技);傅立叶变换红外光谱(EQUINOX55,德国);流辨分析仪(Discovery HR-3,美国);冻干机(Eyel4,日本);视频接触角仪器(北京HARKE-SPCA);粒度分析仪(CILAS 公司,法国);水接触角测试仪(KRUSS DSA25,德国);紫外分光光度计(UV-3600,日本)。小鼠骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)和人脐带静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)(中科院上海生命科学研究院细胞资源中心);DMEM 和ECM培养基(上海中乔新舟公司);Transwell小室(康宁公司,美国);磷酸盐缓冲液、胰酶、胎牛血清、青链霉素(双抗)和CCK-8试剂盒(赛默飞公司,美国);活/死细胞染色试剂盒、碱性磷酸酶(alkaline phosphatse,ALP)试剂盒和茜素红染色试剂盒(上海碧云天公司);倒置荧光显微镜(奥林巴斯公司,日本);基质胶(上海ABW公司)。
1.2 方法
1.2.1 PCL负载CUR微球制备
本研究采用乳液/溶剂蒸发技术成功制备了CUR-PM。首先将100 mg 的PCL 溶解在5 mL 的二氯甲烷中,然后在水浴条件下超声(110 W,35 Hz)处理1 h。接着,将已称量的23 mg CUR药粉加入溶液中,将混合物滴入2%聚乙烯醇溶液中以形成乳液。在室温下500 r/min 搅拌乳液3 h 后,11 000 r/min 离心,收集CUR-PM。随后,用去离子水洗涤CUR-PM 3 次,以去除残留的表面活性剂,从而获得硬化的CUR-PM。最后,经真空冷冻干燥处理后,将其存储在4 ℃冰箱中备用。不含CUR 的PM的制备方法同上。
1.2.2 复合支架的制备
采用冷冻干燥法制备HGSC复合支架。简述如下,在超纯水中制备2% HA、2% SA 和6% GEL,并以1∶1∶1 的比例混合。使用磁力搅拌器搅拌混合物,并加入CUR-PM。用0.33 mm 的DD135-N 喷嘴、印刷速3 mm/s、压力范围0.30~0.45 MPa 进行印刷,最终得到表观体积为6.00 mm×2.81 mm×2.15 mm的三维支架。待印刷完成后,将两组支架浸入2.5%氯化钙溶液中12 h。最后使用去离子水冲洗支架3次,在真空冷冻干燥12 h后备用。
1.2.3 材料微观表征
使用扫描电镜对微球和支架的形貌进行评价。此外,将50 mg PM 样品用超声波(360 W,10 s)分散到10 mL 蒸馏水中,使用纳米粒度分析仪通过动态光散射(dynamic light scattering,DLS)确定微球大小分布。
1.2.4 傅里叶变换红外光谱法分析材料组成
将HGS/HGSC 支架样品压平后放置在光谱仪中,其分辨率为4 cm-1,以获得400~4 000 cm-1范围内的光谱结果。
1.2.5 生物墨水流变学分析
首先将生物墨水铺在流变仪板上,接着在室温条件下,以0~100 s-1的剪切速率施加5%的应变振幅,进行小振幅震荡剪切实验。在15~45 ℃的温度范围内,记录储存模量(G′)和损失模量(G″)。
1.2.6 药物累积释放率
分别将制备好的CUR-PM和HGSC支架分别置于含有30 mL PBS 离心管中并在37 ℃的恒温下孵育。在预定的时间点,收集2 mL上清液并用新鲜PBS替换,以保持30 mL的总体积,使用紫外可见光谱法测定药物释放率,使用公式(1)进行计算。
1.2.7 负载CUR微球的载药率和封包率
将一定量的CUR-PM溶解于5 mL DCM中,然后加入2 mL 二甲基亚砜使药物充分溶解。将混合液超声浸泡1 min后,加入10 mL PBS中,搅拌至二氯甲烷(dichloromethane,DCM)完全蒸发。10 000 r/min离心15 min,收集上清液,用310 nm 波长的紫外分光光度计分析,分别计算载药率(微球中的药物质量/微球的总质量×100%)和包封率[(微球中药物质量-上清中药物质量)/投入药物量×100%]。
1.2.8 支架力学评价
使用材料测试机在37 ℃下进行压缩性能测试,负载为0.1 N,压缩速度为0.1 mm/s。绘制应力-应变曲线。
1.2.9 支架降解评价
在开始体外降解试验之前,所有样品支架干燥并称重以确定初始重量。随后,将所有样品浸泡在PBS中,并在37 ℃下保存3、7、14、28 d。在每个时间点,取出样品干燥处理,重新称重以测定降解后重量,计算支架降解率=(初始重量-降解后重量)/初始重量×100%。
1.2.10 细胞培养
在实验前,所有复合支架都经过环氧乙烷灭菌处理。在细胞培养箱中37 ℃、5%CO2条件下进行培养,使用含10%胎牛血清和1%青链霉素溶液的DMEM 培养基进行培养。每2 d 更换培养基,待细胞达到80%融合时传代,用于后续实验。按照国际标准化组织(ISO 10993-12)的要求获得浸提液(scaffold extraction solution,SE)。无菌支架以0.1 g/mL的比例浸泡在无血清的DMEM 培养基中。在细胞培养箱中孵育48 h后,收集上清液,无菌过滤,加入10%PBS和1%青链霉素溶液后在4 ℃保存,空白组为无血清的DMEM 培养、对照组为HGS 支架组、实验组为HGSC支架。
1.2.11 支架的毒性和增殖特性评价
通过CCK-8 试剂盒检测支架对细胞的增殖影响,将BMSC 细胞以4×103个/孔的密度接种于96 孔板,按照说明书与SE 分别孵育1、3、5 d。随后,使用酶联免疫吸附测定仪测量每孔在450 nm 处的吸光度。接着使用EdU试剂盒进行增殖评价,将BMSC以1×105个/孔密度种植在96孔板中,孵育1 d,根据试剂商说明书提示进行荧光染色。
1.2.12 支架对内皮细胞管形成能力评价
先将基质胶提前1 d 4 ℃下解冻,接着快速将基质胶涂覆到48 孔板上。然后将3×104个/孔的HUVEC 细胞直接接种到基质凝胶层上并用SE 培养。孵育6~7 h后,进行钙黄绿素荧光染色,并采用倒置荧光显微镜记录HUVEC 在每组基质凝胶上形成的网格状荧光,并且对节点和分支数量进行定量分析,试验重复3次。
1.2.13 ALP染色
在6 孔板中接种5.0×104个/孔BMSC 并用SE 培养7 d 后,根据制造商的说明书使用ALP 检测试剂盒进行染色。
1.2.14 Transwell实验
使用Transwell 小室(8 μm 孔径)进行细胞迁移能力评估。首先将200 μL 的HUVEC 悬浮液(不含胎牛血清的培养基,细胞密度为2.0×105个/mL)加入上室,同时在下室加入SE。经过24 h孵育后,用棉签轻轻擦除上层孔中的细胞,然后用4%的甲醛固定下层细胞15 min。随后,对细胞进行结晶紫染色30 min。通过光学显微镜观察细胞迁移情况,并对细胞迁移数量进行定量分析。
1.3 统计学方法
采用Origin 8.0 软件和GraphPad Prism 9.1 软件进行统计学分析并绘图。所有数据均以均数±标准差()表示。多组间比较使用ANOVA 单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 材料微观表征
值得注意的是,支架的孔径大小不仅影响营养交换,而且对骨和血管组织的长入也有显著影响。扫描电镜结果显示,HGS/HGSC复合支架表面粗糙,各孔径均匀(图1A)。在HGSC 周围局部区域可以观察到由白色箭头标记的分散的CUR-PM。LDS法确定微球尺寸分布,结果表明微球大小主要分布在(355.00±23.89)nm附近(图1B)。
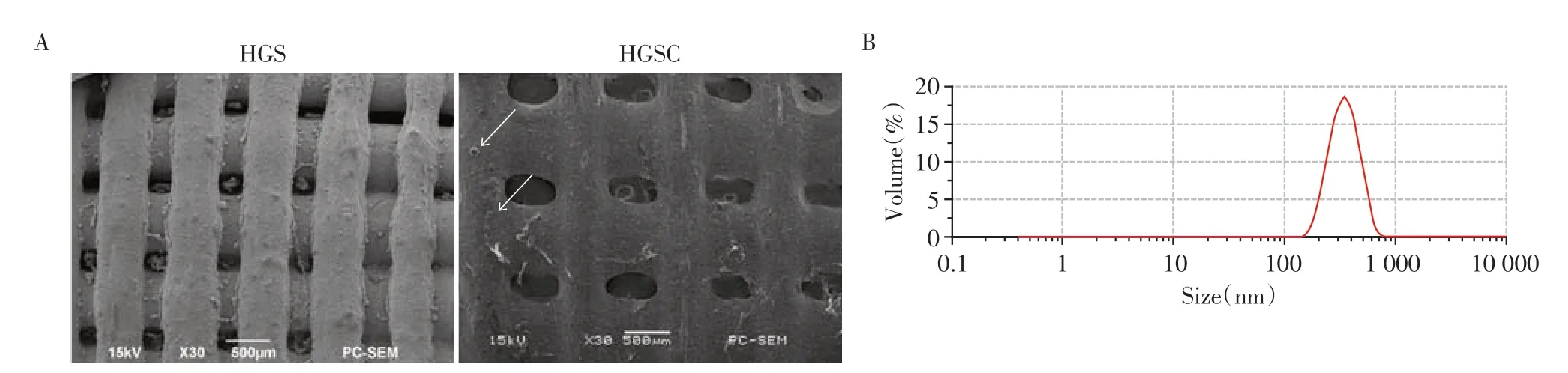
图1 对支架进行微观表征Figure 1 Microscopic characterization of the scaffolds
2.2 红外光谱
在CUR 药物的红外光谱中可以看到在1 700~1 750 cm-1附近存在较强的峰波,可能是由于羧基(C=O)振动所导致;羟基磷灰石的的显著波峰分布在1 010 cm-1主要是由于磷酸盐的拉伸振动和变形振 动;SA 的-COO-的典型峰出现在1 600 cm-1和1 400 cm-1附近。此外,在3 300 cm-1附近出现较宽的峰波可能由于氢键形成;GEL 的特征峰酰胺键-Ⅰ(amideⅠ)和酰胺键-Ⅱ(amide Ⅱ)分别出现在1 630 cm-1和1 540 cm-1(图2A)。根据图2B,HGSC组可以看到1 715 cm-1附近有CUR 特征性峰波,说明支架成功加载CUR-PM。

图2 支架的FTIR光谱图Figure 2 FTIR spectrum of the scaffolds
2.3 生物墨水流变学分析
如图3A 所示,无论温度变化如何,HGSC 的生物墨水在10~45 ℃的存储模量(G′)都高于损失模量(G″)。然而在30 ℃时,含有HGS的生物墨水的存储模量(G′)低于损失模量(G″)。此外,发现两者都表现出剪切变薄行为,并随着剪切速率的增加,出现黏度降低现象(图3B)。
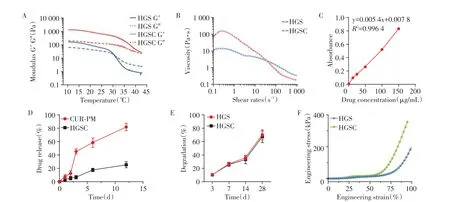
图3 HGS/HGSC支架的理化性质表征Figure 3 Physicochemical characterization of HGS/HGSC scaffolds
2.4 载药率、包封率、药物累积释放率、降解率和支架的力学性能评价
通过测得的上清药物浓度分别为0、12.5、25.0、50.0、100.0、150.0 μg/mL 时的吸光度数据绘制标准曲线得到CUR/PCL微球对CUR的载药率为(16.98±2.23)%,包封率为(33.33±3.17)%(图3C)。在第3 天时,CUR-PM和HGSC两组药物释放分别占总药物的(45.10±3.51)%、(6.86±1.05)%。在第12 天时,CUR-PM的药物释放率为(82.00±4.90)%,HGSC的药物释放率为(25.70±3.10)%(图3D)。降解率曲线显示HGS支架和HGSC支架的降解趋势相似,两组支架3~7 d的降解速率均加快(图3E),7~14 d降解速率减缓,14~28 d降解速率再次加快。工程应力-应变曲线显示,HGSC支架的变异性低于HGS支架(图3F)。
2.4 支架的毒性和增殖能力评价
CCK-8 细胞增殖实验表明,在第1 天和第3 天,3 组BMSC 细胞活力接近,提示支架无明显细胞毒性,并且在第7 天,HGSC 组的BMSC 细胞活力明显增高(图4A)。EdU 荧光染色结果再次表明两组支架对BMSC细胞均无明显增殖抑制(图4B)。

图4 支架的细胞毒性和增殖特性评价Figure 4 Evaluation of cytotoxicity and proliferation properties of scaffolds
2.5 支架的血管化和成骨潜能评价
Transwell 实验表明HGSC 组的HUVEC 细胞迁移数量明显高于HGS组(图5A、C)。细胞成管实验显示,与HGS 组相比,HGSC 组HUVEC 细胞形成了明显的管状结构,节点和分支数量的定量分析表明,HGSC 组成管明显增多(图5B、D、E)。ALP 是早期骨形成的标志物,ALP 染色实验结果显示,HGSC组ALP活性明显高于HGS组(图6)。
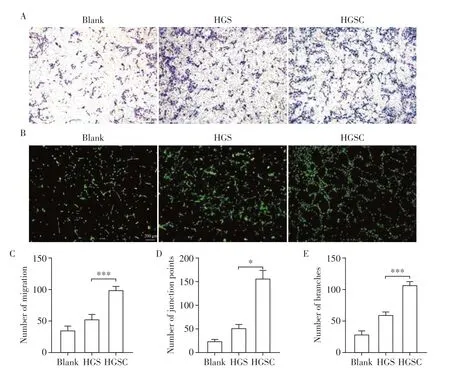
图5 评价支架对HUVEC的迁移能力和细胞成管的效果Figure 5 Evaluation of the scaffold’s effect on HUVEC migration and cell tube formation
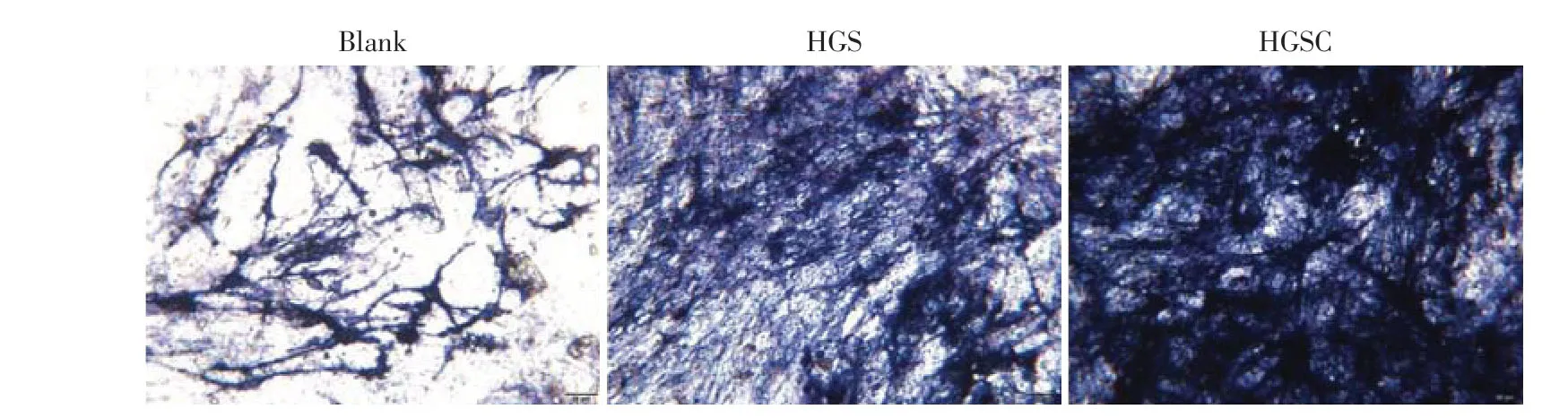
图6 ALP染色评价支架对BMSC的早期成骨效果(×400)Figure 6 Evaluation of scaffold for early osteogenic effect on BMSC by ALP staining(×400)
3 讨论
在骨组织工程应用中,微球在药物控释方面发挥着重要作用,这对于药物靶向作用并提升生物利用率具有重要意义[12]。PCL拥有良好的生物降解性和价格便宜的特性,相比高成本以及更容易产生酸性环境的聚乳酸(polylactic acid,PLA)和聚乳酸-乙醇酸共聚物(lactic-co-glycolic acid,PLGA)等合成聚合物而言,PCL更适合作为药物传递系统的载体[13-14]。
CUR 是从仙茅中分离出来的天然化合物。Wang 等[10]研究表明,它可以有效减少活性氧(reactive oxygen species,ROS)的产生和脂质过氧化来保护成骨细胞。Ma等[9]研究证明,CUR具有促进骨前体细胞向成骨分化的作用。本研究首次将CUR 与骨组织工程和微球载药技术相结合,希望能为骨缺损修复提供一个切实可行的解决方案。
一方面,药物微球可以从支架孔隙中逐渐深入到周围受损组织,从而精准释放和调控药物;另一方面,微球的粒径大小对微球的比表面积、聚合物降解速率、以及被包被微球的药物释放速率有很大影响[15-16]。通过乳液/溶剂蒸发法与3D 打印技术结合制备CUR-PM,本研究成功构建了HGSC 支架,红外光谱图显示HGSC 支架存在1 715 cm-1CUR 特征性波峰,支架中的孔隙有助于细胞生长,可以让必需的营养物质更容易地进入细胞[17]。
生物墨汁良好的流变性能是成功构建3D 打印支架的基础,HGS和HGSC的生物墨汁体现出了良好的稳定性和剪切变薄现象,这可以确保材料在打印过程中持续稳定的流动性和形状可塑性[18]。根据时间与药物释放关系来看,微球具有更快的药物释放速率,反映了支架对药物微球进行二次包裹,从而显著减缓药物释放,实现了药物释放的可持续性,而持续药物释放是长时间调节局部药物浓度和获得更高药效而不引起不良反应的主要关注点之一。微球的药物负载率和包封率结果显示,本研究设计的PM在一定程度上能够有效负载CUR并将其包裹其中。尽管可能受到制备工艺、药物溶解度以及微球与药物之间相互作用等多种因素的影响,但是微球与CUR 结合在骨组织工程领域是一个大胆的尝试,将会为骨缺损的治疗开辟全新的视野[16]。无论是细胞培养还是动物植入,生物支架都需要具备优秀的机械性能,以保持结构的稳定性。应力-应变曲线的结果表明,HGSC 支架具有良好的稳定性。同时,因为可生物降解支架可能会促进使组织适应性改变,所以这对局部骨组织和血管修复的影响是其重要。支架降解实验结果表明,在7~14 d时降解速率有所减缓。本研究认为这可能是与明胶分子的降解程度以及分子链断裂的逐渐减少有关。此外,HA 和SA 也可能对降解速率产生影响。然而,在最后的14 d 里,降解出现了再次加速,这可能是由于GEL 等成分的降解程度加深导致材料结构进一步松解,从而引起整体降解速度的明显加快[19]。
具有生物相容性和无毒性的支架是决定细胞能否正常增殖和分化的前提,本研究通过CCK-8、EdU等实验成功验证了HGSC 支架的生物安全性,可用于进一步实验[20-21]。内皮细胞增殖和迁移是血管化的关键步骤,血管化可以改善骨组织的微环境,使新生骨组织获得更多的有益成分[19]。实验结果表明,HGSC支架显著促进HUVEC细胞管形成和细胞迁移能力。同时,ALP 染色结果显示HGSC 支架具有促进BMSC 细胞增殖和骨诱导的潜力,这一发现与Ma 等[9]实验结论一致。本研究发现负载CURPM 的支架可以作为一种可持续且稳定释放CUR的方法,并具有无毒性和良好的降解性,这为骨组织工程提供了新的材料。需要指出的是,本研究并没有对成骨标志物如OPN 和RUNX2进行基因和蛋白水平的检测。此外,为了证明其成骨效果和安全性,还需要进行具体机制研究以及体内实验以进一步探究。
总之,HGSC 复合支架有望用于修复骨缺损和促进血管化,为解决临床上由多种原因导致的巨大骨缺损提供了一个切实可行的治疗方案。
