控制玉米株高基因PHR1的基因克隆
2024-02-17杨晨曦周文期周香艳刘忠祥周玉乾刘芥杉杨彦忠何海军王晓娟连晓荣李永生
杨晨曦 周文期,,* 周香艳,* 刘忠祥 周玉乾 刘芥杉 杨彦忠 何海军 王晓娟 连晓荣 李永生
1甘肃农业大学生命科学技术学院, 甘肃兰州, 730070; 2甘肃省农业科学院作物研究所, 甘肃兰州 730070
玉米(ZeamaysL.)是禾本科的一年生草本植物,和小麦、水稻并称为世界三大谷物。玉米与传统的粮食作物相比, 具有更强的环境适应性, 其营养价值也比较高, 近年来玉米的实际播种面积在逐步提高, 因此, 不断提高玉米产量是农业工作者面临的重要任务和挑战[1]。玉米株高(plant height, PH)主要为雄穗轴线顶端向下到地平面的距离; 穗位高(ear height, EH)主要为从玉米底部(露出地面)到果穗第一着生节的距离。玉米株高和穗位高会影响玉米光合、产量和抗倒伏等生长发育指标。20世纪60年代, 全球“第一次绿色革命”是在小麦和水稻之中推广运用了矮化品种, 有效的解决了一些植株因倒伏而减产的问题。美国玉米研究与生产的成功经验表明, 增加种植密度是提高产量最现实可行的举措[2]。但一定的环境资源在种植密度增加的情况下, 会导致植株易倒伏, 影响植株的品质, 反而造成产量损失[3], 降低株高对提高玉米产量和品质具有重要意义。然而, 控制株高和穗位高的遗传机理及调控系统网络十分复杂, 现在仍然有许多问题尚待解决。尤其像小麦、水稻这样既能有效降低株高和穗位高又没有明显减产效应的半矮秆基因在玉米遗传机理中仍未得到定位。
株高和穗位高与赤霉素、生长素、油菜素内酯等一些植物激素息息相关[4]。目前为止已知的玉米株高基因与植物激素相关的有BR2、D8、D9、D11、Dt、NA1、NA2等60多个[5-6]。其中D8、D9和Na2对赤霉素不敏感,D8和D9基因编码DELLA蛋白,为显性突变;Na2雄穗雌性化, 功能缺失为隐性突变[2]。D11、Dt和Na1对赤霉素较为敏感,D11簇生,花器官发育异常, 有显性遗传因子;Dt茎节数量没有减少, 是节间长度缩短导致变矮, 为显性基因;Na1植株极度矮小, 花期延迟, 功能缺失为隐性突变[2,6]。目前被报道的玉米矮秆基因中最有育种利用价值的基因包括BRACHYTIC2, 简称为BR2[7]。BR2基因编码ATP结合转运蛋白, 通过生长素极性运输参与玉米株高和穗位高调控,BR2基因变异可以降低穗部以下的节间长度, 所以被应用于玉米株高矮化育种[8]。本研究发现一个新玉米矮秆突变材料,将其命名为phr-1, 通过遗传分析和基因定位, 发现该突变材料是一个玉米BR2基因的等位突变体,该突变体的发掘为矮秆玉米育种提供理论基础和育种材料。
1 材料与方法
1.1 试验材料
所用材料玉米自交系KWS39 (来源于德国KWS种业公司, 简写KWS39, 由甘肃省农业科学院作物研究所提供)作为父本, 成熟种子经过快中子4.19 Gy的剂量辐照, 方法参考刘忠祥等[9]快中子辐照玉米自交系方法。种植M1代, 严格套袋单株自交, 单穗收获后, M2代大田种植筛选, 分离突变体, 后代筛选得到株高和穗位降低突变体, 命名为plant heightreducingmutant-1(phr-1)。其中phr-1突变体表现为株高降低, 穗位高下降, 后期结实正常, 矮秆表型后代中能稳定遗传。自交系B73,Brachytic2(Br2-1)终止突变体来源: 购自Maize EMS induced Mutant Database (MEMD)突变体库, 网站http://www.elabcaas.cn/memd[10]。本试验所用到的定位群体为突变体phr-1与B73杂交后的F2群体。
1.2 突变体筛选及遗传分析
将KWS39和phr-1种植在甘肃省农业科学院张掖试验场基地。田间随机选取KWS39和phr-1各15株, 考察株高、穗位高、节间数、各节间长度等重要性状。使用Microsoft Excel 2019进行数据处理。种植phr-1和B73, 杂交得到F1。种植F1, 自交获得F2种子。种植F2群体。成熟期统计F2分离群体中正常和矮化植株的分离比并进行卡方检验。
1.3 初步定位目的基因
phr-1与B73杂交得到F1群体, F1自交构建F2遗传群体。在分离群体搭建过程中, 子代会根据表型进行选择, 筛选出突变型子代池和野生型子代池,F2群体中分别选取矮秆突变体和正常植株各60株,等大小打孔取样, 构建混合基因池, 测序深度为20X, 利用BSA (bulk segregant analysis)测序方法筛选可能与目标基因连锁的分子标记。BSA-seq是可以快速定位并且能较为简单的寻找到目标性状的一种方法[11]。初步确定目标基因所在染色体位置, 将候选基因进行初步定位。
1.4 精细定位并克隆候选基因
依据玉米数据库网站(https://www.maizegdb.org/)中初定位区段的结果, 利用DNASTAR软件设计特异性引物, 开发新标记, 对目的基因进行精细定位。候选基因的测序依据MaizeGDB数据库候选基因的基因组序列, 利用Premier 5软件设计引物,分别PCR扩增KWS39和phr-1的基因组DNA和开放阅读框(ORF)。PCR反应体系为50 µL体积, PCR反应体系: 94℃预变性2 min; 98℃变性10 s, 57℃退火20 s, 72℃延伸2 min 30 s, 循环数为35次; 72℃延伸7 min, 最后用1%琼脂糖凝胶电泳检测目的条带,电泳切胶回收; 再将回收正确的产物T-A连接构建到T载体中, 随后将连接产物用DH-5α感受态转化大肠杆菌, 用对应引物进行菌液PCR检测, 阳性菌液送生工生物工程(上海)公司进行测序。利用DNAMANVersion 8.0软件分析测序结果, 确定变异位点。
1.5 等位杂交验证
为检测突变体phr-1是否为BR2基因的等位变异, 从玉米EMS诱变突变体库中订购了BR2突变体与phr-1杂交, 2个材料分别做正反交, 鉴定F1代表型与突变体phr-1表型一致。
1.6 实时荧光定量PCR
采用Eco (Illumina公司)荧光定量PCR仪, 荧光定量试剂盒(Sigma)进行实时荧光定量实验。PCR反应体系为20 µL体积, PCR反应体系: 95℃变性10 s;60℃退火30 s, 72℃延伸30 s, 循环数为40次; 每份样品重复3次, 用GAPDH作为内参基因(表1), 由2–ΔΔCt方法计算得出[12]。

表1 本研究所用到的引物Table 1 Primers used in this study
2 结果与分析
2.1 突变体phr-1植株表型分析
快中子诱变后代自交获得M2和M3代植株, 田间种植筛选, M2代表型鉴定中分离到矮秆突变体phr-1,对phr-1的各类农艺性状进行统计, 结果表明该突变体株高及穗位高比对照KWS39极显著降低(P<0.01),株高降低50.0%, 穗位高降低62.2% (图1-A~C)。进一步对整株的节点数统计及每节间长度测量, 发现KWS39和phr-1总节间数相同, 共有11节, 穗上穗下节数相同, 但是节间长度极显著减小, 茎节长度不能正常延伸, 导致株高和穗位高比对照降低(图1-D, E)。

图1 野生型KWS39和突变体phr-1植株表型Fig. 1 Phenotype of KWS39 (CK) and phr-1 mutant plants

(图1)
对KWS39和phr-1苗期萌芽5 d的幼苗进行比较, 二者株高和根系发育正常, 无显著变化(图2-A);田间观察一直生长到小喇叭口期(七八叶期),phr-1与对照植株均无显著差异; 大喇叭口期间逐渐表现出差异的矮化表型; 拔节期直至成熟期, 株高和穗位高差异极显著。测量成熟期植株phr-1剑叶叶长和叶宽也无明显差异, 但倒2叶和倒3叶相比CK明显变窄、变长(图2-B), 倒3叶叶长差异显著,P<0.05 (表3)。由于phr-1茎秆矮化粗壮, 观察其根系发育, 次生根比对照更发达(图2-C), 调查phr-1和KWS39开放授粉的果穗和籽粒性状, 两者果穗长、果穗宽、穗行数、行粒数、籽粒大小与百粒重无差异显著性(图2-D, E和表2)。说明PHR1基因主效控制玉米株高及穗位高, 对单株产量及百粒重等产量性状无显著负效应, 对产量没有显著影响。
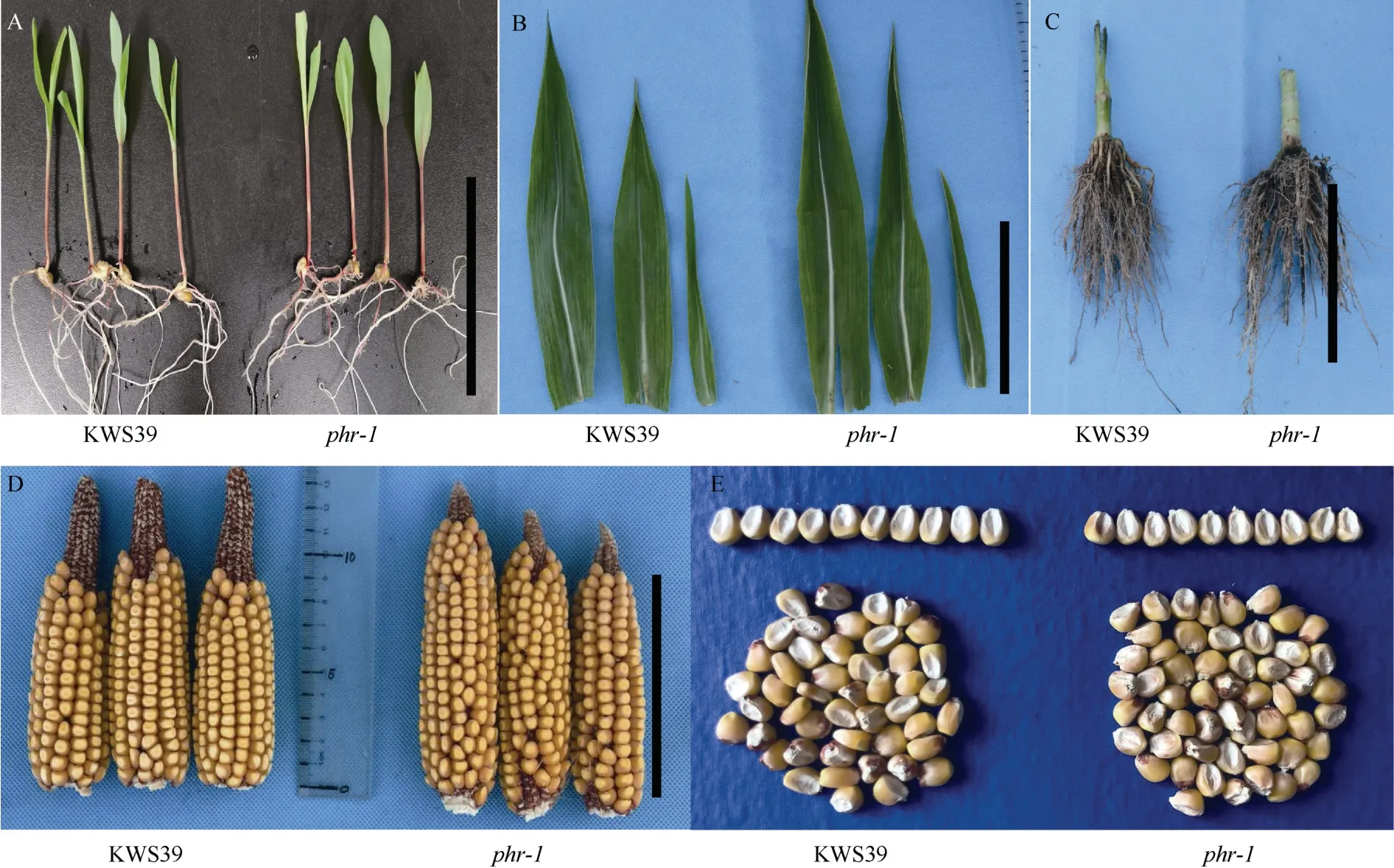
图2 野生型KWS39和突变体phr-1植株表型Fig. 2 Phenotype of KWS39 (CK) and phr-1 mutant plants

表2 突变体phr-1和野生型KWS39农艺性状分析Tablel 2 Analysis of agronomic traits between KWS39 and phr-1 (mean±SD)

表3 F2分离群体的卡方测验Table 3 Chi-square test of F2 population
2.2 phr-1的突变性状是由核单基因隐性遗传变异控制
将phr-1和自交系B73杂交, 收获F1代植株, F1株高和穗位高与对照相当(图3), 观察F1自交, 构建F2群体, F2后代分离出矮秆突变体, 并对后代野生型植株和突变型植株进行统计, 统计1000株F2后代植株, 野生型与phr-1植株数量分别为762株和238株, 卡方检验结果表明野生型与突变体分离比例符合孟德尔单基因隐性遗传3∶1比例分离, 表明phr-1株高和穗位高降低性状是由核单基因隐性遗传变异控制。

图3 KWS39、phr-1、杂交F1和F2矮秆植株表型Fig. 3 Phenotype of KWS39, phr-1, F1 hybrid plant, and dwarf mutant in F2 plant
2.3 phr-1基因初步定位
为了克隆phr-1突变基因, 利用phr-1与B73杂交构建的F2分离群体进行初步定位。根据公共标记数据库, 进行集团分离分析法(bulked segregation analysis, BSA)测序。根据BSA极端性状混池测序原理, 提取亲本KWS39、phr-1和B73亲本各3株, 选择phr-1×B73 F2子代池株高和穗位最高的植株60株,株高和穗位最低的植株60株, 混池提取其DNA, 建库进行BSA测序。根据遗传连锁交换定律, 子代池的基因型会和表型产生共分离, 反应在物理图谱层面, 与表型连锁的染色体区段会和不连锁的染色体区间产生稳定的SNP-index差异。根据差异初步确定候选基因区间位置。差异大小范围为0~1。若该参数为0, 代表子代所有测到的Reads都来自野生亲本; 若该参数为1, 代表子代所有Reads都来自突变亲本; 该参数为0.5, 则代表此子代混池中SNP来自2个亲本基因组的频率一致。先将野生型和突变型分离群体2个DNA池筛选多态引物, 再进行全基因组的分析, 初步定位到候选基因区间, 位于1号染色体Bin1.06位置的约4 Mb区间内(图4)。

图4 phr-1候选基因的连锁定位图Fig. 4 Linkage map of phr-1 candidate genes
2.4 PHR1基因精细定位
根据Maize GBD (http://www.maizegdb.org/)网站的基因信息对定位区间内的序列进行分析, 设计多态性引物, 利用F2分离群体, 提取约500个单株进行候选基因的精细定位, 选择1号染色体的初步定位区间附近约40对标记, 将候选基因缩小到umc1122和umc1583a两个标记之间(表4)。候选基因更靠近umc1122, 目标区间约 600 kb, 查找该区间内已知基因功能, 发现存在一个已报道控制玉米株高的关键基因BR2, 表型与该突变体表型非常相似。推测目标基因可能是GRMZM2G315375。GRMZM2G315375基因全长6653 bp, CDS序列长4140 bp, 编码氨基酸序列1380个。为了验证该结果,在野生型KWS39和突变体phr-1中提取RNA, 反转录cDNA测序。参考基因组B73序列设计特异性引物, 对GRMZM2G315375基因完整编码区扩增, 分析候选基因GRMZM2G315375与对照的序列碱基差异, 测序检测发现phr-1突变体CDS序列第1636位置碱基发生突变, 插入了一段165 bp的碱基序列,导致氨基酸编码错乱, 在第546位氨基酸由P (脯氨酸)变成Q (谷氨酰胺), 第547位氨基酸变为终止子,蛋白翻译提前终止(图5)。查阅已报道的BR2基因变异位点, 没有插入突变导致蛋白翻译的提前终止。说明phr-1突变体的候选基因可能就是BR2基因,phr-1是BR2基因的一个新的等位突变体。
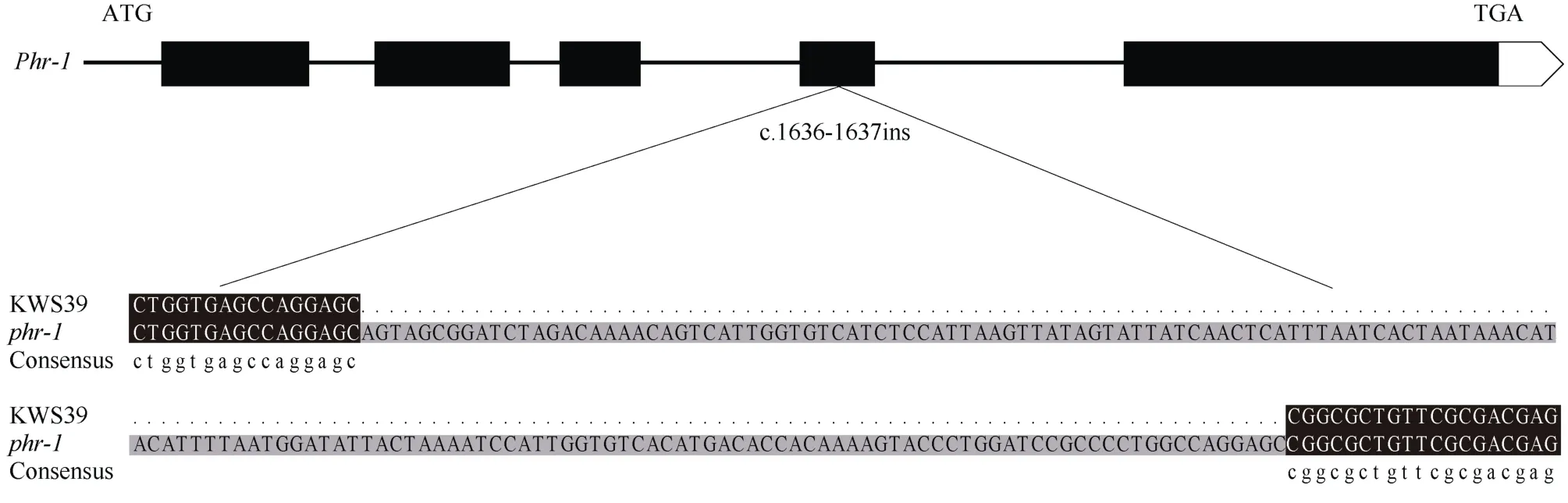
图5 BR2转录本在KWS39和phr-1突变体中的序列分析Fig. 5 Sequence analysis of BR2 transcript between KWS39 and phr-1

表4 初步定位标记与表型的交换频率Table 4 Crossing-over value of preliminary localization markers and phenotypes
2.5 等位突变体杂交后代表型鉴定
为了进一步验证BR2基因就是控制phr-1株高和穗位高候选基因。在以B73自交系为诱变背景的EMS突变体库中订购了基因号为GRMZM2G315375,BR2基因的1个功能缺失突变体, 命名为br2-1(图6),测序验证br2-1突变体CDS序列第2382位置碱基发生突变, 由G变成A, 导致氨基酸编码过程, 第794位氨基酸由W (色氨酸)变成终止子, 蛋白翻译提前终止。br2-1株高和穗位高比对照B73极显著降低,拔节期生长受阻, 不能正常长高, 但抽雄、散粉及吐丝都正常, 能正常结实, 单株产量及百粒重等产量性状无显著变化, 植株表型与phr-1非常相似, 将phr-1与br2-1进行正反交, 观察了br2-1×phr-1F1植株表型, 株高和穗位高与2个突变体phr-1和br2-1的表型一致(图6), 测序结果表明,phr-1的基因变化和突变方式与br2-1单个碱基发生变异位点完全不同,phr-1是第4个外显子处, 插入了165 bp的碱基序列, 导致氨基酸编码的提前终止。因此, 根据对候选基因全基因测序结果和两个等位突变体的杂交等位验证实验, 确定phr-1突变体就是br2-1的一个新等位突变体,phr-1突变基因就是BR2基因。
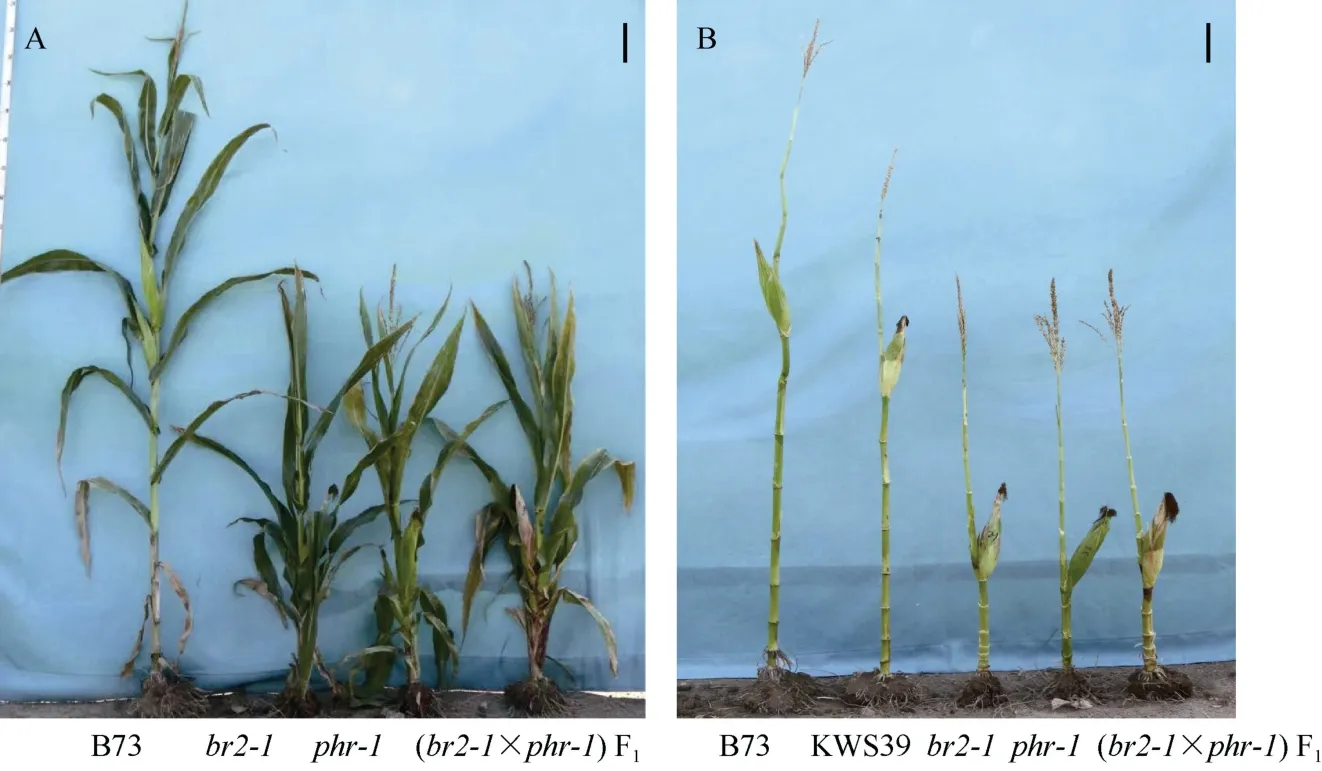
图6 等位鉴定突变体F1代表型一致Fig. 6 Generic identification of mutant F1 representative type is consistent
2.6 BR2基因表达分析
因发现phr-1突变体是br2-1的等位突变, 在B73、KWS39和突变体phr-1幼苗期和抽雄期采样进行实时荧光定量PCR (Real-time Quantitative polymerase chain reaction, qPCR)。结果发现BR2在phr-1中的相对表达量均明显低于对照(图7), 由于基因突变造成转录水平的降低, 导致目标基因蛋白功能减弱或缺失, 蛋白翻译提前终止, 不能发挥正常功能, 致使玉米株高和穗位高极显著降低。

图7 BR2基因在4个玉米自交系中的相对表达Fig. 7 Relative expression pattern of BR2 genes in four maize inbred line leaves
2.7 不同物种中BR2蛋白功能保守性及进化分析
在Rice Genome Annotation Project (http://rice.plantbiology.msu.edu/annotation_pseudo_apk.shtml)数据库中查找了GRMZM2G315375在其他物种的同源基因(表5), 在NCBI基因组数据库(https://www.ncbi.nlm.nih.gov/)中进行Blast比对, 搜索到相应基因的氨基酸序列, 使用 DNAMAN软件构建了该基因的系统进化树(图8)。

(图8)

表5 BR2在不同物种中的基因编号及功能注释Table 5 Genetic code and function annotation of BR2 in different species
结果发现, 在水稻、拟南芥、玉米和高粱4个物种中的同源性为55.61%, 氨基酸序列重复较低,但是将玉米和高粱中序列进行比对, 同源性高达93.91%, 具有非常高的相似性(图8-A), 同源树和系统发育进化树分析表明AtBR2和OsBR2在进化上相对保守(图8-B, C)。而玉米和高粱中BR2蛋白同源关系更近。以上结果说明玉米中ZmBR2与高粱中SbBR2具有更保守的氨基酸序列和进化关系, 发挥相似的功能。
3 讨论
BSA-Seq和BSR-Seq都是快速定位突变体候选基因的重要方法[13]。BSA-Seq是将2组DNA个体分别混合形成2个DNA池, 将这2个DNA池进行2组群体在多态位点的等位基因频率比较, 考察是否有较为明显的差异, 通过高密度分子标记再进行SNP的计算, 筛选出性状相关联的基因。BSR-Seq是转录组测序及集群分离分析法[11]。这2种方法定位基因简单且快速, 并且节约成本, 得到了广泛的应用[14-15]。Han等通过BSA方法快速将一个玉米多性状突变体muw定位到2号染色体靠近着丝粒的位置,发现该位置存在一个大概5 Mb的片段缺失[16]。Cai等发现了一个控制玉米籽粒发育的突变体emp10,通过BSA方法定位到1号染色体末端位置且成功克隆目标基因[17]。本研究采用野生型和突变体各60株, 运用BSA快速将phr-1定位到BR2基因1号染色体末端的4 Mb区间内。
图位克隆(map-based cloning)又称定位克隆, 通过选用合适的分子标记对功能基因组中相对稳定的基因筛选DNA文库, 根据遗传连锁原理通过染色体逐渐缩小目标基因所在区间, 进而克隆候选基因,最后再进行功能验证[18]。图位克隆作为基因克隆的方法之一, 在基因分离和克隆研究中得到了许多具有实际价值的基因在植物性状研究中。牛静等[19]利用图位克隆方法克隆了水稻株型基因RAD1和RAD2,验证该基因功能与生长素响应基因OsFH5等位。周文期等[20-21]利用图位克隆方法, 克隆到控制水稻叶表皮形态建成相关基因LPL2和LPL3, 单基因功能缺陷导致水稻对干旱和盐胁迫响应更敏感。吕洪坤等[22]通过图位克隆的方法得到玉米d2003矮秆基因,通过序列分析和等位性检验表明是Vp8的等位基因。张素梅等[23]通过图位克隆发现了一个玉米矮秆基因Dt, 并通过 RNA 干扰、过表达载体载体转化验证了Dt基因具有矮化功能。
玉米株高和穗位高决定着玉米的抗倒伏性和种植密度, 是影响玉米品质和产量的重要性状之一[24]。因此, 研究控制玉米株高和穗位高的分子遗传机制具有十分重要的理论和应用价值。前人在植物株高和穗位高研究中发现并克隆多个主效位点, 同时也证明了株高和穗位高之间互相关联[2]。本研究通过对野生型KWS39和突变体phr-1的株高、穗位高、节间长度等多个农艺性状的考察, 发现突变体phr-1成熟期相比于KWS39的株高穗位高极显著降低。与前人研究进行比较, 在1号染色体Bin1.06区间内存在一个控制玉米株高和穗位高的BR2基因, 通过与突变体br2-1的等位鉴定, 确定phr-1是一个br2-1新等位变异突变体。BR2基因很早就被认为是最具有价值的玉米矮化基因。
玉米的株型会直接影响光照与有效辐射, 从而影响光合效率和产量。如果植株高而纤细则会因为对光竞争产生倒伏问题[25]。调查发现株高与植株体内物质积累呈现正相关, 并且矮株具有更高效的将物质转化为籽粒的效率, 但是如果植株极端变矮,常常也会伴随一些不良性状, 进而影响产量[12]。虽然种植密度的增加是提高玉米产量的重要方向, 而高密度种植对玉米株型有着更高的要求条件, 株高和穗位过高容易发生倒伏, 也不能极度矮化, 降低了产量[2]。通过phr-1与KWS39的田间农艺性状比较,phr-1株高及穗位高相比对照, 极显著降低, 但不影响产量。phr-1的综合性状表明, 矮秆相较于高秆有利于通风和光照, 更适宜高密度种植[26]。前人研究也表明, 优良的综合性状使BR2基因在矮秆育种过程中发挥了重要作用, 其等位基因在生产上也被广泛应用[27]。因此, 在玉米育种中对矮秆基因的发掘及功能解析越来越受重视, 利用理化诱变等不同方法, 创造或筛选新矮秆种质资源, 克隆株高和穗位高基因对玉米种质创新及生产应用都具有非常重要的意义[28-30]。
br2-1植株矮小, 节间数不变、但节间长度缩小,叶片直立, 绿色保持时间长。前人经过对不同突变体的鉴定、QTL定位以及图位克隆等方法, 多个BR2等位突变体被鉴定和应用[28]。从玉米B73得到等位突变体br2-23, 该突变体在BR2基因的第5外显子上发生了8 bp的碱基缺失, 编码氨基酸因为移码造成了200个氨基酸的缺失, 进一步影响了生长素的运输而导致的植株矮化性状[31]。同样从B73中分离到矮秆材料NC238和br2进行等位杂交, 发现杂交的F1代没有野生型的高秆表型, 推测NC238是BR2的一个等位突变体, 通过测序发现该突变体在BR2第4内含子上插入了一个572 bp的微型反向重复转座元件(MITE), 造成了ZMABCB1的蛋白质结构发生了变化[32]。对玉米subr2进行等位基因分析及定位时发现, 在矮秆亲本52220中BR2基因的最后一个外显子上缺失了241 bp, 导致其编码蛋白中NTP激酶结构域失去功能, 该突变体不仅降低了玉米穗位高和株高, 还可以少量增加茎秆直径, 具备理想株型的增产潜能[33]。将突变体中BR2基因变异位点导入到正常植株, 可以通过缩短节间的长度来降低株高, 节间和叶片数目不会受其影响, 且导入系材料叶片保持绿色时间更久。另外, 研究表明BR2作为生长素的代谢途径的关键基因, 不仅可以促进玉米的生长, 还会影响叶片的夹角[31]。符合高密度种植的理想株型的一个重要方面是叶片直立, 夹角减小, 所以这些都表明在玉米改良的进程中BR2基因都具有相当大的应用价值[31-32]。在本研究中, 突变体phr-1株高和穗位高极显著降低, 其他部位发育正常, 正常结实, 百粒重无显著差异, 推测该基因在玉米株型育种中可能有着重要的应用价值。
4 结论
本研究旨在定位玉米矮秆基因PHR1, 并初步阐明其生物学功能。通过等位杂交实验证明了phr-1突变体就是br2-1的一个新等位突变体, 候选基因就是BR2基因。该研究丰富了BR2的遗传材料并为株高性状的遗传改良提供重要的理论依据和基因资源。
