木质素高效降解复合菌群构建及其降解效果
2024-02-14高付来田如意何寻阳李德军刘秋梅夏世斌







摘要:为构建一组高效降解木质素的复合菌群,并提高堆肥过程中辣椒秸秆内木质素的降解率。利用苯胺蓝褪色试验并测定菌株木质素降解酶(木质素过氧化物酶、锰过氧化物酶、漆酶)活性,从猪粪桑枝堆肥材料中筛选木质素降解菌株,以5株菌株为最小单位构建符合菌群。进行室内发酵试验,以CK(自然发酵)为对照、设置7种接菌处理(接种量均为3%)即单一菌剂(CB12、CF53、CF30、CF18、CF5)、复合菌剂(CS1)、市售菌剂(EM),测定木质素和纤维素降解率。结果表明,猪粪桑枝堆肥材料中的Achromobacter CB12、Bacillus altitudinis CB38、Bjerkandera CF5、Trichoderma harziana CF18、Myrothecium CF30、Cladsporium CF53对木质素具有较高的降解效果。菌株CF5、CF18、CF30、CF53、CB12的组合(复合菌群CS1)对木质素的降解能力优于其他菌株组合。复合菌群CS1木质素过氧化物酶活性和对辣椒秸秆中木质素的降解率分别是7.99 U/L和40.33%,较单一菌株分别提高了1.71倍和1.51倍。可见,符合菌群CS1综合表现良好,作为构建出的较优菌群,可有效提高堆肥时辣椒秸秆中木质素的降解效果,推进辣椒秸秆的肥料化。
关键词:木质纤维素;堆肥;复合菌群;木质素降解;水解酶
中图分类号:S182;S141.4" 文献标志码:A
文章编号:1002-1302(2024)24-0233-08
收稿日期:2023-12-16
基金项目:广西重点研发计划(编号:桂科AB22080097);中国科学院乡村振兴项目(编号:KFJ-XCZX-202303)。
作者简介:高付来(1999—),男,河南南阳人,硕士,主要从事甘蔗黑穗病的生物防治技术研究。E-mail:1079679996@qq.com。
通信作者:刘秋梅,博士,副研究员,主要从事微生物肥料研究,E-mail:liuqiumie@isa.ac.cn;夏世斌,博士,教授,主要从事生态修复及碳减排研究,E-mail:xiashibin@126.com。
我国作为农业大国,每年产生的农作物秸秆数量庞大。据统计,2021年我国秸秆产量约8亿t,居世界首位且秸秆产量依然呈上升趋势[1-2]。秸秆中包含丰富的C、N、P等营养物质和微量元素,将其肥料化还田能减少化肥施用,从而实现秸秆的资源化[3-5]。然而,秸秆中的木质纤维素降解效率较低,限制了其完全肥料化。木质纤维素主要由纤维素、半纤维素和木质素等组成,其中,木质素拥有紧密的碳水化合物结构,并以共价键的形式嵌入纤维素和半纤维素之间,形成了天然的物理屏障[6]。这限制了纤维素和半纤维素的酶解,因此,提高木质素的降解效率是突破辣椒秸秆肥料化技术瓶颈的关键。
生物法降解木质素具有能耗小、无污染、成本低的特点,是近年来国内外研究的热点[7]。木质素降解菌的来源多为腐烂的树叶和木材,其中白腐真菌、褐腐真菌和链霉菌是目前广泛研究的菌种。白腐菌可以分泌漆酶和木质素过氧化物酶,选择性破坏木质素单体间的醚键(C—O—C)和碳碳(C—C)键,以提高木质素的降解率[8-9],如Ceriporiopsis subvermispora、Dichomitus squalens和Phanerochaete chrysosporium。此外,Trametes versicolor和Fomes fomentarius等白腐菌对纤维素和半纤维素也有一定的降解作用[10]。褐腐菌通过产生羟基自由基(·OH)氧化木质素和分泌胞外酶2种方式降解木质素[11]。链霉菌能通过分泌漆酶和过氧化物酶破坏木质素中的羰基(CO)和甲氧基(—OCH3)[12]。此外,部分类芽孢杆菌属和木霉属的微生物也具有一定的木质素降解能力[13-14]。已发掘的微生物中,真菌的木质素降解能力通常强于细菌。但是,细菌具有繁殖快、环境耐受性强以及基因组小的优势。多项研究表明,复合菌群具有更加完备的协同酶系统,对木质素的降解效率高于单一菌株[15-18]。如,将2株芽孢杆菌复合后对木质素的降解效果有所提升;利用康宁木霉(Trichoderma koningiopsis)和黄孢原毛平革菌(Phanerochaete chrysosporium)构建的复合菌剂对木质素和纤维素的降解能力优于单一菌株;将毛曲菌(Trametes hirsuta)S13和平菇菌(Pleurotus ostreatus)S18复合后,结木质素降解酶活力得到了提升,并且烟杆中木质素的降解率提高到了41.1%[16-18]。因此,构建高效复合菌群是提高木质素生物降解率的有效途径。在湖南省,辣椒作为重要的经济作物,每年产生大量辣椒秸秆。然而,当前对木质素降解菌群的研究主要集中在玉米秸秆和小麦秸秆上,对辣椒秸秆的研究尚显不足。此外,在现有的研究中,所使用的菌株大多并非来源于堆肥材料,这使得研究的实用性和针对性受到限制。
本研究以碱木质素为唯一碳源,采用褪色试验和木质素降解酶活力检测的方法,从猪粪堆肥样品中分离筛选出具有木质素降解能力的菌株。通过形态学和分子生物学方法对这些菌株进行鉴定,并以木质素降解酶活力为筛选指标,构建了高效复合菌群CS1。通过室内发酵试验,明确了该复合菌群对辣椒秸秆的降解效果,为辣椒秸秆的肥料化和资源化利用提供了理论支撑。
1 材料与方法
1.1 材料
1.1.1 菌株样品来源
菌株来自腐熟期的堆肥试验堆样品(材料以猪粪桑枝为主),取各个部位均匀混合后采用四分法混合收集样品。碳氮比为15.51、pH值为9.78、含水量为24.00%、总氮含量为22.09%、总碳含量为22.09%。辣椒秸秆和玉米秸秆来源于长沙附近农户,粉碎后过20目筛备用。所有试验均在中国科学院亚热带农业生态研究所(湖南省长沙市芙蓉区远大二路644号)进行,试验时间为2020年6月至2021年12月。
1.1.2 培养基
(1)马铃薯葡萄糖琼脂培养基(PDA)-苯胺蓝培养基:马铃薯200.00 g/L、葡萄糖 20.00 g/L、琼脂20.00 g/L、苯胺蓝0.10 g/L,加入 1 L 蒸馏水,115 ℃灭菌30 min,用于真菌的初筛。
(2)LB-苯胺蓝培养基:蛋白胨10.00 g/L、酵母膏5.00 g/L、NaCl 10.00 g/L、琼脂20.00 g/L、苯胺蓝0.10 g/L,加入1 L蒸馏水,115 ℃灭菌30 min,用于细菌的初筛。
(3)液态产酶培养基:碱木质素 2.00 g/L、K2HPO4 1.00 g/L、MgSO4·7H2O 0.10 g/L、CaCl2 0.08 g/L、FeSO4·7H2O 0.05 g/L、MnCl2 0.02 g/L、KH2PO4 1.00 g/L、蛋白胨2.00 g/L,用于检测木质素降解菌的产酶能力。
1.2 试验方法
1.2.1 木质素降解菌的筛选
(1)初筛:将单菌株接种于PDA-苯胺蓝或LB-苯胺蓝培养基,每种菌株设置3个平行样本,在30 ℃恒温、避光条件下进行培养。细菌样本培养36 h后进行观察,真菌样本培养3 d后进行观察,确认是否存在褪色圈[17]。若存在褪色圈,以A值来判断菌株降解木质素的能力,A值越大表明菌株的降解能力越强。A=D/d,其中d代表菌株直径,D代表变色圈直径。
(2)复筛:选取Agt;1的真菌和Agt;3的细菌作为样本,接种在液态产酶培养基上,30 ℃下在180 r/min摇床中分别培养3 d、36 h,然后测定木质素降解酶活力。
1.2.2 酶活力测定
取发酵培养液在4 ℃、12 000 r/min 条件下离心10 min,取其上清液作为粗酶液。利用藜芦醇(VA)氧化法分光光度法、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)氧化法分光光度法和2,6-甲氧基苯酚(2,6-DMP)氧化法分光光度法,分别测定漆酶(Laccase,Lac)、锰过氧化物酶(Mn-dependent peroxidase,Mnp)、木质素过氧化物酶(Lignin Peroxidase,LiP)的活力。酶活性单位(U)分别为 1 min 氧化1 μmol VA、ABTS和2,6-DMP所需酶量[19]。
1.2.3 木质素降解菌的鉴定
(1)形态学观察:将菌株CB38、CB12、CF53、CF30、CF18、CF5分别接种在PDA培养基上,30 ℃恒温避光条件下培养3 d,并观察菌落形态特征。
(2)分子生物学鉴定:按照快速DNA提取试剂盒的说明提取菌株DNA。以提取的DNA为模板,利用真菌、细菌通用引物对菌株的18S rDNA或者16S rDNA序列进行PCR扩增。扩增后的产物送至生工生物工程(上海)股份有限公司进行测序,测序结果在NCBI网站上进行比对,并基于比对结果构建Neighbor-joining系统发育树。
(3)引物序列如下:真菌18S rDNA引物序列为ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′);细菌16S rDNA引物序列为27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGYTACCTTGTTACGACTT-3′)。PCR反应程序:97 ℃预变性3 min;97 ℃ 变性30 s,56 ℃退火30 s,72 ℃延伸90 s,循环30次;72 ℃终末延伸10 min。
1.2.3 高效降解木质素复合菌群的构建
将互不拮抗的单菌株悬液以等体积随机配对的方式混合,然后按3%接种量接入碱木质素液体培养基。在 30 ℃ 恒温、避光条件下培养,每12 h取1次样,连续收集7 d并测定木质素降解酶活性。
采用单因素试验对复合菌群的产酶条件进行优化,初始pH值设置为7,接种量设置为3%,培养温度设置为 30 ℃。采用控制变量法,在单一条件下分别考察初始pH值(4、5、6、7、8、9)、接菌量(1%、3%、5%、7%、9%)对于复合菌群木质素降解酶(锰过氧化物酶、过氧化物酶、漆酶酶)活性的影响。根据复合菌群的动态变化曲线,在培养第6天时进行取样测定。
1.2.4 室内发酵试验
设置不接菌(C)、单一菌剂(CB12、CF53、CF30、CF18、CF5)、复合菌剂(CS1)、市售菌剂(EM)共8个处理,进行为期28 d的室内发酵试验。辣椒秸秆和玉米秸秆按照2 ∶1的比例作为发酵材料,调节含水量至55%~65%。每个处理组称取30 g混匀后的材料置于500 mL锥形瓶中,115 ℃灭菌30 min,烘干后按照处理组分别接种3%的菌液。接种后,用纱布包裹瓶口,在 30 ℃ 下避光培养28 d。
试验前和结束时,利用范氏(Van Soest)洗涤分析法测定辣椒秸秆的木质素、纤维素含量,并计算降解率。同时,利用扫描电子显微镜观察试验结束时秸秆的结构。
1.3 统计分析
使用IBM SPSS Statistics 26软件进行统计分析,采用Duncans新复极差法进行多重比较。运用Origin 2018软件进行绘图。
2 结果与分析
2.1 木质素降解菌的产酶能力
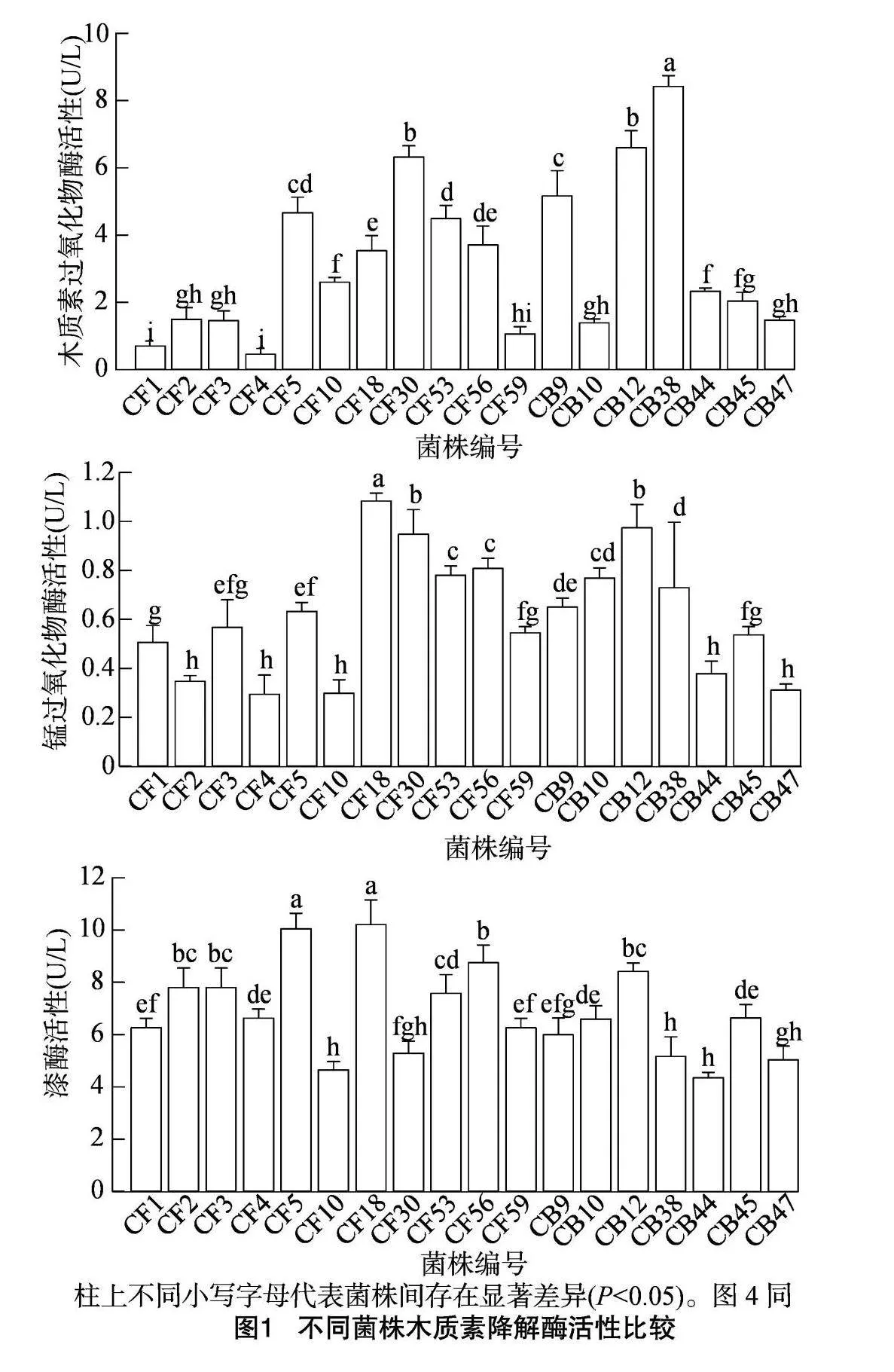
经过苯胺蓝培养基培养,筛选了具有木质素降解能力的11株真菌和7株细菌(表1)。酶活性测定结果表明,18株菌株的木质素降解酶活性存在显著差异。其中,菌株CB38、CB12、CF30的Lip活性显著高于其他菌株,分别为8.41、6.59、6.32 U/L。菌株CF18、CB12、CF30的Mnp活性均显著高于其他菌株,分别为1.08、0.97、0.95 U/L。另外,菌株CF18和CF5的Lac活力显著高于其他菌株,分别为10.20、10.04 U/L(图1)。经过比较,筛选出6株具有较高木质素降解酶活性的菌株,分别为CB38、CB12、CF53、CF30、CF18、CF5。
2.2 木质素降解菌的鉴定
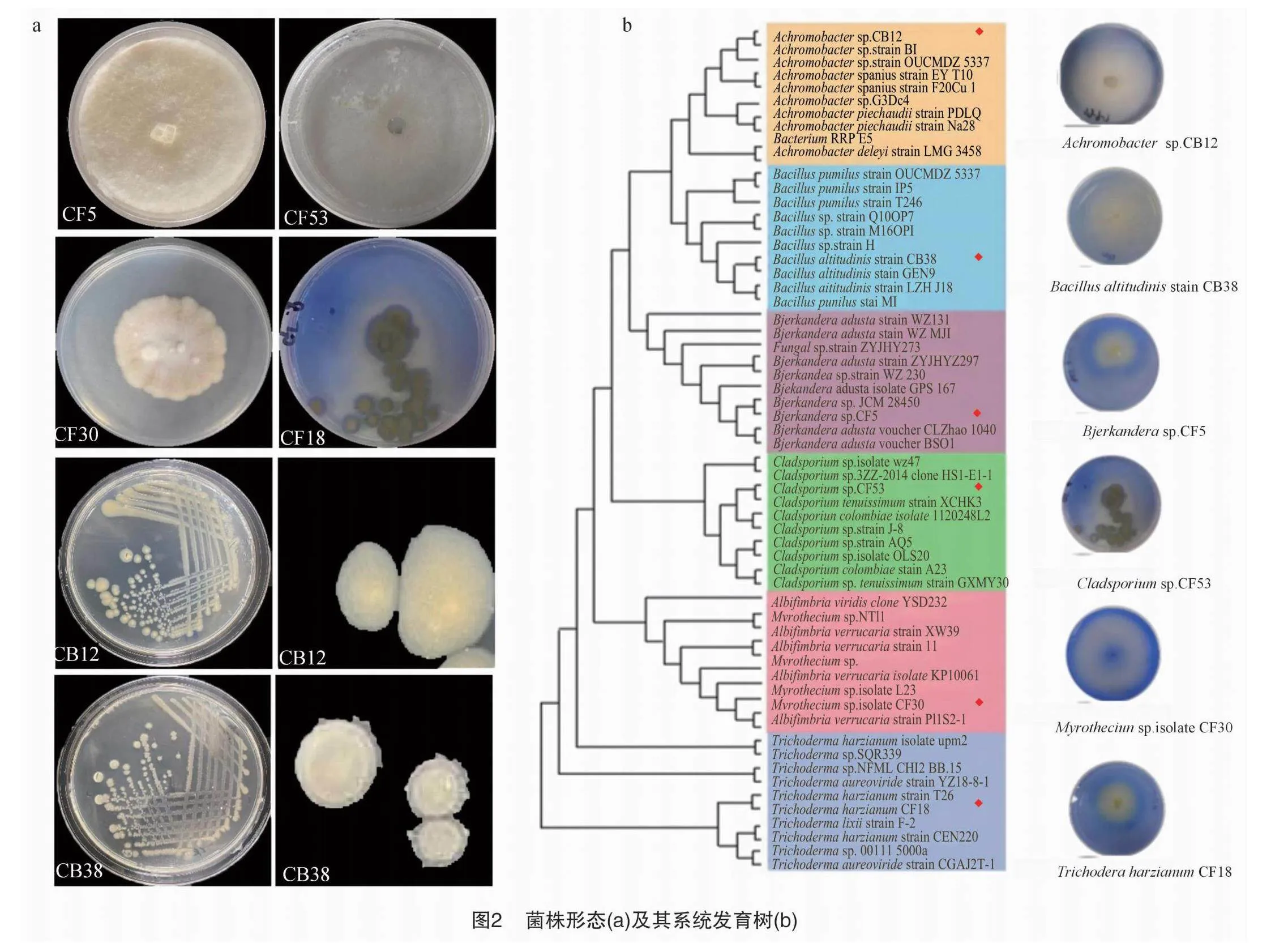
这6株菌株具有各自独特的形态特征(图2-a)和分子水平(图2-b)。菌株CB38在培养基上呈现米黄色不透明锯齿状的圆形菌落,其序列与Bacillus altitudinis(高地芽孢杆菌)具有高达99%的同源性。菌株CB12与Achromobacter(无色杆菌属)的同源性超过99%,在培养基上呈现米黄色透明整齐的圆形菌落。菌株CF53生长缓慢,表面无菌丝,孢子为绿色,其序列与Cladsporium sp.(枝孢霉属)具有99%的同源性。菌株CF30具有白色棉絮状菌丝,边缘呈现波纹状,其序列与Myrothecium(漆斑菌属)的同源性超过97%。菌株CF18的菌落呈圆形,菌丝生长较为稀疏、颜色为米色,产绿色孢子,其序列与Trichoderma harzianum(哈茨木霉菌)的同源性为97%以上。而菌株CF5的菌落为毛茸茸的白色网状圆形状态,不产孢子,其序列与Bjerkandera(烟管菌属)具有98%以上的同源性。
2.3 最优木质素降解菌群的确定
2.3.1 复合菌群的组成 表2中数据显示,筛选出的木质素降解菌株之间不存在拮抗关系。因此,根据最小复合菌群体系的构建方法 将这6种菌株进行随机组合[20]。共组成6组复合菌群,编号分别为CS1、CS2、CS3、CS4、CS5、CS6(表3)。
2.3.2 复合菌群的产酶能力
不同菌群木质素降解酶活性变化趋势相同,所有菌群Lip和Mnp活性都呈现先降低后升高再降低的趋势,而Lac活性整体呈现先升高后降低的趋势。此外,所有菌群木质素降解酶活性均在第6天达到峰值(图3)。
取菌群最佳酶活性值点,与单一菌株最高酶活性值作为对照进行比较。结果表明,6组复合菌群的Mnp最佳活性值均低于Lip和Lac。其中,菌群CS1的Lip和Lac最佳酶活性值显著高于其他复合菌群,分别为7.99、8.74 U/L,较单一菌株分别提高了56.52%、35.15%,其中CS1的Lip活性是单一菌株的1.71倍。然而,复合菌群CS2、CS3、CS4、CS5的木质素降解酶活性值反而低于单一菌株(图4)。以上结果表明,菌群CS1具有较高的木质素降解酶活性,而其他复合菌群的酶活性并不理想。因此,后续研究将仅针对构成菌群CS1的单一菌株以及菌群CS1进行辣椒秸秆降解效果探究。
2.3.3 产酶条件优化
菌群CS1的木质素降解酶活性受培养条件影响(图5)。随着pH值的升高,菌群CS1的木质素降解酶活性先升高后下降,在初始pH值为7时木质素降解酶活性达到最高,其Mnp、Lip、Lac的活性分别为0.95、6.42、8.27 U/L。这表明偏酸或偏碱的条件对于菌群CS1的酶活性影响较大(图5-b)。
另外,在接种量大于3%后,菌群CS1的木质素降解酶活性出现了显著降低的情况。在接种量为3%时,菌群CS1的Mnp、Lip、Lac活性分别达到了1.24、8.82、9.09 U/L(图5-a)。
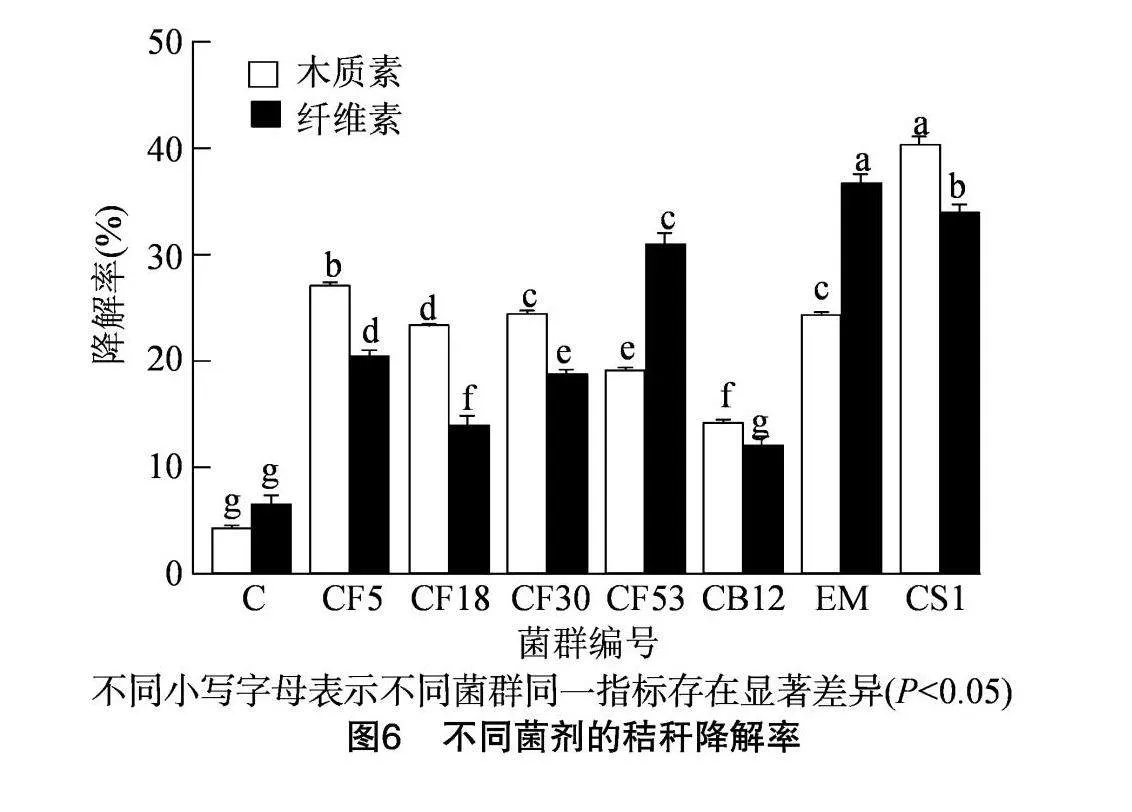
2.4 最优菌群CS1的辣椒秸秆降解效果
在对照组、单一菌剂处理和复合菌剂处理间,辣椒秸秆中木质素的降解效果存在显著差异(图6)。对照组辣椒秸秆中木质素的降解率仅为4.4%。在单一菌剂处理组中,木质素降解率由大到小依次是CF5、CF30、CF18、CF53、CB12,分别为26.8%、24.6%、23.2%、18.9%、13.9%,显著高于对照组(Plt;0.05)。这一结果表明,单一菌株对辣椒秸秆中木质素的降解具有促进作用。菌群CS1处理后辣椒秸秆中木质素的降解率为40.33%,是菌株CF5的1.51倍,显著高于其他处理(Plt;0.05)。与单菌株相比,菌群CS1对木质素的降解率提高了13.57%,同时对纤维素的降解率也有所提高。与市售菌剂相比,菌群CS1的木质素降解率提高了15.97%,纤维素降解率降低了7.5%。这一结果表明菌群CS1在促进辣椒秸秆中木质素降解方面的效果显著,且优于市售菌剂。
在电子显微镜观察下,对照组、菌群CS1处理组、EM菌剂处理组的辣椒秸秆表面结构存在显著差异(图7)。在对照组中,辣椒秸秆表面平坦光滑,木质素以平行的方式紧密排列。而在菌群EM处理组中,辣椒秸秆表面呈现疏松状态,内部存在碎片化迹象,部分木质素已发生降解。而在菌群CS1处理组中,辣椒秸秆表面存在微生物定殖的情况,木质素被大量破坏,产生了大范围的空腔。经过EM菌剂和复合菌群CS1处理后,均能破坏木质素形成的天然屏障,使易降解的物质暴露出来,进而促进辣椒秸秆的发酵。
3 讨论与结论
在好氧堆肥过程中,存在大量能够降解木质素的微生物,且与白腐菌、褐腐菌等常见木质素降解菌相比,能更好地适应辣椒秸秆肥料化过程中多变的环境条件。微生物主要通过胞外酶来降解木质素,其降解能力与酶活性呈正相关关系[21-23]。因此,通过测量酶活性,可以反映出微生物的分解能力。本研究发现,Trichoderma harzianum(哈茨木霉)CF18和Bjerkandera(烟管菌)CF5是堆肥过程中降解木质素能力最强的菌株,主要通过分泌Lac来降解木质素。同时,土壤中的哈茨木霉菌也具有产Lac能力和较强的木质素降解能力[14]。而在汪文强等的试验中烟管菌主要通过分泌Mnp降解木质素,这可能与菌株产酶时的生存环境有关[24]。此外,本研究发现Bacillus altitudinis CB38(高地芽孢杆菌)具有较高的Lip酶活性。但是,Bacillus altitudinis CB38参与构成的复合菌群木质素降解酶活性降低,与前人的结果存在一定差异[25]。这可能是因为部分菌株的代谢产物抑制了木质素降解酶活性,后续可以通过代谢组学的手段,研究菌株代谢产物对木质素降解酶生成过程的影响[26]。16S rDNA测序结果表明,无色杆菌是腐烂木材木质素降解菌群的主要优势菌属之一[27],本研究的结果与之相符。最后,本研究还在堆肥中发现了Myrothecium(漆斑菌)CF30和Cladsporium(枝孢霉菌)CF53这2种具备较强木质素降解能力的菌种。特别是Cladsporium CF53,它还具备降解纤维素的能力,这与前人的研究结果[28-29]一致。
本研究构建了6种复合菌群,其中复合菌群CS1是本研究构建的最优菌群,包含1种细菌(Achromobacter CB12)和4种真菌(Bjerkandera CF5、Trichoderma harzianum CF18、Myrothecium CF30、Cladsporium CF53)。所有菌群的木质素降解酶活性都在第6天左右达到峰值,与前人的研究展现了相似的趋势[29]。pH值和溶氧量是菌株酶活性出现峰值的重要因素,木质素降解前期产生了NH3导致pH值升高并逐渐达到菌株最佳生长条件,这一过程中菌株产酶能力随之上升,而随后菌株数量的增长引起了培养液中溶氧量和营养物质的减少从而导致酶活性降低[30]。在单因素试验中 也发现pH值会对复合菌群的木质素降解酶活性造成较大影响,这可能与菌群自身的最佳生长条件有关。同时,所有菌群Mnp活性较低,可能是因为以碱木质素为碳源的液态产酶培养基和生长条件使得菌株更偏向于产Lip和Lac[30]。本研究中菌群CS1的木质素降解酶活性是单一菌株的1.2倍,但其他菌群的木质素降解酶活性反而低于单菌株。可能是因为组合菌群的次生代谢产物存在差异,部分次生代谢会抑制酶活性,从而导致了这一结果的产生[25]。
本研究结果表明,无论是单菌株还是复合菌群,均具有降解辣椒秸秆的能力。其中,复合菌群CS1的降解效果比单一菌株高出1.51倍,这进一步验证了不同菌种之间酶系互补、相互促进的重要性[31]。这种优势使得复合菌群在辣椒秸秆发酵和肥料化过程中更具效率。然而,本研究中菌株的木质素降解酶活性较低,初步的单因素试验表明,初始培养条件可能是导致这一结果的关键因素。此外,本研究还观察到菌群CS1能在辣椒秸秆表面形成生物膜,这有助于破坏辣椒秸秆的细胞壁,增加其表面空隙,从而增大菌株与木质素、纤维素等物质的接触面积。复合菌群CS1主要通过产生Lip和Lac来氧化木质素中的酚类物质和非酚类物质间的化学键,破坏木质素组成的天然屏障,进一步促进纤维素的降解,进而提高辣椒秸秆的发酵过程和肥料化效果。
由于不同秸秆中木质素的结构和致密性存在差异,导致秸秆的降解效果存在一定的差异。因此,本研究中菌群对辣椒秸秆的降解效果与梅新兰等的结果[32]存在一定差异。在木质素降解过程中,细菌和真菌具有专化性。与市面在售的菌剂EM相比,复合菌群CS1对木质素的降解率提高了16%,但纤维素的降解效果不如市售菌剂。这表明复合菌群CS1对木质素具有一定的选择性。
本研究结果表明,从腐熟期堆肥材料中筛选了木质素降解菌株:无色杆菌CB12、芽孢杆菌CB38、烟管菌CF5、哈茨木霉CF18、漆斑菌CF30以及枝孢霉菌CF53。基于这些菌株,构建了复合菌群CS1。复合菌群CS1的构建能显著提升木质素降解酶的活性,并进一步提高辣椒秸秆的降解效率。
参考文献:
[1]罗 洋,张桂玲,王 芳,等. 辣椒秸秆生物炭对黄壤化学特性及小白菜生长的影响[J]. 四川农业大学学报,2022,40(6):847-852.
[2]于 帅,王思明. 盆几赏玩、举箸如药:中国辣椒利用方式的历史变迁[J]. 自然辩证法研究,2023,39(4):97-102.
[3]申煜丽,牛欣璐,贾若蕴,等. 辣椒秸秆高效利用的研究现状[J]. 现代园艺,2021(23):20-24.
[4]李雪菲,靳 拓,邵明娜,等. 外源菌剂对茄子秸秆原位堆肥微生物群落结构影响及其相关性分析[J]. 农业资源与环境学报,2023,40(4):883-892.
[5]李雪菲,靳 拓,张 凯,等. 微生物菌剂对设施辣椒秸秆原位堆肥土壤理化性质及细菌群落的影响[J]. 中国农业大学学报,2022,27(10):33-43.
[6]Buranov A U,Mazza G. Lignin in straw of herbaceous crops[J]. Industrial Crops and Products,2008,28(3):237-259.
[7]Zhao L,Sun Z F,Zhang C C,et al. Advances in pretreatment of lignocellulosic biomass for bioenergy production:challenges and perspectives[J]. Bioresource Technology,2022,343:126123.
[8]Bilal M,Ahmad Qamar S,Yadav V,et al. Exploring the potential of ligninolytic armory for lignin valorization:a way forward for sustainable and cleaner production[J]. Journal of Cleaner Production,2021,326:129420.
[9]Suryadi H,Judono J J,Putri M R,et al. Biodelignification of lignocellulose using ligninolytic enzymes from white-rot fungi[J]. Heliyon,2022,8(2):e08865.
[10]Masran R,Zanirun Z,Bahrin E K,et al. Harnessing the potential of ligninolytic enzymes for lignocellulosic biomass pretreatment[J]. Applied Microbiology and Biotechnology,2016,100(12):5231-5246.
[11]Atiwesh G,Parrish C C,Banoub J,et al. Lignin degradation by microorganisms:a review[J]. Biotechnology Progress,2022,38(2):3226.
[12]薛正莲,王 珊,孙俊峰,等. 链霉菌形态分化与次级代谢产物合成的研究进展[J]. 微生物学报,2021,61(12):3870-3886.
[13]Wang C M,Shyu C L,Ho S P,et al. Characterization of a novel thermophilic,cellulose-degrading bacterium Paenibacillus sp. strain B39[J]. Letters in Applied Microbiology,2008,47(1):46-53.
[14]Sijinamanoj V,Muthukumar T,Muthuraja R,et al. Ligninolytic valorization of agricultural residues by Aspergillus nomius and Trichoderma harzianum isolated from gut and comb of Odontotermes obesus (Termitidae)[J]. Chemosphere,2021,284:131384.
[15]Kamimura N,Sakamoto S,Mitsuda N,et al. Advances in microbial lignin degradation and its applications[J]. Current Opinion in Biotechnology,2019,56:179-186.
[16]付冰妍,孙向阳,余克非,等. 降解园林废弃物专用固体复合菌的构建及其堆肥效应研究[J]. 环境科学研究,2021,34(5):1231-1237.
[17]张仲卿,张爱忠,姜 宁. 混合真菌发酵对玉米秸秆纤维素与木质素降解率的影响[J]. 动物营养学报,2019,31(3):1385-1395.
[18]Yang L,Yuan H L,Yang Y,et al. Enhanced lignin degradation in tobacco stalk composting with inoculation of white-rot fungi Trametes hirsuta and Pleurotus ostreatus[J]. Waste and Biomass Valorization,2020,11(7):3525-3535.
[19]崔堂武,袁 波,凌 晨,等. 木质素降解酶的酶活测试方法的评价与分析[J]. 化工进展,2020,39(12):5189-5202.
[20]Puentes-Téllez P E,Falcao Salles J.Construction of effective minimal active microbial consortia for lignocellulose degradation[J]. Microbial Ecology,2018,76(2):419-429.
[21]李佩琪,孙庆培,王志慧,等. 棉秆固体发酵中木质素降解与酶活性变化的关联分析[J]. 新疆农业科学,2023,60(6):1423-1432.
[22]韩月颖,张喜庆,曲云鹏,等. 一株低温木质素降解菌的筛选、产酶优化及酶学性质[J]. 微生物学通报,2021,48(10):3700-3713.
[23]王进军,韦慧仙,鲍 飞,等. 土壤中木质素降解菌株的筛选及产酶条件优化[J]. 江苏农业科学,2023,51(16):210-222.
[24]汪文强,李 勇,张旭辉,等. 烟管菌M-1对柑橘炭疽病菌的抑制作用及发酵条件优化[J]. 中国生物防治学报,2018,34(3):423-430.
[25]Mathews S L,Grunden A M,Pawlak J. Degradation of lignocellulose and lignin by Paenibacillus glucanolyticus[J]. International Biodeterioration amp; Biodegradation,2016,110:79-86.
[26]Fang X X,Li Q M,Lin Y Q,et al. Screening of a microbial consortium for selective degradation of lignin from tree trimmings[J]. Bioresource Technology,2018,254:247-255.
[27]李 强,吴晓青,张新建. 微生物降解秸秆木质素的研究进展[J]. 微生物学报,2023,63(11):4118-4132.
[28]Struszczyk-S'wita K,Droz·dz·yński P,Murawska K,et al. PUF-Immobilized Bjerkandera adusta DSM 3375 as a tool for bioremediation of creosote oil contaminated soil[J]. International Journal of Molecular Sciences,2022,23(20):12441.
[29]Wilhelm R C,Singh R,Eltis L D,et al. Bacterial contributions to delignification and lignocellulose degradation in forest soils with metagenomic and quantitative stable isotope probing[J]. The ISME Journal,2019,13(2):413-429.
[30]郭晓威,王秀然,解长睿,等. 木质素降解菌株的分离及其降解玉米秸秆过程中产酶特点[J]. 微生物学报,2017,57(12):1806-1816.
[31]张 鑫,青格尔,高聚林,等. 玉米秸秆低温降解复合菌的筛选及其菌种组成[J]. 农业环境科学学报,2021,40(7):1565-1574.
[32]王新光,田 磊,王恩泽,等. 玉米秸秆高效降解微生物复合菌系的构建及降解效果评价[J]. 生物技术通报,2022,38(4):217-229.
[33]梅新兰,郑海平,李水仙,等. 降解水稻秸秆细菌-真菌复合菌系的构建与评价[J]. 农业环境科学学报,2021,40(10):2217-2225.
