桦褐孔菌品质鉴定及抗氧化活性研究
2024-02-13常明珠李亭昱崔云鹤刘腾达母润红
常明珠,李亭昱,崔云鹤,刘腾达,郭 笑,母润红
(1.北华大学基础医学院,吉林 吉林 132013;2.北华大学药学院,吉林 吉林 132013)
桦褐孔菌(Inonotusobliquus)主要生长于俄罗斯北部、中国东北及日本北海道等寒冷地区,是白桦树上生长的药用真菌[1-2]。大量研究[3-4]表明,桦褐孔菌可治疗和预防癌症、心脑血管疾病和糖尿病等多种疾病,此外,桦褐孔菌还具有抗衰老、抗病毒和免疫调节等作用[1-5]。多糖(polysaccharides)是构成细胞和生物体的重要物质,在生物体的生命活动中发挥着重要作用[6]。菌类多糖在抗肿瘤、抗氧化、抗病毒、抗炎及增强免疫力等方面都具有明显作用[7-9],因此,菌类多糖的研究受到国内外学者的广泛重视。
本研究通过水提法、超声法、微波法和酶法4种方法[8-11]对桦褐孔菌多糖进行提取,并对其抗氧化活性进行测定,其中包括总抗氧化能力及DPPH·、·OH和ABTS·还原能力的测定[12-13]。本研究可为桦褐孔菌多糖进一步开发相应的抗氧化食品、保健品、药品等提供理论基础。
1 材料与方法
1.1 试验材料
桦褐孔菌(吉林省长白山地区)经北华大学韩东副教授鉴定为桦褐孔菌的亚实体。
1.2 主要试剂
葡萄糖标准品、纤维素酶、2,2-二叠氮化物-双(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、1,1-二苯基-2-三硝基苯肼(DPPH)、抗坏血酸(VC)、2,4,6-三吡啶基三嗪(TPTZ:)(北京定国长盛生物科技有限公司);无水乙醇、乙酸、无水乙酸钠、氯化铁、过氧化氢、硫酸亚铁、氯化钠、水杨酸、过硫酸钾等均为分析纯(辽宁泉瑞试剂有限公司)。
1.3 仪器与设备
微型高速粉碎机(上海博润实业有限公司医疗器械厂);ATY224型电子天平(日本SHIM ADZU);RE-52A系列旋转蒸发仪(上海亚荣生化仪器厂);UV-2550型紫外分光光度计(SHIMADZU公司,日本);infiniteM200型酶标仪(TECAN公司,瑞士)。
1.4 试验方法
1.4.1 葡萄糖标准曲线的绘制
标准液制备:称取100 mg葡萄糖定容100 mL,分别取溶液1、2、3、4、6、8 mL至100 mL的容量瓶中,制成10、20、30、40、60、80 μg/mL的标准液。
苯酚溶液制备:称取5 g苯酚,溶解于95 mL蒸馏水中。
反应液制备:分别取1 mL的标准液,加入1 mL的苯酚溶液,迅速加入5 mL的浓硫酸,震荡摇匀。在沸水浴中加热15 min后冷却至室温,在490 nm波长下测定其吸光值。
梯度浓度的葡萄糖标准溶液浓度为横坐标,通过苯酚浓硫酸法制得的反应液在490 nm波长处所测得的吸光度为纵坐标,绘制葡萄糖标准曲线[14]。
1.4.2 不同方法提取桦褐孔菌多糖
取适量桦褐孔菌干燥至恒重,粉碎过60目筛,分别用水提法、超声法、微波法和酶法对桦褐孔菌多糖进行提取,比较其提取率。
水提法:料液比m(g)∶V(mL)=1∶20(桦褐孔菌粉末5 g),80 ℃回流提取90 min,收集上清液,重复2次,上清液通过旋转蒸发浓缩至50 mL。加无水乙醇至乙醇浓度为80%,静置24 h,沉淀即为桦褐孔菌粗多糖。将乙醇蒸发后,用50 mL蒸馏水溶解,测定桦褐孔菌多糖的浓度。桦褐孔菌多糖的提取率=(x×稀释倍数×50)/m×%,式中:x是根据葡萄糖标准曲线获得的桦褐孔菌试验样品的浓度,m为桦褐孔菌粉末质量。
超声法:料液比m(g)∶V(mL)=1∶20、超声功率为400 W、提取温度为80 ℃、提取时间为90 min,后续操作与水提法相同[9]。
微波法:料液比m(g)∶V(mL)=1∶20、微波功率为400 W、提取温度为80 ℃、提取时间为20 min,后续操作与水提法相同[10]。
酶法:料液比m(g)∶V(mL)=1∶20 、提取温度为80 ℃、提取为90 min,3 500 U/g的纤维素酶在50 ℃水浴中振荡处理30 min,后续操作与水提法相同[11]。
1.4.3 抗氧化活性试验
选取4种方法中提取率最高的超声法提取的桦褐孔菌多糖用于抗氧化能力的测定。
1)总抗氧化能力的测定:以10∶1∶1的比例将醋酸-醋酸钠缓冲液(300 mmol/L,pH 3.6)、TPTZ溶液(10 mmol/L)与FeCl3溶液(20 mmol/L)混匀,配成FRAP工作液。取20 μL系列浓度的FeSO4溶液于96孔酶标板中,再加入150 μL FRAP工作液,混匀后37 ℃孵育10 min,测定其在593 nm处吸光度值。以吸光度值(OD)为横坐标,FeSO4溶液的浓度(FRAP值)为纵坐标,绘制标准曲线[12-15]。分别取VC和桦褐孔菌多糖提取液20 μL于96孔酶标板,与上述操作步骤相同。在593 nm条件下,样品测得吸光度值为Ai,蒸馏水做空白吸光度值为A0,VC为Amax。相对总还原百分率=(Ai-A0)/(Amax-A0)×100%。
2)DPPH·清除率的测定:用95%乙醇配制DPPH溶液(0.2 mmol/L),备用,配制梯度浓度的VC溶液和桦褐孔菌多糖溶液适量。取100 μL样品溶液于96孔酶标板中,再分别加入100 μL DPPH溶液,混匀后避光室温反应30 min,测定其在517 nm处吸光度值。同时用水做空白,以溶液浓度为横坐标,DPPH·清除率为纵坐标,绘制清除率曲线[13-14]。清除率=[A0-(Ai-Aj)]/A0× 100%,式中,Ai:样品溶液+DPPH溶液的吸光度值;Aj:样品溶液+95%乙醇的吸光度值;A0:水+DPPH溶液的吸光度值。
3)·OH清除率的测定:用无水乙醇配制9 mmol/L水杨酸溶液,用蒸馏水配制9 mmol/L FeSO4溶液、9 mmol/L H2O2溶液备用,配制梯度浓度VC溶液和不同浓度桦褐孔菌多糖溶液适量。分别吸取50 μL VC溶液于96孔酶标板中,再分别加入50 μL FeSO4溶液、50 μL水杨酸溶液迅速混匀,37 ℃避光反应10 min后,加入50 μL 9 mmol/LH2O2溶液迅速混匀,37 ℃避光反应30 min,于510 nm读取吸光度值。用蒸馏水做空白,以溶液浓度为横坐标,·OH清除率为纵坐标,绘制清除率曲线[15]。清除率=[A-(Ai-Aj)]/A0× 100%,式中,Ai:样品溶液+FeSO4溶液+水杨酸溶液+H2O2溶液的吸光度值;Aj:样品溶液+FeSO4溶液+水杨酸溶液+H2O的吸光度值;A0:H2O+FeSO4溶液+水杨酸溶液+H2O2溶液的吸光度值。
4)ABTS·清除率的测定:将100 mL ABTS(7 mmol/L)和1.782 mL过硫酸钾(140 mmol/L)混匀,室温避光过夜,制备成ABTS工作溶液。测量前用PBS缓冲液(pH 6.8)稀释至A734=0.700±0.020。取40 μL系列浓度的VC溶液和多糖样品溶液,然后分别加入160 μL的ABTS工作液,25 ℃下静置4 min,测定其在734 nm处的吸光度。通过向无样品的反应液中加入蒸馏水作为空白,以溶液浓度为横坐标,清除率为纵坐标,绘制清除曲线[16]。清除率=[A0-(Ai-Aj)]/A0× 100%,式中,Ai:VC溶液+ABTS·工作液的吸光度值;Aj:样品溶液+蒸馏水的吸光度值;A0:水/无水乙醇+ABTS·工作溶液的吸光度值。
1.5 统计学分析

2 结果与分析
2.1 葡萄糖标准曲线结果
本研究结果显示,以梯度浓度的葡萄糖标准溶液浓度为横坐标,通过苯酚浓硫酸法制得的反应液在490 nm波长处所测得的吸光度为纵坐标,所测得的线性回归方程为y=0.015 60x-0.002 33,R2=0.999 94。见图1。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
2.2 不同方法对桦褐孔菌多糖提取率影响
本研究结果显示,4种方法按上述条件分别提取3 次,取平均值。不同提取方法所得桦褐孔菌多糖提取率见表1。由表1可见,超声法、微波法、酶法较水提取法均显著提高了桦褐孔菌多糖的提取率。其中超声法效果最好,多糖提取率较水提法提高30.85%。因超声法可加速桦褐孔菌细胞壁的破裂,增加其多糖的溶解速率和溶解量,从而提高了提取率[16]。微波法可使桦褐孔菌内部的水分加速运动而产生大量热量,同时水分汽化产生压力导致细胞壁破裂,这有利于多糖组分的快速溶解并节省时间,但高温会引起多糖的降解或变性[17]。通常,植物细胞壁的主要成分是纤维素、半纤维素和果胶等[18-19],但微波时,蛋白等杂质也会被大量释放,这反而会降低桦褐孔菌多糖的溶解度[17]。与水提取和酶法相比,超声法操作简单,节约成本;与微波法相比,超声法可控性强,安全性高。因此,超声法更适合桦褐孔菌多糖的提取。
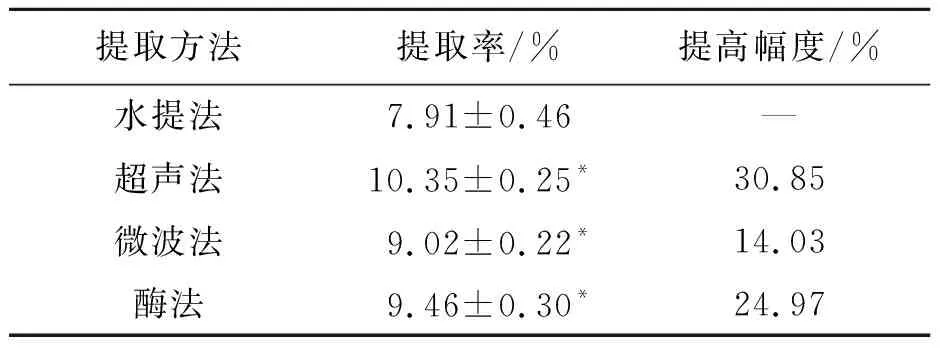
表1 各种提取方法对桦褐孔菌多糖提取率的影响Tab.1 Effect of extract methods on the yields of polysaccharide from Inonotus obliquus
2.3 抗氧化活性试验结果
2.3.1 总抗氧化能力测定结果
以吸光度值(OD)为横坐标,FeSO4溶液的浓度(FRAP值)为纵坐标,建立线性回归方程为y=834.279 62x+2.102 59,R2=0.999 94。VC的总抗氧化能力的线性回归方程结果为y=0.011 72x-0.000 49,R2=0.999 91。经计算,400 μg/mL时,VC的吸光度(OD)为4.69,桦褐孔菌多糖的OD值为0.29,两者FRAP值分别为3 914.87、244.04 μmol/L,即桦褐孔菌多糖还原能力相当于VC的0.16倍。见图2、3。
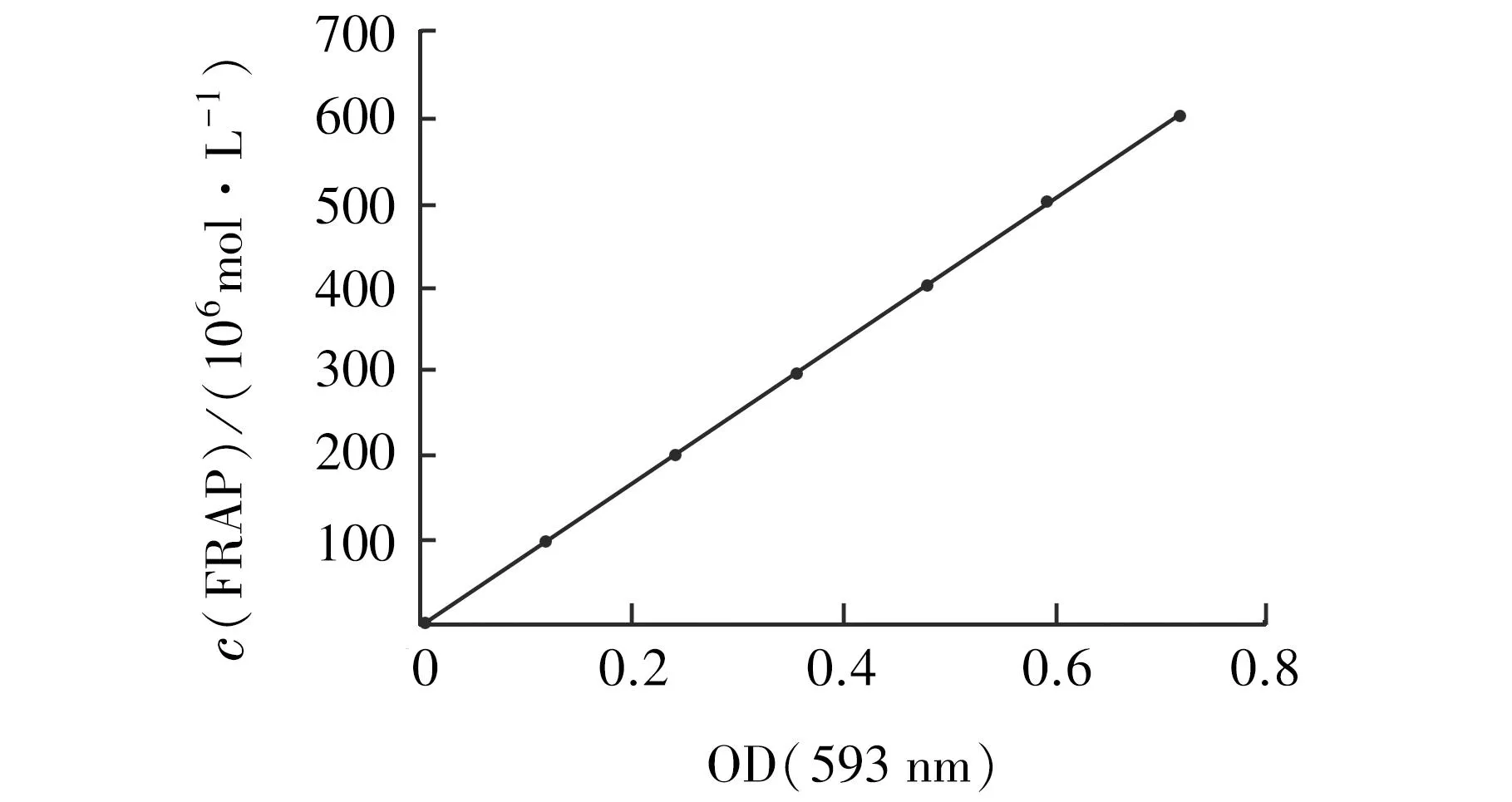
图2 FeSO4的总抗氧化能力Fig.2 Total antioxidant capacity of FeSO4
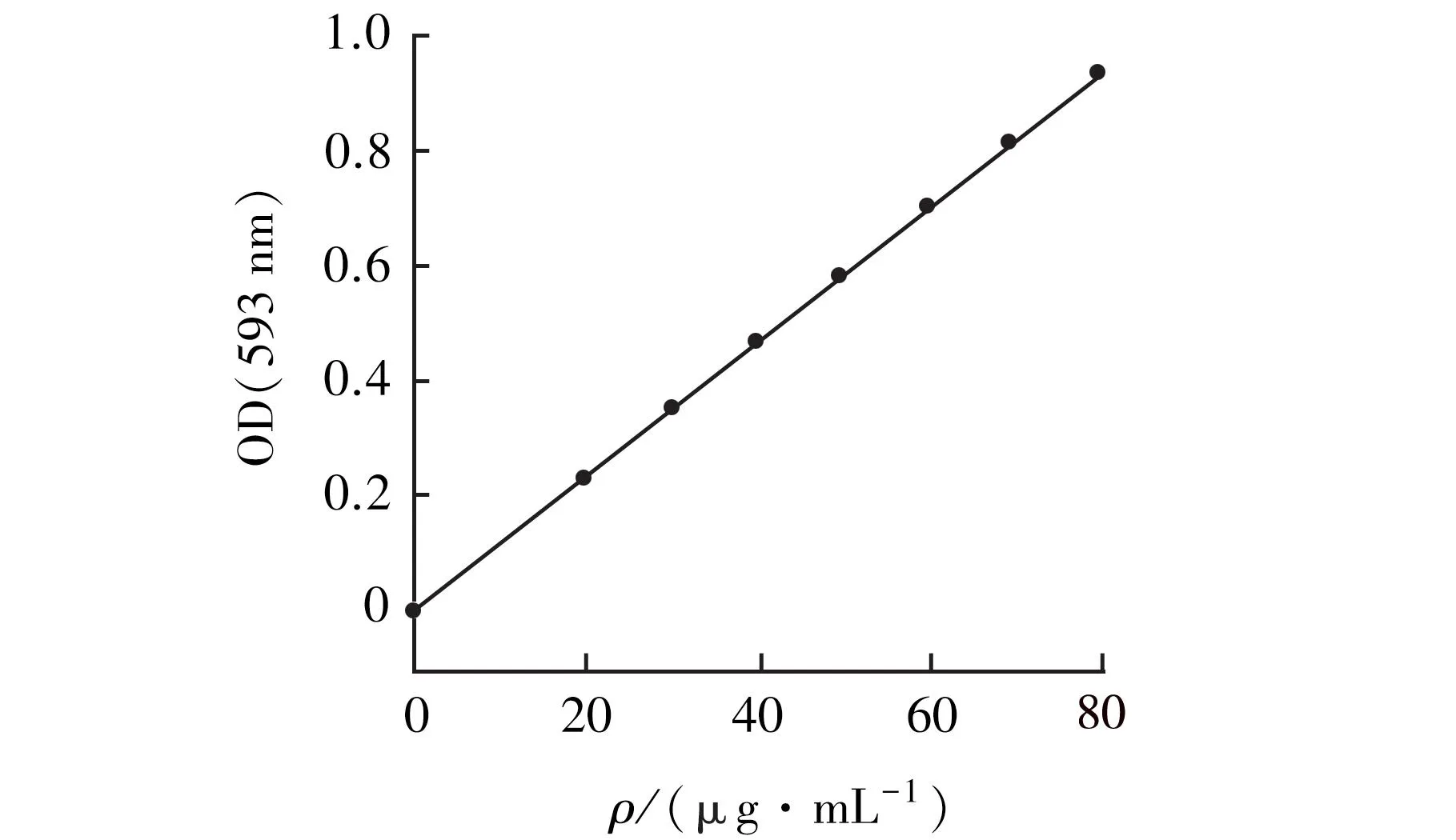
图3 VC的总抗氧化能力Fig.3 Total antioxidant capacity of VC
2.3.2 DPPH·清除率的测定结果
本研究结果显示,VC和桦褐孔菌多糖对DPPH·的清除能力均随着样品质量浓度增大而增大,其药物安全性指标EC50分别为17.12、290.32 μg/mL。EC50越小,其抗氧化能力越强。说明桦褐孔菌粗多糖对DPPH·清除能力较弱,由此提示我们可通过进一步分离纯化桦褐孔菌多糖筛选其强抗氧化组分。见图4。
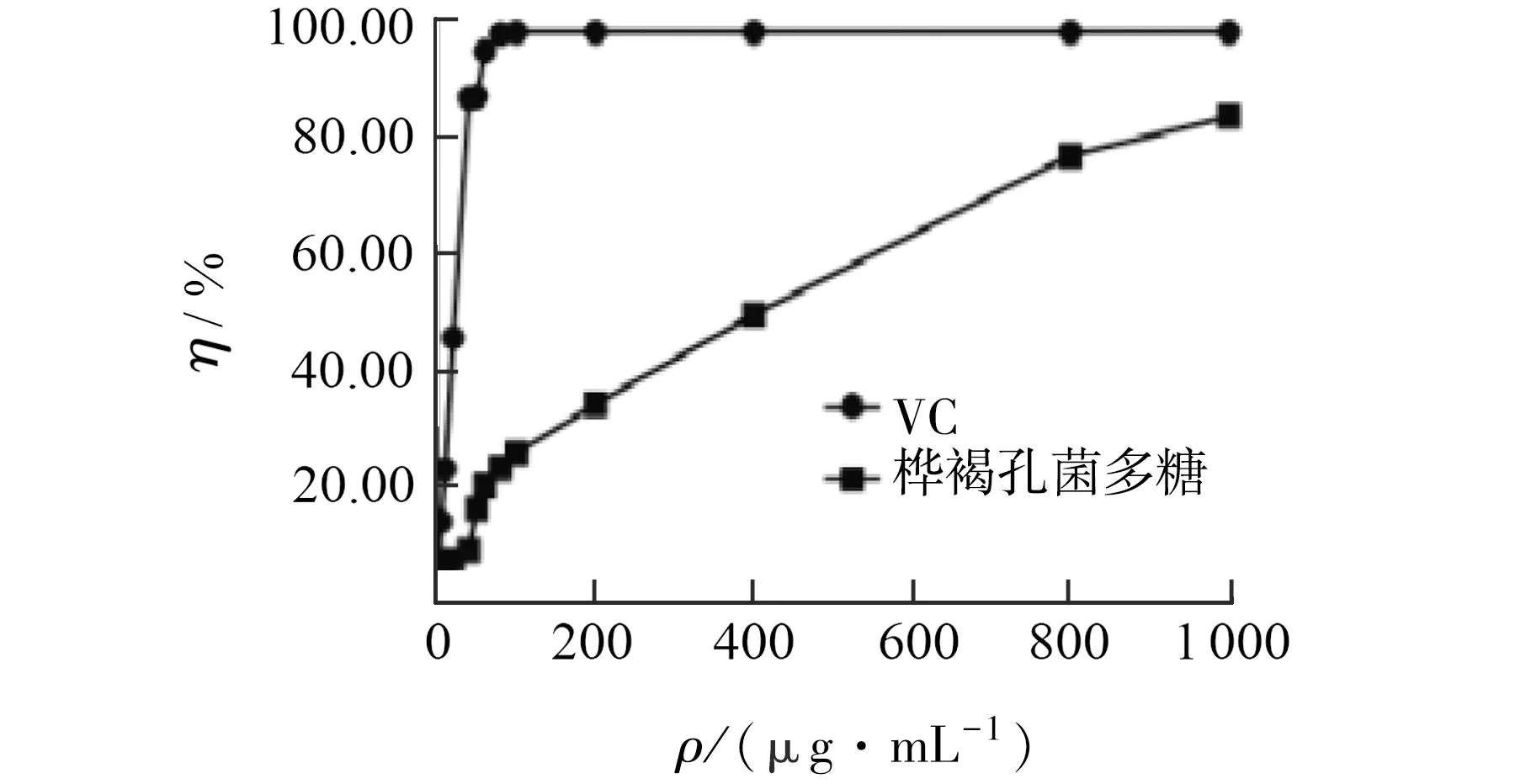
图4 VC和桦褐孔菌多糖对DPPH·的清除作用Fig.4 Clearance effect of VC and polysaccharides from Inonotus obliquus on DPPH· free radicals
2.3.3 ·OH清除率的测定结果
本研究结果显示,VC和桦褐孔菌多糖随着其质量浓度的增大其对DPPH·的清除能力也增强,其EC50分别为11.49、65.67 μg/mL。桦褐孔菌多糖对DPPH·清除能力弱于VC,但在一定浓度下,两者对DPPH·的清除能力均能达到80%以上,说明桦褐孔菌多糖对·OH具有较好的清除能力。见图5。

图5 VC和桦褐孔菌多糖对·OH的清除作用Fig.5 Clearance effect of VC and polysaccharides from Inonotus obliquus on ·OH free radicals
2.3.4 ABTS·清除率的测定
本研究结果显示,VC和桦褐孔菌多糖随着其质量浓度的增大其对 ABTS·的清除能力也增强,其EC50分别为149.41、512.22 μg/mL。在一定浓度下,两者对ABTS·的清除能力均能达到80%以上。见图6。
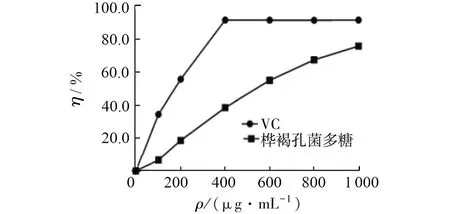
图6 VC和桦褐孔菌多糖中黄酮类化合物对ABTS的清除作用Fig.6 Clearance effect of VC and flavonoids from Inonotus obliquus on ABTS free radicals
3 结 论
本研究通过水提法、超声法、微波法和酶法分别对桦褐孔菌多糖进行了3次提取,提取结果显示,超声法、微波法和酶法对桦褐孔菌多糖的提取率显著优于水提法,其中超声法在料液比m(g)∶V(mL)=1∶20、超声功率为400 W、提取温度为80 ℃和提取时间为90 min时,多糖提取率最高,为10.35%。选取4种方法中提取率最高的超声法对桦褐孔菌多糖进行提取,用于后续抗氧化能力的测定。以VC为对照,桦褐孔菌多糖的抗氧化能力测定发现其总抗氧化能力微强于VC,大约为VC的0.16倍;桦褐孔菌多糖对DPPH·的清除率对应的EC50为290.32 μg/mL,显著低于VC,显示其在对DPPH·的清除率方面能力较弱;桦褐孔菌多糖清除·OH和ABTS·的药物安全性指标(EC50)分别为65.67、512.22 μg/mL,虽低于VC,但在一定浓度下,两者对·OH和ABTS·的清除率均可达到80%以上。
综合以上试验结果可以得出,超声法是4种方法中提取桦褐孔菌多糖的最佳工艺,且桦褐孔菌多糖具有较好的抗氧化活性,但关于其强抗氧化组分和强抗氧化机制方面还有待于进一步的研究与补充。在后续的研究中可采用多种方法辅助或改良、完善提取率最高的超声法,进一步提高提取率,也可通过对桦褐孔菌粗多糖进行纯化,促进桦褐孔菌多糖抗氧化作用的发挥。本研究结果可为桦褐孔菌多糖的深入研发提供参考。
