芽孢杆菌Ya-1的定殖特性及其对辣椒根际细菌多样性的影响
2024-02-09赵志祥李道敏谭诗梦严婉荣王宝肖彤斌





摘要:【目的】研究芽孢杆菌Ya-1(简称Ya-1)在辣椒根际、根和叶中的定殖特性及其对辣椒根际细菌多样性的影响,为微生态调控防治辣椒枯萎病及芽孢杆菌的开发利用提供参考依据。【方法】以自然土+蛭石(Ns)和灭菌土+蛭石(Ss)2组基质盆栽辣椒为试验材料,采用利福平标记法,分别对2组基质设接种无菌水(A)、接种抗200 μg/mL利福平的Ya-1突变株(Ya-1-200)发酵液(B)、接种辣椒枯萎病菌SMPLJLD-1孢子悬浮液(C)和接种Ya-1-200发酵液+辣椒枯萎病菌SMPLJLD-1孢子悬浮液(D)4个处理,接种后0、1、2、3、7、10和20 d,测定Ya-1在根际、根和叶片的定殖量的,并结合绝对定量PCR验证Ya-1的定殖规律。同时利用高通量测序技术对接种0、10、20 d根际细菌多样性及其群落结构差异进行比较分析。【结果】稀释分离法检测Ya-1在辣椒植株及根际中的定殖情况结果显示,接种3 d 后,B、D处理下根际和叶中Ya-1的定殖量逐渐下降,20 d后趋于稳定,定殖量均大于1×104 CFU/g。绝对定量PCR检测结果显示,B、D处理后,辣椒根际、根和叶中Ya-1单位样本拷贝数呈先增加后减少的变化趋势,接种3 d后达到峰值,并在20 d后稳定在1.0×105 copies/g以上。基于高通量测序分析结果显示,Ns组接种10 d与接种20 d相比,B处理ACE指数和Chao1指数显著降低(Plt;0.05,下同),而C和D处理2个指数显著升高。辣椒根际细菌群落中相对丰度大于4%的优势菌门包括放线菌门、酸杆菌门、拟杆菌门、绿弯菌门、芽单胞菌门和变形菌门。接种10 d时,C处理辣椒根际细菌群落中芽单胞菌门相对丰度最低(4.07%),B处理该菌门的相对丰度最高(6.77%)。与A处理相比,B处理在接种10和20 d时贪铜菌属、Aquicella、Trinickia、Crenobacter、产碱杆菌属、戴氏菌属、假单胞菌属、Pseudogulbenkiania、芽孢杆菌属、罗河杆菌属和Vogesella均明显富集;接种10 d后,与A处理相比,B处理鞘氨醇单胞菌属的相对丰度明显升高,Gp6、假甲基杆菌属的相对丰度明显降低。【结论】Ya-1可在辣椒根际、根和叶中有效定殖,接种该菌后能改变辣椒根际细菌Alpha多样性指数,提高辣椒根际中具有抗病促生和改善辣椒品质等相关功能细菌的相对丰度。推测Ya-1具有开发应用的
潜力。
关键词:芽孢杆菌;利福平标记;绝对定量PCR;定殖;根际细菌多样性
中图分类号:S641.306 文献标志码:A 文章编号:2095-1191(2024)11-3346-12
Colonization characteristics of Bacillus sp. Ya-1 and its effects on rhizosphere bacterial diversity of pepper
ZHAO Zhi-xiang, LI Dao-min, TAN Shi-meng, YAN Wan-rong, WANG Bao, XIAO Tong-bin*
(Institute of Plant Protection, Hainan Academy of Agricultural Sciences/Research Center for the Quality Safety and Standards of Agricultural Products, Hainan Academy of Agricultural Sciences/Hainan Key Laboratory for
Control of Plant Diseases and Insect Pests/Scientific Observation and Experiment Station of Crop Pests in Haikou, Ministry of Agriculture and Rural Affairs, Haikou, Hainan 571100, China)
Abstract:【Objective】To investigate the colonization characteristics of Bacillus sp. Ya-1 in rhizosphere,root and leaf of pepper and its effects on rhizosphere bacterial diversity,so as to provide reference for the control of pepper wilt disease by microecological regulation and the further development and utilization of Bacillus sp.【 Method】Natural soil + vermicu‐lite( Ns) and sterilized soil + vermiculite( Ss) matrix potted pepper were used as experimental materials. Using rifampi‐cin labeling method,the 2 groups of matrix were inoculated with sterile water( A), inoculated with Ya-1 mutant( Ya-1-200) fermentation broth that was resistant to 200 μg/mL rifampicin( B), inoculated with spore suspension of pepper fu‐sarium wilt bacteria SMPLJLD-1( C), and inoculated with YA-1-200 fermentation broth + spore suspension of pepper fu‐sarium wilt bacteria SMPLJLD-1( D). At 0, 1, 2, 3, 7, 10 and 20 d after inoculation, the colonization amounts of Ya-1 in rhizosphere, root and leaf were determined, and the colonization rule of Ya-1 was verified by absolute quantitative PCR. At the same time, the diversity and community structure difference of rhizosphere bacteria at 0, 10 and 20 d after ino-culation were compared and analyzed by high-throughput sequencing technology.【 Result】The results of the detection of Ya-1 colonization in pepper plants and rhizosphere using rifampicin labeling method showed that after 3 d of inoculation,the colonization amount of Ya-1 in rhizosphere soil and leaves under treatments B and D gradually decreased, and tended to be stable after 20 d, and it was above the level of 1×104 CFU/g after 20 d. The results of absolute quantitative PCR showed that after B and D treatment, the copy number of Ya-1 unit samples in rhizosphere, root and leaf of pepper in‐creased first and then decreased, reached the peak after 3 d of inoculation, and stabilized above 1.0×105 copies/g after 20 d. Analysis based on high throughput sequencing showed that comparing with 10 and 20 d after inoculation in Ns group,ACE index and Chao1 index in B treatment were significantly decreased( Plt;0.05, the same below), while the 2 indexes in C and D treatments were significantly increased. The dominant bacterial phyla with relative abundances more than 4% in the rhizosphere of pepper included Actinobacteria,Acidobacteria,Bacteroidetes,Chloroflexi,Gemmatimonadetes and Proteobacteria. At 10 d after inoculation,the relative abundance of Gemmatimonadetes in the rhizosphere soil bacterial community of pepper was the lowest( 4.07%) in treatment C,while it was the highest( 6.77%) in treatment B. Compared with treatment A,treatment B showed obvious enrichment of Cupriavidus,Aquicella,Trinickia,Crenobacter,Alcaligenes,Devosia,Pseudomonas,Pseudogulbenkiania,Bacillus,Rhodobacter and Vogesella at 10 and 20 d after inoculation,after 10 d of inoculation, the relative abundance of Sphingomonas was greatly higher in treatment B than in treatment A, while the relative abundances of Gp6 and Methylobacillus were significantly decreased in treatment B. 【Conclusion】Ya-1 can colonize in the rhizosphere, root, and leaf of pepper, and can affect the Alpha diversity of pepper rhizosphere bacteria, increase the relative abundance of bacteria with disease resistance,growth promotion and quality improvement functions in the rhizosphere soil of pepper. It is speculated that Bacillus sp. Ya-1 has the potential for further development and appli‐cation.
Key words: Bacillus sp.; rifampicin marker; absolute quantitative PCR; colonization; rhizosphere bacteria diversity
Foundation items: High-level Talent Project of Hainan Natural Science Foundation(324RC537); Hainan Provincial Scientific Research Institute Technology Research and Development Project(FW20230002); Technical System Project of Winter Melon and Vegetable Industry in Hainan(HNARS-05-ZJ04); Innovative Team Project of Hainan Academy of Agricultural Sciences(HAAS2023TDYD12)
0 引言
【研究意义】辣椒是我国产业规模最大的蔬菜作物(邹学校等,2022),也是海南主要的冬种北运蔬菜之一,其种植面积占冬种瓜菜总面积的10%,产量占出岛瓜菜总量的1/3,已成为海南地方经济发展的支柱产业(丁莉和刘海清,2018)。然而,随着种植面积不断扩大,土地复种指数不断提高,连作障碍日趋严重,导致土壤退化、土传病害猖獗,严重影响辣椒产业的健康和可持续发展(王立浩等,2021)。由辣椒尖孢镰刀菌(Fusarium oxysporum f. sp. capsici)侵染引起的枯萎病是辣椒生产上最常见的土传病害之一(El-Abeid et al.,2020)。该病原菌为土壤习居菌,隐蔽性强,化学药剂不能从根本上防治,且对生态环境和人畜健康产生不利影响(Gabrekiristo and Demiyo,2020)。因此,开发生物防治、微生态调控等环境友好型辣椒枯萎病防治技术,通过接种生防菌在根际定殖并调节微生物群落结构,降低病原菌丰度,对微生态调控防治辣椒枯萎病及辣椒的清洁生产具有重要意义。【前人研究进展】芽孢杆菌因其能够防治多种土传病原物而广泛应用于农业生产,定殖能力的检测是判断芽孢杆菌是否具有开发应用潜力的前提。目前检测的主要方法有绿色荧光标记法(冯丹等,2022;祁山颜等,2023)和抗生素标记法(王艺茹等,2024),二者均能对环境样本中的原有菌株和标记的生防芽孢杆菌进行区分。其中,抗生素标记法以操作简单快捷,不改变菌株原有重要特性等优点获得广泛应用。王军强等(2016)采用抗链霉素和利福平双抗标记法,测定海洋多黏类芽孢杆菌L -91在黄瓜根部及幼苗中的定殖情况,结果发现该菌在根表土壤中的定殖量最高,且在黄瓜外根际、根际、根表土壤和黄瓜组织中的定殖动态基本一致。宋露洋等(2024)通过采用抗利福平标记法,发现接种贝莱斯芽孢杆菌ZB36 28 d后能在苦瓜根、茎和叶组织中稳定定殖,并对苦瓜枯萎病具有较好的防治效果。此外,谢强等(2022)、陈梦多等(2023)采用利福平标记法分别研究了巨大芽孢杆菌Bm、多粘类芽孢杆菌HQ1-2在烟草根际、叶面和黄瓜根际的定殖规律。外源生防菌接种后在根际中有效定殖,对根际微生物产生积极影响,是评价该外源生防菌是否具有防治土传病害开发潜力的关键指标。根际微生物被认为植物“第二基因组”,其群落结构与植物生长密切相关(Li et al.,2019)。土传病害暴发是根际微生物群落结构失衡的结果(陈巧环等,2021)。根际微生物群落演替与植物免疫息息相关,也是土壤健康的重要评价指标(Jiang et al.,2022)。相关研究表明,镰刀菌侵染对辣椒根和茎微生物群落的影响大于果实。辣椒发病后,病土中贪噬菌属(Variovorax)、链霉菌属(Streptomyces)、慢生根瘤菌属(Bradyrhizo‐bium)、假单胞菌属(Pseudomonas)和鞘氨醇单胞菌(Sphingomonas)等降解自毒物质的细菌丢失,并招募了Conexibacter、厌氧粘细菌属(Anaeromyxobacter)、蛭弧菌属(Bdellovibrio)、黄杆菌属(Flavobacterium)和芽单胞菌属(Gemmatimonas)等代谢小分子糖和酸的细菌(Wen et al.,2022)。余贤美等(2014)研究发现在枣树根际中定殖枯草芽孢杆菌Bs-15能提高细菌和放线菌的多样性指数和整体活性,说明外源益生菌的施入对提高根际细菌多样性和降低病原物的丰度起至关重要的作用。Zhao等(2018)研究发现向根际中施入含解淀粉芽孢杆菌JDF35的生物有机肥不仅能调节土壤pH,提高有效氮、磷、钾的浓度和土壤酶活性,还能提高根际细菌多样性,降低根际真菌多样性和镰刀菌丰度,从而构建对镰刀菌具有抗病力的土壤生态环境;Luo等(2023)研究发现接种外源益生菌PSB06,能提高根际细菌Alpha多样性,增加Nitrososphaera、单胞菌属(Arenimonas)、藤黄色单胞菌属(Luteimonas)、分枝乳杆菌属(Ramli‐bacter)等物种丰度,降低土传病原物丰度并促进辣椒生长。【本研究切入点】本课题组前期研究表明,芽孢杆菌Ya-1对生姜青枯病菌和辣椒枯萎病菌等均具有较强的抑制效果。在对生姜青枯病菌的室内平板拮抗测试中,接种48 h后,平均抑菌圈直径为23 mm(赵志祥等,2015);在对辣椒枯萎病的盆栽防效评价中,接种芽孢杆菌Ya-1 20 d后,对辣椒枯萎病的防病效果高达77.26%,且根际真菌多样性和枯萎病菌的丰度均发生改变(赵志祥等,2023)。但有关芽孢杆菌Ya-1定殖规律及对根际细菌多样性的具体影响机制尚不清楚,且针对该菌不同时间段的定殖量和引起优势细菌种属的丰度变化尚未见报道。【拟解决的关键问题】以盆栽辣椒为研究对象,采用利福平标记法和绝对定量PCR研究芽孢杆菌Ya-1在辣椒根际、根和叶中的定殖规律,并结合利用高通量测序分析技术研究该菌对辣椒根际细菌多样性的影响,为微生态调控防治辣椒枯萎病及芽孢杆菌的开发利用提供参考依据。
1 材料与方法
1. 1 试验材料
供试芽孢杆菌为Bacillus sp. Ya-1,简称Ya-1,由海南省农业科学院植物保护研究所保存提供。供试辣椒枯萎病菌株为Fusarium oxysporum SMPLJLD-1,简称SMPLJLD-1,由本课题组分离、纯化并保存。供试辣椒品种为乾隆大椒,种子购自海南省农业科学院蔬菜研究所。主要试剂:磁珠法土壤 amp; 粪便基因组DNA抽提试剂盒购自天根生化科技(北京)有限公司;FastDNA® Spin Kit for Soil试剂盒购自美国Mpbio公司。主要仪器设备:Qubit 4.0荧光计购自美国ABI公司。
1. 2 试验方法
辣椒种子经5%次氯酸钠溶液表面消毒10 min后,无菌水冲洗3~4次,置于无菌培养皿中保湿催芽3~5 d,播种于营养钵,栽培基质为土壤和蛭石,二者体积比为8∶2。其中,土壤分为自然土和灭菌土,均采自大田中健康辣椒根际和根围0~25 cm处,采集后过80目筛。每钵播种2颗辣椒种子,待苗长至4叶1心时接种备用。
1. 2. 1 利福平标记 首先将Ya-1在LB固体培养基上划线,31 ℃过夜培养,挑单菌落转入含5 μg/mL利福平的LB液体培养基,31 ℃下200 r/min摇菌培养24 h后,在含利福平5 μg/mL的LB培养基上划线,31 ℃过夜培养,挑单菌落转入含10 μg/mL利福平LB液体培养基,31 ℃、200 r/min培养24 h。重复上述过程直到标记出抗利福平200 μg/mL的突变株,命名Ya-1-200,于4 ℃冰箱中保存备用。
1. 2. 2 Ya-1发酵液及SMPLJLD-1孢子悬浮液制备 将Ya-1-200在含200 μg/mL利福平的LB固体培养基上划线,31 ℃过夜培养。挑单菌落接种于含相应浓度利福平的LB液体培养基中,31 ℃下200 r/min培养48~72 h,用含相应浓度利福平的LB液体培养基调节OD600 nm为0.6~0.8或菌悬体浓度为1×107 CFU/mL,即制得利福平标记的Ya-1-200发酵液,备用。另挑辣椒枯萎病菌SMPLJLD-1菌丝块接种于PDA培养基,28 ℃下倒置培养7~10 d,打菌饼接种于PDA液体培养基,28 ℃下180 r/min振荡培养72 h,镜检,并用无菌PDA液体培养基调整孢子悬浮液浓度为1×107孢子/mL,备用。
1. 2. 3 接种及样品采集 分自然土+蛭石(Ns)和灭菌土+蛭石(Ss)两组盆栽辣椒。每组分别设接种无菌水(A)、接种Ya-1-200发酵液(B)、接种辣椒枯萎病菌SMPLJLD-1孢子悬浮液(C)和接种Ya-1-200发酵液+辣椒枯萎病菌SMPLJLD-1孢子悬浮液(D)共4个处理,每处理3次重复,接种方法参考赵志祥等(2023)的方法。ANs、BNs、CNs、DNs分别代表自然土+蛭石盆栽辣椒下A、B、C、D处理,ASs、BSs、CSs、DSs分别代表灭菌土+蛭石盆栽辣椒下A、B、C、D处理。分别于接种前(0 d)和接种后1、2、3、7、10、20 d采集辣椒根际、根和叶样本,每样本采集1.0 g。另BNs和DNs在上述时间段的土壤样品均重复采集1.0 g,用于基因组DNA提取和绝对定量PCR检测。1. 2. 4 稀释分离法测定Ya-1的定殖情况 将BNs、DNs和BSs、DSs处理的根际、根和叶样品分别加入灭菌研钵中,加入10 mL PBS缓冲液(pH 7.0),研磨3~5 min后,转入250 mL三角瓶中,另取90 mL上述PBS缓冲液,冲洗研钵并转入相对应的三角瓶中,31 ℃下200 r/min振荡培养30 min,取100 μL上述各悬浮液,补足无菌水至1 mL,混匀,得到10-3样本悬浮液。重复上述过程,依次得到10-4、10-5样本悬浮液。取各悬浮液100 μL,均匀涂布于LB固体培养基(含终浓度为200 μg/mL的利福平),31 ℃下培养48 h,各样本和各浓度梯度重复3次,以仅涂布无菌水为对照,观察并记录各培养基菌落数量。
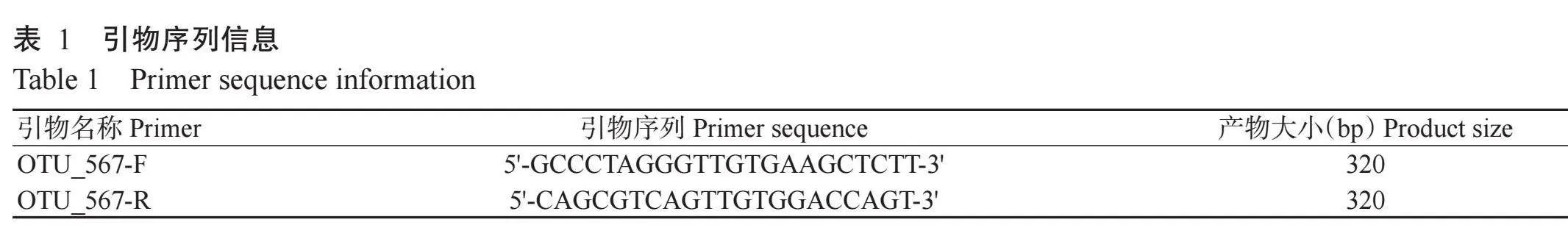
1. 2. 5 绝对定量PCR检测Ya-1的定殖情况 首先,按照磁珠法土壤 amp; 粪便基因组DNA提取试剂盒说明,提取BNs和DNs处理0、1、3、7、10和20 d的根际、根和叶基因组总DNA。取2 μL各DNA样本,经1%琼脂糖凝胶电泳检测,分析条带亮度和杂质污染程度。然后,根据高通量测序结果,Ya-1部分序列为OTU_567,设计引物OTU_567-F和OTU_567-R进行绝对定量PCR并统计单位样本拷贝数,经Ste‐pOne Software和BioRadCFXmanager分析,明确各样本中Ya-1的定殖能力。引物信息见表1。
1. 2. 6 根际基因组DNA提取和高通量测序 收集Ns接种0、10、20 d的根际样本各1.0 g,用FastDNA® Spin Kit for Soil试剂盒提纯根际总DNA,以DNA为模板,采用16S rDNA的V3~V4区为引物进行PCR扩增(Guo et al.,2018)。反应体系50.0 μL:2×Taq Mas‐terMix 25.0 μL,10 μmol/L 上、下游引物各2.0 μL,1.0 μg/μL DNA模板1.0 μL,ddH2O补足至50.0 μL。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,55 ℃ 45 s,72 ℃ 60 s,进行34个循环;72 ℃延伸10 min。12 ℃保存。扩增产物采用Qubit 4.0荧光计定量并完成建库。检测合格的文库送武汉天一辉远生物科技有限公司HiSeq/Miseq平台进行PE250测序。
1. 3 统计分析
测序数据经Tags拼接、Tags过滤和嵌合体去除,最终得到有效序列(Effective tags)后再开展操作分类单元(OTU)聚类等分析(Yan et al.,2013)。采用Uparse算法基于97%相似性将有效序列聚类为OTUs,并计算各样品中每个OTU的绝对丰度和相对信息(Edgar,2013)。在RDP Classifier中,使用Silva嵌合体数据库进行注释,得到OTU代表序列门水平和属水平上的物种分类信息。为方便计算Alpha多样性指数,将各样本OTU丰度抽平到统一值(OTU丰度最低值),并计算门优势种群的相对丰度。将抽平后的OTU计算Alpha多样性指数,包括Chao1指数、ACE指数等。
采用Duncan’s新复极差法进行显著性分析;使用Excel 2007制图。
2 结果与分析
2. 1 稀释分离法检测Ya-1在辣椒根际、根和叶中的定殖量
由图1可知,接种0 d所有处理均未检测出Ya-1,说明基质中本身不含Ya-1。接种1 d时,BNs、DNs、BSs和DSs处理下,根际和根均能检测出Ya-1定殖量,并随着接种时间的延长,定殖量呈逐渐升高后逐渐降低的变化趋势。BSs处理根中Ya-1的定殖量在接种2 d时达到峰值,为6.11×105 CFU/g;BNs、DNs和DSs处理根中Ya-1定殖量均在接种第3 d时达到峰值,分别为4.53×105、4.27×105和5.03×105 CFU/g。BNs、DNs、BSs和DSs处理下根际中Ya-1定殖量在接种第3 d时达到最大值,分别为7.22×105、5.64×105、8.46×105和6.29×105 CFU/g;而叶片中接种第3 d才能检测出Ya-1,且此时该菌定殖量为峰值,分别为3.68×105、3.40×105、4.52×105、4.13×105 CFU/g。3 d后,4个处理下根际和叶中Ya-1的定殖量逐渐下降,20 d后趋于稳定,定殖量均大于1×104 CFU/g。除BSs处理外,同一处理、同一接种时间下Ya-1定殖量排序为根际gt;根gt;叶。
2. 2 绝对定量PCR检测辣椒根际、根和叶中Ya-1单位样本拷贝数
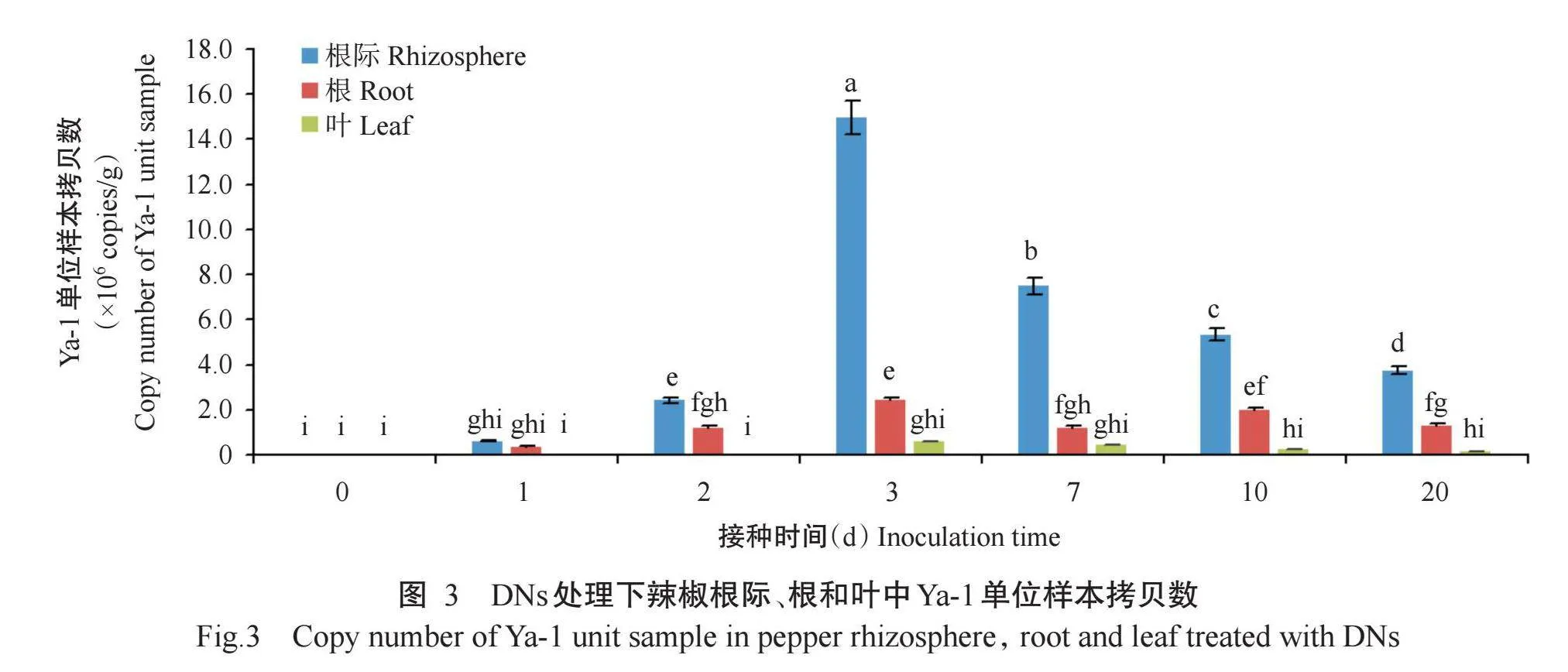
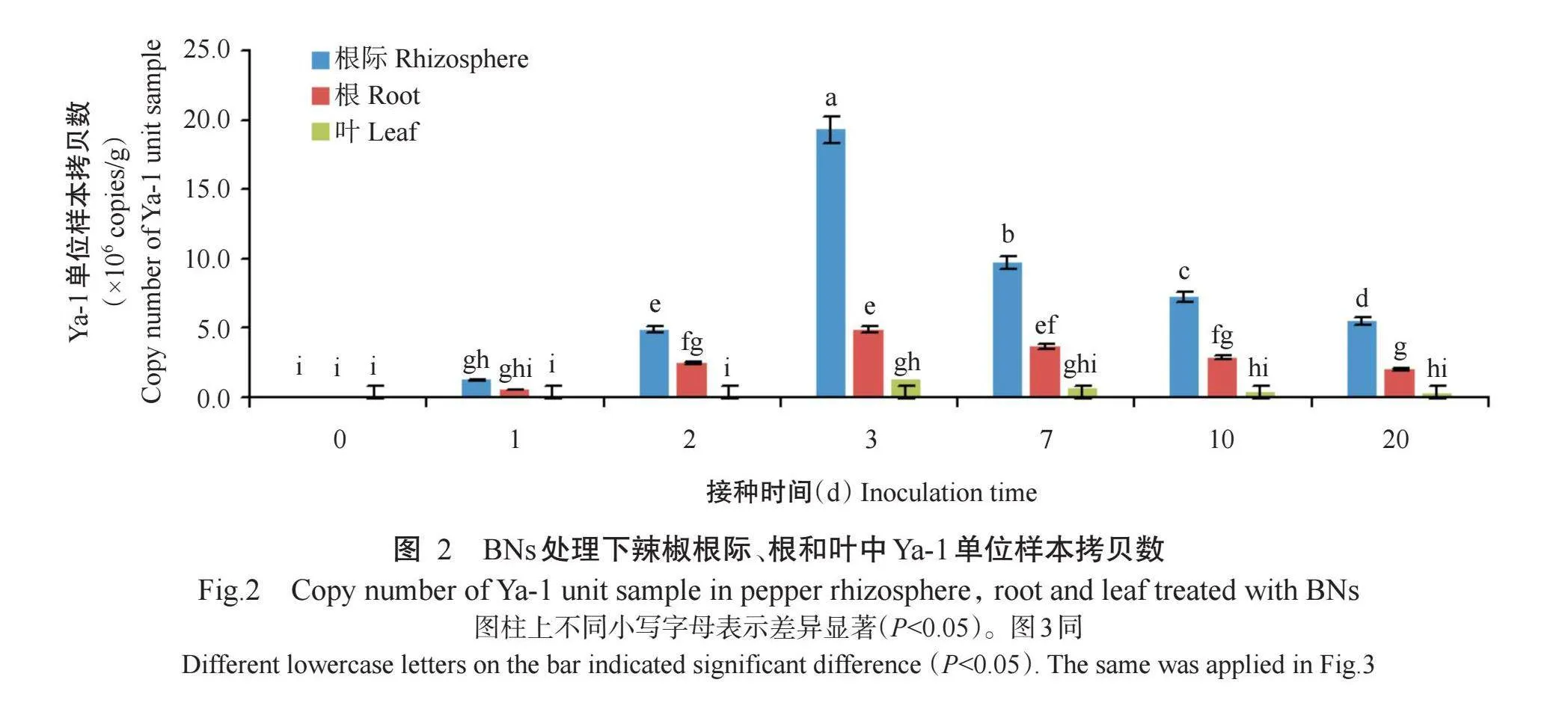
2. 2. 1 BNs处理 如图2所示,辣椒根际、根和叶在BNs处理下,样本中Ya-1单位样本拷贝数随接种时间增加呈先增加后减少的变化趋势,接种3 d后达到峰值,并在接种20 d稳定在1.0×105 copies/g以上。辣椒根际、根和叶中Ya-1单位样本拷贝数在接种3 d后分别为19.0×106、4.8×106和1.2×106 copies/g,接种20 d后降低至5.4×106、2.0×106和0.3×106 copies/g。此外,同一接种时间下Ya-1单位样本拷贝数排序均为根际gt;根gt;叶。说明Ya-1能在辣椒根际、根和叶中有效定殖,且定殖量呈先增加后减少的变化趋势,接种3 d后达到最大值,20 d后趋于稳定。
2. 2. 2 DNs处理 通过绝对定量PCR检测结果(图3)可知,辣椒根际、根和叶经D处理0 d时,单位样本拷贝数为0;辣椒根际和根中Ya-1单位样本拷贝数在接种1 d时开始增加,接种3 d时增加至峰值,分别为15.0×106和2.4×106 copies/g;叶中Ya-1样本拷贝数在接种3 d时才能检测到,且为不同接种天数下叶中Ya-1位样本拷贝数的峰值。辣椒根、叶及根际中Ya-1单位样本拷贝数于接种20 d后趋于稳定,此时根际、根和叶片中Ya-1单位样本拷贝数分别为3.7×106、1.3×106和0.1×106 copies/g。同一接种时间下Ya-1单位样本拷贝数排序均为根际gt;根gt;叶。说明DNs处理下,Ya-1也可在辣椒根际、根部和叶片中有效定殖。2. 3 不同处理对Ns组辣椒根际细菌多样性及其群落结构的影响
2. 3. 1 根际细菌测序结果 由图4可知,Ns组接种前共得到714214条原始序列,A、B、C、D处理10 d的辣椒根际样本中共获得563853~718414条原始序列,处理20 d的辣椒根际样本中共获得555290~709216条原始序列。去除没有重叠(Overlap)的读长(Reads)和未通过Tag过滤的Tags以及嵌合体序列,最终获得502029~671963条有效序列,序列长度为251~491 bp,平均序列长458.12 bp,各样本覆盖率均大于99%,表明样本中细菌16S rDNA序列检出概率高,该高通量测序能真实反映细菌群落多样性。根据97%序列相似性分类水平,对有效序列进行分类,共得到91883个细菌OTUs,归类到57门128纲206目403科880属1670种。
2. 3. 2 不同处理下辣椒根际细菌Alpha多样性指数
由图5可知,A、B、C、D处理下根际细菌群落的ACE指数和Chao1指数在接种0~20 d的变化趋势不同。接种0~20 d时,A处理下ACE指数和Chao1指数逐渐下降,B处理下2个指数均呈先升高后降低的变化趋势,C和D处理下2个指数均呈先降低后升高的变化趋势。与接种10 d相比,接种20 d B处理下ACE指数和Chao1指数显著降低(Plt;0.05,下同),而C和
D处理下2个指数均显著升高。
与A处理相比,B处理10 d时辣椒根际细菌的ACE指数和Chao1指数显著增加;B处理20 d时根际细菌ACE指数和Chao1指数无显著变化(Pgt;0.05,下同);C和D处理10 d时辣椒根际细菌的ACE指数和Chao1指数显著降低,20 d时,C和D处理下的2个指数显著增加。处理10和20 d D处理下ACE指数和Chao1指数虽较C处理有所提高,但未达到显著水平。2. 3. 3 门分类水平上不同处理对辣椒根际细菌群落组成的影响 由图6可知,辣椒根际细菌群落中相对丰度大于4%的优势菌门包括放线菌门(Acti‐nobacterioa)、酸杆菌门(Acidobacterioa)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)和变形菌门(Proteobacteria)。变形菌门、酸杆菌门和芽单胞菌门在所有处理中均属于优势菌群。接种10和20 d时,A处理下变形菌门的相对丰度为4个处理中最低,其中接种10 d时该菌的相对丰度为 41.97%,接种20 d时为47.95%,D处理下变形菌门的相对丰度最高,接种10 d该菌门的相对丰度为54.08%,接种20 d为53.05%。A处理下辣椒根际细菌群落中酸杆菌门的相对丰度最高,其中接种10 d该菌门的相对丰度为18.04%,接种20 d为16.15%。D处理下酸杆菌门的相对丰度最低,接种10 d时该菌门的相对丰度为12.08%,接种20 d为10.98%。C处理10 d时辣椒根际细菌群落中芽单胞菌门相对丰度最低(4.07%),B处理该菌门的相对丰度最高(6.77%);接种20 d时,B处理芽单胞菌门的相对丰度最低(5.38%),A处理该菌门的相对丰度最高(5.73%)。与C处理相比,D处理10 d时明显提高了变形菌门、放线菌门和芽单胞菌门的相对丰度,降低了酸杆菌门和绿弯菌门的相对丰度;D处理20 d时明显提高了变形菌门、拟杆菌门和放线菌门的相对丰度,降低了酸杆菌门、绿弯菌门和芽
单胞菌门的相对丰度。
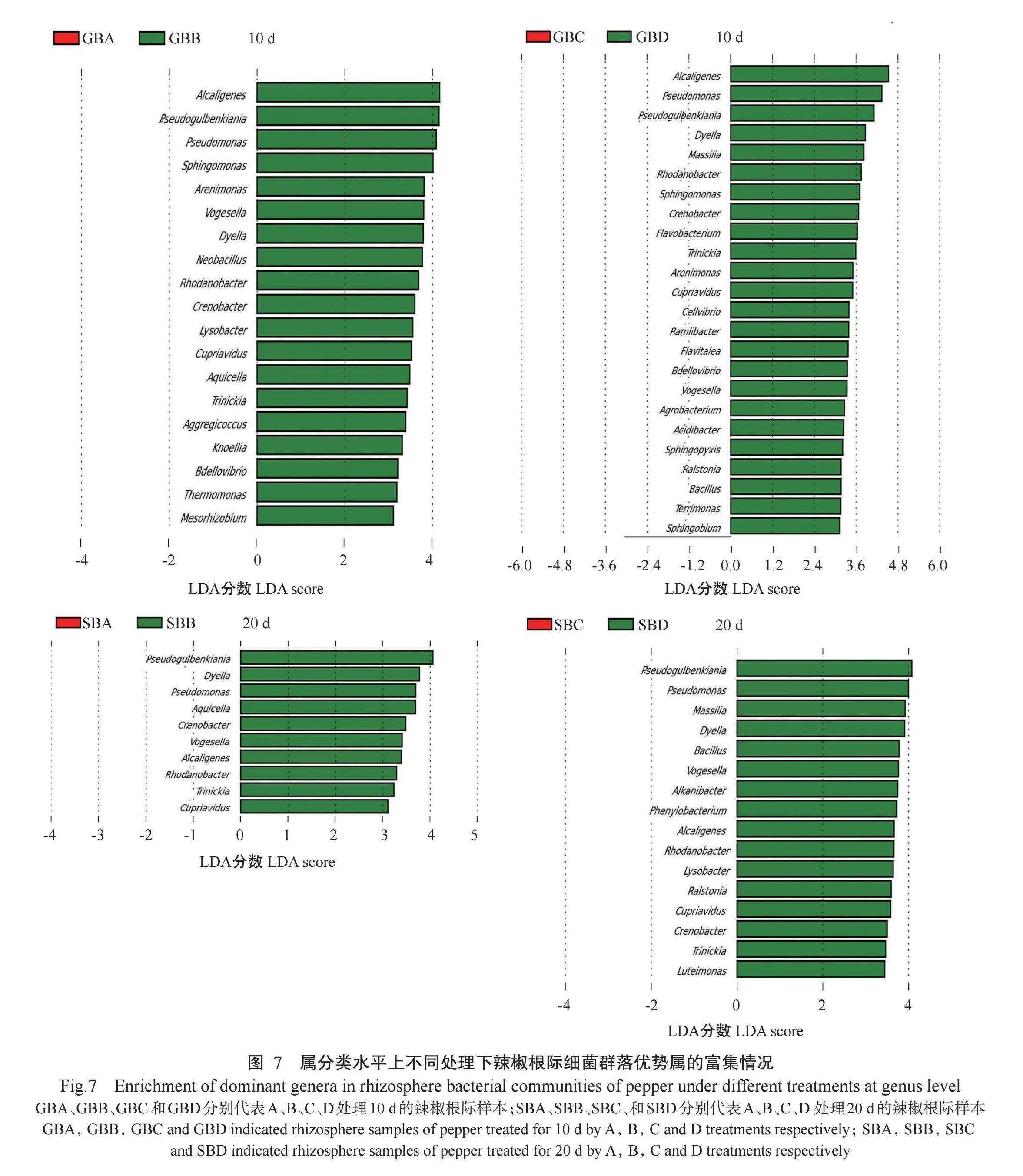
在属分类水平上,利用Lefse对属分类水平上不同处理下辣椒根际细菌群落优势属富集情况进行分析,由图7可知,与A处理相比,B处理10和20 d时贪铜菌属(Cupriavidus)、Aquicella、Trinickia、Creno‐bacter、产碱杆菌属(Alcaligenes)、戴氏菌属(Dyella)、假单胞菌属、Pseudogulbenkiania、芽孢杆菌属、罗河杆菌属(Rhodanobacter)和Vogesella均明显富集;与C处理相比,D处理10和20 d 时Trinickia、Creno‐bacter、产碱杆菌属、戴氏菌属、假单胞菌属、Pseu‐dogulbenkiania、罗尔斯通菌属(Ralstonia)、芽孢杆菌属和Vogesella均明显富集。
对不同处理下辣椒根际细菌群落10个优势细菌属的相对丰度进行分析,结果(图8)表明,不同处理间优势菌属群落发生明显差异。接种10 d时,与A处理相比,B处理鞘氨醇单胞菌属(Sphingomonas)的相对丰度明显升高,Gp6、假甲基杆菌属(Pseudo‐methylobacillus)的相对丰度显著降低;C处理Sac‐charibacteria genera incertae sedis的相对丰度显著升高,Gp1、Gp3、Gp6的相对丰度显著降低。接种10 d后,与C处理相比,D处理下假甲基杆菌属的相对丰度显著降低。接种20 d时,与A处理相比,B处理下10个优势菌属无显著差异;C处理假甲基杆菌属的相对丰度显著升高。与C处理相比,D处理假甲基杆菌属的相对丰度显著降低。
3 讨论
细菌定殖对建立植物—细菌相互作用至关重要,而此相互作用是决定植物健康及其生产力的关键因素(Knights et al.,2021)。对生防细菌而言,其定殖能力的强弱与抵御病原菌侵染和促进植物健康生长呈正相关(Zou et al.,2023)。定殖不仅发生在植物根际,也可定殖在植物的根、茎、叶和果实等组织中。余贤美等(2014)研究发现接种枯草芽孢杆菌Bs-15 28 d后,在枣树根际中的定殖量达104 CFU/g以上;李健等(2021)研究发现枯草芽孢杆菌L1-21可在柑橘叶片和果实中定殖,且对果实绿霉病有较好的防治效果。本研究通过利福平标记法和绝对定量PCR验证了Ya-1的定殖能力。结果发现Ya-1能在辣椒根际、根和叶中有效定殖,且在自然土和灭菌土条件下,定殖趋势均呈先增加后减少的变化规律,Ya-1数量整体上在3 d 时达到峰值,20 d 后趋于平稳,并维持在1×104 CFU/g水平。绝对定量PCR法检测辣椒植株及根际中Ya-1定殖规律与利福平标记法一致。3 d 后单位样本拷贝数增加到峰值,20 d后趋于稳定,并维持在1.0×105 copies/g水平。2种方法均证实Ya-1能够定殖在辣椒根际、根和叶中,且定殖量能维持在较高水平,具有开发利用的潜力。然而,单位样本拷贝数因操作误差,统计误差导致结果与菌落数并不相等,此外,样本DNA浓度,标准品制作,定量PCR反应体系和反应条件的差异,也会导致单位样本拷贝数和菌落数不一致。
细菌—细菌相互作用普遍存在于根际,通过代谢交换、分泌抗菌化合物等影响细菌的持久性和根际定殖,并形成特定的根际微生物群(Knights et al.,2021)。根际微生物群通过各种机制对植物健康和生产力产生积极影响,包括增强养分获取、启动植物防御和控制植物病原体(Trivedi et al.,2020)。近年,宏基因组研究表明大量微生物栖息于不同根生态位,且细菌是根际微生物群中最普遍的存在(Uroz et al.,2010)。
本研究自然土+蛭石组中,接种Ya-1-200发酵液在前10 d时辣椒根际细菌的ACE指数和Chao1指数较接种无菌水显著增加,接种20 d也有所增加,但未达到显著水平;接种辣椒枯萎病菌SMPLJLD-1孢子悬浮液和Ya-1-200发酵液+辣椒枯萎病菌SMPLJLD-1孢子悬浮液处理在接种10 d辣椒根际细菌的ACE指数和Chao1指数显著降低,接种20 d时,2个处理下根际细菌ACE指数和Chao1指数显著增加。说明随着接种天数增加,接种Ya-1-200发酵液和Ya-1-200发酵液+辣椒枯萎病菌SMPLJLD-1孢子悬浮液根际细菌多样性增加;接种辣椒枯萎病菌SMPLJLD-1孢子悬浮液则显著降低了根际细菌Alpha多样性。
尽管土壤中细菌种类繁多,但放线菌门、拟杆菌门、厚壁菌门和变形菌门细菌是根际微生物主要组成(Uroz et al.,2010)。然而,植物由于受多种生物和非生物胁迫,导致根际微生物在属分类和种分类水平上的分类组成差异很大(Tkacz et al.,2020)。本研究中,各处理辣椒根际优势细菌为酸杆菌门、放线菌门、拟杆菌门、绿弯菌门、芽单胞菌门和变形菌门。接种后10和20 d时,与接种无菌水相比,接种Ya-1-200发酵液+辣椒枯萎病菌SMPLJLD-1孢子悬浮液处理变形菌门的相对丰度明显提高,而酸杆菌门相对丰度明显降低。在接种后10 d时,与接种辣椒枯萎病菌SMPLJLD-1孢子悬浮液相比,接种Ya-1-200发酵液处理下芽单胞菌门相对丰度明显增加;20 d时,接种Ya-1(B)组芽单胞菌门的相对丰度最低。与接种辣椒枯萎病菌SMPLJLD-1孢子悬浮液相比,接种Ya-1-200发酵液+辣椒枯萎病菌SMPLJLD-1孢子悬浮液在10 d时变形菌门、拟杆菌门、放线菌门和芽单胞菌门的相对丰度均明显提高,酸杆菌门和绿弯菌门的相对丰度则降低;20 d时变形菌门、拟杆菌门和放线菌门相对丰度均明显提高,酸杆菌门、绿弯菌门和芽单胞菌门的相对丰度则降低,与张慧等(2021)用草假单胞菌HT1处理蚕豆根部,结果发现厚壁菌门、放线菌门、拟杆菌门和变形菌门的相对丰度显著提高的研究结果基本一致。Lee等(2021)研究发现放线菌门、厚壁菌门、拟杆菌门和变形菌门与植物土传病害生物防治相关。本研究接种Ya-1改变了根际细菌群落结构,推测接种该菌能提高抗辣椒枯萎病的能力。
本研究中与接种无菌水相比,接种Ya-1-200发酵液在接种10和20 d时贪铜菌属、Aquicella、Trinickia、Crenobacter、产碱杆菌属、戴氏菌属、假单胞菌属、Pseudogulbenkiania、芽孢杆菌属、罗河杆菌属和Vogesella均明显富集;研究表明,芽孢杆菌属(李健等,2021)、假单胞菌属(张慧等,2021)、产碱杆菌属(麦靖雯等,2018)和鞘氨醇单胞菌属(Matsumoto et al.,2021)等均与植物抗病促生相关,是组成植物根围促生细菌的主要类群。Vogesella是水稻土中的主要菌群,可以降解苯、甲苯、五氯酚、DDT等多种有机污染物,减少有机污染物被植物吸收,提高农产品质量安全(牟山,2017)。本研究中,接种Ya-1-200发酵液Vogesella相对丰度较高,推测与海南稻—菜轮作耕作模式有关。盆栽试验土样采自于田间种植过水稻的土壤,其中Vogesella得到富集,而接种Ya-1-200发酵液后,Vogesella进一步在根际发挥益生菌的作用。
4 结论
Ya-1能在辣椒根际、根和叶中有效定殖,接种该菌后能改变辣椒根际细菌Alpha多样性指数,提高辣椒根际中具有抗病促生和改善辣椒品质等相关功能细菌的相对丰度。推测Ya-1具有开发应用的潜力。
参考文献((References)):
陈梦多,胡春艳,马肖静,何梦菡,沈虎生,王艺茹,朴凤植,申顺善. 2023. 植物根际细菌HQ1-2的根际定殖与土壤微生态调节及枯萎病防治[J]. 中国生物防治学报,39(4):924-932.[ Chen M D,Hu C Y,Ma X J,He M H,Shen H S,Wang Y R,Piao F Z,Shen S S. 2023. Rhizosphere colo‐nization of plant growth promoting rhizobacteria HQ1-2 and regulation effects of soil microecology and control effects on the fusarium wil[t J]. Chinese Journal of Biologi‐cal Control,39(4):924-932.] doi:10.16409/j.cnki.2095-
039x.2023.02.034.
陈巧环,苗玉焕,王铁霖,郭兰萍,刘大会. 2021. 枯萎病对菊花根际土壤微生物群落结构的影响[J]. 中国实验方剂学杂志,27(11):180-186.[ Chen Q H,Miao Y H,Wang T L,Guo L P,Liu D H. 2021. Fusarium wilt changes micro‐bial community structure in rhizosphere soil of Chrysan‐themum morifolium[J]. Chinese Journal of Experimental Traditional Medical Formulae,27(11):180-186.] doi:10. 13422/j.cnki.syfjx.20210713.
丁莉,刘海清. 2018. 海南省辣椒产业SWOT分析及展望[J]. 农业展望,14(2):65-68.[ Ding L,Liu H Q. 2018. SWOT analysis and prospect of chili industry in Hainan Province[J]. Agricultural Outlook,14(2):65-68.] doi:10.3969/j.issn.1673-3908.2018.02.012.
冯丹,曹永清,刘艳,任嘉红. 2022. 南方红豆杉根际促生细菌蜡状芽孢杆菌CLY07的接种效应[J]. 西南林业大学学报(自然科学),42(1):30-36.[ Feng D,Cao Y Q,Liu Y,Ren J H. 2022. Inoculation effect of growth-promoting rhi‐zobacteria Bacillus cereus CLY07 of Taxus chinensis var. maire[iJ]. Journal of Southwest Forestry University(Natu‐ral Science),42(1):30-36.] doi:10.11929/j.swfu.2020 09028.
李健,何鹏飞,李咏梅,吴毅歆,何鹏搏,孔宝华,李兴玉,Munir Shahzad,何月秋. 2021. 枯草芽孢杆菌L1-21在柑橘上的定殖能力及其防治绿霉病效果[J]. 华中农业大学学报,40(5):31-36.[ Li J,He P F,Li Y M,Wu Y X,He P B,Kong B H,Li X Y,Munir S,He Y Q. 2021. Coloniza‐tion ability of Bacillus subtilis L1-21 in Citrus and its con‐trol effect on green mold[J]. Journal of Huazhong Agricul‐tural University,40(5):31-36.] doi:10.13300/j.cnki.hnlkxb. 2021.05.005.
麦靖雯,黎瑞君,张巨明. 2018. 植物根际促生菌研究综述[J]. 现代农业科技,12:179-180.[ Mai J W,Li R J,Zhang J M. 2018. Research summary on plant growth promoting rhizobacteria[J]. Modern Agricultural Science and Tech‐nology,12:179-180.] doi:10.3969/j.issn.1007-5739.2018. 12.115.
牟山. 2017. 水稻土中性微氧型亚铁氧化机制研究[D]. 成都:电子科技大学.[ Mou S. 2017. The study on mecha‐nism of neutral microaerophilic Fe(Ⅱ) oxidation inpaddy soil[D]. Chengdu:University of Electronic Science and Technology of China.]
祁山颜,朱峰,王继春,田成丽,王东元,欧玉苹,刘晓梅,李莉,姜兆远. 2023. 枯草芽胞杆菌GB519在水稻植株中的定殖及对稻瘟病田间防效[J]. 植物保护,49(2):48-56. [Qi S Y,Zhu F,Wang J C,Tian C L,Wang D Y,Ou Y P,Liu X M,Li L,Jiang Z Y. 2023. Colonization dunamics of Bacillus subtilis GB519 in rice plants and its biocontrol efficacy against rice blast in the field[J]. Plant Protection,49(2):48-56.] doi:10.16688/j.zwbh.2021719.
宋露洋,高沛,张涵,王留超,赵莹,文才艺. 2024. 苦瓜枯萎病生防细菌ZB36的分离鉴定及其定殖特性研究[J]. 河南农业大学学报,58(2):228-238.[ Song L Y,Gao P,Zhang H,Wang L C,Zhao Y,Wen C Y. 2024. Isolation,identifica‐tion and colonization of biocontrol bacteria ZB36 against bitter gourd Fusarium wilt[J]. Journal of Henan Agricul‐tural University,58(2):228-238.] doi:10.16445/j. cnki. 1000-2340.20231025.001.
王军强,汪晶晶,王琦,马桂珍,暴增海,王淑芳,周向红. 2016. 海洋细菌L1-9双抗菌株的定殖能力及其对黄瓜枯萎病的防治作用[J]. 生物技术通报,32(6):193-198. [Wang J Q,Wang J J,Wang Q,Ma G Z,Bao Z H,Wang S F,Zhou X H. 2016. Colonization of double-resistance strain of marine bacterium L1-9 and its biocontrol effect on fusarium wilt of cucumber[J]. Biotechnology Bulletin,32(6):193-198.] doi:10.13560/j.cnki.biotech.bull.1985.2016.06.028.
王立浩,张宝玺,张正海,曹亚从,于海龙,冯锡刚. 2021.“ 十三五”我国辣椒育种研究进展、产业现状及展望[J]. 中国蔬菜,(2):21-29. [Wang L H,Zhang B X,Zhang Z H,Cao Y C,Yu H L,Feng X G. 2021. Status in breeding and production of Capsicum spp. in China during‘ The Thir‐teenth Five-year Plan’ period and future prospec[t J]. China Vegetables,(2):21-29.] doi:10.19928/j.cnki.1000-6346. 2021.0004.
王艺茹,潘培培,沈虎生,张林林,王润东,何梦菡,申顺善. 2024. 番茄疫霉根腐病菌拮抗细菌HP8-1的鉴定及生物防治潜力[J]. 河南农业大学学报,58(1):78-86.[ Wang Y R,Pan P P,Shen H S,Zhang L L,Wang R D,He M H,Shen S S. 2024. Identification and biocontrol potential of antagonist bacteria HP8-1 against Phytophthora root rot of tomato[J]. Journal of Henan Agricultural University,58(1):78-86.] doi:10.16445/j.cnki.1000-2340.20231019.003.
谢强,夏建华,徐传涛,王飞,李慧,于卫松,孙惠青. 2022. 巨大芽胞杆菌(Bacillus megaterium,Bm)的抑菌活性及定殖规律分析[J]. 烟草科技,55(10):19-25.[ Xie Q,Xia J H,Xu C T,Wang F,Li H,Yu W S,Sun H Q. 2022. Anti‐bacterial activity of Bacillus megaterium strain Bm and its colonization laws[J]. Tobacco Scienceamp;Technology,55(10):19-25.] doi:10.16135/j.issn1002-0861.2022.0257.
余贤美,侯长明,王海荣,安淼,张琼,王中堂,周广芳. 2014. 枯草芽孢杆菌Bs-15在枣树体内和土壤中的定殖及其对土壤微生物多样性的影响[J]. 中国生物防治学报,30(4):497-502. [Yu X M,Hou C M,Wang H R,An M,Zhang Q,Wang Z T,Zhou G F. 2014. Colonization of Bacillus subtilis Bs-15 in jujube plant and soil and its influence on the microbial diversity in the soi[l J]. Chinese Journal of Biological Control,30(4):497-502.] doi:10. 16409/j.cnki.2095-039x.2014.04.002.
张慧,马连杰,卢文才,余端,杭晓宁,廖敦秀. 2021. 草假单胞菌HT1在蚕豆根和茎的定殖特性及对内生细菌多样性的影响[J]. 微生物学通报,48(12):4677-4687.[ Zhang H,Ma L J,Lu W C,Yu D,Hang X N,Liao D X. 2021. Colo‐nization characteristics of Pseudomonas poae HT1 in roots and stems of faba bean and its effect on endophytic bacterial diversity[J]. Microbiology China,48(12):4677-4687.] doi:10.13344/j.microbiol.china.210298.
赵志祥,王殿东,周亚林,王培,严婉荣,严蓓,罗路云,张卓. 2023. 枯草芽孢杆菌Ya-1对辣椒枯萎病的防治及其对根际真菌群落的影响[J]. 生物技术通报,39(9):213-224. [Zhao Z X,Wang D D,Zhou Y L,Wang P,Yan W R,Yan B,Luo L Y,Zhang Z. 2023. Control of pepper fusarium filt by Bacillus subtilis Ya-1 and its effect on rhizosphere fungal microbial community[J]. Biotechnology Bulletin,39(9):213-224.] doi:10.13560/j.cnki.biotech.bull.1985. 2022-1457.
赵志祥,严婉荣,陈圆,肖彤斌,肖敏. 2015. 一株生姜青枯病拮抗菌的筛选、鉴定及发酵条件优化[J]. 南方农业学报,46(3):421-427.[ Zhao Z X,Yan W R,Chen Y,Xiao T B,Xiao M. 2015. Isolation,identification and fermentation optimization of biocontrol bacteria YA-1 against ginger bacterial wil[t J]. Journal of Southern Agriculture,46(3):421-427.] doi:10.3969/j:issn.2095-1191.2015.3.421.
邹学校,胡博文,熊程,戴雄泽,刘峰,欧立军,杨博智,刘周斌,索欢,徐昊,朱凡,远方. 2022. 中国辣椒育种60年回顾与展望[J]. 园艺学报,49(10):2099-2118.[ Zou X X,Hu B W,Xiong C,Dai X Z,Liu F,Ou L J,Yang B Z,Liu Z B,Suo H,Xu H,Zhu F,Yuan F. 2022. Review and pros‐pects of pepper breeding for the past 60 years in China[J]. Acta Horticulturae Sinica,49(10):2099-2118.] doi:10. 16420/j.issn.0513-353x.2022-0677.
Edgar R C. 2013. UPARSE:Highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods,10:996-998. doi:10.1038/nmeth.2604.
El-Abeid S E,Ahmed Y,Daròs J A,Mohamed M A. 2020. Reduced graphene oxide nanosheetdecorated copper oxide nanoparticles:A potent antifungal nanocomposite against fusarium root rot and wilt diseases of tomato and pepper plants[J]. Nanomaterials,10(5):1001. doi:10.3390/nano
10051001.
Gabrekiristo E,Demiyo T. 2020. Hot pepper fusarium wilt (Fusarium oxysporum f. sp. capsici):Epidemics,charac‐teristic features and management options[J]. Journal of Agricultural Science,12(10):347-360. doi:10.5539/jas.v12n10p347.
Guo H H,Xue S H,Nasir M,Lȕ J L,Gu J. 2018. Role of ben‐tonite on the mobility of antibiotic resistance genes,and microbial community in oxytetracycline and cadmium con‐taminated soi[l J]. Frontiers in Microbiology,9:2722. doi:10.3389/fmicb.2018.02722.
Jiang G F,Zhang Y L,Gan G Y,Li W L,Wan W,Jiang Y Q,Yang T J,Zhang Y,Xu Y C,Wang Y K,Shen Q R,Wei Z,Dini-Andreote F. 2022. Exploring rhizo-microbiome trans‐plants as a tool for protective plant-microbiome manipula‐tion[J]. ISME Communications,2(1):10. doi:10.1038/s43705-022-00094-8.
Knights H E,Jorrin B,Haskett T L,Poole P S. 2021. Deciphe-ring bacterial mechanisms of root colonization[J]. Environ‐mental Microbiology Reports,13(4):428-444. doi:10.1111/ 1758-2229.12934.
Lee S M,Kong H G,Song G C,Ryu C M. 2021. Disruption of Firmicutes and Actinobacteria abundance in tomato rhizo‐sphere causes the incidence of bacterial wilt disease[J].The ISME Journal,15(1):330-347. doi:10.1038/s41396-020-00785-x.
Li X G,Jousset A,de Boer W,Carrión V J,Zhang T L,Wang X X,Kuramae E E. 2019. Legacy of land use history deter‐mines reprogramming of plant physiology by soil micro-biome[J]. The ISME Journal,13(3):738-751. doi:10. 1038/s41396-018-0300-0.
Luo L Y,Wang P,Wang D D,Shi X B,Zhang J W,Zhao Z X,Zeng J,Liao J Q,Zhang Z,Liu Y. 2023. Rhodopseudomo‐nas palustris PSB06 agent enhance pepper yield and regu‐lating the rhizosphere microecological environment[J]. Frontiers in Sustainable Food Systems,7:56. doi:10.3389/fsufs.2023.1125538.
Matsumoto H,Fan X Y,Wang Y,Kusstatscher P,Duan J,Wu S L,Chen S L,Qiao K,Wang Y L,Ma B,Zhu G N,Hashi‐doko Y,Berg G,Cernava T,Wang M C. 2021. Bacterial seed endophyte shapes disease resistance in rice[J]. Na-ture Plants,7(1):60-72. doi:10.1038/s41477-020-00826-5.
Tkacz A,Bestion E,Bo Z Y,Hortala M,Poole P S. 2020. Influence of plant fraction,soil,and plant species on micro‐biota:A multikingdom comparison[J]. mBio,11:e02785-19. doi:10.1128/mBio.02785-19.
Trivedi P,Leach J E,Tringe S G,Sa T,Singh B K. 2020. Plant-microbiome interactions:from community assembly to plant health[J]. Nature Reviews Microbiology,18:607-621. doi:10.1038/s41579-020-0412-1.
Uroz S,Buée M,Murat C,Frey-Klett P,Martin F. 2010. Pyrosequencing reveals a contrasted bacterial diversity between oak rhizosphere and surrounding soi[l J]. Environ Microbiology Reports,2:281-288. doi:10.1111/j.1758- 2229.2009.00117.x.
Wen T,Xie P H,Penton C R,Hale L,Thomashow L S,Yang S D,Ding Z X,Su Y Q,Yuan J,Shen Q R. 2022. Specific metabolites drive the deterministic assembly of diseased rhizosphere microbiome through weakening microbial deg‐radation of autotoxin[J]. Microbiome,10(1):177. doi:10.1186/s40168-022-01375-z.
Yan L,Yang M,Guo H,Yang L,Wu J,Li R,Liu P,Lian Y,Zheng X,Yan J,Huang J. 2013. Single-cell RNA-Seq pro‐filing of human preimplantation embryos and embryonic stem cells[J]. Nature Structural amp; Molecular Biology,20(9):1131-1139. doi:10.1038/nsmb.2660.
Zhao J,Wang Y G,Liang H,Huang J,Chen Z,Nie Y J. 2018. The rhizosphere microbial community response to a bio-organic fertilizer:Finding the mechanisms behind the sup‐pression of atermelon fusarium wilt disease[J]. Acta Phy-siologiae Plantarum,40:17. doi:10.1007/s11738-017-
2581-8.
Zou L,Wang Q,Wu R X,Zhang Y P,Wu Q S,Xiong W,Ye K H,Dai W,Huang J. 2023. Root endophytic bacterial com‐munity composition of Aconitum carmichaelii debx. from three main producing areas in China[J]. Journal of Basic Microbiology,63(3-4):454-468. doi:10.1002/jobm.2022 00282.
(责任编辑 李洪艳)
