马铃薯块茎蛾幼虫粪便可培养细菌群落结构及多样性分析
2024-02-09张凌英苏造堂郑亚强徐天梅王文倩肖关丽陈斌








摘要:【目的】揭示马铃薯块茎蛾幼虫粪便中可培养细菌群落结构及多样性,为系统研究该虫肠道菌群多样性及相关细菌功能提供理论依据。【方法】以马铃薯块茎蛾幼虫新鲜粪便和干粪便为研究对象,采用培养分析法将幼虫粪便菌悬液于LB培养基上进行细菌分离培养和纯化,根据16S rDNA双向测序结果,结合细菌菌株的培养特性和形态特征进行分类鉴定;利用Contigexpress对测序结果进行序列拼接和校对,并将结果提交至NCBI(GenBank)数据库比对;通过MEGA 7.0构建系统发育进化树;通过Margalef丰富度指数、Simpson优势度指数、Shannon-Wiener多样性指数和Pielou均匀度指数等综合评估新鲜粪便和干粪便中可培养细菌群落的多样性。【结果】马铃薯块茎蛾新鲜粪便中可培养细菌有3门9科9属14种,其中蒙氏肠球菌(Enterococcus mundtii)为优势种,相对丰度达71.25%。干粪便中可培养细菌有3门6科7属11种,其中琥珀葡萄球菌(Staphylococcus succinus)和腐生葡萄球菌(Staphylococcus saprophyticus)为优势种,相对丰度分别为29.45%和18.70%。新鲜和干粪便中细菌群落物种多样性指数分别为1.23和2.02、均匀度指数分别为0.47和0.84,表明干粪便可培养细菌多样性高于新鲜粪便,且细菌群落种类组成更为均匀,而新鲜粪便可培养细菌种类组成相对集中。【结论】马铃薯块茎蛾幼虫粪便中的细菌种类丰富,且新鲜粪便与干粪便在可培养细菌的种类组成、优势种、丰富度和均匀度上均存在明显差异,新鲜粪便中可培养细菌种类组成相对集中且群落表现出较高的物种丰富度,干粪便则展现出更均匀的细菌群落种类组成。
关键词:马铃薯块茎蛾;干粪便;新鲜粪便;细菌群落结构;多样性
中图分类号:S433.4 文献标志码:A 文章编号:2095-1191(2024)11-3298-13
Community structure and diversity of culturable bacteria in the feces of potato tuber moth( Phthorimaea operculella Zeller) larvae
ZHANG Ling-ying1,2,3, SU Zao-tang1,2,3, ZHENG Ya-qiang3, XU Tian-mei3,4 WANG Wen-qian3, XIAO Guan-li1*, CHEN Bin3*
(1College of Agronomy and Biotechnology, Yunnan Agricultural University, Kunming, Yunnan 650201, China;College of Agronomy and Life Sciences, Zhaotong University, Zhaotong, Yunnan 657000, China; 3College of Plant Protection, Yunnan Agricultural University/State Key Laboratory for Conservation and Utilization of Bio-resources in Yunnan, Kunming, Yunnan 650201, China; 4Mouding Branch, Chuxiong company, Yunnan Tobacco Company, Chuxiong, Yunnan 675500, China)
Abstract:【Objective】To reveal the community structure and diversity of culturable bacteria in the feces of potato tu‐ber moth( Phthorimaea operculella Zeller) larvae, which provide scientific basis for a deeper understanding of the diver‐sity and function of its gut microbiota.【 Method】Fresh and dry feces of potato tuber moth larvae were used as research ob‐jects. The bacterial suspension of potato tuber moth larvae feces was isolated, cultured, and purified on LB medium using culture analysis method. Various species were classified and identified based on the results of 16S rDNA bidirectional se‐quencing, combined with the culture characteristics and morphological features of the strain. Contigexpress software was used for sequence assembly and proofreading of the sequencing results, and the results were submitted to the NCBI( Gen‐Bank) database for alignment. A phylogenetic tree was constructed using MEGA7.0 software. The diversity of the cultura-ble bacterial community in fresh and dry feces was comprehensively assessed using Margalef richness index, Simpson dominance index, Shannon Wiener diversity index, and Pielou evenness index.【 Result】There were 3 phyla, 9 families, 9 genera and 14 species of culturable bacteria in the fresh feces of potato tuber moth, with Enterococcus mundtii being the dominant species, with 71.25% relative abundance. In the dry feces, there were 3 phyla, 6 families, 7 genera, and 11 species of culturable bacteria, with Staphylococcus succinus and Staphylococcus saprophyticus being the dominant species, relative abundances were 29.45% and 18.70% respectively. The bacterial community species diversity indexes in fresh and dry feces were 1.23 and 2.02 respectively, and the evenness indexes were 0.47 and 0.84 respectively. The results indicated that the diversity of culturable bacteria in dry feces was higher than that in fresh feces, and the bacterial community had a more even species composition, while the culturable bacterial community in fresh feces was rela‐tively concentrated in species composition. 【Conclusion】The bacterial species in potato tuber moth feces are abundant, and there are obvious differences in the composition of culturable bacteria, dominant species, richness, and evenness between fresh and dry feces, especially the culturable bacterial community in fresh feces is concentrated and show higher species richness, while the dry feces show a more even bacterial community composition.
Key words: potato tuber moth; dry feces; fresh feces; bacterial community structure; diversity
Foundation items: National Natural Science Foundation of China(32360711,31760519)
0 引言
【研究意义】马铃薯块茎蛾(Phthorimaea opercu‐lella Zeller)又名马铃薯麦蛾,隶属于鳞翅目(Lepi‐doptera)麦蛾科(Gelechiidae)(闫俊杰等,2019)。作为一种分布广泛的害虫,马铃薯块茎蛾已遍布全球除南极洲外的六大洲,尤其在气候温暖、干燥、风力较小的马铃薯种植区域常见,对马铃薯生产构成严重威胁(Rondon and Xue,2010;Gao,2018)。马铃薯块茎蛾的繁殖速度快,对温度的耐受性高,对农药具有较强的抗性,防治极为困难(Doğramaci and Tingey,2010;马艳粉等,2012;Andreadis et al.,2016)。昆虫肠道微生物群对其消化和代谢过程、生长调节以及环境适应至关重要(杨红和黄勇平,2018;李青晏等,2020)。而微生物可以通过“食物—肠道—粪便循环”模型传播,因而昆虫粪便细菌菌群组成能够部分反映肠道的细菌菌群组成(Qin et al.,2022)。此外,不同种类昆虫其粪便菌群组成不同,粪便中含有一些对昆虫具有特殊功能的微生物(Wada-Katsumata et al.,2015;Suraporn et al.,2024)。因此,对昆虫粪便细菌群落结构及其多样性的研究,不仅有助于挖掘具有潜在应用价值的微生物,还可以加深对昆虫生物学特性的理解,对系统研究粪便细菌对昆虫生命活动的影响具有重要意义。【前人研究进展】昆虫粪便细菌群落研究已引起学术界的广泛关注。如Vencl等(2009)发现叶甲科昆虫Chelymorpha alter‐nans享受着粪便中尖孢镰刀菌(Fusarium oxyspo‐rum)的保护,在甲虫脆弱的蛹期,尖孢镰刀菌以某种方式抵御天敌昆虫的捕食;当成年甲虫从蛹中出来时,甲虫会将尖孢镰刀菌传播到其共同宿主植物上。Leroy等(2011)从豌豆蚜蜜露中分离到1种相当于利它素功能的松鼠葡萄球菌(Staphylococcus sciuri),其能提高食蚜蝇对蚜虫的捕食效率,利用这种与寄主有关的细菌为控制田间和温室系统的蚜虫提供了一条新途径。Chouvenc等(2013)发现台湾乳白蚁(Coptotermes formosanus)将粪便用作其巢穴结构的建筑材料,粪巢中有多种肠道微生物群,其中链霉菌属(Streptomyces sp.)菌株#2338为台湾乳白蚁群体提供了一层保护罩,使其免受天敌和病原体的侵害。李文红等(2015)从小菜蛾幼虫粪便中分离获得5属6种细菌,与肠道菌群结构具有一定的相似性,其中蒙氏肠球菌(Enterococcus mundtii)数量最多,但这些菌株在体外具体的生理功能并不清楚。Azeem等(2015a,2015b)发现大松象虫(Hylobius abietis)可以通过粪便覆盖的方式来保护自身,其原因是粪便中汉逊德巴利酵母(Debaryomyces hansenii)、Ophios‐toma canum和Ophiostoma pluriannulatum等真菌可产生具有挥发性气味的拒食素来对抗天敌。Diehl等(2015)发现不同龄期的欧洲球螋(Forficula auricu‐laria)粪便的抑菌活性存在差异,其中幼龄欧洲球螋粪便对真菌的抗性高于老龄欧洲球螋,但对细菌的抗性无明显差异。Wada-Katsumata等(2015)发现德国小蠊(Blattella germanica)通过其粪便中的鸟肠球菌(Enterococcus avium)、食窦魏斯氏菌(Weissella cibaria)和不动杆菌属(Acinetobacter sp.)等细菌参与了聚集信息素的诱导生成,产生的聚集信息素有助于使德国小蠊彼此靠近。Grau等(2017)从地中海面蛾(Ephestia kuehniella)幼虫粪便中分离出1株蒙氏肠球菌,该菌株对革兰氏阳性和阴性细菌具有广谱抗菌活性。张硕等(2020)对黄翅大白蚁(Macro‐termes barneyi)粪便进行了微生物种类分析,发现其终级粪便菌群结构与肠道菌群结构具有相似性,但终级粪便微生物的丰度明显高于初级粪便(菌圃)。Suraporn等(2024)在家蚕幼虫粪便中分离到8株潜在益生菌,其中5株粪肠球菌(Enterococcus faecalis)具有耐酸性、胆盐耐受性以及细胞表面疏水性,可显著提高肠道适应能力。上述研究表明,昆虫粪便中的微生物群落不仅具有多样性,而且在昆虫的生存和适应中发挥关键作用。【本研究切入点】尽管近年来对马铃薯块茎蛾幼虫肠道细菌群落结构、多样性及功能的研究取得了一定进展(樊清艳等,2020,2021;Zheng et al.,2020;Wang et al.,2022a,2022b),但其粪便细菌群落结构、多样性和功能还不清楚,尚待进一步研究。【拟解决的关键问题】以马铃薯块茎蛾幼虫新鲜粪便和干粪便为研究对象,采用培养分析法结合16S rDNA双向测序技术对幼虫粪便中可培养细菌进行分类鉴定,以期明确马铃薯块茎蛾幼虫新鲜粪便和干粪便中可培养细菌群落结构及多样性,为系统研究马铃薯块茎蛾肠道菌群多样性及相关细菌功能提供理论依据。
1 材料与方法
1. 1 试验材料
供试虫源:马铃薯块茎蛾采集自云南省马龙区月望乡马铃薯种植基地(25°18′42″N,103°44′6″E),在室内用马铃薯薯块(丽薯6号)饲养3代以上,直到构建稳定种群。主要仪器设备:SW-CJ-1FD无菌超净工作台(苏州安泰空气技术有限公司)、LDZM-40KCS-Ⅱ高压蒸汽灭菌锅(上海申安医疗器械厂公司)、2-16R高速冷冻离心机(湖南恒诺仪器设备有限公司)、T100 PCR仪(Bio-Rad公司)、1645050电泳仪(Bio-Rad公司)、莱卡ICC50W显微镜、佳能EOS-6D单反微距相机。主要试剂:氯化钠、酵母粉和胰蛋白胨购自北京奥博星生物技术有限责任公司,琼脂购自德国BioFroxx公司,细菌通用引物27F和1492R由生工生物工程(上海)股份有限公司合成,Taq PCR Master Mix购自北京全式金生物技术有限公司。LB培养基:氯化钠10 g、酵母粉5 g、胰蛋白胨10 g、琼脂20 g、蒸馏水1 L,pH 7.0,121 ℃(101 kPa)蒸汽灭菌20 min(樊清艳等,2020)。
1. 2 试验方法
1. 2. 1 马铃薯块茎蛾幼虫粪便收集 试验前通过高压蒸汽灭菌锅对培养皿、称量纸、称量勺和离心管等进行灭菌,收集粪便过程使用一次性无菌手套,减少因人为操作过程对粪便中细菌的污染。新鲜粪便收集:挑取200头以马铃薯薯块饲养的3龄幼虫移入灭菌培养皿中,收集当天灭菌培养皿中的粪便。收集的粪便置于离心管并封口,放置在4 ℃冰箱保存备用(任静涛等,2007)。干粪便收集:与新鲜粪便收集方法相同,但培养皿中的粪便在盖上培养皿盖的情况下自然风干15 d,备用。
1. 2. 2 粪便原液制备及细菌的分离、纯化 取0.1 g粪便加入0.9 mL无菌水,在30 ℃、200 r/min的摇床上振荡浸提30 min,取出后置于高速离心机中,以3000 r/min离心1 min使粪便中的杂质沉淀,取上清液备用。通过稀释涂布法培养粪便中微生物:将上清液分别稀释为10-3、10-4和10-5 3个浓度梯度,然后分别吸取0.1 mL粪便上清液涂布在LB培养基上,置于30 ℃恒温培养箱中培养24 h后,统计各培养基上颜色、形态和大小各异的细菌菌落,并及时将不同形态的单菌落用新的无菌培养基进行多次转接纯化,取纯化菌株用于后续研究(樊清艳等,2020)。试验重复3次。
1. 2. 3 细菌菌株分子鉴定 参照冯广达等(2013)采用冻溶法提取细菌DNA,使用细菌通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'- AAGGAGGTGATCCAGCC-3')作为16S rDNA序列扩增的上、下游引物。PCR反应体系25.0 µL:2×Taq PCR Master Mix 12.5 µL,上、下游引物各1.0 µL,DNA模板1.0 µL,ddH2O 9.5 µL。扩增程序:94 ℃预变性5 min;94 ℃ 1 min,53 ℃ 1 min,72 ℃ 2 min,进行32个循环;72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测合格后送至生工生物工程(上海)股份有限公司进行双向测序。
1. 3 统计分析
1. 3. 1 可培养细菌16S rDNA序列系统发育分析
利用Contigexpress对双向测序原始序列进行拼接和校对,提交至NCBI(GenBank)数据库比对,下载相似性最高的同源序列。将下载的序列通过MEGA 7.0,采用Neighbor-joining和Kimura双参数矫正模型构建系统发育进化树,以重复抽样1000次进行Bootstrap验证,分析评估系统进化树拓扑结构的稳定性(张凌英等,2020)。
1. 3. 2 马铃薯块茎蛾幼虫粪便中可培养细菌多样性分析 细菌多样性分析参数Margalef丰富度指数(D')、Simpson优势度指数(D)、Shannon-Wiener多样性指数(H')和Pielou均匀度指数(J)等均用Excel 2013进行计算。
N=∑Ni, D'=, D=1-∑Pi2, H'=-∑Pi ln Pi,
J=H'/ln S。式中,Ni为物种i的个体数,N为群落中所有物种的总个体数,S为物种总数,Pi为物种i的个体数占全部个体数的比例(王蕊蕊等,2018)。
2 结果与分析
2. 1 马铃薯块茎蛾幼虫粪便可培养细菌分离结果
分离结果显示,无菌条件下通过自然干燥得到的干粪便与新鲜粪便中的细菌菌量存在显著差异(Plt;0.05,下同),干粪便中的细菌菌量为7.1×106 CFU/g,而新鲜粪便中的细菌菌量高达1.3×107 CFU/g,后者的可培养菌量是前者的1.8倍。可培养细菌的菌体形
态特征及培养性状描述见表1,菌落形态见图1。
干粪便经稀释涂布法培养分离得到23株细菌,其中共有11种典型的颜色、形状、大小各异的细菌菌落。从菌落形态来看,分为不规则、边缘叶形,圆形、边缘规则,圆形、边缘齿形,圆形、边缘瓣状,不规则、边缘细小瓣状等;从颜色来看,分为橘黄色、淡黄色、白色、初期白色后期深红、黄色、乳白色、土黄色、黄色至白色等;从凸起状态来看,分为隆起、凸起、高凸、四周隆起中央凹陷、中央略凹陷、中央微凸有褶皱、隆起、菌落扁平、四周较低中央凸起等;从透明度来看,分为不透明和边缘透明;从湿润度来看,所有菌株均为湿润;从光泽度来看,分为无光泽和有光泽。
新鲜粪便经稀释涂布法培养分离得到24株细菌,其中共有14种典型的颜色、形状、大小各异的细菌菌落。从菌落形态来看,分为圆形、边缘规则,圆形、边缘不规则,不规则、边缘细小瓣状,圆形、边缘齿形等;从颜色来看,分为白色、淡黄色、黄色、乳白色、土黄色、黄色至白色等;从凸起状态来看,分为表面褶皱状凸起、表面褶皱中央凸起、中央凹陷四周褶皱隆起、凸起、中央略凹陷、中央微凸有褶皱、隆起、菌落扁平、四周较低中央凸起等;从透明度来看,分为不透明和边缘透明;从湿润度来看,分为半湿润、湿润和湿润有黏性;从光泽度来看,分为无光泽和有光泽。
2. 2 马铃薯块茎蛾幼虫干粪便细菌菌株的系统发育分析结果
提取马铃薯块茎蛾幼虫干粪便细菌菌株的基因组DNA并作为模板用于16S rDNA扩增及双向测序,共获得23条具有差异的DNA序列。将测序序列于GenBank数据库中进行BLAST比对,结果(表2)显示,23株细菌与模式菌株的相似性均在99.00%以上。
从系统发育进化树(图2)可看出,马铃薯块茎蛾幼虫干粪便的可培养细菌可分为三大支11小支。第一大支由厚壁菌门(Firmicutes)菌株组成,Kd3141、Kd5241和Kd3143等10株菌株与已公布的隶属于芽孢杆菌目(Bacillales)葡萄球菌科(Staphylococca‐ceae)葡萄球菌属(Staphylococcus)的5株模式菌株首先聚为5小支,说明该10株来自马铃薯块茎蛾幼虫干粪便的细菌菌株之间亲缘关系较近,10株菌再与模式菌株乳杆菌目(Lactobacillales)肠球菌科(Enterococcaceae)的蒙氏肠球菌(Enterococcus mun- dtii)及Kd5321和Kd4261聚为一大支。第二大支由放线菌门(Actinobacteria)菌株组成,Kd3231、Kd3131、Kd3171和Kd3161与已公布的微球菌目(Micrococ‐cales)微球菌科(Micrococcaceae)的盐生谷氨酸杆菌(Glutamicibacter halophytocola)和噬尼古丁节杆菌(Paenarthrobacter nicotinovorans)2株模式菌株聚为2小支。第三大支由变形菌门(Proteobacteria)菌株组成,Kd5221、Kd5121、Kd3322和Kd4121与已公布的隶属于假单胞菌目(Pseudomonadales)莫拉氏菌科(Moraxellaceae)的乙酸钙不动杆菌(Acinetobacter calcoaceticus)聚为一小支,Kd4231、Kd3312和Kd3211与已公布的隶属于肠杆菌目(Enterobacterales)欧文菌科(Erwiniaceae)的侧耳泛菌(Pantoea pleuroti)和耶尔森菌科(Yersiniaceae)的深红沙雷氏菌(Serratia
rubidaea)聚为另外2小支。
综上所述,从马铃薯块茎蛾幼虫干粪便中分离出的23株细菌中,厚壁菌门(12株)、放线菌门(4株)和变形菌门(7株)菌株分别占总分离菌株的52.17%、17.39%和30.43%。12株厚壁菌门细菌中有4株与腐生葡萄球菌(Staphylococcus saprophyticus)关系密切,其次分离到3株琥珀葡萄球菌(Staphylococcus succinus)、2株蒙氏肠球菌、1株松鼠葡萄球菌、1株鸡葡萄球菌(Staphylococcus gallinarum)、1株木糖葡萄球菌(Staphylococcus xylosus);放线菌门细菌主要与盐生谷氨酸杆菌(2株)和噬尼古丁节杆菌(2株)密切相关;7株变形菌门细菌中有4株与乙酸钙不动杆菌关系密切,其次分离到2株深红沙雷氏菌和1株侧耳泛菌(Pantoea pleuroti)。
2. 3 马铃薯块茎蛾幼虫新鲜粪便细菌菌株的系统发育分析结果
提取马铃薯块茎蛾幼虫新鲜粪便细菌菌株的基因组DNA并作为模板用于16S rDNA扩增及双向测序,共获得24条具有差异的DNA序列。将测序序列于GenBank数据库中进行BLAST比对,结果(表3)显示,24株细菌中除KW2331与模式菌株MK424284.1的相似性为98.79%外,其余菌株与模式菌株的相似性均在99.00%以上。
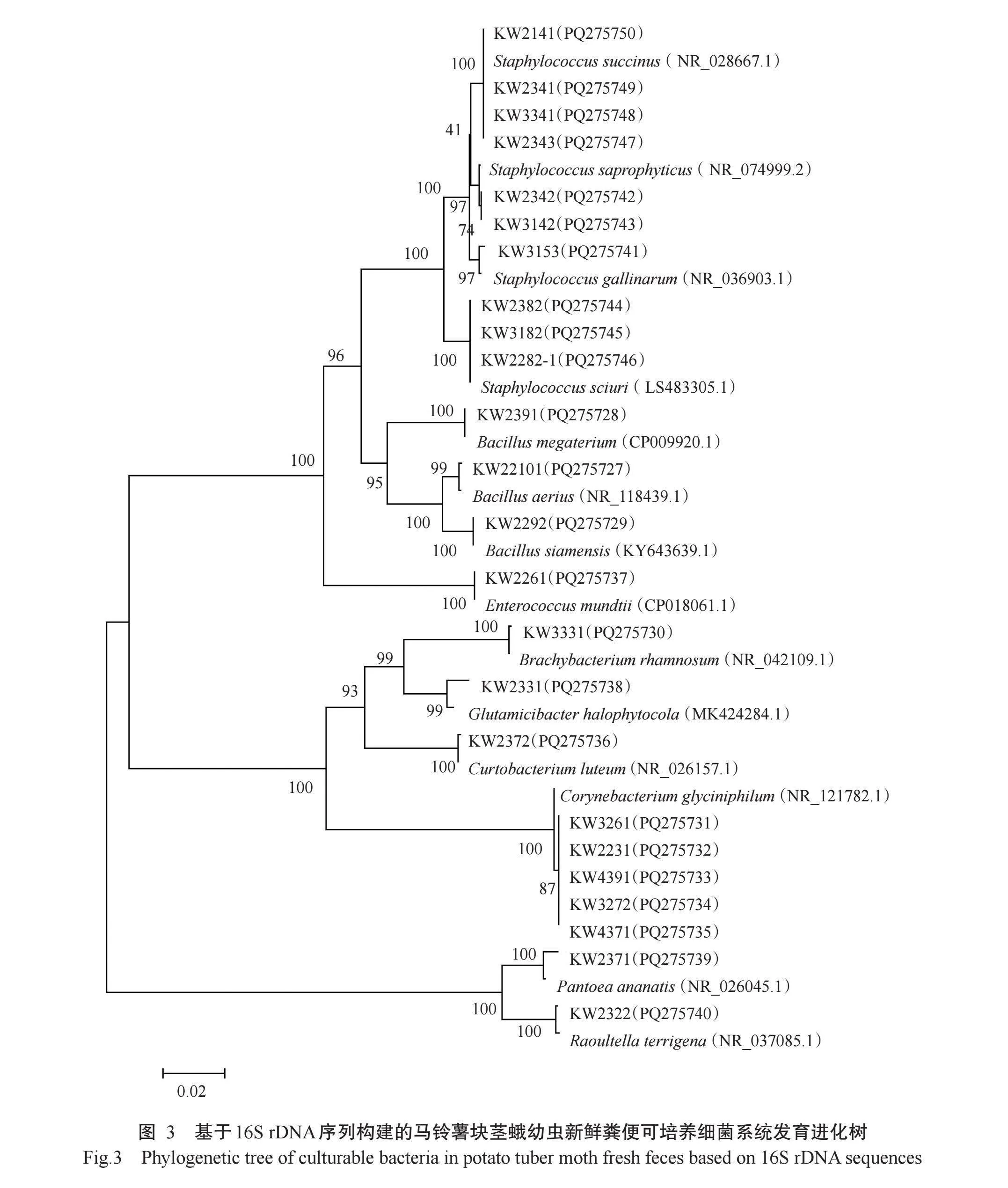
从系统发育进化树(图3)可看出,马铃薯块茎蛾幼虫新鲜粪便的可培养细菌可分为三大支14小支。第一大支由厚壁菌门菌株构成,KW2141、KW2341和KW3341等10株菌株与已公布的隶属于芽孢杆菌目葡萄球菌科葡萄球菌属的4株模式菌株首先聚为4小支,表明该10株来自马铃薯块茎蛾幼虫新鲜粪便的细菌菌株之间亲缘关系较近;KW2391、KW22101和KW2292与已公布的隶属于芽孢杆菌目芽孢杆菌科芽孢杆菌属(Bacillus)的3株模式菌株聚为3小支,表明3株菌之间亲缘关系较近;最后该2小支与乳杆菌目肠球菌科的模式菌株蒙氏肠球菌及KW2261小支聚在一起。第二大支由放线菌门菌株构成,第二大支可分为4小支,其中3小支分别由KW3331、KW2331、KW2372与微球菌目的皮杆菌科(Dermabacteraceae)、微杆菌科(Microbacteriaceae)和微球菌科(Micrococcaceae)的3株模式菌株组成,4小支由KW3261、KW2231和KW4391等5株菌与棒杆菌目(Corynebacteriales)棒状杆菌科(Coryne‐bacteriaceae)的嗜甘氨酸棒杆菌(Corynebacterium glyciniphilum)组成。系统发育进化树中最后一大支由变形菌门菌株构成,KW2371和KW2322分别与已公布的隶属于肠杆菌目欧文菌科和肠杆菌科
(Enterobacteriaceae)的2株模式菌株聚为2小支。
综上所述,从马铃薯块茎蛾幼虫新鲜粪便中分离出的24株细菌菌株中,厚壁菌门(14株)、放线菌门(8株)和变形菌门(2株)菌株分别占总分离菌株的58.33%、33.33%和8.33%。14株厚壁菌门细菌中,有4株与琥珀葡萄球菌关系密切,其次分离到3株松鼠葡萄球菌、2株腐生葡萄球菌、1株鸡葡萄球菌、1株空气芽孢杆菌(Bacillus aerius)、1株巨大芽孢杆菌(Bacillus megaterium)、1株暹罗芽孢杆菌(Bacil‐lus siamensis)和1株蒙氏肠球菌;8株放线菌门细菌中,有5株菌与嗜甘氨酸棒杆菌关系密切,其次为1株鼠李糖小短杆菌(Brachybacterium rhamnosum)、1株柠檬色短小杆菌(Curtobacterium citreum)、1株盐生谷氨酸杆菌。变形菌门细菌主要与菠萝泛菌(Pantoea ananatis)(1株)及土生拉乌尔菌(Raoultella terrigena)(1株)密切相关。
2. 4 2种粪便中细菌的鉴定结果与数量比较
综合各细菌菌株的培养特性、菌体形态特征、革兰氏染色反应和16S rDNA序列的系统发育进化分析,共鉴定出3门6目11科12属19种细菌,其中从新鲜粪便中分离出3门9科9属14种细菌,从干粪便中分离出3门6科7属11种细菌(图4)。从2种粪便在稀释涂布平板上的原始菌落统计数来看(表4),新鲜粪便和干粪便中的细菌菌落数量分别为1.31×107和7.13×106个/g,前者约为后者的1.8倍,表明2种类型粪便样本中的可培养细菌种类差异明显。在门分类水平上,2种粪便中厚壁菌门细菌均为优势门,新鲜粪便和干粪便中的相对丰度分别为86.26%、61.83%。属分类水平上,新鲜粪便中肠球菌属(Enterococcus)为优势属,其相对丰度高达71.25%;而干粪便中葡萄球菌属为优势属,其相对丰度为58.56%。在种分类水平上,新鲜粪便中蒙氏肠球菌为优势种,其相对丰度高达71.25%;而干粪便中琥珀葡萄球菌和腐生葡萄球菌为优势种,2个种的相对丰度分别为29.45%和18.70%,表明新鲜粪便中的优势种类相对集中。
进一步分析马铃薯块茎蛾幼虫2种粪便样本的细菌多样性,结果显示,新鲜粪便的D'=0.79、D=0.48、H'=1.23、J=0.47;干粪便的D'=0.63、D=0.83、H'= 2.02、J=0.84。从D'的角度看,新鲜粪便和干粪便中细菌群落物种D'分别为0.79和0.63,表明新鲜粪便中可培养细菌群落表现出较高的物种丰富度;从D、H'和J的角度看,新鲜粪便和干粪便中细菌群落物种D分别为0.48和0.83、H'分别为1.23和2.02、J分别为0.47和0.84,表明干粪便可培养细菌多样性高于新鲜粪便,且细菌群落种类组成更为均匀,而新鲜粪便可培养细菌种类组成相对集中。
3 讨论
本研究采用LB培养基对马铃薯块茎蛾3龄幼虫的粪便样本进行细菌分离培养,旨在探究取食马铃薯薯块的马铃薯块茎蛾幼虫粪便中的细菌种类组成与多样性。研究结果显示,在属分类水平上,新鲜和干粪便中共有12个细菌属,但干粪便和新鲜粪便细菌种类组成存在明显差异。具体而言,干粪便中分离得到7个细菌属,新鲜粪便分离得到9个细菌属,造成这种差异的主要原因可能是有些细菌对水分较敏感(马馨怡等,2024),其随着粪便的干燥失去活性而在培养基上无法培养;此外,在粪便含水量急剧减少过程中,微生物群落结构可能向有利于自身生存的方向发生改变。
本研究发现,马铃薯块茎蛾幼虫新鲜粪便和干粪便中厚壁菌门细菌相对丰度分别为86.26%、61.83%,远高于放线菌门和变形菌门,表明厚壁菌门是马铃薯块茎蛾幼虫粪便细菌组成的优势类群,与马铃薯块茎蛾肠道细菌优势类群鉴定结果相似(郑亚强等,2017);此外,陈勃生等(2017)研究发现,肠球菌属是鳞翅目昆虫肠道中优势菌属,表明昆虫粪便中的部分细菌很可能来自肠道,粪便细菌菌群组成能部分代表肠道的细菌菌群组成( 李文红等,2015)。出现这种现象的原因与昆虫肠道微生物的传播途径有关,部分微生物在昆虫肠道内占有一定范围并能长时间定居,而另一些过路群落可以随着卵、菌胞、食物残渣等排出体外(相辉和黄勇平,2007;Ohkuma and Brune,2010),从而在昆虫粪便中被检测到。
郑亚强等(2017)从马铃薯块茎蛾4龄幼虫肠道中共分离到细菌8属10种,而本研究从马铃薯块茎蛾3龄幼虫粪便中分离到12属19种细菌;在属分类水平上,2个研究均分离到不动杆菌属(Acineto‐bacte)和葡萄球菌属;在种分类水平上,2个研究均分离到腐生葡萄球菌和松鼠葡萄球菌。产生差异的原因:一是可能与样本来源和取样方法不同有关;二是可能与马铃薯块茎蛾的虫源、龄期、薯块品种和培养基种类有关。郑亚强等(2017)的研究中,马铃薯块茎蛾来源于云南省宣威市板桥镇,采用合作88号马铃薯薯块饲养,细菌样本来源于马铃薯块茎蛾肠道,所用的培养基为牛肉膏蛋白胨培养基,而本研究中的马铃薯块茎蛾来源于云南省马龙区月望乡,采用丽薯6号马铃薯薯块饲养,细菌样本来源于马铃薯块茎蛾的干粪便和新鲜粪便,所用的培养基为LB培养基;三是细菌群落结构在“食物—肠道—粪便循环”模型传递过程中会发生变化。Qin等(2022)通过共现网络分析与三元相图分析研究家蚕幼虫食物组、肠道组及粪便组中细菌群落结构关系,发现在属分类水平上肠道组和粪便组中的微生物种群数量更多,且肠道组和粪便组的细菌群落结构关系更密切,但优势种群和丰度有所不同,幼虫在爬行过程中会使粪便富集食物中的细菌,从而使粪便中可以分离到未经过肠道的细菌种类。在粪便样本收集过程中,尽管采取了严格消毒和灭菌措施以减少人为污染,但寄主植物和幼虫体表微生物对粪便微生物群落结构的影响仍不可避免(Stavrinides et al.,2009);此外,由于不同种细菌在LB培养基上的菌落形态可能相近,可能导致观察者在对细菌表型特征进行主观判断时出现误差(闫寒等,2019)。
在复杂多变的生态环境中,微生物的存在对寄主昆虫的生命活动具有重要意义。据报道,蒙氏肠球菌对革兰氏阳性和革兰氏阴性细菌具有广谱抗菌活性(Grau et al.,2017),蒙氏肠球菌可通过分泌抗菌肽(抗生素)的方式杀灭其他细菌,从而使蒙氏肠球菌成为昆虫肠道菌群中的优势种群,保护宿主抵抗病原菌侵染(Shao et al.,2017);此外,蒙氏肠球菌除了参与昆虫细胞运动、跨膜转运和生物膜形成外,还可参与碳水化合物代谢、氨基酸代谢和脂质代谢等多种代谢途径(Mazumdar et al.,2021;常吕恕等,2022)。本研究发现,新鲜粪便中以蒙氏肠球菌为优势种,占据明显的生态位,推测粪便中的蒙氏肠球菌可能通过与其他细菌争夺粪便中的养分及分泌抗生素的方式,帮助马铃薯块茎蛾幼虫抵抗粪便中其他有害病原菌的侵染。同时,本研究从干粪便和新鲜粪便中均分离到盐生谷氨酸杆菌,有研究表明盐生谷氨酸杆菌具有降解茄科植物毒素龙葵素和卡茄碱的功能(Wang et al.,2022a,2022b),推测马铃薯块茎蛾幼虫可能通过排泄的方式将盐生谷氨酸杆菌释放到环境中从而降低马铃薯薯块中的龙葵素和卡茄碱含量。葡萄球菌属的菌株能产生化学信息素(Doug‐las,2015),如豌豆蚜蜜露中的松鼠葡萄球菌分泌的利它素可提高天敌昆虫食蚜蝇的捕食效率(Leroy et al.,2010),本研究中干粪便和新鲜粪便中均分离到的松鼠葡萄球菌是否同样可分泌利它素来引诱马铃薯块茎蛾自然天敌前来捕食有待明确。本研究从马铃薯块茎蛾粪便中分离到12属19种细菌,其对宿主生物学特性的影响有待进一步探究。
4 结论
马铃薯块茎蛾幼虫粪便中共可培养出3门6目11科12属19种细菌。其中新鲜粪便中有3门5目9科9属14种细菌,以蒙氏肠球菌为优势种,占据了明显的生态位;而干粪便中有3门5目6科7属11种细菌,以琥珀葡萄球菌和腐生葡萄球菌为优势种。马铃薯块茎蛾幼虫粪便中的细菌种类丰富,新鲜粪便中可培养细菌种类组成相对集中且群落表现出较高的物种丰富度,干粪便则展现出更均匀的细菌群落种类组成。
参考文献((References)):
常吕恕,王文倩,杨韵,杨航,杨进波,杜广祖,张庭发,易小光,肖关丽,陈斌. 2022. 番茄潜叶蛾幼虫肠道可培养细菌结构组成及对大分子化合物的降解作用研究[J]. 环境昆虫学报,44(5):1240-1251. [Chang L S,Wang W Q,Yang Y,Yang H,Yang J B,Du G Z,Zhang T F,Yi X G,Xiao G L,Chen B. 2022. Study on the composition of cul‐tivable gut bacteria in the larvae of Yunnan population of Tuta absoluta and their degradation of macromolecular compounds[J]. Journal of Environmental Entomology,44(5):1240-1251.] doi:10.3969/j.issn.1674-0858.2022.05.18.
陈勃生,鲁兴萌,邵勇奇. 2017. 鳞翅目昆虫肠道微生物的多样性及其与宿主的相互作用[J]. 昆虫学报,60(6):710-722.[ Chen B S,Lu X M,Shao Y Q. 2017. Diversity of the gut microbiota in lepidopteran insects and their interaction with hosts[J]. Acta Entomologica Sinica,60(6):710-722.] doi:10.16380/j.kcxb.2017.06.011.
樊清艳,郑亚强,陈斌,Souksamone P,肖关丽. 2020. 取食马铃薯块茎和叶片的马铃薯块茎蛾肠道内可培养细菌的多样性[J]. 植物保护学报,47(3):497-507.[ Fan Q Y,Zheng Y Q,Chen B,Souksamone P,Xiao G L. 2020. Diversity of intestine cultivable bacteria in potato tuber moth Phthorimaea operculella feeding on potato tubers and leaves[J]. Journal of Plant Protection,47(3):497-507.] doi:10.13802/j.cnki.zwbhxb.2020.2019168.
樊清艳,郑亚强,葛文超,李冰超,陈斌. 2021. 马铃薯块茎蛾肠道可培养细菌对宿主营养指标的影响[J]. 绿色科技,23(20):34-37.[ Fan Q Y,Zheng Y Q,Ge W C,Li B C,Chen B. 2021. The effects of cultivable bacteria in the gut of potato tuber moth on host nutritional indicators[J]. Jour‐nal of Green Science and Technology,23(20):34-37.] doi:10.16663/j.cnki.lskj.2021.20.010.
冯广达,陈美标,羊宋贞,朱红惠. 2013. 用于PCR扩增的细菌DNA提取方法比较[J]. 华南农业大学学报,34(3):439-442.[ Feng G D,Chen M B,Yang S Z,Zhu H H. 2013. A comparative study on bacteria DNA extraction methods used for PCR amplification[J]. Journal of South China Agricultural University,34(3):439-442.] doi:10.7671/j.issn.1001-411X.2013.03.031.
李青晏,唐运林,蒋睿轩,张永红,朱峰,白兴荣,顾偌铖,吴燕燕,吴玉娇,陈洁,李田,李春峰,韦俊宏,潘国庆,周泽扬. 2020. 云南地区草地贪夜蛾肠道细菌的分离及鉴定[J]. 西南大学学报(自然科学版),42(1):1-8.[ Li Q Y,Tang Y L,Jiang R X,Zhang Y H,Zhu F,Bai X R,Gu R C,Wu Y Y,Wu Y J,Chen J,Li T,Li C F,Wei J H,Pan G Q,Zhou Z Y. 2020. Isolation and identification of gut bacteria of Spodoptera frugiperda feeding on maize in Yunnan,China[J]. Journal of Southwest University(Natural Scien-
ce),42(1):1-8.] doi:10.13718/j.cnki.xdzk.2020.01.001.
李文红,金道超,金剑雪,程英,李凤良. 2015. 基于幼虫粪便的小菜蛾肠道细菌分离鉴定及其抗生素敏感性分析[J]. 昆虫学报,58(5):546-552. [Li W H,Jin D C,Jin J X,Cheng Y,Li F L. 2015. Isolation,identification and antibio-tic susceptibility testing of gut bacteria from larval feces of the diamondback moth,Plutella xylostella (Lepidoptera:Plutellidae)[J]. Acta Entomologica Sinica,58(5):546-552.] doi:10.16380/j.kcxb.2015.05.009.
马馨怡,高威,李颜,郭晓彬,贾仲君,吴金水,王连峰. 2024. 基于细胞水平高通量测序的土壤水分对活性微生物的影响研究[J]. 生态学报,44(16):7160-7171.[ Ma X Y,Gao W,Li Y,Guo X B,Jia Z J,Wu J S,Wang L F. 2024. Effect of soil water status on active microbes at cellular level based on high-throughput sequencing[J]. Acta Eco‐logica Sinica,44(16):7160-7171.] doi:10.20103/j.stxb.202 309252082.
马艳粉,胥勇,肖春. 2012. 10种寄主植物挥发物对马铃薯块茎蛾产卵的引诱作用[J]. 中国生物防治学报,28(3):448-452.[ Ma Y F,Xu Y,Xiao C. 2012. Oviposition attrac‐tion effect of ten host-plant volatiles on potato tuber moth,Phthorimaea operculella[J]. Chinese Journal of Biologi‐cal Control,28(3):448-452.] doi:10.16409/j.cnki.2095-039x.2012.03.023.
任静涛,胡纯华,王旭,肖春. 2007. 幼虫粪便提取物对马铃薯块茎蛾雌虫产卵的抑制作用[J]. 江西农业学报,19(2):77-78.[ Ren J T,Hu C H,Wang X,Xiao C. 2007. Inhibi‐tory effects of larval excrement extract on oviposition of female potato tuber moth[J]. Acta Agriculturae Jiangxi,19(2):77-78.] doi:10.19386/j.cnki. jxnyxb.2007.02.027.
王蕊蕊,胡颖,杨振德,郭春晖,朱林慧,郑霞林,玉舒中. 2018. 桉树枝瘿姬小蜂雌成虫体内可培养细菌分离鉴定及多样性分析[J]. 南方农业学报,49(12):2432-2439. [Wang R R,Hu Y,Yang Z D,Guo C H,Zhu L H,Zheng X L,Yu S Z. 2018. Isolation,identification and diversity of culturable bacteria in female adults of Leptocybe invasa Fisher amp; La Salle[J]. Journal of Southern Agriculture,49(12):2432-2439.] doi:10.3969/j.issn.2095-1191.2018.12.12.
相辉,黄勇平. 2008. 肠道微生物与昆虫的共生关系[J]. 昆虫知识,45(5):687-693.[ Xiang H,Huang Y P. 2008. Sym‐biosis between gut microbiota and insects[J]. Chinese Bul‐letin of Entomology,45(5):687-693.] doi:10.3969/j.issn. 0452-8255.2008.05.003.
闫寒,李虎林,郎彬,朱诗苗,陈越,姬文秀. 2019. 吉烟9号内生细菌的分离及多样性分析[J]. 中国烟草科学,40(1):75-81.[ Yan H,Li H L,Lang B,Zhu S M,Chen Y,Ji W X. 2019. Isolation and diversity analysis of endophytic bacte‐ria in Jiyan 9[J]. Chinese Tobacco Science,40(1):75-81.] doi:10.13496/j.issn. 1007-5119.2019.01.010.
闫俊杰,张梦迪,高玉林. 2019. 马铃薯块茎蛾生物学、生态学与综合治理[J]. 昆虫学报,62(12):1469-1482.[ Yan J J,Zhang M D,Gao Y L. 2019. Biology,ecology and inte‐grated management of the potato tuber moth,Phthorimaea operculella( Lepidoptera:Gelechiidae)[J]. Acta Entomo‐logica Sinica,62(12):1469-1482.] doi:10.16380/j.kcxb. 2019.12.012.
杨红,黄勇平. 2018. 昆虫微生物组:昆虫健康和适应的守护者[J]. 微生物学报,58(6):961-963.[ Yang H,Huang Y P. 2018. Insect microbiome:As guardians of insect health and adaptation[J]. Acta Microbiologica Sinica,58(6):961-963.] doi:10.13343/j.cnki.wsxb.20186000.
张凌英,苏造堂,徐天梅,张志红,郑亚强,桂富荣,陈斌. 2020. 云南普洱江城县草地贪夜蛾幼虫肠道中可培养细菌的分离及鉴定[J]. 环境昆虫学报,42(1):60-67.[ Zhang L Y,Su Z T,Xu T M,Zhang Z H,Zheng Y Q,Gui F R,Chen B. 2020. Isolation and identification of culturable intestinal bacteria of Spodoptera frugiperda in Jiangcheng,Puer,Yunnan Province[J]. Journal of Environmental Ento‐mology,42(1):60-67.] doi:10.3969/j.issn.1674-0858.2020.01.8.
张硕,林子佳,肖元玺,李净净,李枝,倪金凤. 2020. 培菌白蚁菌圃和粪便微生物多样性分析[J]. 微生物学通报,47(10):3091-3101.[ Zhang S,Lin Z J,Xiao Y X,Li J J,Li Z,Ni J F. 2020. Symbiotic microorganism diversity in comb and feces of fungus-growing termite[J]. Microbio-logy China,47(10):3091-3101.] doi:10.13344/j.micro‐biol.china.200788.
郑亚强,杜广祖,李亦菲,陈斌,李正跃,肖关丽. 2017. 马铃薯块茎蛾肠道细菌分离鉴定及其对植物源大分子化合物的降解作用[J]. 环境昆虫学报,39(3):525-532.[ Zheng Y Q,Du G Z,Li Y F,Chen B,Li Z Y,Xiao G L. 2017. Iso‐lation and identification of bacteria from larval gut of the potato tuberworm,Phthorimaea operculella(Zeller) and the degradation for plant-based macromolecular compounds[J]. Journal of Environmental Entomology,39(3):525-532.] doi:10.3969/j.issn.1674-0858.2017.03.5.
Andreadis S S,Poulia Y,Noukari S,Aslanidou B,Savopoulou-Soultani M. 2016. Cold hardiness attributes of a field popu‐lation of the potato tuberworm,Phthorimaea operculella[J]. Entomologia Experimentalis et Applicata,160(2):109-116. doi:org/10.1111/eea.12465.
Azeem M,Rajarao G K,Terenius O,Nordlander G, Norden‐hem H,Nagahama K,Norin E,Borg-Karlson A K. 2015a. A fungal metabolite masks the host plant odor for the pine weevil (Hylobius abietis)[J]. Fungal Ecology,13:103-111. doi:10.1016/j.funeco.2014.08.009.
Azeem M,Terenius O,Rajarao G K,Nagahama K,Nordenhem H,Nordlander G,Borg-Karlson A K. 2015b. Chemodiver‐sity and biodiversity of fungi associated with the pine wee‐vil Hylobius abietis[J]. Fungal Biology,119(8):738-746. doi:10.1016/j.funbio.2015.04.008.
Chouvenc T,Efstathion C A,Elliott M L,Su N Y. 2013. Extended disease resistance emerging from the faecal nest of a subterranean termite[J]. Proceedings of the Royal Society B:Biological Sciences,280(1770):20131885. doi:10.1098/rspb.2013.1885.
Diehl J M C,Körner M,Pietsch M,Meunier J. 2015. Feces pro‐duction as a form of social immunity in an insect with facu-ltative maternal care[J]. BMC Ecology and Evolution,15(1):40. doi:10.1186/s12862-015-0330-4.
Doğramaci M,Tingey W M. 2010. Performance of a North American field population and a laboratory colony of the potato tuberworm,Phthorimaea operculella,on foliage of resistant and susceptible potato clones[J]. Journal of Insect Science,10(1):80. doi:10.1673/031.010.8001.
Douglas A E. 2015. Multiorganismal insects:Diversity and function of resident microorganisms[J]. Annual Review of Entomology,60:17-34. doi:10.1146/annurev-ento-010814- 020822.
Gao Y L. 2018. Potato tuberworm:A threat for China potatoes[J]. Entomology,Ornithology amp; Herpetology:Current Re-search,4(8):1. doi:10.4172/2161-0983.1000e132.
Grau T,Vilcinskas A,Joop G 2017. Probiotic Enterococcus mundtii isolate protects the modelinsect Tribolium casta‐neum against Bacillus thuringiensis[J]. Frontiers in Micro‐biology,8:1261. doi:10.3389/fmicb.2017.01261.
Leroy P D,Sabri A,Heuskin S,Thonart P,Lognay G,Verheg‐gen F J,Francis F,Brostaux Y,Felton G W,Haubruge E. 2011. Microorganisms from aphid honeydew attract and enhance the efficacy of natural enemies[J]. Nature Com‐munications,2(1):1-7. doi:10.1038/ncomms1347.
Mazumdar T,Teh B S,Murali A,Schmidt-Heck W,Schlenker Y,Vogel H,Boland W. 2021. Transcriptomics reveal the survival strategies of Enterococcus mundtii in the gut of Spodoptera littoralis[J]. Journal of Chemical Ecology,47(2):227-241. doi:10.1007/S10886-021-01246-1.
Ohkuma M,Brune A. 2010. Diversity,structure,and evolution of the termite gut microbial community[J]. Biology of Ter‐mites:A Modern Synthesis,1(1):413-438. doi:10.1007/978-90-481-3977-4_15.
Qin L J,Qi J P,Shen J W,Qin D Y,Wu J X,Song Y W,Cao Y,Zhao P,Xia Q Y. 2022. Effects of microbial transfer during food-gut-feces circulation on the health of Bombyx mori[J]. Microbiology Spectrum,10(6):e0235722. doi:10. 1128/spectrum.02357-22.
Rondon S I,Xue L. 2010. Practical techniques and accuracy for sexing the potato tuberworm,Phthorimaea operculella(Lepidoptera:Gelechiidae)[J]. Florida Entomologist,93(1):113-115. doi:10.1653/024.093.0115.
Shao Y Q,Chen B S,Sun C,Ishida K,Hertweck C,Boland W. 2017. Symbiont-derived antimicrobials contribute to the control of the Lepidopteran gut microbiota[J]. Cell Chemi‐cal Biology,24(1):66-75. doi:10.1016/j.chembiol.2016.11.015.
Stavrinides J,McCloskey J K,Ochman H. 2009. Pea aphid as both host and vector for the phytopathogenic bacterium Pseudomonas syringae[J]. Applied and Environmental Mi- crobiology,75(7):2230-2235. doi:10.1128/AEM.02860-08.
Suraporn S,Cansee S,Hupfauf S,Klammsteiner T. 2024. Lac‐tic acid bacteria from Bombyx mori frass:Probiotic proper‐ties and antagonistic activities[J]. Agriculture,14(6):924. doi:10.3390/agriculture14060924.
Vencl F V,Gómez N E,Ploss K,Boland W. 2009. The chloro‐phyll catabolite,pheophorbide a,confers predation resis‐tance in a larval tortoise beetle shield defense[J]. Journal of Chemical Ecology,35(3):281-288. doi:10.1007/s10886- 008-9577-1.
Wada-Katsumata A,Zurek L,Nalyanya G,Roelofs W L,Zhang A J,Schal C. 2015. Gut bacteria mediate aggregation in the German cockroach[J]. Proceedings of the National Academy of Sciences of the United States of America,112(51):15678-15683. doi:10.1073/pnas.1504031112.
Wang W Q,Du G Z,Yang G Y,Zhang K,Chen B,Xiao G L. 2022a. A multifunctional enzyme portfolio for α-chaconine and α-solanine degradation in the Phthorimaea operculella gut bacterium Glutamicibacter halophytocola S2 encoded in a trisaccharide utilization locus[J]. Frontiers in Micro-biology,13:1023698. doi:10.3389/fmicb.2022.1023698.
Wang W Q,Xiao G L,Du G Z,Chang L S,Yang Y,Ye J H,Chen B. 2022b. Glutamicibacter halophytocola-mediated host fitness of potato tuber moth on Solanaceae crops[J]. Pest Management Science,78(9):3920-3930. doi:10.1002/ps.6955.
Zheng Y Q,Xiao G L,Zhou W W,Gao Y L,Li Z Y,Du G Z,Chen Bin. 2020. Midgut microbiota diversity of potato tuber moth associated with potato tissue consumed[J]. BMC Microbiology,20(6):149-166. doi:10.1186/s12866-020-01740-8.
(责任编辑 麻小燕)
