苯扎贝特通过AKT/mTOR 通路抑制肺腺癌糖酵解机制研究
2024-02-06李智斌叶锦霞巫艳王桂平
李智斌,叶锦霞,巫艳,王桂平
(广州卫生职业技术学院,广东 广州 510450)
肺癌是我国以及全球范围内发病率和病死率最高的恶性肿瘤之一,严重威胁人类健康和生命[1-2],其中肺腺癌是主要肺癌病理类型,发病率约占肺癌的30%~50%。目前,临床普遍采用外科治疗、放射治疗和化学治疗等多学科综合治疗方法对肺癌进行治疗,而对于肿瘤已经转移不能进行手术切除的患者,化学治疗仍是最主要的治疗手段。当前,肺腺癌的治疗药物主要涉及铂类、第三代细胞毒药物(吉西他滨、紫杉醇、培美曲塞等)、EGFR-TK抑制剂、EGFR 单抗等[3]。然而,绝大多数肺癌患者的预后仍然十分不理想,总体5年生存率仅为10%~15%左右。
苯扎贝特(bezafibrate)是临床常用的一种贝特类降脂药。本团队前期研究发现,苯扎贝特可有效抑制肺腺癌细胞生长。体外实验发现苯扎贝特可有效抑制肺腺癌细胞生长,荷人肺腺癌细胞裸鼠体内实验也显示苯扎贝特可抑制移植瘤生长[4-5]。前期工作还证实了苯扎贝特或联合顺铂可有效抑制HIF-1α的表达,从而抑制肺腺癌的生长[6]。而前期生物信息预测揭示,该药可能通过调控PI3K/AKT/mTOR 信号通路,发挥抗肺腺癌作用。HIF-1α是PI3K/AKT/mTOR 下游重要因子,mTOR 活化后可上调HIF-1α表达,从而调控糖酵解过程。苯扎贝特可能是通过激动PPARα 受体通路,抑制PI3K/AKT/mTOR 途径功能,逆转肺腺癌瓦博格效应(Warburg effect),纠正肿瘤组织异常的物质代谢,发挥抗肺腺癌作用。目前关于苯扎贝特的抗肿瘤机制尚不清楚,本文通过细胞功能、代谢、蛋白水平,利用细胞活性检测、WB 等技术观察苯扎贝特对肺腺癌细胞的作用,探讨该药治疗肺腺癌的分子机制,为发现新的肺腺癌治疗药物提供依据。
1 材料与办法
1.1 细胞
人非小细胞肺癌细胞A549 株购自中国科学院细胞库,解冻复苏、重悬后接种在RPMI Medium1640培养基(含10%胎牛血清、100 U/mL 的青霉素和链霉素)中,置细胞培养箱进行培养,取对数生长期细胞进行实验。
1.2 主要仪器与试剂
TD5K-Ⅱ台式低速离心机(长沙东旺实验仪器有限公司);BDS400 倒置生物显微镜(奥特光学仪器有限责任公司);SW-CJ-1FD 洁净工作台(苏州安泰空气技术有限公司);3111 型CO2培养箱[赛默飞世尔科技(中国)有限公司];液氮生物容器(四川亚西机器有限公司);Multiskan FC 型酶标仪[赛默飞世界尔(上海)仪器有限公司];BG-Power 600i 电泳仪(北京百晶生物技术有限公司);JY92-IIN 超声仪细胞破碎仪(宁波新芝生物科技股份有限公司)。
苯扎贝特(质量分数≥98%)、二甲基亚砜(质量分数≥99%)[西格玛奥德里奇(上海)贸易有限公司];RPMI Medium1640 培养基、DMEM 培养基、胰蛋白酶、青霉素-链霉素[赛默飞世尔科技(中国)有限公司];葡萄糖(GLU)试剂盒、乳酸(LD)测试盒(南京建成生物工程研究所);胎牛血清(浙江天杭生物科技股份有限公司);磷酸酶抑制剂、BCA 法蛋白含量检测试剂盒(南京凯基生物发展有限公司);RIPA 裂解液、一抗稀释液(碧云天生物);AKT、mTOR 和PKM2 一抗(美国Proteintech Group);GAPDH二抗(美国Proteintech Group)。
1.3 细胞毒性试验
取对数生长期的A549细胞,用0.25%的胰蛋白酶消化成单细胞悬液,调整细胞浓度至4×104/mL,以100 µL/孔接种到96 孔培养板中,置于37 ℃、5%(φ)CO2的培养箱中培养24 h。设苯扎贝特组(25、50、100、200、400µmol/L)、阴性对照组(加入完全培养基)、空白对照组(不加入细胞),每组设5个复孔。分别于加药48 h 和72 h 后,取出培养板,每孔加入CCK-8 溶液各10 µL,继续培养1 h,在酶标仪450 nm处检测各孔的吸光度值(A)。
1.4 葡萄糖含量测定试验
按“1.3”细胞毒性实验中的细胞分组,取经药物作用72 h后的细胞悬液,1 000 r/min离心10 min后,弃上清液,留细胞沉淀,用等渗缓冲液清洗,1 000 r/min离心10 min,弃上清,留细胞沉淀;加入适量匀浆介质进行匀浆,冰水浴条件下超声粉碎,按试剂盒操作顺序加入相应试剂,用酶标仪测定各孔于波长340 nm 处的吸光度值;按试剂盒计算公式计算得到各样品对应的葡萄糖含量[7]。
1.5 乳酸含量测定试验
按“1.3”细胞毒性实验中的细胞分组,取经药物作用24 h 后的细胞液,稀释后,按乳酸测试盒说明书配制酶工作液,并准备空白管(蒸馏水20µL+ 酶工作液1 mL + 显色剂200 µL)、标准管(3 mmol/L标准品20µL+酶工作液1 mL+显色剂200µL)和测定管(待测样品20µL+酶工作液1 mL+显色剂200 µL),混匀,37 ℃水浴准确反应10 min 后,每管加入终止液2 mL。在酶标仪530 nm 处检测各孔的吸光度值,用空白管调零,测定各管的吸光度值。按试剂盒计算公式计算各管乳酸含量。
1.6 Western blot检测蛋白表达
取对数生长期的A549细胞,用0.25%的胰蛋白酶消化成单细胞悬液,调整细胞浓度至4×104/mL,以100 μL/孔接种到96 孔培养板中,置于37 ℃、5%CO2的培养箱中培养24 h。加入苯扎贝特试液(100、200、400 µmol/L),对照组加入不含药物的培养基,培养48 h。以PBS 洗涤2 次,每孔加入100 μL含1% PMSF(100 mmol/L)和1% Cocktail 的RIPA裂解液,于冰上裂解30 min;裂解完后于4 ℃下14 000 r/min 离心5 min,收集上清液;采用BCA 蛋白定量试剂盒测定蛋白质量浓度,于95 ℃煮沸10 min 进行蛋白变性。蛋白样品经凝胶电泳分离,电转至PVDF 膜。加入5% 脱脂奶粉溶液于室温封闭2 h,TBST洗膜8 min,1次;分别加入AKT、mTOR和PKM2 抗体于4 ℃孵育过夜;TBST 洗涤3 次,加入Rabbit Anti-Mouse IgG(H+L)-HRP(1∶10 000),于室温孵育50 min~3 h;TBST 洗涤3 次,按试剂盒说明书进行显影曝光。采用Image J 软件对蛋白灰度值进行分析。
1.7 统计学处理
2 结果
2.1 苯扎贝特对肺癌A549细胞的体外抑制作用
结果见表1。苯扎贝特对肺癌A549 细胞有明显抑制作用,在相同时间组内,随着苯扎贝特用药浓度的升高,细胞抑制率也逐步增加,由此可得,苯扎贝特对A549 细胞的抑制作用随浓度增大而增大,48 h 的IC50值为453.30 μmol/L,72 h 的IC50值为439.67 μmol/L;而在相同用药剂量组内,72 h 给药组较48 h 给药组细胞抑制率稍高,但差异无统计学意义。
表1 苯扎贝特干预后A549细胞抑制率Table 1 Inhibition rate of A549 cells after bezafibrate intervention()%

表1 苯扎贝特干预后A549细胞抑制率Table 1 Inhibition rate of A549 cells after bezafibrate intervention()%
与0µmol/L比较:**P<0.01。
?
2.2 苯扎贝特对肺癌A549 细胞有氧糖酵解水平的影响
由表2结果可知,随着苯扎贝特浓度增大,细胞中葡萄糖含量不断增加,乳酸含量不断降低。由于各孔为平衡孔,即细胞初始数量、葡萄糖初始含量及乳酸初始含量一致,该结果表明,在用药过程中,随着苯扎贝特浓度升高,细胞内葡萄糖的消耗量不断减少,乳酸产量不断降低。
表2 苯扎贝特干预后A549细胞葡萄糖含量及乳酸含量Table 2 Glucose and lactic acid content in A549 cells after bezafibrate intervention()c/(mmol·L−1)
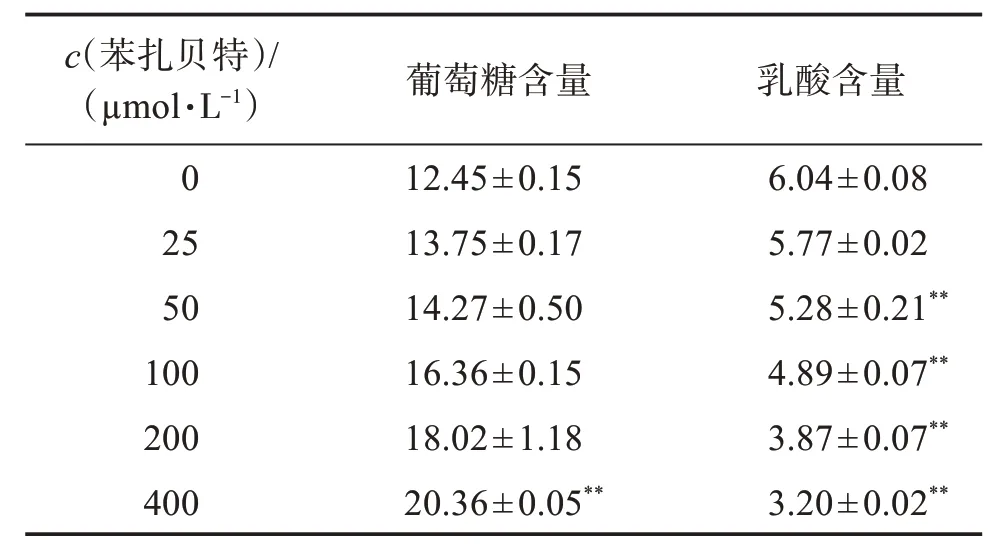
表2 苯扎贝特干预后A549细胞葡萄糖含量及乳酸含量Table 2 Glucose and lactic acid content in A549 cells after bezafibrate intervention()c/(mmol·L−1)
与0µmol/L比较:**P<0.01。
?
2.3 苯扎贝特对肺癌A549细胞蛋白表达量的影响
结果如图1 及表3 所示。结果表明,苯扎贝特干预A549 细胞48 h 后,随着药物浓度的升高,AKT、mTOR和PKM2的表达均有不同程度的降低,其中mTOR 蛋白下降较为明显,且均呈现浓度依赖性。
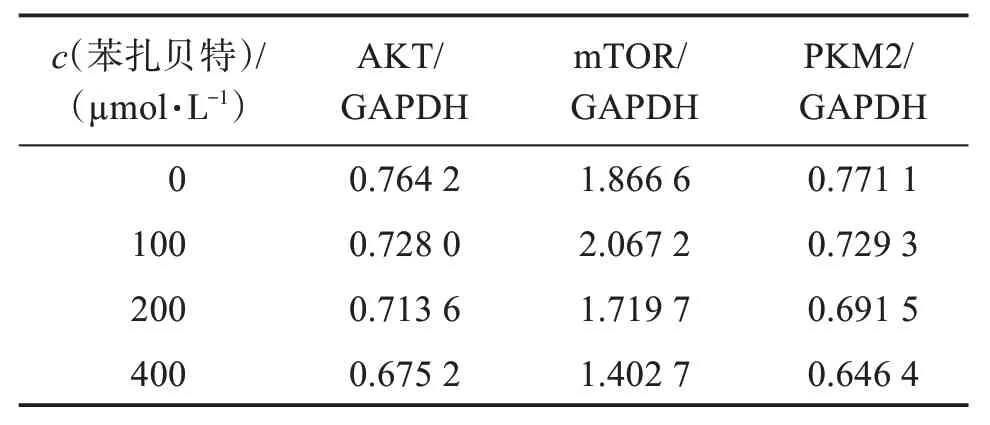
表3 苯扎贝特干预后A549细胞相关蛋白表达量Table 3 Expression of related proteins in A549 cells after bezafibrate intervention
3 讨论
项目组前期基于基因表达谱药物发现途径,筛选到多种肺腺癌候选治疗药物,并通过体内体外实验证实一种PPARα 受体激动剂——苯扎贝特具有较好的抗肺腺癌作用[8]。本文细胞毒性实验结果与前期研究结果一致,证明了苯扎贝特可抑制肺腺癌细胞增殖。
正常细胞在常氧条件下,主要是通过氧化磷酸化的方式产生ATP,提供自身所需的能量,而在肿瘤细胞中,即使是常氧条件下,肿瘤细胞仍然优先利用糖酵解途径提供能量,其典型特点就是葡萄糖的摄取增加以及乳酸生成增加,这就是著名的瓦博格效应[9]。苯扎贝特抗肿瘤作用的确切机制仍不清楚,而代谢异常是肿瘤发生的重要原因,逆转“瓦博格效应”的药物开发是当前肿瘤研究的焦点[10-11]。本研究考察了使用不同浓度的苯扎贝特对A549 细胞糖酵解的影响,结果显示,苯扎贝特对A549 细胞的葡萄糖摄取及乳酸生成有明显的抑制作用,且抑制作用随给药浓度升高而增强,苯扎贝特具有一定的抑制A549 细胞有氧糖酵解的效应,提示肺腺癌A549 细胞凋亡机制可能与苯扎贝特下调糖酵解途径,逆转瓦博格效应有关。
多篇文献报道AKT/mTOR 信号通路[12]及丙酮酸激酶M2(pyruvate kinase M2,PKM2)[13]与肿瘤细胞的糖酵解进程有关。本研究发现,苯扎贝特处理A549 细胞会降低AKT、mTOR 和PKM2 的蛋白表达。由此,本研究推测苯扎贝特可能通过调控AKT/mTOR 信号通路及PKM2,抑制A549 的糖酵解途径,逆转瓦博格效应,从而产生抗肿瘤作用,但其对肺腺癌细胞的抑制机制还有待进一步研究。
