急慢性溃疡性结肠炎小鼠模型的建立与比较研究
2024-02-06刘闯李依林左泽平田颖颖赵新月吕英楠徐意张硕峰王志斌
刘闯,李依林,左泽平,田颖颖,赵新月,吕英楠,徐意,张硕峰,王志斌,
(1.北京中医药大学中药学院,北京 102401;2.北京同仁堂科技发展股份有限公司制药厂,北京 100071)
溃疡性结肠炎(ulcerative colitis,UC)是炎症性肠病(inflammatory bowel disease, IBD)的亚型之一,是一种以结肠黏膜连续性、弥漫性炎症改变为主要特征的慢性非特异性炎症性疾病[1],在临床上具有难治愈、病程长、易复发等特点。流行病学数据显示,在全球范围内UC 的发病率呈上升趋势,UC 的发病率和患病率在发达国家较高并趋于稳定,在发展中国家较低但呈明显上升趋势。近年来,我国UC 门诊就诊人数呈增长趋势[2]。为了探究UC 的发病机制并寻找能够有效防止UC 的药物,选择理想的UC动物模型尤为重要。
目前常用的UC 临床前研究动物模型主要包括化学诱导模型、免疫诱导模型、基因编辑模型以及中医证候模型。其中化学诱导模型主要是通过化学试剂刺激诱导结肠黏膜损伤,进而发生UC[3]。葡聚糖硫酸钠(dextran sulfate sodium salt,DSS)与噁唑酮(oxazolone,OXZ)是常见的2 种化学诱导剂,DSS 多通过自由饮水的方式进行模型制备,OXZ 多通过致敏后联合乙醇灌肠的方式诱导UC[4]。本研究通过DSS 诱导小鼠慢性UC 和OXZ 诱导小鼠急性UC两种模型并进行比较,以期能够为UC治疗方法及机制的研究提供理论和实验依据。
1 实验材料
1.1 实验动物
SPF 级雄性C57/6N 小鼠24 只,8 周龄,体质量22~24 g;SPF 级雄性Balb/c 小鼠30 只,8 周龄,体质量22~24 g,均购自北京维通利华实验动物技术有限公司,生产许可证号SCXK(京)2021-0006,动物在室温(23±2)℃、湿度40%~70%、12 h 昼夜交替环境中适应性饲养1周。动物实验经北京中研同仁堂医药研发有限公司伦理审查委员会批准(批准号:YJY-2022-082902,YJY-2022-110301)。
1.2 主要试剂
DSS(MP Biomedicals,0216011080);4-乙氧基亚甲基-2-苯基-2-恶唑啉-5-酮(噁唑酮,Sigmaaldrich,E0753-10G);无水乙醇(AR,国药集团化学试剂有限公司,批号:20211214);TNF-α检测试剂盒(SEA133Mu)、INF-γ检测试剂盒(SEA049Mu)与IL-10 检测试剂盒(SEA056Mu)均购自武汉云克隆科技股份有限公司。
1.3 主要仪器
BT 25 S 型万分之一天平(赛多利斯);ME3002精密天平(梅特勒-托利多);BX53光学显微镜(日本Olympus);VS200扫描仪(日本Olympus)。
2 方法
2.1 DSS诱导小鼠慢性UC模型[5]
C57/6N 小鼠适应性饲养后开始造模,分为对照组、模型组。模型组第1周1%DSS自由饮水,第2周到第3 周恢复小鼠正常饮水,第4 周更换为1%DSS自由饮水,第5 周到第6 周恢复正常饮水,第7 周更换为1%DSS 自由饮水。对照组始终给予正常动物饮水。期间每两天进行1 次称重与疾病活动指数(DAI)评分(见表1)。第7周结束后,剖检取材。
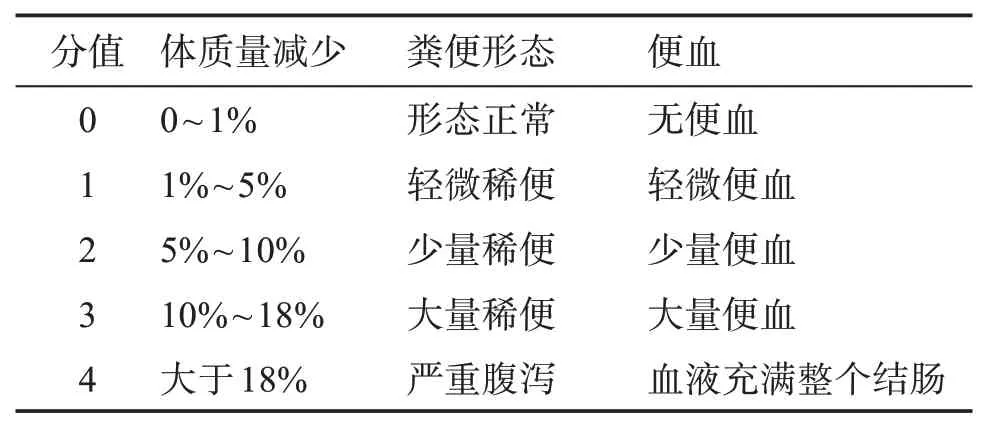
表1 DAI评分标准Table 1 DAI scoring criteria
2.2 OXZ诱导小鼠急性UC模型[6]
Balb/c 小鼠适应性喂养1 周后,随机分成对照组、模型组。模型组小鼠腹部剃毛,皮肤涂抹2.4%的OXZ(溶于无水乙醇)致敏剂0.2 mL,1 d 后重复涂抹1 次,实验第5 天禁食不禁水24 h,第6 天将直径2.5 mm的硅胶软管插入结肠距肛缘约4 cm,缓缓注入0.8%的OXZ(溶于40%乙醇)造模剂0.1 mL,诱导制备UC 小鼠模型。对照组灌肠等量的生理盐水。灌肠后每天进行DAI 评分,评分标准见表1。灌肠后1周进行剖检。
2.3 剖检与取材
剖检前一天禁食不禁水,异氟烷对小鼠进行吸入麻醉后,腹主静脉取血,置于EDTA 抗凝管中,完成血液学检测后,离心分离上清于−80 ℃保存。取小鼠结肠(盲肠至耻骨联合处)、心脏、肝脏、脾脏、胸腺、肾脏、全脑,测量或称重后使用4%(φ)多聚甲醛进行固定,或置于液氮中进行冻存。剖检过程中对结肠进行拍照记录测量结肠长度,取材后立即对各脏器进行称重记录,计算脏脑系数[7](以脏脑比记),公式如下:
2.4 ELISA检测小鼠结肠匀浆中相关细胞因子
样本前处理:准确称取小鼠结肠组织质量,按质量(g)∶体积(mL)=1 g∶18 mL 的比例加入PBS,放入研磨珠,制备结肠组织匀浆,4 ℃,3 500 r/min离心20 min,分装上清液于EP 管中。根据BCA、IL-10、TNF-α、IL-1β试剂盒说明书对结肠匀浆中相关细胞因子进行检测。
2.5 结肠组织病理检查
所有结肠组织经4%多聚甲醛充分固定后,经取材修块,梯度酒精脱水,石蜡包埋,切片厚度4 μm,HE 染色后光镜检查结肠横截面组织病理学变化,记录各组结肠横截面。
2.6 统计分析
3 结果
3.1 一般状态观察
3.1.1 DSS 诱导小鼠慢性UC 模型 DSS 造模小鼠出现体质量下降、稀便与便血的症状,症状出现一般在DSS 自由饮水的第3 天以后出现。图1A、B 所示为DSS 造模小鼠体质量与DAI评分变化。在第1次开始给予DSS 自由饮水后第10 天,模型组小鼠DAI 评分与对照组比较开始出现显著差异(P<0.01)。反复诱导期间,DSS 自由饮水后小鼠症状加重,更换为普通饮水,小鼠症状开始缓解。

图1 两种模型小鼠体质量与DAI评分变化Figure 1 Changes of body weight and DAI score in two model mice(,n=12)
3.1.2 OXZ 诱导小鼠急性UC 模型 第2 次腹部涂抹OXZ 致敏后,小鼠出现明显过敏反应,表现为体质量持续下降,毛色黯淡,耳廓表现出明显红肿。图1C、D 所示为OXZ 造模中小鼠体质量与DAI 评分变化。致敏后小鼠体质量即开始下降,而DAI 评分无显著变化。灌肠后,小鼠反应明显,当天即出现黏液便与便血的症状,DAI 评分与对照组比较差异有统计学意义(P<0.01),灌肠后第3 天小鼠症状最为严重,期间出现造模小鼠死亡的情况,第4天以后造模小鼠症状逐渐开始恢复,但与对照组比较仍有显著差异(P<0.05)。
3.2 结肠大体观察与脏器指数
剖检过程中发现,DSS 诱导UC 小鼠结肠显著缩短(P<0.01),且可见明显出血(图2),模型组小鼠胸腺指数与肾脏指数与对照组比较出现显著降低(P<0.01),而脾脏指数出现了显著升高(P<0.01)。OXZ诱导小鼠急性UC模型中正常组小鼠结肠表面光滑,无充血水肿等表现,结肠内有成形的粪便。OXZ 模型组病变以远端结肠为主,肠黏膜充血、水肿、溃疡,并连续存在。对结肠长度进行统计分析,模型组结肠长度与对照组比较显著缩短(P<0.01)。
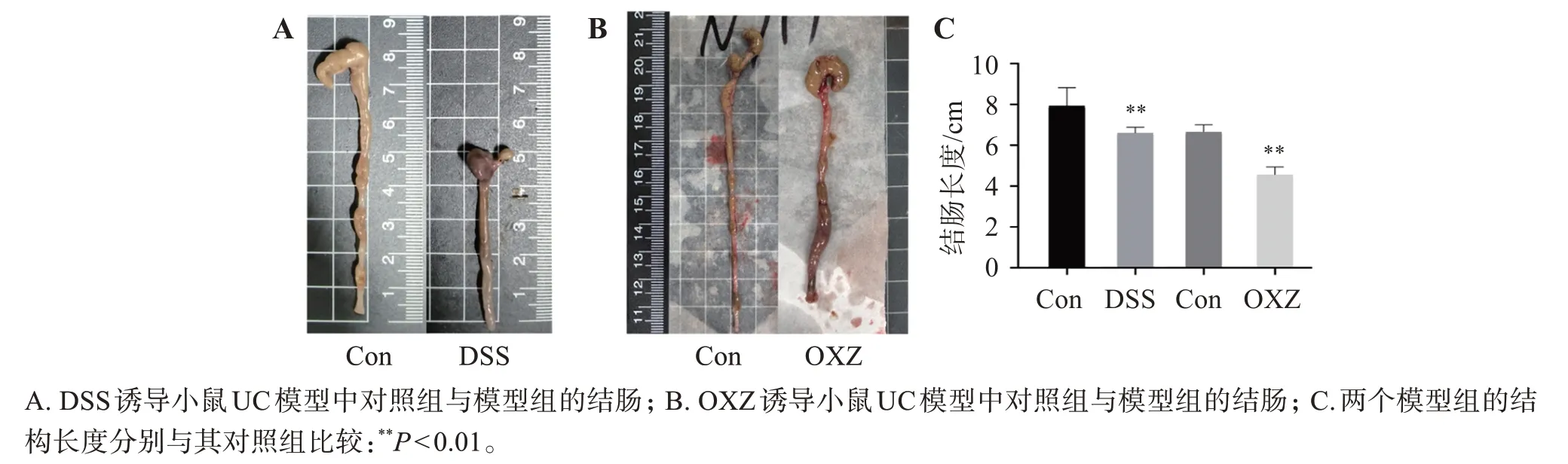
图2 两种UC模型小鼠结肠大体观察Figure 2 Gross observation of the colon in two UC model mice(,n=12)
免疫因素在UC 的发病中有重要的作用,脾脏与胸腺是重要的免疫器官。两种模型中,模型小鼠的脾脏指数与对照组相比均显著升高(P<0.01),而胸腺指数与对照组比较均显著降低(P<0.01),表明DSS与OXZ对小鼠的免疫系统有一定的抑制作用。除此之外,与OXZ诱导小鼠急性UC 模型不同,DSS诱导小鼠慢性UC 小鼠的肾脏指数出现了显著降低(P<0.01),该现象可能是DSS 诱导小鼠慢性UC 的结肠外症状。见图3。

图3 两种UC模型小鼠脏器指数Figure 3 Organ indices in two UC model mice(,n=12)
3.3 血液学检查
在DSS 诱导小鼠慢性UC 模型中,与对照组比较,模型组白细胞计数(WBC)显著升高(P<0.01),说明机体发生炎症反应。模型组小鼠血液中的血小板计数(PLT)与血小板压积(PCT)与对照组比较显著升高(P<0.01)。血液学检查结果显示,与对照组比较模型组小鼠血液中网织红细胞百分比(%RETIC)显著升高(P<0.01),中性粒细胞/淋巴细胞(NLR)、血小板计数/淋巴细胞(PLR)显著升高(P<0.01)。见图4。

图4 血液学检查结果Figure 4 Hematologic test results(,n=12)
在OXZ 诱导小鼠急性UC 模型中,模型组小鼠白细胞计数与对照组比较差异无统计学意义,而模型组小鼠血液中的PLT、PCT 和%RETIC 与对照组相比显著升高(P<0.01)。模型组小鼠外周血NLR与PLR与对照组比较显著升高(P<0.05)。
3.4 ELISA检测相关细胞因子
ELISA 检测结果如图5 所示,DSS 诱导慢性UC小鼠结肠组织匀浆中TNF-α水平和IL-10 水平与对照组比较均显著升高(P<0.01),IFN-γ水平显著降低(P<0.01)。在OXZ 诱导小鼠急性UC 模型中,小鼠结肠组织匀浆中TNF-α水平和IL-10 水平与对照组比较均显著升高(P<0.05),而IFN-γ水平出现下降趋势,但差异无统计学意义。见图5。
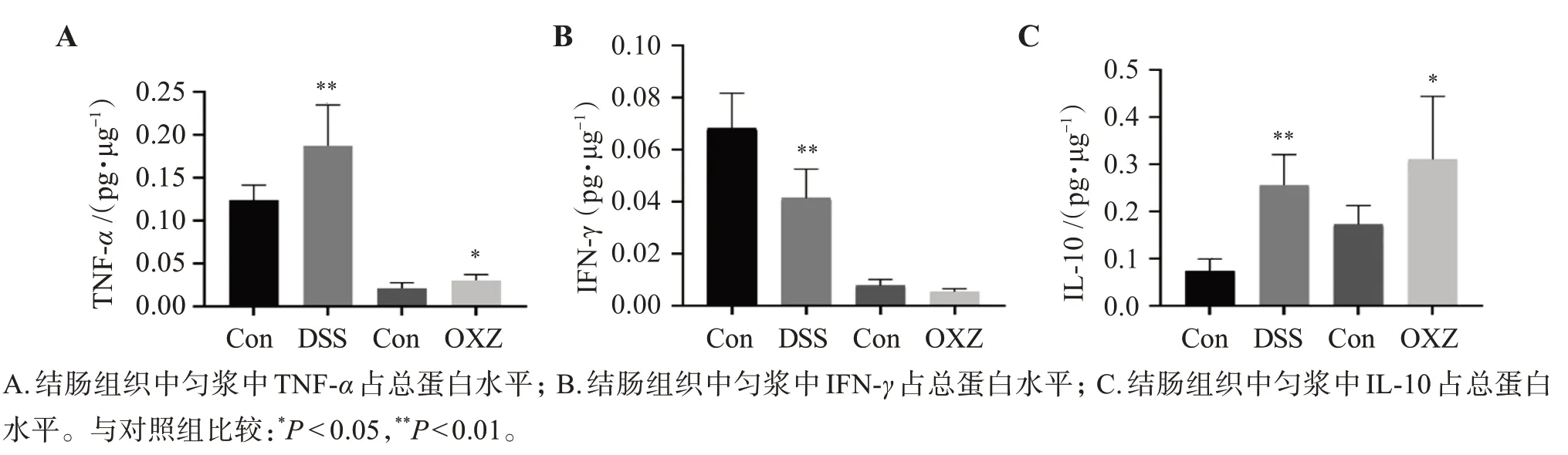
图5 ELISA法检测相关细胞因子结果Figure 5 Results of ELISA assay for relevant cytokines(,n=12)
3.5 病理检查
如图6所示,在两种模型中,对照组小鼠结肠黏膜层、黏膜下层、肌层和外膜各层形态清晰,结构完整,细胞排列规则,肠道结构完整,黏膜下层无水肿增厚,肠基部无淋巴细胞聚集和炎性细胞浸润,肠隐窝排列整齐。模型组结肠组织病理表现有所不同,如图6A 所示,DSS 诱导的慢性UC 小鼠结肠局部黏膜上皮脱落,上皮损伤,大量炎症细胞浸润至黏膜下层,肠腺明显扩张扩大,肠隐窝数量明显减少,肠黏膜下层水肿增厚,隐窝扭曲并萎缩。OXZ 诱导急性UC小鼠结肠上皮细胞消失和(或)上皮组织再生,杯状细胞减少或消失,结肠黏膜增厚,黏膜不完整,细胞排列不规则,有大量红细胞及炎性细胞浸润,肠壁水肿,纤维化,且上述病理表现在灌肠后第2天即出现,第3或第4天最为严重,灌肠后第7天有所缓解,溃疡面积减少且可见隐窝再生(见图6B)。
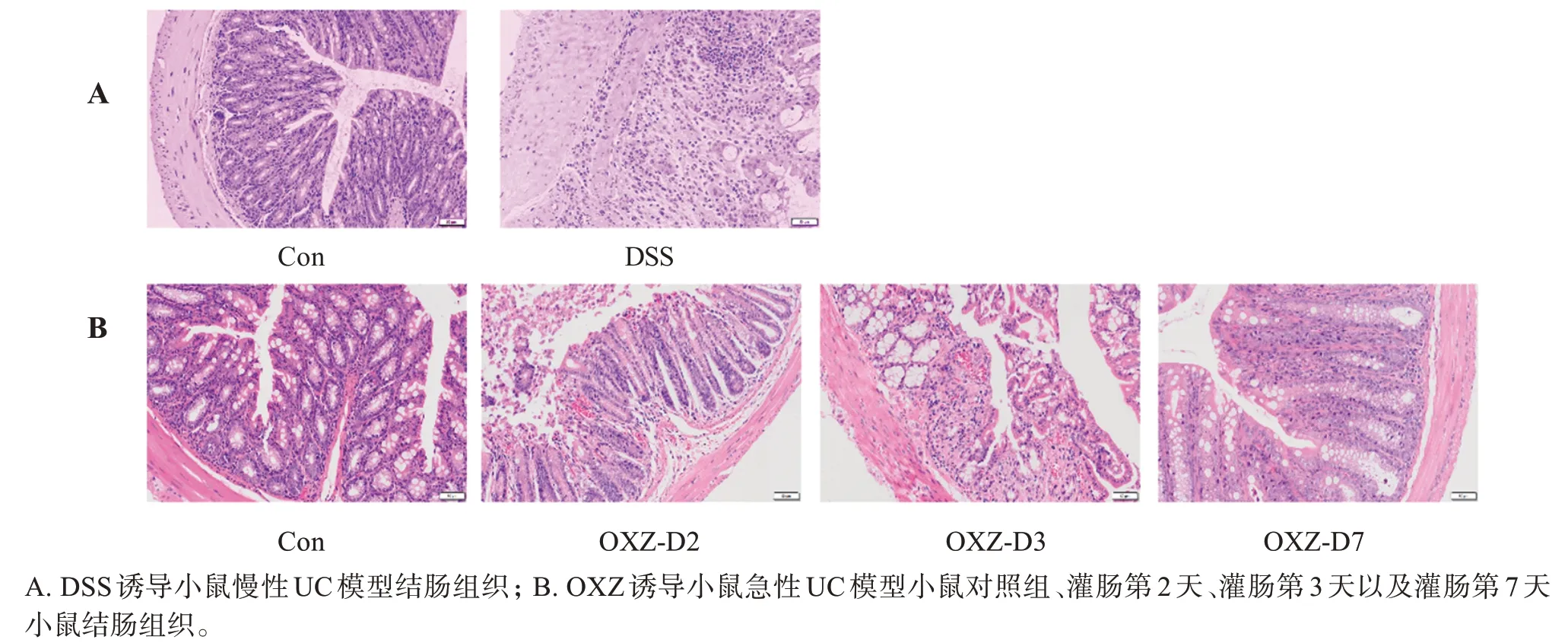
图6 结肠组织病理HE染色Figure 6 HE staining of colon histopathology
4 讨论
DSS 常用于UC 发病机制研究及并发症研究,OXZ常用于UC急性发作期药物药效研究[5−6]。DSS是一种具有抗凝血特性的化合物,能够诱导结肠上皮损伤。通过调整DSS 的浓度以及给药频次可以实现诱导结肠急性、慢性以及复发的模型,具有操作简单、成功率高以及可重复的特点。研究认为DSS 对基底隐窝肠上皮细胞具有毒性,当上皮损伤时,屏障完整性受损,随后黏膜和黏膜下免疫细胞暴露于腔内抗原(例如细菌抗原),导致快速出现明显的炎症免疫反应。因此该模型常被用于研究肠道菌群和饮食等因素对结肠炎发病的影响以及固有免疫机制在黏膜炎症发展和屏障完整性重建中的作用。DSS 是一种高分子化合物,无法穿过细胞膜且吸收不良,其作用仅限于结肠,而其他脏器所产生的损伤多由疾病本身造成,因此可用于研究UC疾病本身对其他脏器造成的伤害[8]。
噁唑酮是一种半抗原试剂,在小鼠直肠给药后可引起严重的结肠炎。在OXZ 诱导的UC 模型中,固有层T 细胞产生的2 型和9 型细胞因子(IL-4、IL-5、IL-9 和IL-13)的升高与人类观察到的UC 的特征相似。分泌IL-13 的自然杀伤T 细胞被认为是疾病的重要触发者,可能是通过CD1d 的抗原呈递而激活。因此,该模型被用于研究肠道炎症过程中与2型和9 型相关的免疫反应。同时,较低剂量的OXZ也可能诱导混合Th1/Th2应答[9]。
DSS 诱导小鼠UC 症状与临床UC 患者症状一致。本研究过程中发现DSS 诱导慢性UC 的小鼠自由饮水5~7 d 成模,在自由饮水期间体质量持续下降,出现稀便伴有明显便血,血液学检查发现小鼠白细胞、血小板及免疫炎症指数升高,病理检查发现黏膜下层水肿增厚明显,造模死亡率0%;OXZ 诱导急性UC 的小鼠灌肠当天即出现症状,致敏期间体质量下降,灌肠后前3 天体质量下降,后逐渐恢复,黏液便明显,造模初期可见便血,血液学检查发现小鼠白细胞变化不明显,病理检查发现肠壁变薄,造模第3 天病理损伤最为严重,造模死亡率约50%,而存活下来的部分动物可能由于造模程度较轻且恢复较快而在试验周期内就恢复,无法与药物治疗组进行比较。在本研究中,出现OXZ 灌肠后,动物体质量快速降低,部分动物由于机体损伤严重而死亡,出现动物死亡率较高的情况,而存活下来的部分动物可能由于造模程度较轻且恢复较快而在试验周期内就恢复,无法与药物治疗组进行比较。因此使用该模型进行药理研究需要大量实验小鼠,代价较高且可能会引发伦理问题。两个模型小鼠均有脾脏指数上升,胸腺指数下降。
此外,在本研究预实验中还利用Wistar 大鼠进行造模,结果发现,大鼠OXZ 造模虽然也出现了体质量下降及稀便的症状,但几乎未出现便血的情况,从造模结果无法诊断其为UC,且动物恢复速度较快,所有造模动物均在1周内恢复正常状态,不再有任何临床症状。因此,作者考虑可能通过少量多次给予OXZ 灌肠反复诱导小鼠UC,降低模型动物死亡率并维持模型动物临床症状,使该模型能更加适用于药物治疗UC 的药理学研究。在对UC 的机制研究和其治疗药物的临床前研究中应根据研究目的与实验特点选择合适的动物模型。
