丙酸氯倍他索脂肪酸囊泡的经皮渗透性及抗银屑病药效的初步研究
2024-02-06赵雅欣李彦杰付琳邹博航张向宇
赵雅欣,李彦杰,付琳,邹博航,张向宇
(佳木斯大学药学院/佳木斯大学实验动物中心,黑龙江 佳木斯 154007)
银屑病是一种常见的慢性炎性皮肤病,以红斑、鳞屑、浸润为主要特征,病因复杂且预后不良,严重影响患者的生活质量[1−5]。银屑病的治疗主要包括局部治疗、光疗和口服治疗。局部治疗是约80%的轻中度银屑病患者的主要治疗方法[6−10]。大多数皮肤病的诱因都是在皮肤下发现的,局部提供的药物治疗比全身的方法更受青睐,具有给药方便、使用安全以及可避免首过效应等优点[11−12]。
丙酸氯倍他索(clobetasol propionate,CP)作为一种高效的糖皮质激素[13],具有抗炎、抗血管收缩、抗有丝分裂和免疫调节能力[14]。然而,CP 短期疗效较好,长期局部应用可诱发皮肤不良反应,如局部萎缩和色素沉着等[15]。丙酸氯倍他索常见剂型以软膏、凝胶等普通剂型为主,普通剂型一般都存在渗透性差、吸收效果差、疗效不理想等缺点。
脂肪酸囊泡(fatty acid vesicles,FAV)是由脂肪酸的盐溶液自组装形成的2层封闭脂质胶体分散体系[16−18],具有两亲性结构,用于经皮给药具有良好的相容性和渗透性,并且脂肪酸具有高可溶性,很容易迅速地分解成人工膜和天然膜[19]。油酸是一种单不饱和ω-9 脂肪酸,参与炎症和免疫反应的调节[20],并且皮肤中含有的各种脂肪酸油酸占比最高,因此制备含油酸的脂肪酸囊泡更有利于膜的融合[21],有助于增强皮肤的屏障强度,可作为一种有效的皮肤渗透增强剂[22−24],使经皮给药达到更好的治疗效果。
基于此,本研究制备丙酸氯倍他索脂肪酸囊泡(CP-FAV),通过体外透皮实验考察CP-FAV 的皮肤透过量和皮内滞留量,并考察其透皮机制及抗银屑病的疗效,为增加药物渗透、延长药物作用时间等研究奠定理论和实验基础,进而为银屑病经皮给药的临床推广提供参考。
1 仪器与材料
1.1 主要仪器
RE-5205A 旋转蒸发仪(上海亚荣生化仪器厂);YB-P6 智能透皮试验仪(天津药典标准仪器厂);JY92-2D 超声细胞粉碎机(宁波新芝生物科技有限公司);STA409PC 差示量热扫描仪(北京恒久实验设备有限公司);Spectrum100 傅里叶红外光谱(PerkinElmer公司)。
1.2 材料
油酸(批号:20201130,国药集团化学试剂有限公司);丙酸氯倍他索(批号:D1402028,上海阿拉丁生化科技股份有限公司);甲醇(天津科密欧化学试剂厂);PBS(批号:P1003,pH 7.4 北京索莱宝技术有限公司);双蒸水(实验室自制);5%咪喹莫特乳膏(批号:40220702,四川明欣药业有限责任公司);白凡士林(批号:220702,青岛锦麟生物科技有限公司)。
1.3 动物
SPF 级健康雄性KM 小鼠,体质量为18~22 g,购于长春市亿斯实验动物技术有限责任公司,生产许可证号为SYXK(吉)2020-0002,动物伦理批准文号:JMSU-2023101901。
2 方法与结果
2.1 CP-FAV的制备
薄膜分散-超声法制备CP-FAV:精密称取15 mg 油酸和10 mgCP 溶解于5 mL 甲醇溶剂中,置于干燥的圆底烧瓶中,减压蒸发至有机溶剂完全挥干,在瓶壁底部形成均匀薄膜,然后加入PBS(pH7.4)溶液20 mL,室温条件下水化2 h,探头超声14 min(285 W,开启3 s,关闭2 s),即得CP-FAV。
2.2 体外透皮研究
2.2.1 离体小鼠皮肤的处理 用刮毛刀和脱毛膏去除小鼠背部毛,将小鼠脱颈处死,用组织剪剥离小鼠背部皮肤,再刮除皮下脂肪,冷冻储存[25]。
2.2.2 体外透皮试验 透皮试验采用Franz扩散池[21]进行。冷冻的鼠皮用PBS(pH 7.4)解冻,用滤纸吸干水分。角质层朝向供给池,用固定夹固定,使真皮层与接收液体密切接触。在测试过程中,在接收池中加入15 mL的接收液,并在供给池中加入待透皮的试剂。有效扩散面积为1.766 cm2,(37.0±0.2)℃恒温水浴,并以200 r/min 磁力恒速搅拌。以不同的时间间隔精密吸取2 mL接受液样品,随即补回相应量,样品经0.22 μm 微孔滤膜过滤后,计算各时间点单位面积皮肤的累积透过量(Qn):
式中:Qn为第n个取样时间点的单位面积累积渗透量;V0为释放介质总体积;Cn为第n个点的药物浓度;Ci为第i(i=n−1)个点的药物浓度;Vi为第i次取样液体积;A为Franz扩散池有效扩散面积。
根据不同剂型在各时间点的取样分析结果,绘制囊泡的累积渗透量(Qn)-时间(t)曲线,见图1。可见,CP 原料药溶液和CP-FAV 渗透趋势基本一致,CP-FAV的累积渗透量高于原料药溶液,24 h累积透皮量为原料药溶液的2.88 倍。因此,脂肪酸囊泡不同程度提高了原料药的皮肤透过率,其释放相关方程拟合结果见表1,其体外渗透过程符合一级模型。

表1 CP-FAV渗透模型拟合结果Table 1 Fitting results of CP-FAV penetration model

图1 CP原料药及CP-FAV体外渗透曲线Figure 1 Penetration curves of Free-CP and CP-FAV(,n=3)
2.2.3 体外皮肤滞留实验 24 h后从Franz扩散池上取下皮肤,剪掉未接触药物的皮肤,生理盐水去除皮肤表面残留药物。充分剪碎皮肤后分别用3 mL无水乙醇提取3 次,合并取上清液,10 000 r/min 高速离心10 min。每组皮肤滞留实验各进行3 次。按以下公式计算单位面积皮内滞留量(Qm):
式中:Cm为提取液浓度,V为提取液体积,A为经皮渗透面积。
结果测得CP-FAV 皮肤滞留量远大于CP,24 h皮肤滞留量为(88.79±2.2)mg/cm2,是CP 原料药溶液的3.37 倍,可能是因为皮肤中含有大量脂肪酸,脂肪酸具有高可溶性,从而提高了药物的递送能力以及滞留能力。
2.3 载体对皮肤结构的影响
2.3.1 傅里叶变换红外光谱(FTIR) 傅里叶变换红外光谱图可以通过皮肤角质层脂质和角蛋白次级结构的红外吸收峰信息反映其结构变化[26]。按照“2.2.1”项方法处理小鼠离体皮肤,PBS(pH 7.4)及空白FAV 溶液2 mL 分别处理小鼠皮肤2 h,将干燥的皮肤样品和KBr 进行充分的研磨直至粉碎均匀,取适量混合物进行压片,进行FTIR 光谱分析(分辨率:2−1,扫描次数:100,扫描范围:500~4 000 cm−1),光谱图见图2。
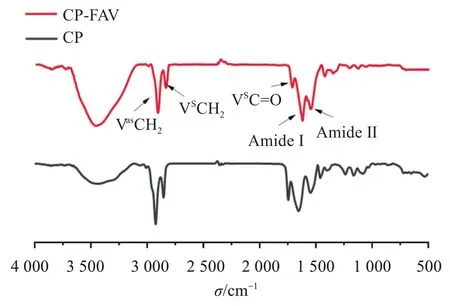
图2 不同处理组小鼠皮肤的红外光谱图Figure 2 Spectrums of mouse skin in different treatment groups
体外透皮试验对小鼠皮肤结构的影响主要是角质层细胞间的类脂组织,红外光谱图中显示了类脂组织的—CH2酰基链的反对称伸缩振动和对称伸缩振动谱带,不同载体处理后角质层脂质和角蛋白振动峰位移变化见表2。
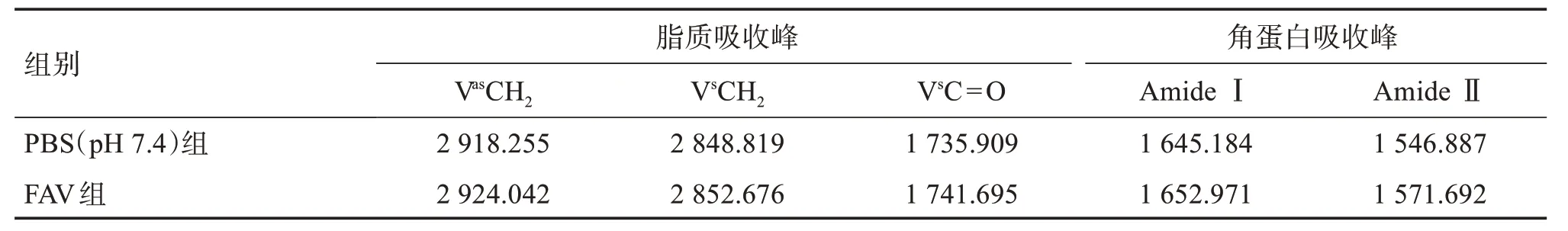
表2 不同载体处理后角质层脂质和角蛋白振动峰位移变化Table 2 Vibrational peak displacement changes in cuticle lipids and keratins after treatment with different vectorsσ/cm−1
与对照相比,FAV 处理组对称和不对称—CH2的伸缩振动值变高,表明脂质由有序向无序转变,这种转变显示了角质层中脂质的流动性增加,从而提高皮肤渗透能力。另外,FAV 处理组中角蛋白吸收峰的峰位产生明显的蓝移,表明处理皮肤后能够影响角质层中角蛋白的螺旋结构,改变角质层致密结构而增加其对药物的通透性[27]。
2.3.2 差示扫描热分析方法(DSC) 按“2.2.1”项方法处理小鼠腹部离体皮肤,将处理12 h 的皮肤置于−80 ℃冰箱中预冻1 h,于冷冻干燥机中48 h 进行干燥脱水处理,取4 mg左右干燥后的皮肤样品置于铝坩埚中进行测定,考察FAV 对皮肤角质层相行为的影响。扫描速率为10 ℃/min,加热范围为0~300 ℃。
不同处理组小鼠腹部皮肤DSC结果见图3。可见,PSB 处理的皮肤的相转换温度为78.44 ℃,FAV处理的皮肤的相转换温度为77.70 ℃。相转变温度向较低温度的转变可以作为脂质结构混乱的参数[28],经FAV处理的皮肤的相转变温度降低,说明增加了类脂质组织的流动性,从而使药物和载体更加容易透过角质层。
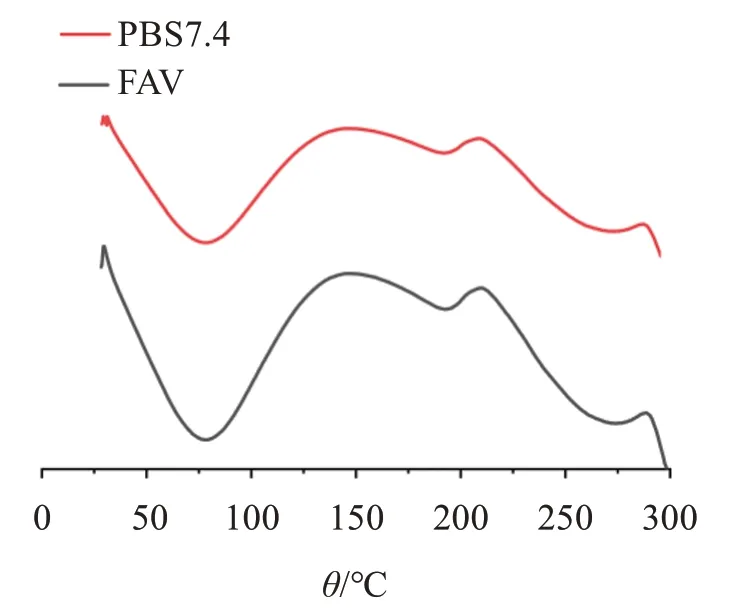
图3 不同处理组小鼠腹部皮肤DSC热谱图Figure 3 DSC thermogram of abdominal skin of mice in dif‐ferent treatment groups
2.4 体内药效学研究
2.4.1 分组及建立模型 小鼠用苦味酸进行编号后,用刮毛刀刮出约2 cm×3 cm 大小皮肤。随机分为模型组、空白组、CP-FAV 组及CP 溶液组,每组8只。除空白组小鼠用等量的白凡士林涂抹外,其余各组小鼠背部每日涂抹62.5 mg 的5%咪喹莫特乳膏,1次/d,连续7 d。造模期间小鼠皮肤起初为境界清楚、形状大小不一的红斑,稍有浸润增厚,后续发展为表面覆盖多层银白色鳞屑,见图4。从造模小鼠皮肤形态看,模型和参考文献基本一致[29−30]。

图4 小鼠造模皮肤皮损状况Figure 4 Conditions of molded skin in mice
2.4.2 银屑病皮损面积及严重程度指数(PASI) 每日观察并拍照记录各组小鼠的皮损变化,参照PASI评分标准。对各组小鼠皮损处红斑、鳞屑及浸润增厚程度进行评分,并根据各自的严重程度分为1~5级,对应0~4分[31],各组小鼠PASI评分见图5。
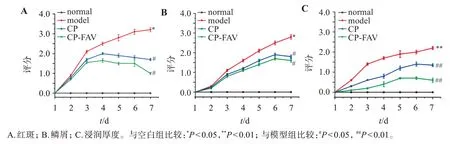
图5 各组小鼠PASI评分Figure 5 The PASI scores of the mice in each group(,n=3)
可见,与正常组相比,模型组小鼠的背部红斑面积扩大(t=−4.580,P<0.05),鳞屑明显增多(t=−3.663,P<0.05),皮肤增厚浸润程度严重(t=−4.571,P<0.01)。经各处方组治疗后的小鼠红斑、鳞屑、皮肤增厚浸润程度均有所下降,其中CP-FAV效果最显著,与模型组相比差异均具有统计学意义(P<0.05 或P<0.01),在实验期间观察到红斑、鳞屑和皮肤增厚强度进展一致,不同治疗组中3 个参数的严重程度降低程度不同。
2.4.3 组织病理学观察 将小鼠脱颈处死后,剪取相对应皮损处组织,固定于10%甲醛中,经脱水、石蜡包埋、切片、HE 染色,光学显微镜下观察皮损组织病理形态并拍照[32],结果见图6。可见,空白组小鼠皮肤组织的表皮层薄,细胞浸润少;模型组小鼠表皮细胞层明显增厚,真皮层可见大量炎性细胞浸润,皮损组织呈银屑病样改变;CP 组和模型组类似,但是表皮增厚、细胞浸润程度等都比模型组轻;CPFAV 组小鼠皮损表皮厚度较模型组降低明显,真皮层炎性细胞浸润明显减少,效果较CP组更明显。
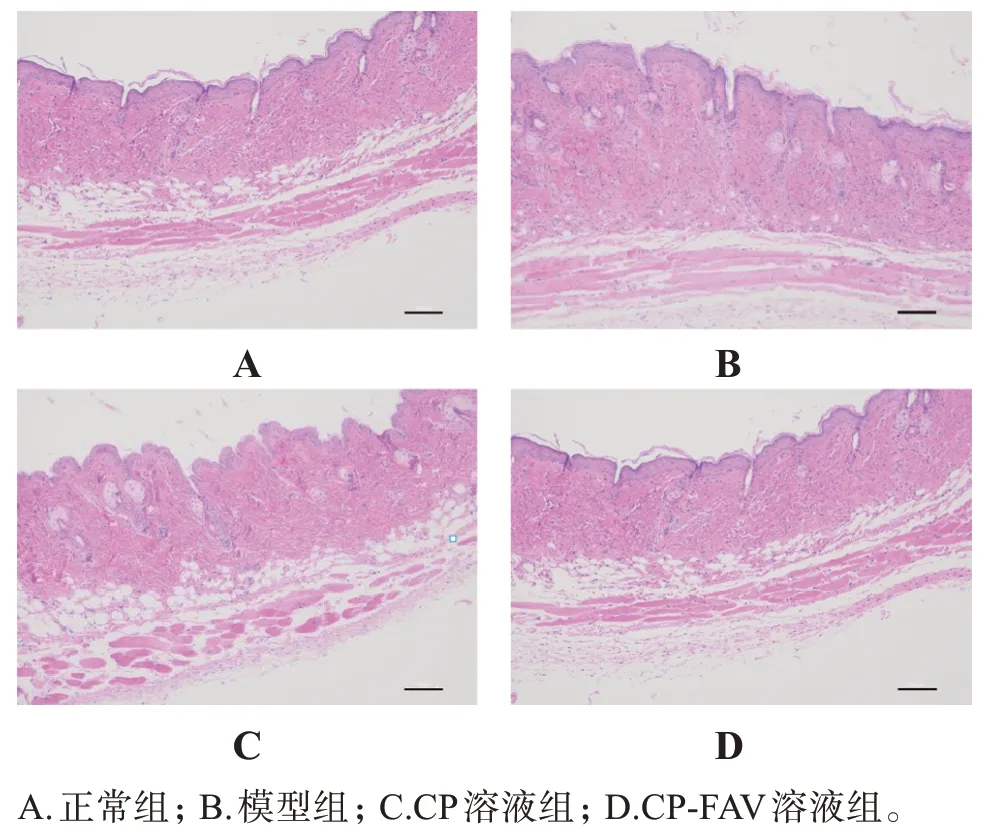
图6 各组小鼠皮肤组织HE染色结果Figure 6 Results of HE staining of skin tissue in each group of mice(×100)
3 讨论
银屑病可见于任何年龄段人群,常反复发作,亚洲成年人发病率约为0.14%[33]。经皮局部治疗最常用激素类药物,但银屑病需长期治疗,为了改善激素类停药后易复发、远期疗效较差等缺点,本课题提出了暂时还没有应用于临床治疗报道的CP-FAV,并进行了体外经皮渗透性和皮肤滞留量实验。从本文研究结果看出,与CP 原料药比较,CP-FAV 可显著增加药物的渗透量,提高皮肤表面的药物滞留量,有利于药物在皮肤内形成药物储库并缓慢释放,并且皮肤中含有大量的脂肪酸还可以作为生物活性物质通过与脂质基质相互作用来降低皮肤扩散阻力的渗透促进剂[34−35],提高了其局部治疗银屑病的功效,较普通溶液可以减少使用次数,降低不良反应。同时,本研究还考察了FAV 对皮肤结构的影响作用,结果显示FAV 并没有对皮肤结构造成破坏,而是提高了角质层的类脂质流动性,促进了药物在皮肤角质层的渗透转移。
咪喹莫特诱导的银屑病样小鼠模型可以全面、稳定地拟生银屑病样临床表征,是一种操作简便且较为理想的评估银屑病药物治疗的实验动物模型。基于银屑病PASI 评分和皮肤组织病理学样本,CPFAV 减少了小鼠皮肤炎症,并对银屑病小鼠有显著的治疗作用。
综上所述,CP-FAV 为银屑病经皮给药提供了新的剂型选择,为以后经皮给药的实际应用提供一定的参考价值和依据。
(本文所有作者声明不存在利益冲突关系。)
