雾水葛总黄酮的提取工艺优化及其对线虫应激能力的影响
2024-02-06吴冬凡李美其王艳
吴冬凡,李美其,王艳
(广东药科大学广东省化妆品工程技术研究中心,广东 广州 510006)
雾水葛为荨麻科植物雾水葛Pouzolzia zeyl‐anica(L.)Benn.的带根全草,为岭南特色药材,具有清热解毒、清肿排脓、利水通淋等功效,主要用于治疗疮疡痈疽、乳痈、风火牙痛、痢疾、腹泻、小便淋痛、白浊、消肿毒排脓[1−2]。
研究表明雾水葛的主要活性成分为黄酮、木脂素、萜类等,且黄酮类化合物大多为黄酮苷类[3−4]。黄酮类化合物在抗感染、抑制肿瘤、保护血管等方面发挥着重要的作用[5−8]。Wang Lujun等[9]用2,2-二苯基-1-苦基肼自由基清除法和铁还原抗氧化法测得总黄酮、酚类具有较好的抗氧化性。
现代医学研究表明,随着年龄增长,体内代谢速度变得缓慢,会产生过量的活性氧(reactive oxygen species,ROS)[10]。而当机体内的ROS 过量时,就会诱导机体发生氧化应激,从而对细胞结构及生物分子功能造成重大损伤,进而直接或间接导致多种疾病的产生[11−12]。因此,研究改善氧化损伤所造成的衰老及衰老疾病的天然抗氧化物,对延缓衰老和预防相关疾病的产生有很大好处[13]。
秀丽隐杆线虫是研究衰老的经典生物模型,具有体型小、寿命短、基因组完全测序,以及含有超过65%的人类疾病相关基因等优点[14]。因此在抗氧化和延缓衰老研究领域具有明显优势,被广泛应用于抗衰老、药物筛选和神经系统疾病等各方面的研究[15]。因为秀丽隐杆线虫在衰老过程中表现出许多和人类高度相似的特征,包括神经退化、运动能力减退和降低免疫力等,因此本试验选用雾水葛总黄酮喂食秀丽隐杆线虫,通过对其寿命、运动能力、应激实验等方面进行研究,探究雾水葛总黄酮的抗衰老作用机理,以期为雾水葛进一步研究与开发利用提供参考。
1 仪器与材料
1.1 仪器
RE52C 旋转蒸发仪(上海亚荣生化仪器厂),THZ-300 恒温培养摇床(上海一恒科学仪器有限公司),WGZ-XT 智能细菌浊度仪(杭州齐威仪器有限公司),AS5150A 超声波清洗机(天津奥特塞恩斯仪器有限公司),TDL80-2B 台式高速离心机(上海安亭科学仪器有限公司),U-3900 紫外可见分光光度计(株式会社日立制作所),SHA-B 恒温水浴摇床(常州澳华仪器有限公司),HPX-9082MBZ 恒温培养箱(上海博迅实业有限公司医疗设备厂),SMZB4连续变倍体视显微镜(重庆奥特光学仪器有限公司),KB-1102G2光照振荡培养箱(匡贝实业上海有限公司),SW-CJ-2FD超净工作台(苏州净化设备有限公司)。
1.2 材料
芦丁对照品(成都埃法生物科技有限公司,批号:153.18.4),野生型秀丽隐杆线虫(N2)于2022 年11月购于厦门大学实验室,大肠杆菌E.coilOP50(山东中科嘉亿生物工程有限公司,ATCC11411),蛋白胨(北京奥特星生物技术有限责任公司),酵母浸膏、MRS 肉汤(广东环凯生物科技有限公司),NGM培养基、培养基添加剂S2229(山东拓普生物工程有限公司),水为蒸馏水,其他试剂均为分析纯。
雾水葛药材于2022 年6 月购于中山市仙逸堂中药饮片有限公司,经广东药科大学中药学院何梦玲副教授鉴定为正品荨麻科植物雾水葛Pouzolzia zeylanica(L.)Benn。
2 方法
2.1 雾水葛总黄酮的含量测定
2.1.1 供试品溶液的制备 药材前处理:将雾水葛全草用万能粉碎机粉碎,过60目筛,混匀,得到雾水葛细粉。分别在2个1 000 mL圆底烧瓶中加入50 g雾水葛细粉,按料液比1∶8 加入400 mL 石油醚,回流1 h,抽滤除去石油醚,滤渣加入400 mL 石油醚,继续回流1 h,抽滤除去石油醚,将2 份滤渣合并混匀,将细粉放入鼓风干燥箱中,于30 ℃挥干石油醚后,收集于干净锥形瓶中密封,备用[16]。
取雾水葛脱脂粉末1.0 g,精密称定,置于锥形瓶中,平行3 份,按料液比1∶8 加入70%(体积分数,下同)乙醇8 mL,在80 ℃、240 W 下,超声提取1 h,提取2次,抽滤,合并滤液。使用旋蒸发仪浓缩回收乙醇,并经4 000 r/min 离心15 min,收集上清液于20 mL容量瓶中,用超纯水定容,制成生药质量浓度为0.05 g/mL的供试品溶液。
2.1.2 芦丁对照品溶液的制备 精密称取芦丁对照品10.8 mg,置于50 mL容量瓶中,加95%乙醇定容,摇匀,即得质量浓度为0.216 mg/mL 的芦丁对照品溶液。
2.1.3 显色反应 参照李晓雪等[17]的方法,分别量取对照品溶液0、2、4、6、8、10 mL 分别置于6 个25 mL容量瓶中,加95%乙醇至10 mL,加5%(质量浓度)NaNO2溶液1 mL,摇匀。放置5 min 后,加10%(质量浓度)Al(NO3)3溶液1 mL,摇匀,放置6 min。加入4%(质量浓度)NaOH 溶液10 mL,加水稀释至刻度线,摇匀,放置15 min显色。
2.1.4 检测波长的确定 分别精密吸取芦丁对照品、供试品溶液各5 mL,按“2.1.3”项下方法进行显色操作,经紫外-可见光分光光度计在400~800 nm的吸收波长范围内进行波长扫描,结果最大吸收波长为507 nm。
2.1.5 标准曲线的绘制 分别精密量取芦丁对照品溶液0、2、4、6、8、10 mL,分别置于6个25 mL容量瓶中,使芦丁的质量浓度分别为0、0.017、0.034、0.051、0.068、0.102 mg/mL,按“2.1.3”项下方法操作。以第1 个容量瓶的溶液为空白对照,在最大吸收波长上测定各质量浓度溶液的吸光度,用空白对照组调零,每组平行操作3次,以质量浓度(ρ)为横坐标,吸光度(A)为纵坐标绘制标准曲线。得回归方程A=12.664ρ+ 0.002 2,r=0.999 8,结果显示,芦丁在0.01~0.05 mg/mL范围内具有较好线性关系。
2.1.6 方法学考察
2.1.6.1 精密度试验 量取芦丁对照品溶液1 mL,置于25 mL容量瓶中,按“2.1.3”项下方法操作,在最大吸收波长507nm 测定A 值,重复操作6 次,结果RSD为1.619%,表明方法精密度良好。
2.1.6.2 稳定性试验 量取供试品溶液2 mL,置于25 mL 容量瓶中,按“2.1.3”项下方法操作,在0、15、30、45、60 min 时,分别在507 nm 测定A 值,结果RSD为2.100%,表明方法稳定性良好。
2.1.6.3 重复性试验 分别量取供试品溶液2 mL 6份,置于6个25 mL 容量瓶中,按“2.1.3”项下方法操作,在507 nm 测定A 值,结果RSD 为0.532%,表明方法重复性良好。
2.1.6.4 加样回收率试验 分别量取供试品溶液2 mL、芦丁对照品溶液1 mL,置于25 mL容量瓶中,摇匀,操作6份。按“2.1.3”项下方法显色,在507 nm测定A 值,代入“2.1.5”项下的标准曲线中,计算回收率,结果RSD值为1.43%,表明方法加样回收率较好,结果见表1。

表1 雾水葛中总黄酮的加样回收率试验结果Table 1 Results of recovery of total flavonoids of Pouzolzia zeylanica(L.)Benn
2.1.7 雾水葛总黄酮提取率的测定 将测得的吸光度代入回归方程,计算出提取液中总黄酮的质量浓度,再根据公式(1)计算出雾水葛总黄酮的提取率。
式(1)中,c为测得的吸光度;b、k为回归方程参数;N为稀释倍数;V为提取液体积,单位为mL;m为样品质量,单位为mg。
2.2 单因素考察
2.2.1 单因素试验方法 按表2所示条件,进行雾水葛总黄酮提取,抽滤,合并滤液。使用旋转蒸发仪浓缩回收乙醇,并以4 000 r/min离心15 min,收集上清液于20 mL容量瓶中,用超纯水定容,制成生药质量浓度为0.05 g/mL的供试品溶液,每个因素水平重复提取3次。按“2.1.3”“2.1.4”项下方法显色、测定,计算总黄酮提取率。

表2 单因素试验因素表Table 2 Single-factor table
单因素考察结果表明,雾水葛中总黄酮的提取率随着乙醇体积分数的升高先升高后降低,在乙醇体积分数为60%时有最大提取量。总黄酮提取率随料液比增加而升高,当料液比增大至1∶32时达最大值,后趋于平缓的趋势。总黄酮提取率随温度增加而升高,当提取温度为60 ℃时,此时总黄酮质提取率达最大值。总黄酮提取率在提取时间为30~50 min 时,随时间增加而升高,在50 min 后总黄酮提取率开始下降。
2.3 正交法优化雾水葛总黄酮提取工艺
2.3.1 正交试验设计 为了更好考察超声法的工艺参数对雾水葛总黄酮提取的影响,根据单因素考察结果,选取提取乙醇体积分数、提取时间、提取温度、料液比为考察因素,以雾水葛总黄酮提取率为指标,设计L9(34)正交实验来确定雾水葛总黄酮的最佳提取工艺,正交实验因素水平表见表3,结果见表4-5。
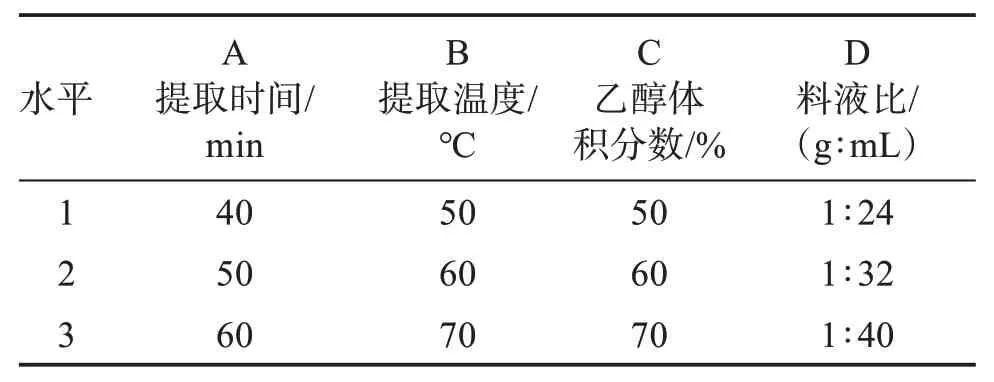
表3 雾水葛总黄酮提取的正交实验因素水平表Table 3 Orthogonal experimental factor level of total flavo‐noids of Pouzolzia zeylanica(L.)Benn
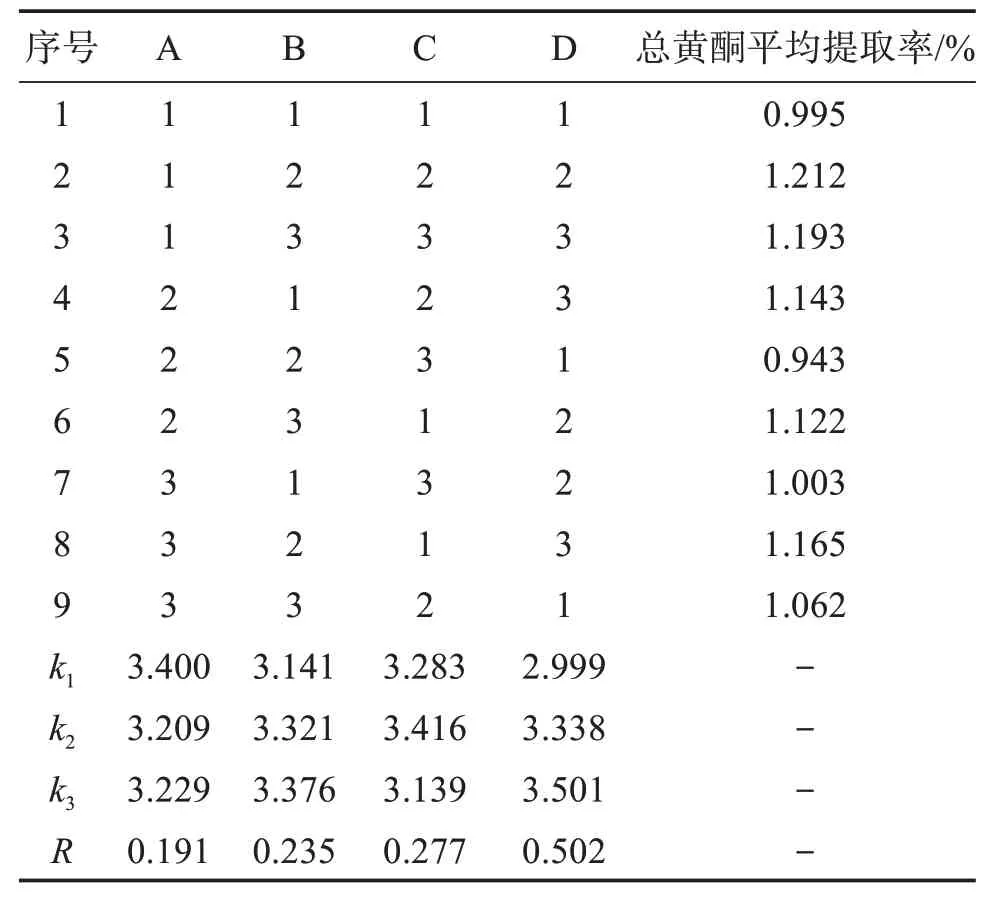
表4 L9(34)正交试验结果Table 4 L9(34)Orthogonal experimental results
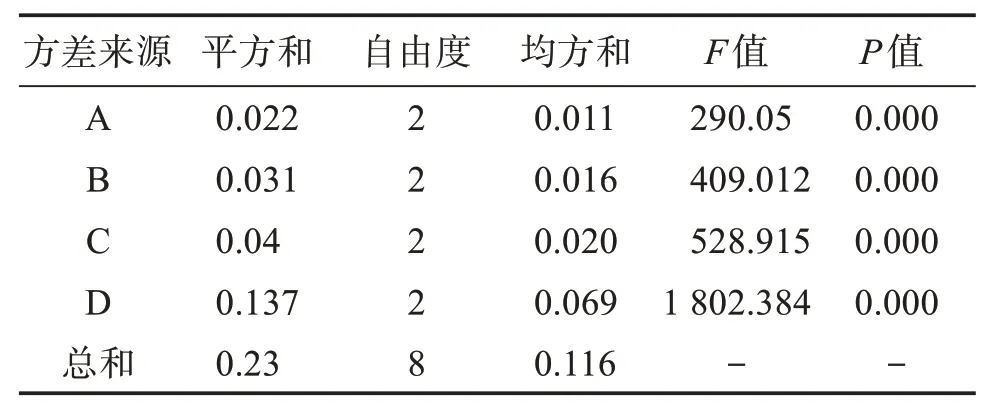
表5 方差分析表Table 5 Variance analysis table
由表可知,雾水葛总黄酮提取率影响因素按大小排序为D>C>B>A,即料液比>乙醇体积分数>提取温度>提取时间。最佳提取工艺参数为A1B3C2D3,即:提取时间为40 min,提取温度为70 ℃,乙醇体积分数为60%,料液比为1∶40 g/mL。
由表4可知,A、B、C、D 4个因素F值均大于F0.01(2,2)=99,说明提取时间、提取温度、乙醇体积分数、料液比这4 个因素对雾水葛总黄酮提取率的影响都有统计学意义(P<0.01),因此选择这4 个因素作为雾水葛总黄酮提取工艺的考察指标合理。
2.3.2 验证试验 称取雾水葛脱脂粉末1.0 g置于锥形瓶中,按料液比1∶40加入70%乙醇,在60 ℃、240 W条件下,超声提取40 min,共2 次,抽滤,合并滤液。使用旋蒸发仪浓缩回收乙醇,并经4 000 r/min 离心15 min,收集上清液于20 mL 容量瓶中,用超纯水定容,制成生药质量浓度为0.05 g/mL 的供试品溶液,重复提取3 次。按“2.1.3”“2.1.4”项下方法显色、测定,计算总黄酮提取率。
结果显示,在最佳提取条件下雾水葛总黄酮提取率可达1.306%,比正交试验中最高提取率相对升高7.76%,RSD=0.63%,表明该提取工艺可靠稳定。
2.4 线虫试验
2.4.1 溶液的配制 NGM培养基:称取NGM培养基2.26 g于三角瓶中,加入超纯水100 mL,加热煮沸至完全溶解,于120 ℃高压灭菌15 min后,将培养基置于60 ℃水浴锅中恒温1 h,加入配套添加剂A 液、B液各1瓶,摇匀,分装于已灭菌培养皿中,冷凝备用。
M9 缓冲液:称量NaCl 5 g、KH2PO43 g、Na2HPO4·12H2O 15.12 g,用超纯水定容至1 000 mL,分装,高压蒸汽灭菌,备用。
线虫冻存液:取甘油与超纯水按体积比1∶1 混合得50 mL,分装到试管,于120 ℃高压灭菌15 min,冷却备用。
裂解液:称量NaOH 4.0 g 溶解于100 mL 超纯水中,与次氯酸钠溶液按体积比1∶1混合均匀,现配现用。
2.4.2 食物大肠杆菌E.coil OP50 的培养 将大肠杆菌E.coil OP50 甘油保种液划板于LB 固体培养基上,置于37 ℃恒温培养箱中,培养24 h,挑取长势较好的单菌落接种于10 mLLB 液体培养基中,置于37 ℃、转速为130 r/min的恒温摇床中,培养10 h,取出,转移至灭菌离心管中,在8 000 r/min 下,离心1 min,倒掉上清液,加入灭菌超纯水重悬,洗涤2次,调整菌液A值至0.4~0.6。
2.4.3 线虫的复苏和保种 将线虫冻存液从−80 ℃冰箱取出,放在4 ℃冷藏室融化。吸取200 μL 线虫冻存液于含OP50 的NGM 培养基(涂布OP50 时,涂布面积要与培养皿留一定的空隙,避免线虫爬上玻璃皿壁而缺水死亡)中,几分钟后就可以看到有线虫开始爬行。复苏培养3 d 后,培养基上会长出大量线虫,通过切块将线虫转移到新的含OP50 的NGM培养基中,进行传代。
用M9 缓冲液4 mL 将同期化或产卵高峰期后培养2 d 的线虫从NGM 培养基冲洗下,收集于灭菌的15 mLEP 管中,于2 000 r/min 离心1 min,弃上清液,再加入M9 缓冲液4 mL 重悬清洗2 次,弃上清液,在沉淀中加入M9 缓冲液1 mL,按1∶1(体积比)加入50%甘油,混匀,分装于2 mL 冻存管中,用封口膜封口。将冻存管放入泡沫箱中,再将箱子放入−80 ℃冰箱冻存,避免速冻导致线虫死亡。
2.4.4 线虫的同期化 用M9 缓冲液2 mL 冲洗处于产卵高峰期的NGM 板,共冲洗2 次并收集于15 mL尖头EP 管中,自然沉降后,弃上清液,继续用M9 缓冲液4 mL 反复冲洗2 次,弃上清液。然后加入M9缓冲液2 mL、裂解液2 mL,振荡3 min,以5 500 r/min 离心30 s,弃上清液。加入M9 缓冲液2 mL 进行重悬清洗,以5 500 r/min离心1 min,弃上清液,重复冲洗2次充分除去裂解液,在沉淀中加入M9缓冲液1 mL,置于20 ℃培养箱中,培养12 h。待卵孵化后,转移至含有OP50 的NGM 培养基中,每个板上分装溶液400 μL,即可得到同期化线虫。
2.4.5 雾水葛提取液对OP50 生长的影响 将大肠杆菌甘油保种液划板于LB 固体培养基上,置于37 ℃恒温培养箱中,培养24 h,挑取长势较好的单菌落接种于10 mL LB液体培养基中,置于37 ℃,转速为130 r/min 的恒温摇床中,培养10 h,取出。将3瓶已灭菌20 mL LB 培养基分为空白组、实验组1、实验组2,在空白组中加入400 μL上述培养好的菌,在实验组1 加入400 μL 上述培养好的菌和800 μL总黄酮质量浓度为0.450 mg/mL 雾水葛的提取液,实验组2 加入400 μL 上述培养好的菌和400 μL 总黄酮质量浓度为0.450 mg/mL 雾水葛的提取液,混匀,吸取2.5 mL在600 nm处测量其吸光度值。余下溶液将瓶口密封放在37 ℃、转速为130 r/min 的恒温摇床中培养。每隔一小时吸取2.5 mL,在600 nm处测量其吸光度值,共6 次,将3 组菌液分别减去初始吸光度值,绘制大肠杆菌生长曲线[18]。见图1。
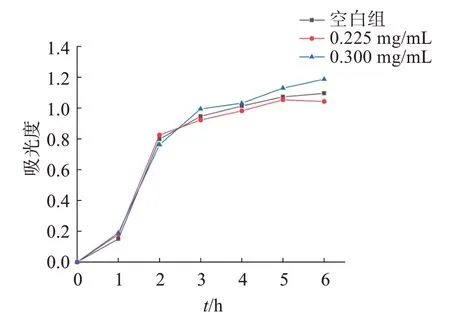
图1 总黄酮提取液对OP50生长的影响Figure 1 The effect of total flavonoid extract on the growth of OP50
由结果可知,雾水葛总黄酮提取物并无明显抑制OP50 生长的情况,在1 h 之后,空白组和实验组的OP50 均进入生长对数期。因此,雾水葛总黄酮提取液不会导致线虫产生热量限制而出现假阳性的情况。
2.4.6 含药培养基的配制 将雾水葛总黄酮提取物过微孔滤膜除菌,用灭菌超纯水将提取液稀释成总黄酮质量浓度为0.450 mg/mL 的提取液,分别与OP50 菌液按体积比1∶2 混合配制成总黄酮质量浓度分别为0.300(实验组1)、0.225 mg/mL(实验组2)的雾水葛总黄酮溶液,吸取400 μL 涂布于NGM 培养基上,即得。
2.4.7 雾水葛总黄酮提取液对线虫运动能力的影响将同期化的线虫培养3 d后,用挑虫器挑取20条线虫至分别含有0 mg/mL、0.225 mg/mL、0.300 mg/mL雾水葛总黄酮提取物的NGM 培养基中,每组3 个板。培养3 d 之后,挑取线虫放在10 μLM9 缓冲液中,观察并记录10 s线虫头部摆动的次数。
结果(见图2)显示,与空白组相比,0.300 mg/mL雾水葛总黄酮增加线虫头的摆动次数有统计学意义(P<0.01);0.225 mg/mL 雾水葛总黄酮能增加线虫头摆动次数,但与空白组相比,差异无统计学意义。0.300 mg/mL 雾水葛总黄酮组与0.225 mg/mL雾水葛总黄酮组相比,差异也具有统计学意义(P<0.05),表明在一定质量浓度范围内增加雾水葛总黄酮给药量能增加线虫头摆动次数。

图2 总黄酮提取液对线虫运动能力的影响Figure 2 The effect of total flavonoid extract on locomotor ability of nematode
2.4.8 H2O2诱导的急性氧化应激试验 将同期化的线虫培养3 d 后,用挑虫器挑取30 条线虫至分别含有0、0.225、0.300 mg/mL 雾水葛总黄酮提取物的NGM 培养基中,每组3个板。培养3 d之后,将各培养基中的线虫重新挑到空白培养基中,然后在各培养基中加入0.2%的30%H202溶液1 mL,开始计时,每隔1 h 计数1 次,挑出死亡线虫并计数,直至线虫全部死亡(丢失、贴壁的线虫为异常数据,不计入死亡统计中),绘制线虫存活时间曲线[19]。结果见表6。

表6 急性氧化应激下不同质量浓度总黄酮提取物对秀丽隐杆线虫寿命的影响Table 6 Effects of total flavonoids extracts with different mass concentrations on the lifespan of cryptomeria elegans under acute oxidative stress
结果表明,在急性H2O2氧化损伤下,与空白组比较,0.300 mg/mL 雾水葛总黄酮能提高线虫的平均寿命、中位寿命及最高寿命,差异有统计学意义,平均寿命延长率达32.28%;0.225 mg/mL 雾水葛总黄酮能提高线虫的平均寿命、中位寿命及最高寿命,但差异无统计学意义。这表明一定质量浓度范围内的雾水葛总黄酮能提高线虫对H2O2的耐受力,从而延长寿命。线虫抗氧化应激生长曲线见图3。
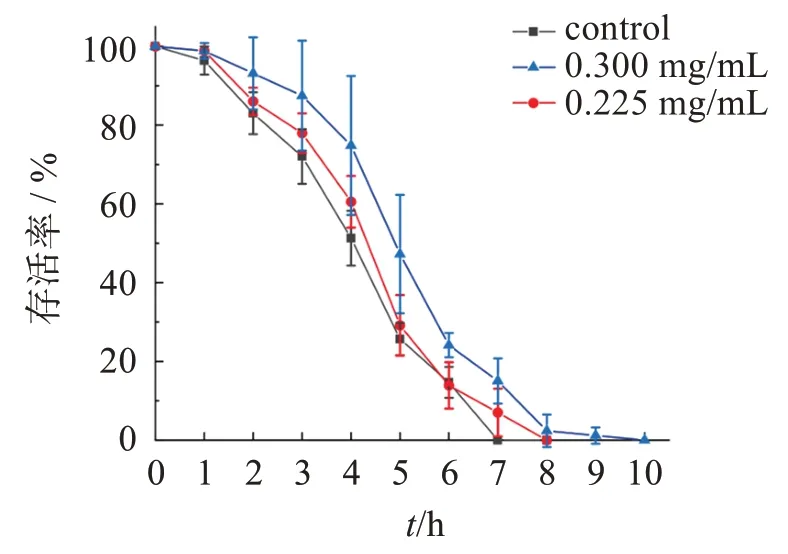
图3 总黄酮提取液抗线虫氧化应激作用的影响Figure 3 The effect of total flavonoid extract on antioxidative stress of nematodes
2.4.9 热应激试验 将同期化的线虫培养3 d 后,用挑虫器挑取30 条线虫至分别含有0、0.225、0.300 mg/mL 雾水葛总黄酮提取物的NGM 培养基中,每组3 个板。培养3 d 之后,将各培养基中的线虫重新挑到空白在培养基中,放置于35 ℃培养箱中进行应激,每隔1 h计数1次,挑出死亡线虫并计数,直至线虫全部死亡(丢失、贴壁的线虫为异常数据,不计入死亡统计中),绘制线虫存活时间曲线。结果见表7、图4。
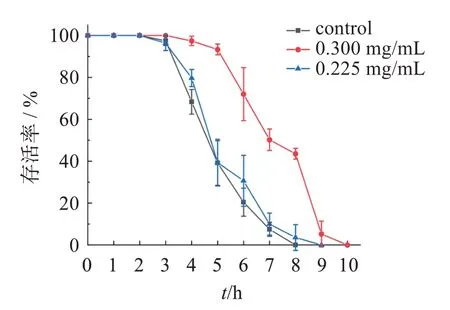
图4 总黄酮提取液抗线虫热应激作用的影响Figure 4 The effect of total flavonoid extract on the heat stress resistance of nematodes
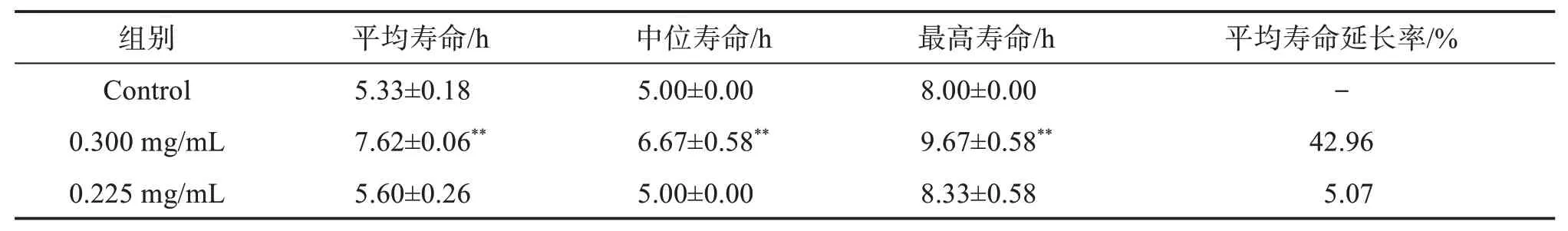
表7 急性热应激下不同质量浓度总黄酮提取物对秀丽隐杆线虫寿命的影响Table 7 Effects of total flavonoids extracts with different mass concentrations on the lifespan of cryptomeria elegans under acute heat stress
由结果可知,在急性热应激损伤下,与空白组比较,0.300 mg/mL雾水葛总黄酮组线虫能增加线虫的平均寿命、中位寿命及最高寿命,差异有统计学意义,平均寿命延长率达42.96%。0.225 mg/mL 雾水葛总黄酮组线虫的平均寿命、中位寿命及最高寿命也高于空白组,但差异无统计学意义,表明雾水葛总黄酮能增强线虫抗热应激的能力,但受剂量影响。
2.5 统计分析
采用SPSS 26.0 软件进行t检验分析,P<0.05 为差异有统计学意义。
3 讨论
在单因素考察试验中,因为雾水葛中的黄酮化合物主要为黄酮苷,水溶性比脂溶性稍好,所以当乙醇体积分数超过60%时,提取液中的成分更多为脂溶性成分,脂溶性成分溶出率提高会影响总黄酮的提取,从而使总黄酮提取率降低。刚开始料液比升高时总黄酮提取率也会升高,可能是因为药材与溶剂之间的浓度差升高,接触面积增大,有利于总黄酮从药材中溶出。当料液比达到1∶32时,药材中的总黄酮基本被提取出来,继续升高料液比可能会导致其他物质的溶出从而抑制总黄酮提取,加之后续抽滤、浓缩的时间也会延长,工作成本升高。雾水葛总黄酮提取率随提取时间、温度升高先升高后降低,因为加热能够促进雾水葛中总黄酮的溶出,提取时间过短,药材中的总黄酮还没有完全溶出,但提取温度过高、时间过长,会导致某些成分被破坏分解,总黄酮提取率下降。
食物减少会出现热量限制,影响胰岛素样生长因子通路的作用,使线虫寿命延长。为避免因雾水葛总黄酮提取物抑制OP50 生长而出现线虫寿命延长的假阳性结果,故将雾水葛总黄酮提取物与OP50混合培养,观察在饲喂雾水葛总黄酮提取液时食物是否达到热量要求。由结果可知,雾水葛总黄酮不会抑制OP50生长。
随着年龄的增长,细胞氧化损伤而引起其抗氧化功能紊乱。氧化应激在衰老相关疾病发作中起着重要作用,抗氧化剂能够减弱或预防衰老所带来的影响[20]。研究发现,黄酮类化合物通过作用于部分信号通路分子调控机体抗氧化[21]。线虫能够调节细胞的抗逆性和新陈代谢,符合衰老的自由基理论,近年来被广泛用作研究氧化应激和衰老的模式生物。随着时间的增长,线虫的弯曲速度会明显变慢,所以运动能力是反映线虫衰老的主要指标之一;通过观察线虫头部一定时间内的摆动次数可以直观判断线虫的衰老程度。本研究结果显示,给药组线虫的头部摆动次数与空白组比较差异有统计学意义,表明雾水葛总黄酮具有一定的抗衰老作用。
