番茄苗期叶位色素含量高光谱检测及可视化研究
2024-02-06赵建贵王国梁赵丽洁王文俊杜慧玲李志伟
赵建贵, 王国梁, 2, 张 宇, 赵丽洁, 陈 宁, 王文俊, 杜慧玲, 李志伟*
1. 山西农业大学农业工程学院, 山西 太谷 030801 2. 山西农业大学谷子研究所, 山西 长治 046000 3. 山西农业大学基础部, 山西 太谷 030801
引 言
在设施番茄栽培过程中, 叶片色素间协同维持植物进行光合作用。 植物叶片对氮素最为敏感, 适宜氮素浓度可促进茎叶生长及色素合成, 有效提升光合速率及有机物转化效率[1]。 同时, 氮素的易转移性导致植物叶位光谱和色素含量形成空间差异。 通过对不同氮素浓度影响下植物叶片的光谱差的观测研究, 既可探索植物最佳氮素浓度, 又可提高叶片色素含量的预测精度。 在色素检测方面主要包括活体叶绿素仪法、 高效液相色谱法、 光声光谱法和紫外分光光度法[2], 这些检测手段虽能准确测定色素含量, 但操作繁琐, 破坏样本, 成本较高。 可见光-近红外光谱分析具有快速、 高效和无损检测等优点, 因此, 近年来采用光谱分析法获取植株叶片色素差异性, 逐渐成为国内外学者的热门研究。
高光谱成像技术具有同时获取图谱信息的优势, 可实现对检测物指标的可视化表达。 赵琨等[3]对不同氮素浓度影响下的油菜叶位及叶点的SPAD值展开研究, 结果表明油菜顶四叶顶部可作为无损检测的最佳叶部。 孙红等[4]对马铃薯开花期不同叶位SPAD值预测, 并绘制了叶位间可视化分布图, 进而反映了叶绿素动态响应关系。 余克强等[5]研究尖椒不同叶位SPAD值和氮素可视化, 较直观反映出不同叶位叶绿素和氮素的分布与变化趋势, 结果表明叶绿素可在一定程度上反映氮含量。 目前, 植株叶片的高光谱反演主要在叶绿素、 氮素和含水率等方面, 且反演部位主要集中于冠层, 而针对不同叶位叶绿素a(chlorophyll a, Chla)、 叶绿素b(chlorophyll b, Chlb)和类胡萝卜素(carotenoid, Caro)的定量化反演及可视化研究较少。
以不同氮素浓度栽培的番茄苗期不同叶位Chla、 Chlb、 叶绿素(chlorophyll, Chll)和Caro为研究指标, 采用竞争自适应加权算法(competitive adaptive reweighted sampling, CARS)和CARS-IRIV(iteratively retains informative variables, 迭代和保留信息变量)算法特征波段提取, 并建立偏最小二乘回归(partial least squares regression, PLSR)预测模型, 采用最优模型将色素定量化反演至不同叶位可视化分布, 旨在探索设施番茄营养液最佳氮素浓度和各项色素定量预测模型及可视化表达, 为设施农业精准化管理提供依据。
1 实验部分
1.1 试验设计及样本采集
于2021年11月12日在山西农业大学农业工程学院科研温室栽培, 从育苗公司购置的“4叶1芯”普罗旺斯品种番茄(LycopersicumesculentumMill.,cv.Provence)幼苗。 营养液采用荷兰温室园艺研究所番茄配方[6]自配水溶肥料, 利用尿素设置10个氮素浓度(氮素浓度范围59.64~605.68 mg·L-1, 步长为60 mg·L-1, 记N20、 N40、 N60、 N80、 N100、 N120、 N140、 N160、 N180、 N200), 每个浓度栽培10株(N200栽培5株), 共95株, 利用“螯合纯钙肥”补充钙离子, 使钙离子浓度保持一致。 本试验对番茄“移栽-开花”(苗期)阶段进行采样, 此时主茎延伸出10—11枝, 将番茄叶片参照图1(a)排列, 其中9—7枝叶片为上叶位(Upper), 6—4枝叶片为中叶位(Middle), 3—1枝叶片为下叶位(Lower)[5]。 番茄枝叶为“单枝多叶”型植物, 同枝节叶片由于营养元素的运输存在一定差异, 采样参照图1(b)部位摘取样本, 从而充分摘取相应叶位样本。 每株按叶位摘取大小均匀和平展的叶片3个样本(6片叶片为一个样本), 依次对样本装入密封袋编号, 共285个样本(1 710片叶片), 置于装有干冰的保温箱储存。
1.2 高光谱成像采集
采用Starter Kit可见光-近红外高光谱(Headwall Photonics, USA)扫描平台[图1(c)]对叶片图像采集, 光谱范围380~1 000 nm, 分辨率0.727 nm, 共856个波段。 由于在量程边缘噪声较大, 因此选取光谱范围430~900 nm, 共646个波段。 系统参数设置: 移动速度2.721 mm·s-1, 推扫行程100 mm, 镜头与叶片表面距离28 cm。 采用去离子水冲洗叶片表面灰尘与杂质, 通过滤纸吸干表面水分, 将每3片叶片平铺于载物台, 通过黑白校正后获取两张高光谱图像(共570张图像)。
采用SpectralView软件二次开发的图像数据批提取和处理软件, 以椭圆模型选取图像ROI, 遵循“从左到右, 从上到下”原则主动提取图像ROI信息, 将每个像素点批输出平均光谱反射率作为后续处理的基础数据集, 见图2。
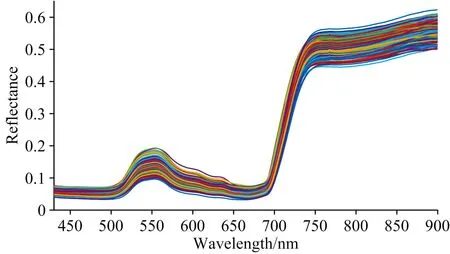
图2 番茄叶片平均光谱曲线
1.3 叶片色素含量测定
对样本采集光谱图像后, 采用分光光度计法测定Chla、 Chlb、 Chll和Caro含量。 将每个样本去除叶脉后剪成约2 mm×2 mm小块, 均匀混合后称取0.2 g, 倒入试管, 采用无水乙醇避光浸提24 h。 将制备好的色素浸提液分别在波长665、 649和470 nm处测定吸光度值, 每个样本重复3次, 具体测量和计算方法按照国家标准进行[7]。
1.4 光谱数据处理及模型建立
采用卷积平滑(Savitzky-Golay, S-G)[8]、 标准正态变量变换(standard normal variate, SNV)[9]和多元散射校正(multiple soattering correction, MSC)[10]消除噪音、 叶片表面散射、 光程变化和组分间干扰引起的多重共线性误差。 采用综合考虑样本光谱特征和理化特性差异的SPXY算法划分数据集[11], 将光谱数据按照3∶1分为训练集和预测集, 其统计结果见表1。 对光谱全波段、 CARS[12]和CARS-IRIV算法提取的特征波段建立PLSR模型。 采用相关系数(R)和均方根误差(RMSE)评价模型的预测性能。
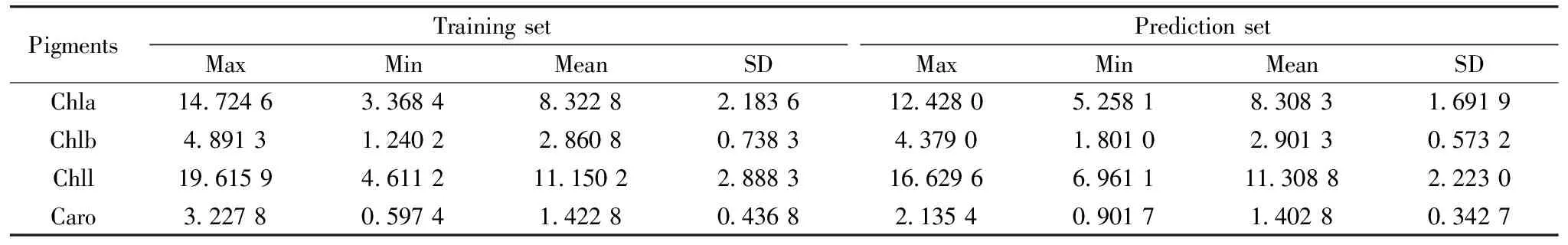
表1 番茄叶片色素数据集统计
2 结果与讨论
2.1 叶片色素含量变化规律分析
不同氮素浓度对番茄叶位色素含量均造成显著差异, 见图3。 当营养液氮素浓度<302.84 mg·L-1时, 随氮素浓度增加, Chla、 Chlb、 Chll和Caro最大增长率分别达到14.29%、 20.75%、 17.45%和17.85%; 当营养液氮素浓度>302.84 mg·L-1时, 随氮素浓度增加, Chla、 Chlb、 Chll和Caro最大下降率分别达到16.35%、 21.74%、 17.78%和27.40%, 因此营养液氮素浓度(N100)为302.84 mg·L-1, 叶片色素含量均达到最大, 即为番茄苗期营养液最佳氮素浓度, 同时高浓度的抑制作用强于低浓度。 随氮素浓度增加, 叶位色素含量均呈上叶位>中叶位>低叶位分布规律, 当叶片上叶位到中叶位时, Chla、 Chlb和Chll含量减少率几乎一致, 达到7.92%左右, 而Caro含量减少率达到13.5%; 当中叶位到下叶位时, Chla、 Chlb、 Chll和Caro含量减少率几乎一致, 达到19.12%左右, 是由于作物光合作用对营养元素的吸收所导致, 表明植株处于生长旺盛阶段。
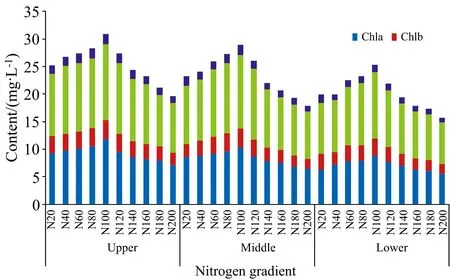
图3 不同氮素浓度对番茄叶片不同叶位影响
2.2 番茄叶片光谱响应特征
叶片色素含量不同, 光谱反射率存在差异。 由图4(a)不同氮素浓度处理下的叶片光谱响应曲线可知: 波长430~500 nm处叶片光谱反射率趋于平缓, 是由于叶绿素和类胡萝卜素强吸收造成; 550 nm附近的波峰是叶绿素强反射区[5]; 650~700 nm处的波谷是叶绿素强吸收区; 700~750 nm处反射率呈陡增趋势, 其斜率与叶片单位面积叶绿素含量有关; 750~900 nm处反射率缓慢增加并有明显波点起伏, 是由于水或氧的吸收造成[3], 符合绿色植物光谱特性。 不同叶位光谱响应曲线见图4(b)。

图4 番茄叶片光谱响应曲线
2.3 特征波段提取
采用CARS算法多次迭代提取特征波段。 图5(a)为特征波段数量的变化, 随着蒙特卡罗随机抽取样本运行次数增加, 提取出的波段均先呈指数减小后逐渐趋于平稳; 图5(b)为交叉验证均方根误差的变化, RMSECV值呈先减后增的变化趋势, 表明在波段提取过程中开始剔除的波段与待测成分无相关性, 之后在波段子集中增加与待测成分无关的波段; 图5(c)为波段回归系数路径变化, 在星号标注处更多的保留了有效波段, 此时RMSECV达到最小值, 即当RMSECV最小时, 提取的波段即为最优波段集合, Chla、 Chlb、 Chll和Caro分别提取10、 14、 14和19条特征波段, 见表2。

表2 CARS和CARS-IRIV算法特征波段提取

图5 CARS算法特征波段提取
经CARS算法特征波段提取结果显示, 各项色素指标均筛选出相邻波段。 针对该状况, 采用IRIV[13]算法对CARS算法提取的波段验证重要性, 通过对强弱信息波段组逆向消除“精”提取获得最优波段集合, Chla、 Chlb、 Chll和Caro分别提取4、 4、 10和11条特征波段, 有效减少了波段数量并更多的保留有效信息, 见表2。 本研究迭取到的Chla、 Chlb、 Chll和Caro特征波段与文献[14]一致, 由于Chla、 Chlb、 Chll和Caro的分子结构和组成不同, 在可见光光谱区域对光的吸收具有一定选择性[15], 其Chla与Chlb特征波段主要集中于可见光光谱区域, 在400~460和630~680 nm有两个强吸收区; Chll和Caro特征波段在可见光与近红外区域均有, 其中Chll在400~460 nm是强吸收区, Caro在400~500 nm是强吸收区。 值得注意的是, Chla、 Chlb、 Chll和Caro有重叠波段选中, 在可见光区域是由于受到生色基团的作用, Chla、 Chll和Caro在近红外区域主要是受到叶片内部OH键和O2的作用。
2.4 模型建立与分析
以光谱全波段(Whole)、 CARS和CARS-IRIV算法提取的特征波段建立PLSR预测模型, 见表3。 各项色素指标基于CARS-IRIV-PLSR预测模型结果均优于Whole-PLSR和CARS-PLSR, 即Chla、 Chlb、 Chll和Caro的Rp分别达到0.772 2、 0.732 1、 0.847 1和0.858 7, 结果表明以“粗-精”特征波段筛选策略的CARS-IRIV算法可以尽可能地剔除相关性较弱变量, 以提高模型预测精度。

表3 基于全谱和特征波段的PLSR模型预测结果
2.5 叶片色素含量可视化分布
采用CARS-IRIV-PLSR分别建立Chla、 Chlb、 Chll和Caro回归模型, 利用ENVI5.1处理将相应波段叠加用于计算各像素点的色素含量, 结合伪彩图反演到叶片图像获得含量可视化分布图。 以最佳氮素浓度(N100)栽培的叶片展示色素分布, 色素含量范围为0~20 mg·L-1, 见图6, 图中数字标注是相应叶片色素含量预测值。 结果表明Chla、 Chlb和Chll含量由叶片底部向顶部和叶脉向叶边逐步减少, 而Caro则相反, 是由于叶片中Chll仅存在于叶绿体类囊体薄膜[16], 且Chla与Chlb等色素构成Chll, 营养物质经叶脉向叶片运输, 致使三者在叶片分布基本一致, 其分布规律与植物营养运输机制一致, 在含量表达上存在差异; 而Caro存在于叶绿体类囊体薄膜和液泡[17], 番茄苗期正处于发育旺盛期, 光合作用促使叶片Chll较活跃且含量高, 而Caro主要作用于叶片颜色且含量低, 导致Caro被Chll所遮盖[17], 致使Chll与Caro在叶片分布相反, 且含量分布存在较大差异; 该分布规律也解释了叶片衰老后叶边率先变黄, 符合绿色植株生理特性。 叶位间色素含量呈上叶位>中叶位>低叶位分布, 是由于作物的光合作用对营养元素的吸收所导致, 与测定结果相一致。 因此, 通过色素可视化表达可直观反映叶片中色素含量分布。

图6 不同叶位色素含量可视化分布
3 结 论
检测番茄苗期叶片Chla、 Chlb、 Chll和Caro含量, 采用可见光-近红外高光谱成像技术对色素含量进行模型预测, 进而便于实现色素可视化表达, 主要结论如下:
(1)营养液氮素浓度为302.84 mg·L-1, 叶片色素含量最大, 叶位色素含量呈上叶位>中叶位>下叶位分布规律, 可为设施农业水肥氮素浓度定量化管理提供数据支撑;
(2)采用CARS-IRIV-PLSR建立番茄叶片各项色素指标预测模型均达到较好效果, 该“粗-精”的特征波段优选策略, 有效减少波段并保留有效信息, 提高了模型预测精度;
(3)结合CARS-IRIV-PLSR模型与高光谱成像技术有效对番茄叶片色素可视化, 有助于对设施农业植物生长状况、 色素含量及养分亏缺无损监测。
