灵菊七蛋白提取及其降糖活性研究
2024-02-05程源航苏泽宇
马 科,程源航,苏泽宇
(郑州轻工业大学 烟草科学与工程学院,河南 郑州 450008)
随着人们回归自然和食疗观念的兴起,糖尿病专属特医食品、功能食品、药膳等的开发和利用得到了人们的认可和重视[1-5].利用这些新型食品辅助药物治疗,改善糖尿病与并发症、减少病人对药物的依赖,被认为是一种更安全可靠的糖尿病治疗新方式.
灵菊七(Gynuramedica.Y.K.Yang)是我国学者发现并鉴定的菊三七属新种[6],民间取其茎叶食用,对糖尿病显示独特疗效.自被发现鉴定以来仅有我国学者对灵菊七降糖作用进行研究.刘莹等[7-8]首次报道了灵菊七降糖和急性毒研究,证明其有较好降糖功效,且无毒性、安全性高.相关学者通过动物模型(包括链脲佐菌素诱导、高糖高脂饮食诱导、肾上腺素诱导、遗传性等糖尿病模型)、细胞模型(MIN6 胰岛细胞)验证了灵菊七水提物具有确切的降糖作用.并且通过安全性研究证明,与同属其他植物相比,其无毒性,安全性高,具有巨大的抗糖尿病药食产品开发潜力[9-13].
α-淀粉酶和α-葡萄糖苷酶抑制活性成分是2种重要的降糖活性成分[14-16],目前还没有该植物中关于这两类降糖活性成分的研究报道.为了阐明灵菊七降糖活性成分,本文从提取溶剂、加热方式、提取时间、提取温度、料液比5个方面对灵菊七活性蛋白提取工艺进行研究,并检测不同方法获得的提取物对α-淀粉酶和α-葡萄糖苷酶的抑制作用.通过以上研究,期望为灵菊七降糖药食产品的开发提供理论依据.
1 材料与方法
1.1 材料与试剂
灵菊七茎叶样品:郑州万田生物科技公司提供,经河南中医药大学药学院生药教研室鉴定为菊科植物灵菊七(Gynuramedica.Y.K.Yang)的干燥茎叶;DNS试剂、蛋白检测试剂盒、α-淀粉酶、α-葡萄糖苷酶:生工生物工程(上海)有限公司;石油醚、磷酸二氢钾、磷酸氢二钠、氯化钠、氯化钾、吐温20、吐温80、十二烷基磺酸钠(SDS)、可溶性淀粉、阿卡波糖、芸豆蛋白提取物、对硝基苯基-α-D-吡喃葡萄糖苷、二甲基亚砜:上海麦克林生化科技有限公司.
1.2 仪器与设备
DF-101S 水浴锅:巩义于华仪器公司;红外辐射式烘箱:上海一恒科学仪器公司;超声波提取器BCT-10L:上海利闻科学仪器有限公司;超声波恒温水浴提取器SCQ-HD300A:上海声彦超声波仪器有限公司;家用型微波炉:中国美的科技有限公司;紫外分光光度计UV-1800PC:梅特勒托利多科技(中国)有限公司;RE-100-S旋转蒸发仪:德拉布科技有限公司;冷冻干燥机BILON-FD80AD:上海比朗仪器制造有限公司.
1.3 实验方法
1.3.1 灵菊七样品前处理
取 200 g 干燥的灵菊七根茎,粉碎过0.077 mm筛,加入20倍体积的I类石油醚,50 ℃ 下浸提 2 h,过滤后的到除去油脂的灵菊七残渣,将残渣在 40 ℃ 烘箱内干燥除去石油醚.得到干燥的灵菊七样品备用.
1.3.2 灵菊七蛋白提取工艺研究
1) 提取溶剂
选取磷酸缓冲盐溶液(PBS)、水、3%吐温20、3%吐温80、5%SDS作为提取溶剂,提取条件为料液比30∶1、提取温度 60 ℃、提取时间 3 h.根据蛋白提取率来判断出最适的提取溶剂.
2) 提取方式
红外辐射加热法 将样品置于红外辐射式烘箱,在温度 50 ℃ 下提取 30 min.
微波加热法 将样品置于微波炉中,在设置为中温档下提取 5 min.
恒温水浴加热法 将样品置于水浴锅中,在 50 ℃ 条件下水浴提取 30 min.
超声提取法 将样品置于超声波恒温水浴,功率 100 W、室温条件下超声 30 min.
超声辅助水浴加热法 将样品置于超声波恒温水浴,在设置功率 100 W、50 ℃ 条件下超声水浴 30 min.其它条件与1)一致.
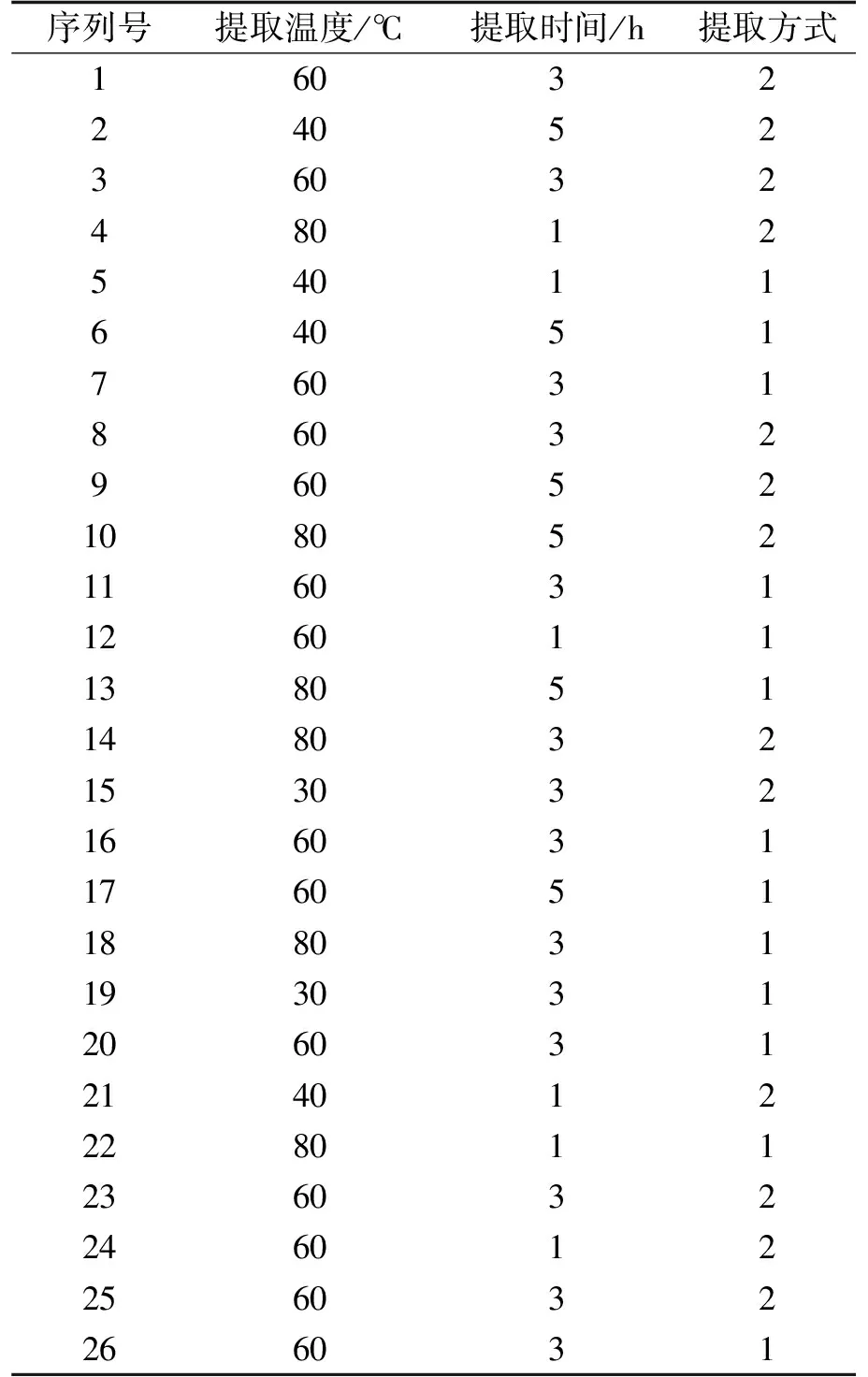
表1 3因素4水平的 BoxBehnken 试验设计(BBD)
1.3.3 灵菊七蛋白提取单因素
料液比 选取10∶1、20∶1、30∶1、40∶1、50∶1 5种料液比.其它条件与1)一致.
提取温度 选取50、60、70、80和 90 ℃ 5个梯度.其它条件与1)一致.
提取时间 选取3、4、5、6和 7 h 5个梯度.其它条件与1)一致.
1.3.4 响应面实验
本实验以提取时间、提取温度作为连续因子,提取方式作为类别因子,采用3因素4水平的BoxBehnken试验设计(BBD)(表 1),对提取温度(30、40、60、80 ℃);提取时间(1、3、5 h)和加热方式(1水浴、2超声水浴)进行优化.
1.3.5 灵菊七蛋白质测定方法
1) 蛋白标准曲线的绘制 以牛血清蛋白(BSA)为标准蛋白绘制标准曲线,准确称取 1 mg 牛血清蛋白溶于 50 mL 蒸馏水中,即 10 mg/mL 原液,将原液梯度稀释为1、2、3、4、5 mg/mL.测定方法参照BCA蛋白试剂盒检测,取适量的A液和B液按照50∶1体积比充分混匀,配置适量BCA工作液,取 20 μL 标准蛋白和 200 μL BCA工作液混匀后,在 37 ℃ 条件下温水浴 1 h 后于波长 595 nm 下检测吸光度.通过Origin绘制蛋白含量标准曲线.
2) 样品测定 根据相关文献[19]报道,提取结束后,对提取液抽滤,取 20 μL 上清液,加入 200 μL BCA工作液,在 37 ℃ 条件下温水浴 1 h 后于波长 595 nm 下检测吸光度,考虑到灵菊七浸提液颜色较重,以不加显色剂的浸提液为空白对照组排除干扰.将样品组吸光度减去空白对照组吸光度后,带入到上述蛋白含量标准曲线中计算出蛋白浓度.
1.3.6 灵菊七浸提液对α-淀粉酶抑制率测定方法
将 0.5 g 可溶性淀粉溶解到 100 mL 去离子水中,配置成 0.5 g/mL 溶液,并在 100 ℃ 条件下让淀粉充分溶解,待到溶液澄清后,室温冷却降温待用;取 0.05 gα-淀粉酶加入到 50 mL 磷酸盐缓冲溶液中,充分溶解,配置成 0.05 g/50 mL 酶溶液,将 50 μL 酶液与 50 μL 分离组分在 40 ℃ 条件下相互作用 1 h,取 100 μL 混合液加入到 1 mL 淀粉溶液中,混匀后于 40 ℃ 恒温反应 15 min,取 100 μL 反应液加入 200 μL 的DNS试剂,反应液于沸水浴中加热 5 min 后取出,并于冰水浴中迅速冷却,取出 100 μL 加入 900 μL 水稀释,于波长 540 nm 处测定吸光度.按下式计算:

(1)
式中,A样品为样品反应液吸光度;A空白为以磷酸盐缓冲液代替酶的吸光度;A对照为以磷酸盐缓冲液代替样品的吸光度.
1.3.7 灵菊七浸提液对α-糖苷酶抑制率测定方法
将 10 mg 对硝基苯基-α-D-吡喃葡萄糖苷溶于 100 μL 二甲基亚砜中,取 10 μL 上述溶液溶解在 990 μL 磷酸缓冲盐溶液(0.1 mol/L,pH 6.8)中.取α-糖苷酶稀释为0.4单位/mL.取 80 μL 酶液和灵菊七浸提液混合在 37 ℃ 条件下预培养 15 min,添加 40 μL 底物开始酶促反应,进一步温育 30 min.通过加入 1 mL 0.1 mol/L 的碳酸钠中止酶活,在 405 nm 下测定吸光度.
1.4 浸提液的冻干、复溶与纯化
将 1 L 浸提液放 -20 ℃ 冷冻 10 h,然后将样品置冷冻干燥机中冷冻干燥,获得冻干物.
取冻干物加入到 10 mL 超纯水中溶解.依次加质量分数为20%、40%、60%的硫酸铵,使溶液产生沉淀,沉淀离心并冷冻干燥,获得冻干物.
1.5 数据处理与分析
本次试验中α-葡萄糖苷酶和α-淀粉酶抑制率数据均重复6次,结果表示均以实验数据的平均值±标准偏差的形式呈现.采用Design-Expert 8.0.6、Minitab进行数据处理;采用Origin 2021 进行图表绘制.
2 结果与讨论
2.1 提取方法对灵菊七蛋白提取的影响
加热为活性蛋白从植物细胞内扩散到胞外提供能量,促进蛋白的浸出,增加溶出速率和浸出率,并且不同加热方式对提取的影响不同[17].本文研究了烘箱、微波、水浴、超声、超声水浴5种加热方式对提取的影响,结果如图1A所示,超声辅助水浴和烘箱的蛋白提取率高于其它.因为在超声的过程中超声产生的空压可以破坏植物细胞膜,利于胞内溶质扩散,从而导致更多的活性蛋白从植物细胞中释放出来[18];烘箱加热法通过红外线辐射加热使细胞内部的水分快速气化导致细胞破裂,从而促使蛋白从细胞内释放出来[19],但是对温度需求较高,容易破坏蛋白的结果而导致其失去活性,因此超声辅助水浴是最适的加热方式.
提取溶剂作为蛋白的溶出的媒介对蛋白提取影响较大,不同溶剂对蛋白的溶解能力不同,提取效果差异较大[20].本文研究了磷酸缓冲盐溶液(PBS)、水、3%吐温20、3%吐温80、5%SDS 5种溶剂对灵菊七蛋白的提取率的影响.结果如图1B所示,吐温80提取灵菊七蛋白效率最高,其次为PBS.这是由于吐温80作为表明活性剂,使细胞表面张力增大,蛋白更易从细胞中释放出来[21],但是吐温80提取物颜色较深,表明含有较多杂质,且考虑到PBS对与活性蛋白有保护作用,因此选用PBS作为最适的提取溶剂.
2.2灵菊七蛋白提取单因素研究
结果如图2A所示,随着料液比的增大蛋白提取率逐步增大,料液比达到30∶1、40∶1、50∶1后,蛋白提取率缓慢增长,因此选择30∶1的料液比对最为合适.
如图2B所示,40~60 ℃ 时候随着温度的增加,蛋白提取率增加,因为温度增加时,有利于蛋白质分子和水分子的运动,增加其溶解度,60 ℃ 以后随着温度的增加蛋白提取率在降低,高温导致蛋白质结构发生改变,蛋白内部的非极性基团暴漏到表面,减少了蛋白的溶解度,随着温度的升高,对于蛋白质活性的破坏程度也在不断提升,很可能影响灵菊七浸提液对与α-淀粉酶与α-葡萄糖苷酶活性的影响,因此50~60 ℃ 为最适的提取温度.
结果如图2C所示,在1~3 h 内灵菊七蛋白的提取率随着时间的增加明显升高,3 h 后蛋白提取率增加不明显,考虑到过长时间在高温水浴条件下对蛋白活性的影响,因此选择 3 h 作为最适的提取时间.
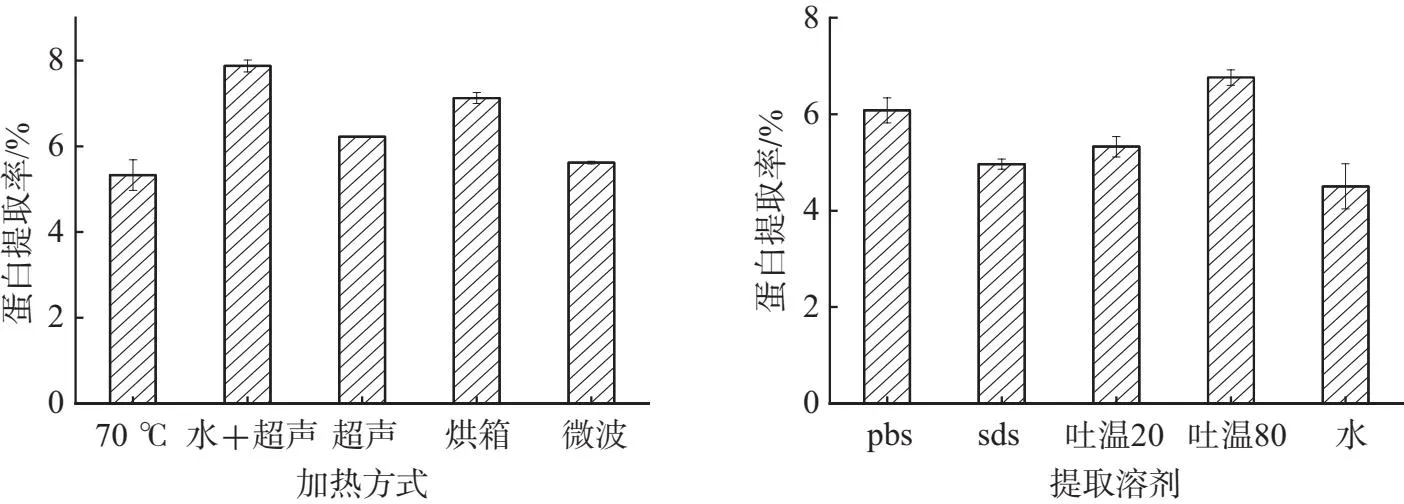
(A)加热方法对灵菊七蛋白提取的影响 (B)提取溶剂对灵菊七蛋白提取的影响图1 提取方法对灵菊七蛋白提取率的影响
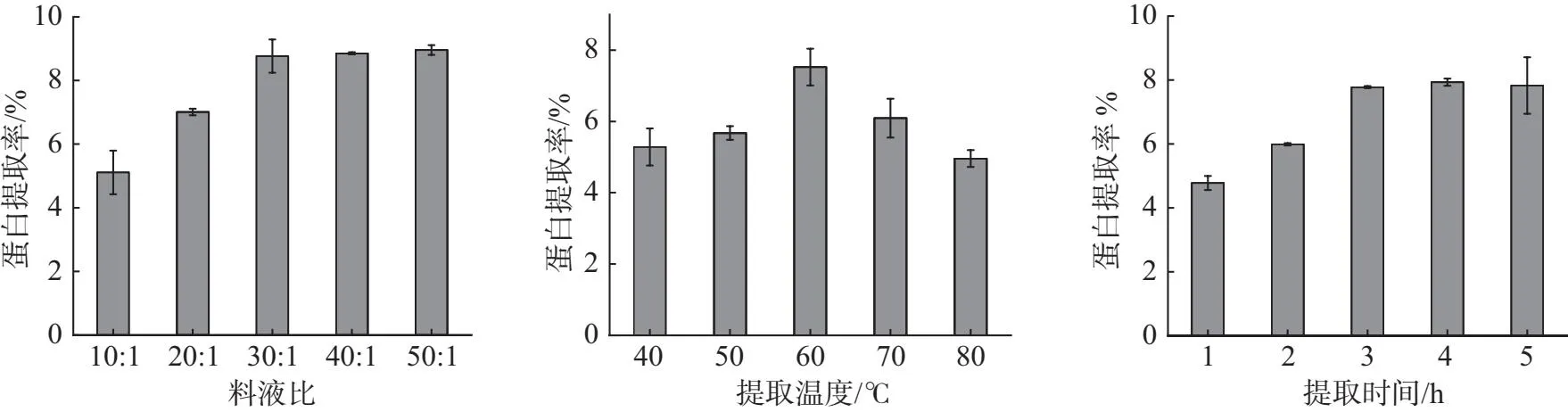
(A)不同料液比对灵菊七蛋白 (B)不同提取温度对于灵菊七蛋白 (C)不同提取时间对灵菊七蛋白 提取率的影响 提取率的影响 提取率的影响图2 提取条件单因素研究
2.3 响应面实验
本文选取提取时间、提取温度作为连续因子,提取方式作为类别因子,以总蛋白提取率和浸提液分别对α-淀粉酶和α-葡萄糖苷酶抑制率作为结果,做了3组响应面实验.
2.3.1 总蛋白提取率
由表2可知,通过Minitab软件对统计结果进行方差分析,模型p值<0.001,模型极显著,失拟项p值0.609>0.05,模型的失拟项不显著,表明该模型具有统计学意义.回归分析结果显示,在蛋白提取过程中的影响因素中,A2项极显著,A、C项显著,说明提取温度、提取方式对灵菊七蛋白提取率有显著影响.各因素对蛋白提取率的影响程度A>C>B, 运用Minitab软件进行分析,得到二次多项式回归方程:
蛋白提取率C1=-15.97+0.773 9A+1.800B-0.005 900A2-0.112 0B2-0.015 66AB
蛋白提取率C2=-17.27+0.796 1A+1.469B-0.005 900A2-0.112 0B2-0.015 66AB
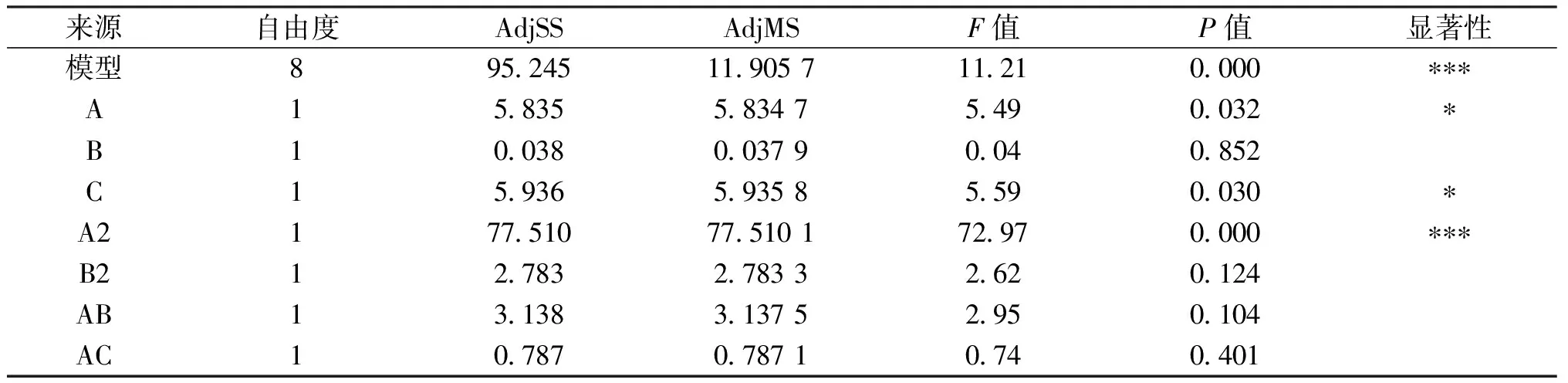
表2 蛋白提取率回归分析
续表2
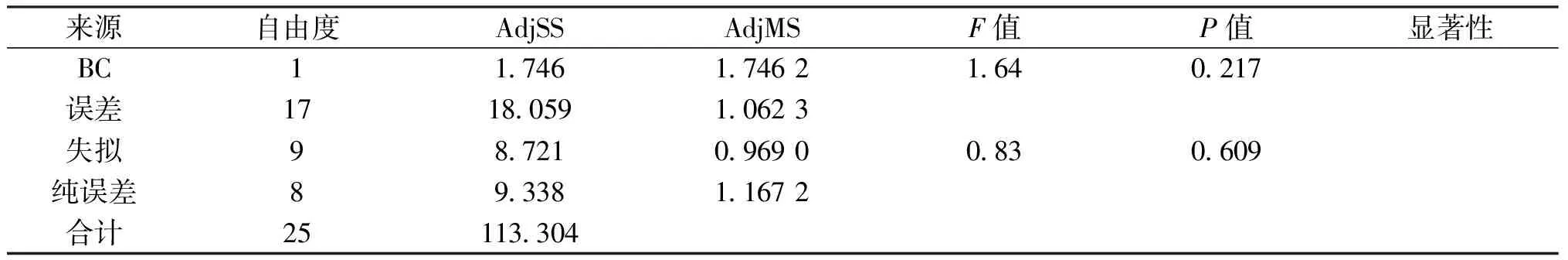
由图3可以得出,提取时间和提取温度交互面的坡面较为陡峭,等高线呈现椭圆形,交互作用明显,与方差分析结果一致.图3a和图3b对比得出,相对与水浴提取法而言,超声辅助热提取法蛋白的最大提取率从10.2%提高到了10.9%,有一定地提升效果.经Minitab软件进一步优化,最终得到灵菊七蛋白的最适提取条件为:超声辅助热提取法、提取温度 62 ℃、提取时间 3 h、料液比1∶30、提取溶剂PBS,灵菊七蛋白的最大提取率可达到10.8%.
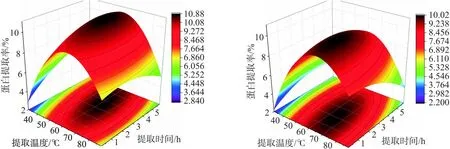
(a) (b)图3 蛋白提取率响应面曲线
2.3.2α-淀粉酶抑制率
由表3可知,通过Minitab软件对统计结果进行方差分析,模型p值<0.05,模型显著,失拟项p值0.954>0.05,模型的失拟项不显著,表明该模型具有统计学意义.回归分析结果显示,在蛋白提取过程中的因素中,A2,A项显著,说明提取温度对灵菊七浸提液对α-淀粉酶抑制率有显著影响.各因素对蛋白提取率的影响程度A>B>C, 运用Minitab软件进行分析,得到二次多项式回归方程:
α-淀粉酶抑制率C1=-30.4+1.664A+0.51B-0.0159 7A2+0.498B2-0.003 5AB
α-淀粉酶抑制率C2=-24.9+1.644A-1.56B-0.015 97A2+0.498B2-0.003 5AB

表3 浸提液对α-淀粉酶抑制率回归分析
由图4可以得出,提取时间和提取温度交互等高线不是椭圆形,两者交互作用不明显,提取时间等高线更为陡峭,该条件对灵菊七对α-淀粉酶抑制率作用更大,与回归分析结果一致.由图4a和图4b对比得出,超声辅助热提取法相对于热提取法,抑制率从24.20%提升到了31.80%,提升非常明显,经Minitab软件进一步优化,得出灵菊七浸提液对α-淀粉酶抑制最适提取条件:超声辅助热提取法、提取温度 59 ℃、提取时间 3 h、料液比1∶30、提取溶剂PBS,灵菊七浸提液对α-淀粉酶的最大抑制率达到31.8%.
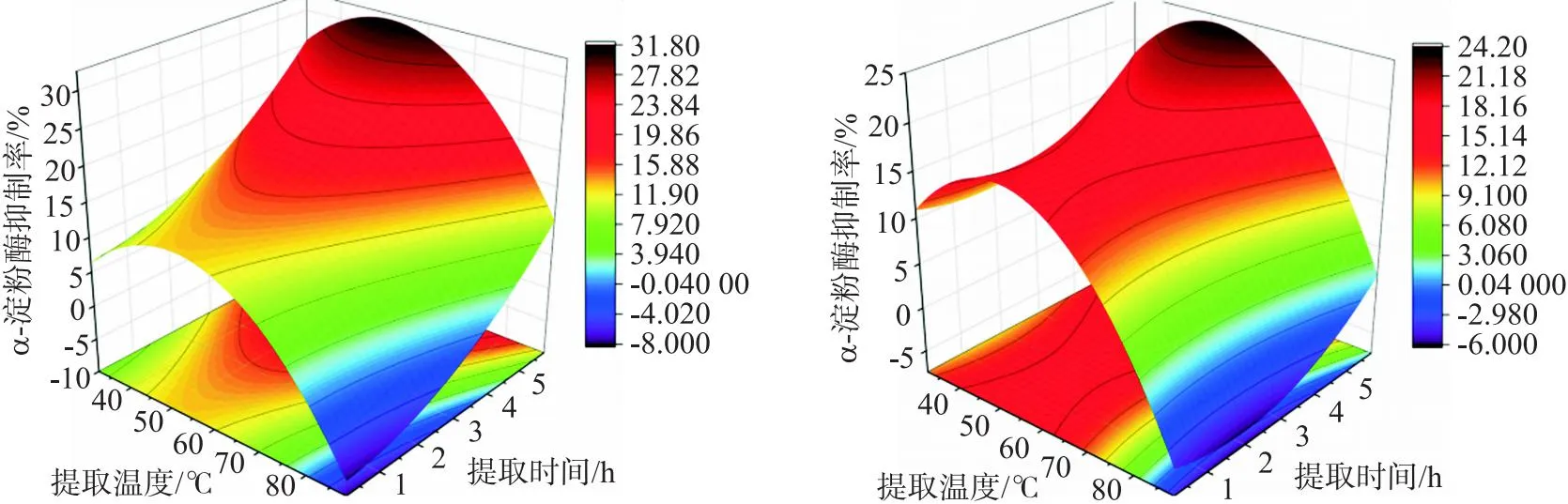
(a) (b)图4 α-淀粉酶抑制率响应面
2.3.3α-葡萄糖苷酶抑制率
由表4可知,通过Minitab软件对统计结果进行方差分析,模型p值<0.05,模型显著,失拟项p值0.853>0.05,模型的失拟项不显著,表明该模型具有统计学意义.回归分析结果显示,在蛋白提取过程中的因素中,B项显著,说明提取时间对灵菊七浸提液对α-淀粉酶抑制率有显著影响.各因素对蛋白提取率的影响程度B>A>C, 运用Minitab软件进行分析,得到二次多项式回归方程:
蛋白提取率C=-4.2+0.484A-2.15B-0.004 69A2+0.526B2
表4 浸提液对α-糖苷酶抑制率回归分析
由图5可以得出,提取时间和提取温度交互等高线不是椭圆形,两者交互作用不明显,提取温度等高线更为陡峭,该条件对灵菊七浸提液对α-糖苷酶抑制率作用更大,与回归分析结果一致.经Minitab软件进一步优化,得出灵菊七浸提液对α-糖苷酶抑制最适提取条件:超声辅助热提取法、提取温度 52 ℃、提取时间 5 h、料液比1∶30、提取溶剂PBS,灵菊七浸提液对α-淀粉酶的最大抑制率达到13.60%.
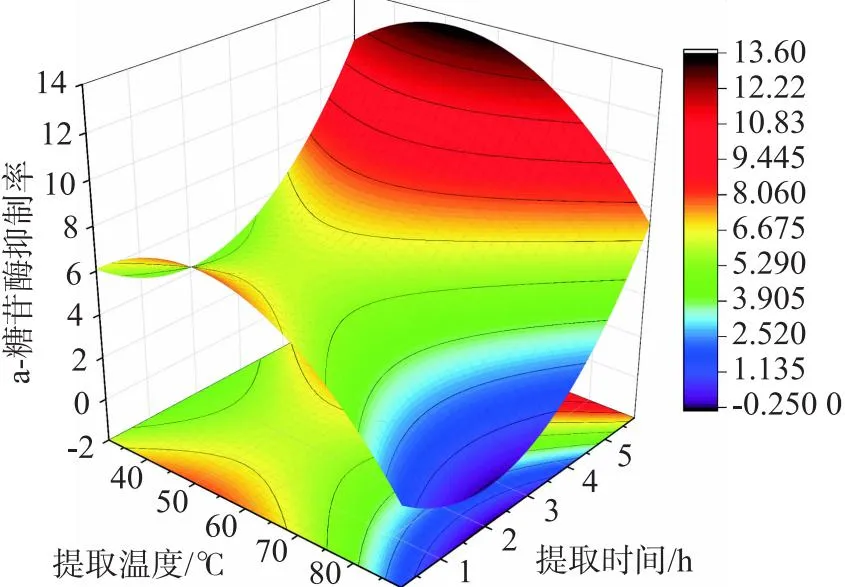
图5 α-葡萄糖苷酶抑制率响应面
2.4 提取液蛋白含量、纯度检测及其α-淀粉酶和α-葡萄糖苷酶抑制活性分析
上述研究通过以提取时间、提取温度作为连续因子,提取方式作为类别因子,采用3因素4水平的BoxBehnken试验设计(BBD),获得了26组不同提取工艺的灵菊七蛋白提取液蛋白含量,并检测了其α-淀粉酶和α-葡萄糖苷酶抑制活性.通过蛋白含量与其对酶的抑制活性相关性分析研究(图5),可以发现灵菊七蛋白浸提液对α-淀粉酶抑制率随着蛋白含量的增加而升高,即提取液蛋白含量与α-淀粉酶抑制率呈正相关,而与α-葡萄糖苷酶抑制率关系不大.另外,进一步对蛋白含量最高、抑制率最大的提取液样品中蛋白含量和纯度进行了研究.结果表明,1 L 该提取液蛋白含量为 20.8 mg,提取液冻干物质量为 80.3 mg,蛋白纯度为25.9%.为了进一步排除干扰,对浸提液冻干物进行复溶,然后依次加质量分数为20%、40%、60%的硫酸铵,其中加40%和60%硫酸铵获得沉淀,分别离心并冷冻干燥后分别获得16.1和 4.2 mg 冻干物.最后2种冻干物配置成 100 mg/L 的溶液并检测α-淀粉酶和α-葡萄糖苷酶抑制活性,其中,40%硫酸铵沉淀物的α-淀粉酶抑制率最大,可达90.2%,2种冻干物对α-葡萄糖苷酶抑制作用很微弱,仅1.8%和1.1%.综上所述,可以推断灵菊七PBS浸提液中含有对α-淀粉酶具有较好抑制作用的活性蛋白.通过文献调研,可以发现已有关于灵菊七同属植物降糖活性成分的研究主要集中在小分子天然产物上,对于具有α-淀粉酶抑制活性的蛋白和多肽还没有研究报道.
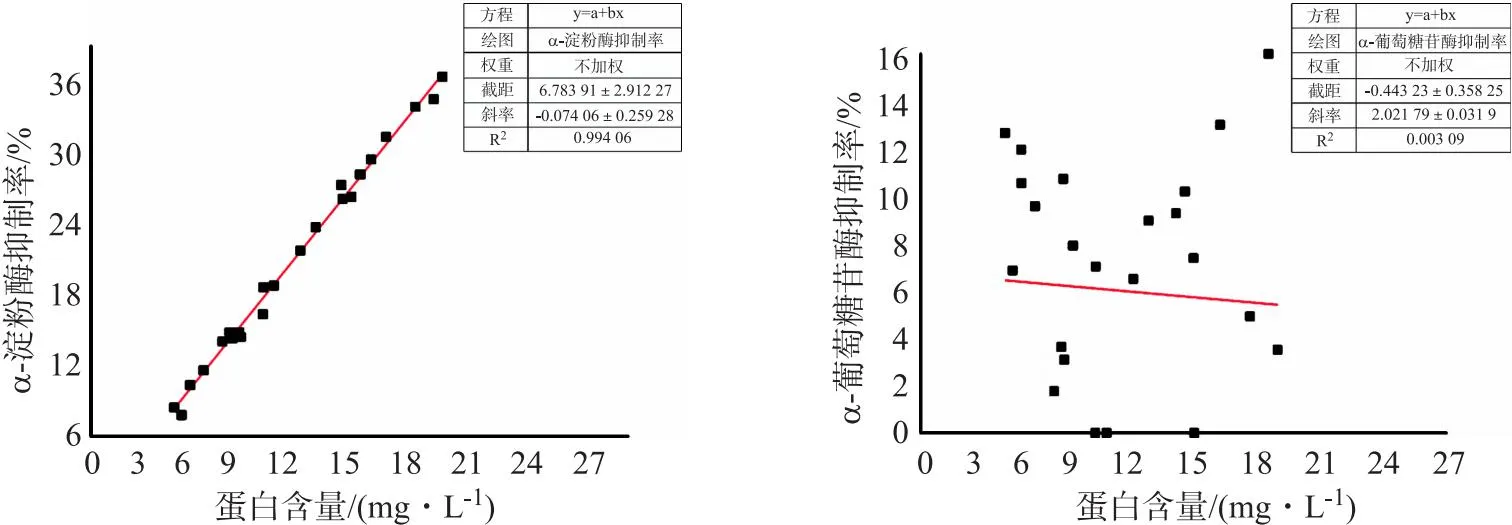
图6 蛋白含量与抑制率相关性
3 结语
本文确定了灵菊七蛋白最佳提取方式为以PBS为溶剂,超声辅助水浴加热法提取.通过响应面法优化了提取工艺条件,最佳条件下总蛋白提取率最高可达10.8%,提取物对α-淀粉酶最大抑制率为34.49%,提取物对α-葡萄糖苷酶最大抑制率为13.6%,并且浸提液对α-淀粉酶抑制率随着蛋白含量的增加而升高,结合浸提液冻干物的40%硫酸铵沉淀物对α-淀粉酶抑制率可达90.2%,可以推测提取液含有对α-淀粉酶具有较好抑制作用的活性蛋白.以上研究结果表明,灵菊七茎叶中可能含有新型α-淀粉酶抑制活性蛋白,具有开发为α-淀粉酶抑制活性药食产品的巨大潜力.但是,本文仅对灵菊七粗提物和硫酸铵沉淀物进行了研究,虽然蛋白纯度高,但并没有完全排除干扰.后续可以根据该提取条件,大批量提取灵菊七,以分离高纯度活性蛋白,完全排除小分子干扰,进一步明确灵菊七含有α-淀粉酶抑制活性蛋白,并解析蛋白结构及构效关系.
