西瓜ClPP2C3克隆及表达分析
2024-02-05朱毅柳唐镜宫国义张洁王晋芳张海英
朱毅 柳唐镜 宫国义 张洁 王晋芳 张海英
(1. 中国农业大学园艺学院,北京 100193;2. 北京市农林科学院蔬菜研究所,北京 100097;3. 广西壮族自治区农业科学院园艺研究所,南宁 530007)
脱落酸(abscisic acid, ABA)是一种重要的植物激素,已被证实参与植物响应环境胁迫及多种植物生长发育过程,如胚胎和种子发育、种子休眠和萌发、幼苗生长和营养器官发育等[1-2]。外源施加ABA,能够促进番茄[3]、葡萄[4]、西瓜[5]等作物果实的糖酸比提高、可溶性固形物积累、果实软化、果实色泽形成等,显示ABA在果实成熟和品质形成中发挥重要调控作用[2]。目前,众多学者对ABA响应逆境胁迫、调节植物生长发育等分子机制进行深入研究,但关于ABA调控果实成熟(尤其是呼吸非跃变型果实成熟)机制研究还相对缺乏[2]。2C型蛋白磷酸酶(protein phosphatase 2C, PP2C)是ABA信号转导途径中的重要成员,参与ABA信号转导[6]。ABA能够诱导编码PP2C基因表达,PP2C蛋白活性降低会增强植物对ABA的响应能力。目前,已在拟南芥、草莓、番茄、棉花、小麦、油菜和水稻等多种植物中鉴定出PP2C成员,如编码草莓PP2C的FaABI1表达水平在草莓果实发育过程中迅速下降,过表达FaABI1抑制草莓果实成熟[7-8]。干扰编码番茄PP2C家族成员的SlPP2C1可以促进番茄果实成熟,表明PP2C蛋白负调控ABA信号转导[9]。
西瓜[Citrullus lanatus(Thunb.)Matsum. et Nakai]是一年生草本园艺作物,属非呼吸跃变型果实,揭示其果实成熟及品质形成机理是目前研究热点,但PP2C基因家族成员在西瓜果实成熟中的作用尚不明确。
前期通过生物信息学手段结合转录组学分析,在西瓜基因组中共鉴定出5个PP2C基因家族成员[10]。随着果实成熟,Cla021986、Cla012597、Cla006546、Cla006233的表达量显著降低,而Cla-008212的表达量却逐渐提高,且在栽培品种和野生品种中表达差异较大[11]。结合重测序数据分析,Cla008212在西瓜基因组驯化阶段受到选择[11-12]。因此,推测Cla008212对西瓜果实成熟及品质形成起重要作用。
本研究以‘97103’西瓜果实为材料,克隆获得Cla008212(ClPP2C3),对其进行生物信息学分析、不同果实发育阶段和组织中表达分析和亚细胞定位,为进一步研究ClPP2C3的生物学功能和对非呼吸跃变型果实成熟及品质进化机制提供理论基础。
1 材料与方法
1.1 材料
供试材料包括栽培西瓜类型CL(C. lanatus.cultivar)6种:‘97103’‘WDM’‘ZZJM’‘JMT’‘MG72 8’‘JX1M’;半野生西瓜类型CM(C. mucosospermus)3种:‘PI595203’‘PI248178’‘PI254740’;野生西瓜类型CC(C. colocvynthis)5种:‘PI220778’‘PI63 2755’‘PI549161’‘PI296337’‘PI296341-FR’。均由北京市农林科学院蔬菜研究所西瓜遗传育种课题组保存并提供。筛选上述14份西瓜种质用于分析不同含糖量品种中ClPP2C3的相对表达量,其中,选取‘ZZJM’授粉10 d果实作为对照。
试验材料种植于北京市农林科学院蔬菜研究所四季青农场。授粉26 d采集西瓜果肉,取样后立即用液氮冷冻,置于-80℃保存备用。
1.2 方法
1.2.1 西瓜总RNA提取和cDNA合成及荧光定量PCR 使用快速通用植物RNA提取试剂盒3.0(北京华越洋生物科技有限公司)提取西瓜果肉组织总RNA。采用北京康润诚业生物科技有限公司(GenStar)StarScript III All-in-one RT Mix with gDNA Remove试剂盒进行cDNA合成。将cDNA链作为模板,西瓜Cla007792作为内参基因[5],利用LightCycler 480型荧光定量PCR仪(Roche)进行定量PCR分析。PCR反应体系为2×Mix 10 μL(南京诺唯赞生物科技股份有限公司)、cDNA模板1 μL、上下游引物(10 μmol/L)各1 μL和ddH2O 7 μL。PCR扩增程序为95℃ 30 s;95℃ 30 s,55℃ 20 s,72℃ 2 min,45个循环。比较C-T法计算相对表达量。利用Primer Premier 6软件设计特异性引物(表1),引物合成和测序均在北京天一辉远生物科技有限公司完成。

表1 引物序列信息Table 1 Primer sequence information
1.2.2 ClPP2C3克隆 根据ClPP2C3(Gene ID: Cla-008212)基因序列设计特异性引物,引物序列见表1。PCR反应体系为2×Phanta Flash Master Mix 10 μL(南京诺唯赞生物科技股份有限公司)、叶片模板cDNA 1 μL、上下游引物(10 μmol/L)各1 μL和ddH2O 7 μL。扩增程序为95℃ 5 min;95℃ 15 s,55℃ 15 s,72℃ 1 min 30 s,35个循环;72℃ 5 min。PCR产物用1.2%琼脂糖凝胶进行电泳并回收目的条带。
1.2.3 ClPP2C3生物信息学分析 运用DNAMAN 1.0软件对不同序列进行多重比对分析。使用ExPASy软件(https://web.expasy.org/cgi-bin/protparam/Protparam)进行蛋白质理化性质预测分析。用MEGA7.0软件,采用邻接法(neighbor-joining, NJ)将西瓜和其他植物PP2C蛋白氨基酸序列构建系统进化树(1 000次重复)。
1.2.4 ClPP2C3亚细胞定位 构建pMDC87d-GFP克隆载体,转入大肠杆菌DH5α对阳性克隆菌液进行测序并提取质粒。将GFP和ClPP2C3重组载体转入农杆菌GV3103,涂板,48-72 h培养后,筛选阳性菌在液体培养基(含Kan和Rif抗性)中进行扩繁,28℃摇床培养至OD600为1.0。于4 000 r/min 5 min收集菌体,用终体积为2-3 mL的悬浮液进行悬浮,至OD600为0.6。黑暗孵育3 h,用1 mL无针头注射器侵染烟草叶片,暗培养、光照培养各1 d后,用激光扫描共聚焦显微镜(蔡司LSM710)对烟草叶下表皮进行荧光信号检测。
1.2.5 ClPP2C3启动子活性比较 利用DNAMAN对西瓜栽培品种和野生品种的启动子序列进行比对发现,SNP主要集中在启动子序列1-2 kb范围。为了探究SNP是否影响启动子活性,将栽培品种和野生品种ClPP2C3的启动子分成3个片段扩增,分别是0.5、1.0和2.0 kb,其中0.5 kb启动子为对照。构建pGreenII 0800-LUC重组载体,转化DH5α菌株,测序比对正确后提取质粒。将质粒转入农杆菌中并配制烟草注射缓冲液重悬菌体至OD值为0.6。使用注射器将菌液注射至烟草叶片中,温室正常光照培养48-60 h。随后取样和标号,液氮速冻,进行荧光素酶互补试验。通过生物化学发光分析设备定性定量检测荧光强度,分析不同片段长度的启动子活性。
2 结果
2.1 ClPP2C3 CDS克隆
以‘97103’西瓜果肉cDNA为模板,通过特异性引物进行PCR扩增,获得ClPP2C3的CDS序列(图1)。ClPP2C3的cDNA序列长度为1 317 bp,编码438个氨基酸,分子量大小为47.81 kD,蛋白质等电点为5.12。

图1 西瓜ClPP2C3的CDS序列Fig. 1 CDS sequence of ClPP2C3 in watermelon
2.2 ClPP2C3同源性分析
使用NCBI网站BLAST工具搜索与ClPP2C3同源性较高的氨基酸序列发现,西瓜ClPP2C3与拟南芥AtAHG3和番茄SlPP2C3蛋白序列同源性达35.79%。DNAMAN软件多序列比对结果(图2)显示,这些蛋白均具有PP2C基因家族中PP2C转录因子的典型特征,序列中均含有PP2C蛋白结构域,且在PP2C结构域保守性较高。使用MEGA 7.0中邻接(neighbor-joining)法对筛选出的蛋白进行系统进化树构建,结果(图3)显示,ClPP2C3与拟南芥AtAHG3、番茄SlPP2C3蛋白具有较高的一致性,其亲缘关系最近,ClPP2C3可能同这些蛋白具有相似的功能。
2.3 ClPP2C3亚细胞定位分析
通过激光共聚焦显微镜观察ClPP2C3蛋白在烟草叶片中亚细胞定位情况,结果(图4)显示,重组载体GFP荧光信号主要集中在细胞核中,而对照空载体GFP荧光信号分布于整个细胞,说明ClPP2C3蛋白均在细胞核中表达并发挥功能。

图4 ClPP2C3亚细胞定位分析Fig. 4 Subcellular localization analysis of ClPP2C3
2.4 ClPP2C3表达量分析
对不同品种西瓜荧光定量PCR分析(表2),ClPP2C3在含糖量9-12的栽培型类型CL(C.lanatus. cultivar)中的表达量分别是含糖量为2-3的半野生类型CM(C. mucosospermus)、含糖量为1-2的野生类型CC(C. colocvynthis)的4倍和9倍,显著高于半野生类型CM(C. mucosospermus)和野生类型CC(C. colocvynthis)(图5)。表明ClPP2C3在含糖量高的类型中表达量高于含糖量低的类型,二者呈正相关关系。
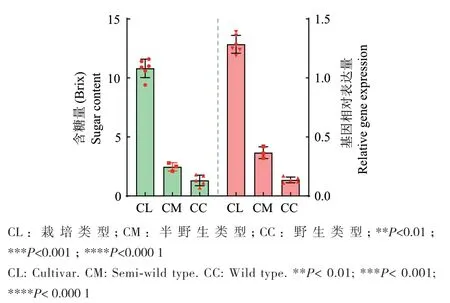
图5 西瓜ClPP2C3在不同含糖量品种中的表达量分析Fig. 5 Expressions of ClPP2C3 in watermelon varieties with different sugar contents

表2 西瓜ClPP2C3在不同含糖量品种中的表达量分析Table 2 Expressions of ClPP2C3 in watermelon varieties with different sugar contents
2.5 ClPP2C3启动子活性差异分析
西瓜栽培品种和野生品种ClPP2C3表达量存在差异,推测可能是启动子活性对其产生影响。对启动子序列进行比对发现,SNP主要集中在1-2 kb范围。将启动子分成3段:0.5、1.0和2.0 kb,分别构建融合表达载体,进行荧光素酶互补试验,并通过生物化学发光分析设备定性定量检测荧光强度。结果显示,西瓜栽培品种2 kb长度启动子活性是野生品种2 kb长度启动子活性的1.3倍,显著强于野生品种2 kb长度启动子活性,但二者1 kb长度启动子活性以及0.5 kb长度启动子活性无明显差异。证明栽培品种和野生品种启动子活性差异是由启动子序列1-2 kb间SNP导致的,可能造成表达差异(图6)。通过启动子序列分析发现,栽培品种ClPP2C3启动子序列上缺少了1个WRKY转录因子结合元件(图7),可能影响了启动子活性。
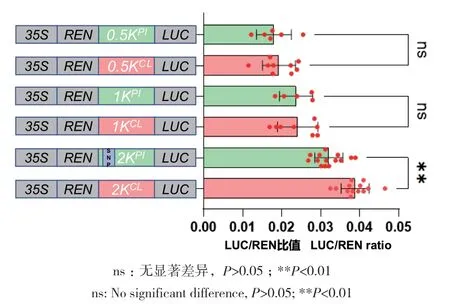
图6 栽培和野生品种中西瓜ClPP2C3的3个片段长度启动子活性差异分析Fig. 6 Difference analysis of promoter activities at three fragment lengths of ClPP2C3 between cultivated and wild watermelon
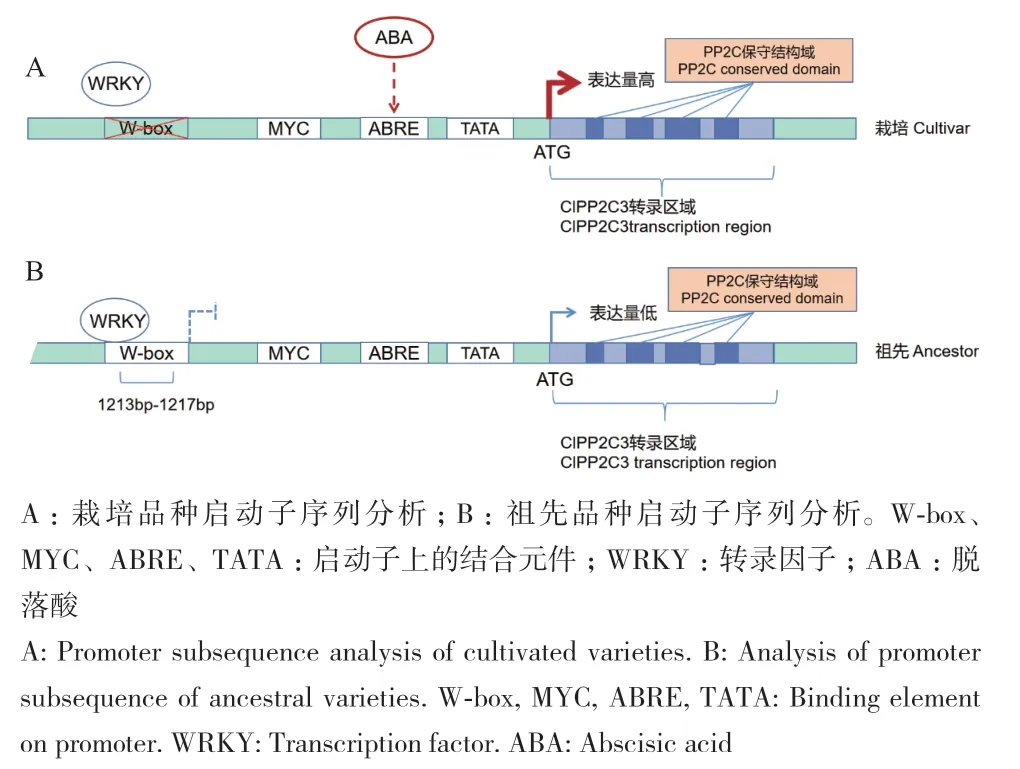
图7 不同品种西瓜ClPP2C3的转录调控模型Fig. 7 Transcription regulation models of ClPP2C3 in different watermelon varieties
3 讨论
PP2C是ABA信号转导途径中重要的负调节因子,参与调控植物生长发育,以及抵御逆境胁迫反应的生物学过程[13-15]。近年来,PP2C被报道负调控果实成熟,多集中在呼吸跃变果实番茄上,但PP2C多个家族成员调控果实成熟的分子机制仍不明确,需要进一步挖掘[13]。
由于大多数非呼吸跃变果实缺乏稳定高效的遗传转化体系,PP2C调控非呼吸跃变果实成熟机制一直未能有效探明。仅有研究发现在草莓瞬时沉默PP2C促进果实着色,但调控机制未得到深入挖掘[8]。西瓜作为重要的非呼吸跃变果实,ABA被证明是主导其果实成熟的关键激素,但ABA信号如何参与西瓜果实成熟调控仍不清晰[5]。本研究前期以能够正常成熟的栽培西瓜和不能正常成熟的野生西瓜为研究对象,通过转录组分析发现,ClPP2C3在栽培品种和野生品种中的表达存在较大差异[12]。在此基础上,本研究通过在14个代表性品种中分析ClPP2C3的表达,明确ClPP2C3表达量与果实含糖量呈正相关。然而,PP2C作为ABA信号途径中的负调控因子,其表达却随着西瓜果实ABA和含糖量的积累逐渐提高,其作用机制仍不明确。前人研究显示,ABA处理后,拟南芥中的ABRE类转录因子能够激活PP2C表达,反馈调节ABA信号[16]。借鉴前人研究发现,ClPP2C3启动子上确实存在ABRE结合元件。因此,推测在西瓜果实成熟过程中也存在关键ABRE转录因子激活ClPP2C3的表达,但其基因功能和作用机制亟待深入研究。
西瓜果实由不能正常成熟的野生西瓜进化为可以食用的栽培西瓜,经过了3个进化阶段。Cla008212位于第2进化阶段,即驯化阶段,西瓜果实由完全不能成熟的野生西瓜进化为半野生西瓜[5,12]。通过单倍型分析,ClPP2C3的启动子序列上具有8个SNP。结合启动子活性分析推测,位于1-2 kb区间的(-1 216,A/G)变异位点可能是影响启动子活性的关键SNP。通过启动子结合元件分析发现,该位点变异导致栽培品种中WRKY转录因子的结合位点TGAC缺失。因此,推测野生品种中可能存在一个转录抑制的WRKY转录因子抑制ClPP2C3表达,而栽培品种中该转录因子不能结合ClPP2C3启动子,缓解了其对ClPP2C3表达的抑制。WRKY转录因子可能介导ClPP2C3调控西瓜成熟及果实含糖量,但该假设仍需下一步研究确认。
4 结论
西瓜ClPP2C3编码蛋白定位于细胞核,其基因表达与西瓜果实含糖量呈正相关,含糖量高的品种中表达高于含糖量低的品种。该基因可能是调控西瓜果实含糖量的关键候选基因。由1-2 kb区间SNP导致的启动子活性差异对不同含糖量品种中ClPP2C3表达量存在影响。