TiO2纳米管的制备及其光电性能研究
2024-02-04李荡张杨
李荡,张杨
(凯里学院 理学院,贵州 凯里 556011)
宽带隙的半导体TiO2因具有优异的电学和光学性能而备受关注。目前,TiO2已广泛应用于各种领域,如太阳能电池[1]、光催化剂[2]、锂电池[3]和高比化学传感器[4]等。研究发现,TiO2的表面积与器件的性能及效率密切相关,因此学者们在增加TiO2表面积方向做了各种尝试。为了增加TiO2的比表面积,科研工作者们在形貌控制上付出了大量努力。Park等[5]研究发现TiO2纳米颗粒由于颗粒之间的接触区域能够中断电子在薄膜中的传输,而具有较好的光电转化效率。同时,研究者们还研究了TiO2其他结构,如纳米线[6]、纳米纤维[7]、空心半球[8]、空心球[9]、纳米管[10]等,在这些结构中,一维结构的TiO2纳米管由于可为电子传输提供有效的路径,改善电子的传输路径,从而降低了电子和空穴的复合率,具有比纳米颗粒更高的光电转化效率而备受关注[11]。TiO2纳米管阵列制备方法有很多,有阳极氧化水解法[12]、溶胶-凝胶法[13-14]、电泳沉积法[15]和液相沉积[16]等。其中水热法与其他方法相比具有许多优点,如样品均匀性好、易于成分控制、加工温度低、低的设备成本和良好的光学性能。且水热法工艺在生产薄的、透明的、多组分的氧化物层方面优势尤其明显。如Na等人[17]通过使用电沉积合成的ZnO纳米棒为模板,再采用水热法制备了TiO2纳米管,但结果发现合成的TiO2纳米管有序度并不高,导致光电转化效率较低。Michailowski[18]采用水热成功合成了纳米晶二氧化钛管,并将其组装至太阳能电池中,获得了7.3%的光电转换效率。Mor等人[19]首次提出了高度有序TiO2纳米管阵列的合成办法,其采用金属钛片作为基底,利用阳极氧化法将钛表面氧化而在钛金属表面上制备出一层TiO2纳米管阵列薄膜。Mor等人[20]研究了反应工艺条件如溶质的组成、溶质的pH值、阳极氧化的电压及反应时间对TiO2纳米管阵列薄膜微观形貌的影响,从而实现对纳米管的尺寸及厚度的可控合成。尽管研究者在TiO2纳米管的制备研究中做了大量的努力,但目前制备的TiO2纳米管光催化效率及光电研究效率还不高,纳米管在制备过程中的形成机理及影响因素等还有待于进一步研究。
因此,本文采用简单的水热法制备TiO2纳米管,探究在水热反应过程中TiO2纳米管的形成机理和影响因素,并对其光催化活性和热稳定性进行表征和分析,拟制备出质量稳定可靠、光催化活性高的TiO2纳米管,以期为后期高效光催化的研究提供理论依据。
1 实验部分
1.1 试剂及仪器
试剂:氢氧化钠(分析纯,贵州摩尔化学有限公司),无水乙醇(分析纯,南京试剂),钛酸四正丁酯(化学纯,武汉康琼生物医药科技),聚乙二醇400(PEG400)(分析纯,广西南宁市鹏程化学品有限公司),浓硝酸(茂名市雄大化工有限公司),去离子水(实验室自制)。
仪器:利用差热-热重分析仪(TG-DSC、BOEN1250,费尔伯恩实业发展有限公司)分析产物在受热过程中热量及质量变化,利用X射线衍射仪(XRD、FRINGE EV,苏州朗声科学仪器有限公司)对产物的结构进行分析,利用紫外-可见漫反射光谱仪(UV-Vis、UV-1100型,上海美谱达有限公司)分析产物对紫外可见光的吸收情况,利用透射电子显微镜(TEM、JEM-Z200FSC型,日本电子株式会社)分析产物的微观结构。
1.2 TiO2纳米粉的制备
准确量取15 mL钛酸四正丁酯置于烧杯中,在磁力搅拌器搅拌下,将体积比1∶1无水乙醇和10%乙酸混合液缓慢滴加至烧杯,滴速控制为1滴/min,形成透明黄色溶液。然后,向上述烧杯中滴加15 mL 1 moL·L-1HNO3,继续剧烈搅拌1.5 h,得到透明TiO2溶胶。最后,经过陈化、干燥、研磨、煅烧后得到了TiO2粉体。
1.3 TiO2纳米管的制备
将0.2 g上述制备的TiO2粉末与20 mL 10 moL·L-1NaOH溶液混合,并将混合物转移至密闭的聚四氟乙烯高压釜内,在120 ℃下恒温分别反应8,10,12,14 h。反应结束后,用无水乙醇、蒸馏水洗涤分别洗涤沉淀物三次,在80 ℃烘干,即得到二氧化钛纳米管。
1.4 光催化实验
配制10 mg·L-1的甲基橙作目标降解物:称取10 mg的甲基橙放入小烧杯中,加适量蒸馏水用玻璃棒搅拌溶解,再将其倒入1 L的容量瓶中,将小烧杯与玻璃棒润洗三遍倒入容量瓶中,之后定容,盖上玻璃塞,摇匀即得溶液。然后,分别用电子天平准确称取0.04 g的样品与质量浓度为10 mg·L-1的20 mL的甲基橙溶液混合并放入5 mL的锥形瓶中,置于自然光下进行光催化反应。分别记录0,1,2,3,4,5 h的吸光度值。用吸管吸取5 mL左右的溶液(最好为上清液)放入离心管中,再置于台式离心机内以转速为8 500 r/min离心分离5 min。再将上清液过滤,最后测定滤液的吸光度值。最后,用分光光度计在波长464 nm下测滤液的吸光度值。降解率计算公式如下:Φ=(A0-A1)/A0,式中:A0—甲基橙的初始吸光度,A1—甲基橙经降解后的吸光度。
2 结果与分析
2.1 TG-DSC
图1是TiO2纳米管的TG-DSC分析图。
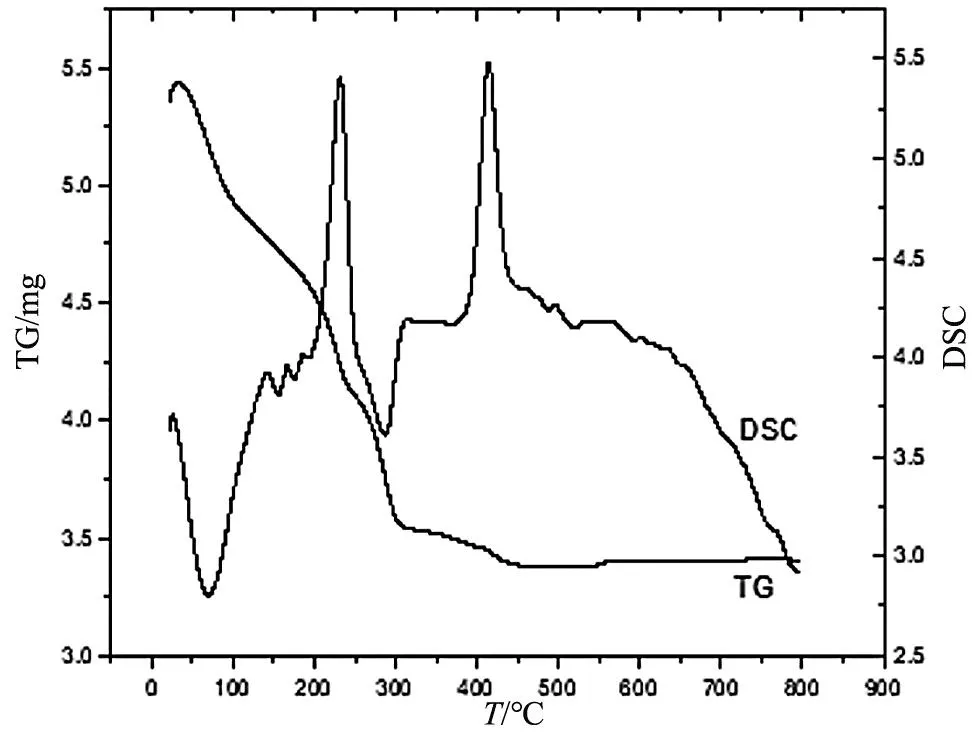
图1 TiO2纳米管的TG-DSC分析图
从TG曲线上可以看出,TiO2纳米管的质量损失过程大概可以分为三个区域。第1个质量损失过程温度为40~250 ℃区间,曲线的斜率较大,质量损失较快,在DSC曲线中,可以发现在80 ℃附近存在一个较大的热量吸收峰。这可能是由于合成的TiO2纳米管中还存在少量与其缔合的水和乙醇分子,在加热的条件下,这些水和乙醇分子挥发而导致样品对热量吸收而形成了吸收峰。第2个质量损失过程温度为250~310 ℃区间,在该区间上,TG曲线斜率减小,表面该阶段样品的质量损失减少。第3个质量损失过程温度为320~445 ℃区间,该区间TG曲线斜率更小,趋近于0。在DSC曲线上,可发现在225和410 ℃处出现了两个非常明显的放热峰,除了这两处之外,其他温度处没有较明显的放热峰存在。由此可得TiO2纳米管金红石相及锐钛矿相的煅烧温度分别为225和410 ℃,TiO2纳米管煅烧温度达到450~500 ℃时可望锐钛矿相TiO2。
2.2 XRD分析
图2为不同反应时间下制备TiO2纳米管的XRD图。衍射角2θ为25.24°,37.64°,48.28°分别为锐钛矿相的(101),(004),(200)晶面衍射峰,衍射角2θ为27.66°为金红石相的(110)晶面衍射峰。由图可知TiO2纳米管由锐钛矿型和金红石型两种晶型组成。从图还可以看出,随着反应时间的增长,金红石相特征峰的峰型逐渐宽化,衍射峰强度也逐渐减弱,说明反应时间的增长,TiO2纳米管金红石相比例减少。根据公式:ε=Δd/d=β/ 4tgθ(其中ε是晶体尺寸,β是XRD衍射峰的半高宽,θ为衍射角) 可以估算晶体的大小。取锐钛矿相的(200)晶面的衍射峰为研究对象,此时2θ为48.28°。从图可知,随着反应时间的增加,试样衍射峰的半高宽增加,由此根据上面公式计算出的ε也呈递增趋势。由此说明反应时间使TiO2晶体颗粒增加,纳米管长度增加。
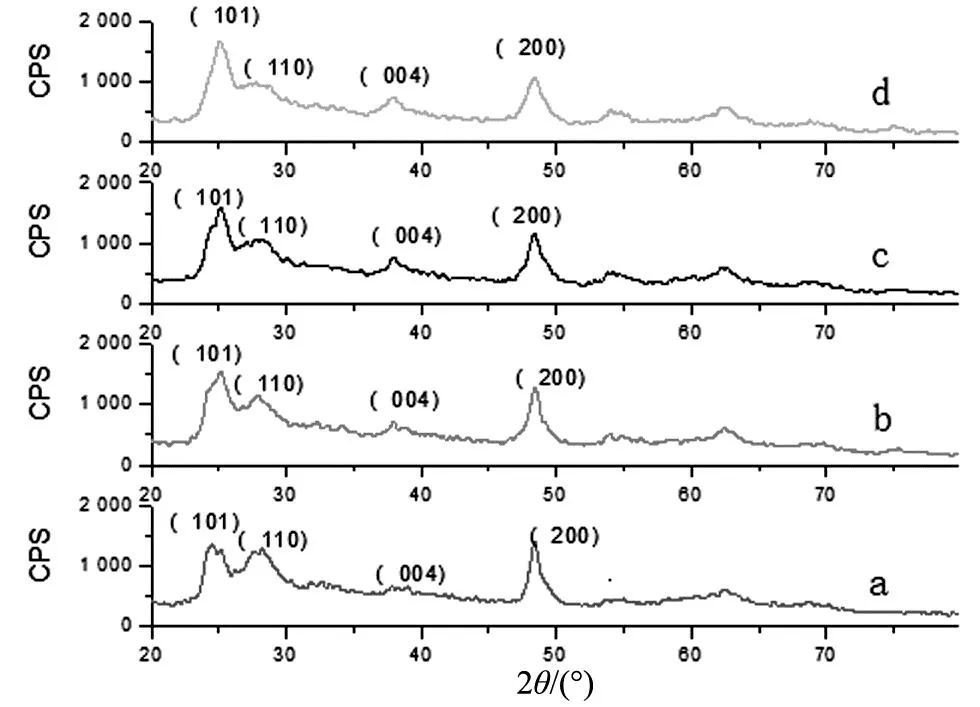
(a) 8 h;(b) 10 h;(c) 12 h;(d) 14 h。图2 不同反应时间下制备TiO2纳米管的XRD图
2.3 TEM分析
图3为TiO2纳米粉末及不同反应时间下制备TiO2纳米管的TEM图。从图3a可看出,在前驱液未转入聚四氟乙烯高压釜前,合成的TiO2粉末为球状的纳米颗粒,这些纳米颗粒由于纳米效应聚集在一起,且尺寸不均匀。从图3b可看出,对TiO2纳米粉末进行了8 h水热处理后,球状TiO2纳米颗粒转变成纳米片状,且有少许纳米片开始卷起来形成纳米管状固体,但此时形成的纳米管长度较短,数量较少。当水热反应时间增加至10 h时,如图3c所示,纳米片卷起来形成纳米管的数量增加,片状TiO2和管状TiO2相互交织,纳米管的尺寸不均匀。当水热反应时间继续增加至12 h时,如图3d所示,所有的纳米片卷起来形成纳米管,片状结构TiO2消失,TiO2纳米管长度及尺寸均匀,管和管之间界限清晰,其管厚度为1 nm,直径为15 nm,生长良好。当水热时间继续增加至14 h,TiO2纳米管开始弯曲,如图3e所示。TiO2会发生这样的变化,可能原因如下:在水热条件下,TiO2粉末与高浓度的NaOH反应首先形成具有层状结构的碱金属钛盐Na2TiO3,从而导致片状物的生成。随着水热处理时间的增加,高比表面积片状碱金属钛盐在强碱作用下逐渐卷曲成纳米管,这种自发的卷曲可能是由于静电表面积和弹性形变等多因素的共同作用下以降低能量,从而转化为比片状结构稳定性更好的纳米管。

(a) TiO2纳米粉末;(b) 8 h;(c) 10 h;(d) 12 h;(e) 14 h。
2.4 UV-Vis
图4为120 ℃下恒温反应8,10,12,14 h下制备TiO2纳米管的紫外-漫反射光谱图,扫描波长为200~700 nm。从图中可以得知,反应时间为8 h下制备的TiO2纳米管在波长较短的紫外区对光的反射率R较低,吸收较好。当波长向可见光范围内增加时,TiO2纳米管对光的反射率R出现突跃,表明对光的吸收迅速减弱;在波长400~700 nm,样品对光的吸收基于平缓,达到一个稳定的吸收值。从图中还可以看出,在400 nm时,反应时间8,10,12,14 h下制备的TiO2纳米管的反射率R分别为68.7%,49.2%,42.9%和24.7%,说明反应时间增加以后,样品对光反射率R有所降低,即对光的吸收增强,且随着掺杂量的增加,样品对光的吸收能力也逐渐增强。从图4中还能发现反应时间增加引起了吸收带的红移,红移了80 nm。
反应时间增加不仅提高了样品在紫外区的吸收强度,还增强了它在可见光区的吸收。从本质上分析,反应时间增加引起对光的吸收的变化是因为:在合成的样品中,锐钛矿型和金红石型两种晶型的比例发生变化,锐钛矿型TiO2更能够在光的激发下产生电子-空穴对的有效分离从而提高了TiO2对光的吸收效率。
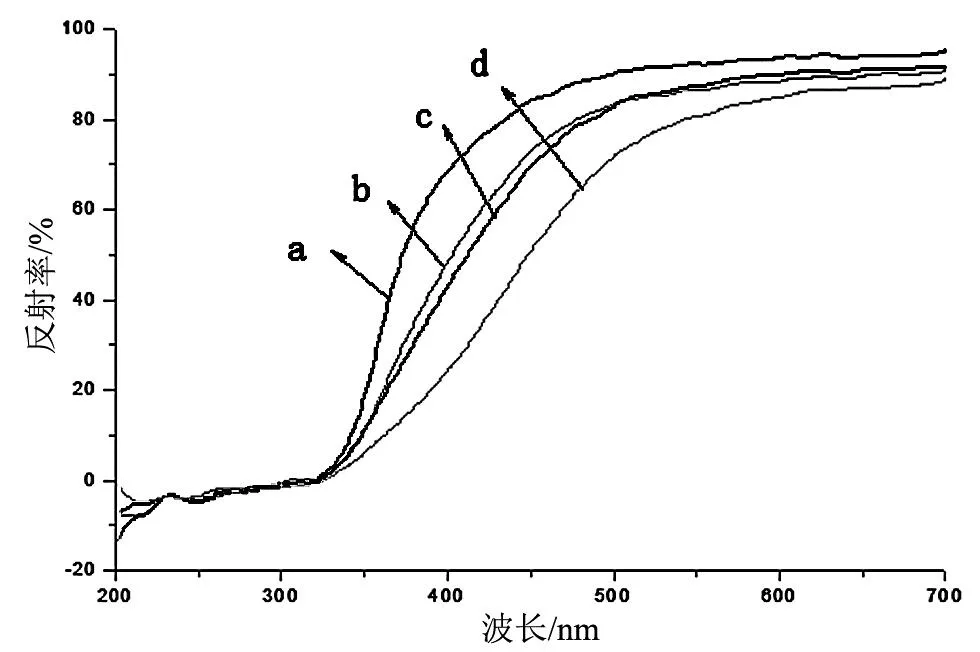
(a) 8 h;(b) 10 h;(c) 12 h;(d) 14 h。图4 不同反应时间下制备TiO2纳米管的UV-Vis图
2.5 TiO2纳米管光催化性能的影响研究
图5是不同反应时间下制备TiO2纳米管对甲基橙的降解图,从图上可看出,在反应时间为12 h的样品光催化效果最好,对甲基橙溶液降解率为49.4%,而在反应时间为8 h的样品对甲基橙溶液降解率只有14.1%。这表明,金红石相较多的TiO2颗粒和片状TiO2混合结构对甲基橙的光催化降解效率低,一方面可能受活性低金红石相量的影响,另一方面可能受混合结构的影响,片状及管状混合结构阻碍了电子的传输路径,增加了光生载流子的复合,从而导致光催化效率低。随着反应时间的增长,片状结构逐渐卷曲成纳米管,并且其长度也会增加,12 h制备的样品具有较大的比表面积,因而光催化活性会增强。而在14 h制备的纳米管由于发生弯曲,光生载流子的复合率增加,因而光催化效果降低。
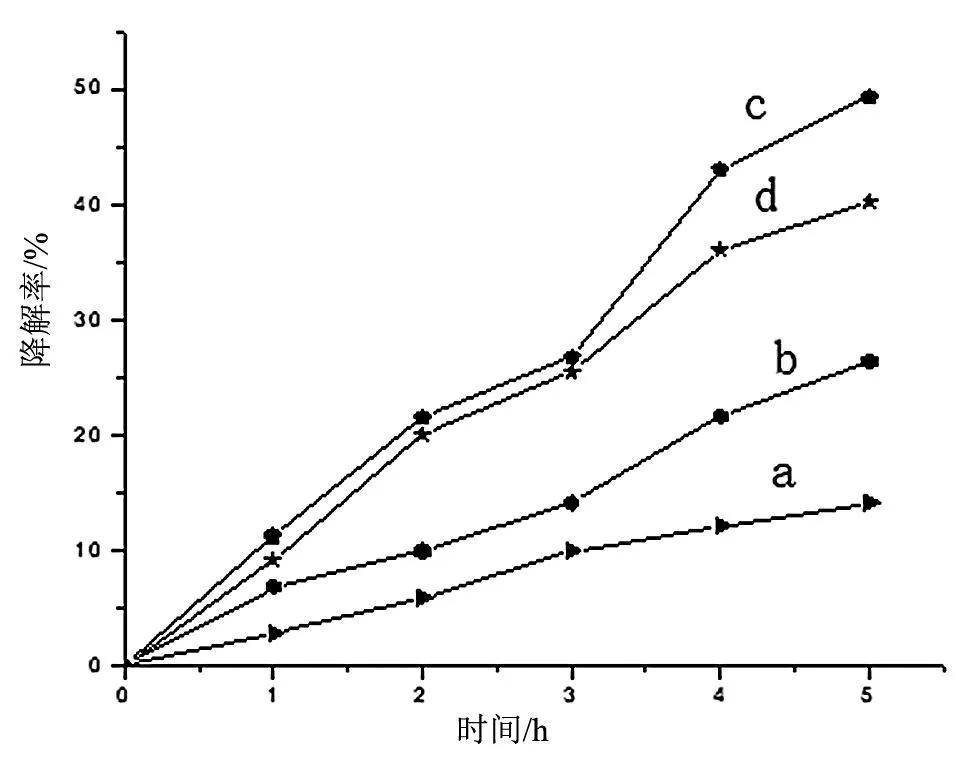
(a) 8 h;(b) 10 h;(c) 12 h;(d) 14 h。图5 不同反应时间下制备TiO2纳米管对甲基橙的降解图
3 结论
采用简单的水热法成功制备了TiO2纳米管,通过TEM、XRD、TG-DSC对在不同工艺条件下获得的产物进行表征,并对其光催化活性进行评价。结果表明:1)TiO2纳米管外径约15 nm,壁厚为1 nm的,由锐钛矿型和金红石型两种晶型组成;2)随着反应时间的增长,TiO2纳米管金红石相比例减少;3)反应时间为12 h时制备的样品,由于具有更合适晶型的比例及更佳的形貌结构,光催化性能最好。
