一种注射式软骨移植体的构建及应用探究
2024-02-03马超群李海强吴炜
马超群 李海强 吴炜
颌面部由于肿瘤,外伤及先天性发育不良导致的软骨缺损畸形严重影响了患者的美观和心理健康,在临床上需要通过外科手术的方式借助软骨移植体进行修复和整形。常用的移植材料包括人工合成材料和自体软骨,然而人工材料易引起多种并发症[1-2]。因此自体软骨仍然是临床修复移植的金标准[3-4]。目前常用的自体软骨包含鼻中隔软骨,耳软骨以及肋软骨[5]。鼻中隔软骨是最常用于鼻背侧重建的移植体,不需要额外的手术切口,同时提供了良好的刚性支持[6]。鼻中隔软骨优势显著,但可取量不足限制了应用[7]。耳软骨作为另一种选择,自然弯曲形态及组织学结构导致其难以雕刻,且质地偏脆,远期移植的畸形和翘曲发生率较高[8-9]。肋软骨的优势在于其丰富的可用性。对于需要大量移植材料的病例,肋软骨是首选的移植供体[10-11]。肋软骨相对容易雕刻成形,吸收率低,但是易发生不可预测的翘曲[12]。
为解决以上问题,临床上通常将软骨切割为直径1~3 mm左右的碎块,避免了块状移植带来的翘曲和变形,有利于精确充填不规则的缺损畸形[13]。碎片化的软骨结构单元有利于周围纤维组织和血管的长入,便于移植体的营养交换和长期存活[14]。但碎块大小往往依赖于术者的经验,缺乏准确的评估。不均匀的碎片移植会导致外观的不平整和颗粒感明显而影响美观效果。本研究探索了一种冷冻研磨的快速软骨颗粒化处理方式,能够短时间内将软骨块处理为均匀的颗粒化移植单元,结合富血小板凝胶(platelet-rich gel, PRG)共移植评价颗粒化软骨移植的效果来为该方式的进一步应用提供参考。
1 材料与方法
1.1 实验动物
动物实验获得空军军医大学实验动物中心伦理委员会批准(批准号: IACUC-20231257),于空军军医大学实验动物中心完成。 6 只2~2.5 kg成年新西兰白兔,用于获得新鲜的肋软骨; 3 月龄健康新西兰白兔5 只,雌雄不限,体重 2 kg,由耳中央动脉提取PRG; 6~8 周雄性免疫缺陷鼠 15 只(湖南维通利华实验动物技术有限公司),用于颗粒软骨和颗粒软骨-PRG移植体埋植及鼻背增高模型构建。
1.2 主要试剂与仪器
DMEM培养基、胎牛血清、磷酸盐缓冲液(PBS)、青霉素链霉素、 II型胶原酶(Gibco,美国); 扫描电镜(S 4800, Hitachi公司,日本); 激光粒度分析仪(Mastersizer 3000, Malvern公司,英国)。
1.3 颗粒软骨及PRG的制备
过量麻醉处死新西兰兔,取出肋软骨,用含1%青霉素-链霉素的PBS反复清洗5 遍。剥除肌肉筋膜及表面纤维,用无菌手术刀将软骨切割成直径3~5 mm的碎块。碎块置入研钵后依次进行液氮低温冷冻和研磨获得颗粒软骨。将制备好的颗粒软骨保存在冰上备用。取200 mg置于蒸馏水中用于粒径分析。用含枸橼酸钠抗凝剂的采血管从兔耳中动脉采集15 mL血液转移至无菌离心管, 1 800 r/min离心8 min,将上层血浆转移至新的无菌离心管, 3 600 r/min离心8 min。弃去上层1/2的血浆,重悬底部黄白色沉淀,即得PRP。 PRP 加入微量凝血酶可成胶为PRG。
1.4 体外培养颗粒软骨活性评估
将研磨的软骨颗粒平均分成6 份,每份约200 mg,在六孔板中进行培养。每2~3 d更换培养基,分别于第1、 7、 14 天用0.2% Ⅱ型胶原酶消化过夜。用含血清的培养基终止消化,通过70 μm细胞滤网过滤后,收集细胞悬液1 000 r/min离心5 min。用300 μL PBS重悬细胞,与PI避光孵育15 min,流式细胞仪分析活死细胞的比例。
1.5 可注射移植体的制备及表征
对照组(n=5)为500 mg的颗粒软骨,装入2.5 mL的注射器中以备裸鼠注射;实验组(n=5)分别按照60%、 80%以及100%质量体积分数混合PRP与颗粒软骨,加入微量凝血酶成胶后测定强度以筛选最佳比例,以最佳比例的移植体装入2.5 mL的注射器以备注射。实验组移植体用4%多聚甲醛固定48 h,梯度脱水后喷金,扫描电镜观察。
1.6 裸鼠注射移植
麻醉裸鼠,碘伏棉球擦拭皮肤,装有移植体的2.5 mL注射器更换16G无菌针头,刺入皮下后水平行进至距离进针点2 cm时将移植体挤出。逆着进针方向缓慢抽出针头,消毒进针口。在8 周解剖分离标本,直接称量记录湿重,以排水法重复测量体积记录并对大体轮廓拍照后4%多聚甲醛固定,梯度脱水,二甲苯透明(2 次),石蜡包埋进行组织切片,分别行HE和番红染色。
1.7 裸鼠鼻背增高功能模型构建
根据前期结果,选用实验组构建裸鼠鼻背增高模型(n=5)。麻醉裸鼠,消毒皮肤,将移植体注射入鼻背皮下,抽出针头,消毒皮肤。记录注射前后和8 周时的裸鼠鼻背形态。
2 结 果
2.1 颗粒软骨活性分析及移植体表征
手动切割的软骨碎块(图1A)经过低温研磨的流程成为白色粉末状态的颗粒软骨(图1B)。研磨所得颗粒主要分布区间在15~126 μm,呈近似正态分布,平均直径约为76 μm(图1C)。体外培养实验中,随着时间加长颗粒软骨中细胞的存活率逐渐上升。在第1 天仅为74.5%,第7 天为80.7%, 第14 天达到88.1%(图1D)。对照组移植体呈现流动态而难以成型(图1B);实验组移植体成胶后可以维持形态((图2B),扫描电镜结果显示颗粒软骨被大量纤维蛋白网络连接而形成整体,随着颗粒软骨含量增高,纤维蛋白的比例逐渐减少(图2A);压缩强度测试显示80%质量体积分数的移植体在同等大小应力下具有较小的应变量(图2C),其弹性模量最高为210 kPa(图2D)。80%质量分数移植体具有最佳的力学性能,后续实验采用该比例。

图1 颗粒软骨的制备与活性分析
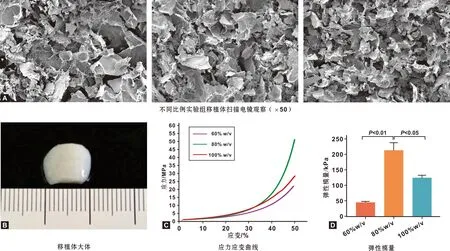
图2 可注射移植体的表征
2.2 移植体大体观察
对照组移植体形态保持较差,移植物容易与周围组织分离,表面无包膜,仅可见附着少量血管组织(图3A);实验组移植体形态保持良好,不易与周围组织分离,表面被光滑的纤维膜包裹,其下有大量血管爬行(图3D)。与对照组相比,实验组移植体保留了更饱满光滑的轮廓和合适的厚度,质量保留率为81.64%,而对照组质量保留率仅为75.50%(表1)。

表1 移植物的湿重、 体积和质量保留率

图3 可注射移植体的体内评估
2.3 组织切片观察
HE染色显示,两组移植体软骨陷窝结构清晰,实验组可见大量毛细血管,而对照组仅偶见毛细血管。对照实验组软骨陷窝周围阳性着色面积高于对照组,表明细胞活性更强。实验组颗粒软骨与纤维组织结合紧密,而对照组软骨颗粒与纤维组织接触松散(图3B~3E)。在safranin O染色中,实验组的阳性染色面积更大, 显示颗粒软骨的活性优于对照组(图3C~3F)。CD31免疫荧光染色进一步证实,实验组移植体新生毛细血管数量远远高于对照组移植体(图3G~3I)。
2.4 鼻背增高模型效果观察
裸鼠鼻背增高模型证实,移植体在注射即刻形成了顺应鼻背自然曲度的形态,达到显著的增高效果(图4A)。在8 周后,鼻背增高的厚度相较于注射即刻略有减小,但仍然保留了清晰的轮廓和自然的增高曲线(图4B)。CT结果显示了移植物与周围组织的良好融合(图4D)。大体观察显示移植体表面光滑,并有血管组织爬行,保证了移植体内部的营养供应(图4E)。番红O染色也显示移植体重塑为一个形态自然的整体,切片局部证实了颗粒软骨良好的生存活力(图4C~4F)。
3 讨 论
在颌面部修复中,平滑的轮廓和自然的形态是整复手术的终极目标[15]。有研究利用软骨细胞聚集体负载PRF的方式促进软骨再生,但是该方法需要复杂的实验室培养流程,短期内难以实现临床转化[16]。目前而言,临床上碎块化软骨的应用更加普遍[17-18]。但已有报道是通过手动切割的方式实现软骨的碎化,过程十分耗时,由此得到的颗粒大小也不均一[19]。在远期的效果中,软骨颗粒大小的不均一会导致形态的不规则[20]。除此之外,软骨经过碎化后的移植活力也是影响远期效果的重要因素。关于碎化软骨的活力也有相关报道,虽然其中有一些矛盾的结果,但是多数研究表明严重程度的挤压和碎化会降低软骨细胞的存活率[21-23]。除此之外,已有报道均是在常温下对于软骨组织进行挤压和切割[24-25]。但已有报道均是在常温下对于软骨组织进行挤压和切割。在本研究中,软骨块在低温下进行物理研磨,有效避免了常温下机械作用力对于细胞活力的损伤,流式细胞术分析也证实颗粒软骨中的细胞存活率仍然能够达到80%。
软骨经过颗粒化处理之后会成为无定形状态,难以实现精确的形态塑造。许多报道通过筋膜包裹的方式来应对这一问题[26-27],但是筋膜的获取往往造成二次创伤,而且筋膜隔绝了移植体与受体部位的直接接触导致其组织融合缓慢。利用筋膜包裹移植体也需要开放式的手术切口,手术瘢痕难以避免,难以满足颌面部整复手术微创美观的要求。本研究利用富血小板凝胶中的纤维蛋白网络将颗粒软骨连接为一个整体,解决了颗粒软骨难以定型的问题,同时利用注射的方式可以避免瘢痕的产生。在动物实验中,颗粒软骨与PRG构建的移植体展现了良好的形态维持和显著的鼻背增高效果。同时可以看到PRG的加入也促进了移植体的血管化和组织融合,组织切片染色更证实了其对于颗粒软骨活性保持的积极作用。
综上所述,基于低温研磨技术能够实现软骨组织的快速颗粒化处理并保证其活性,与富血小板凝胶构建的可注射式移植体能够实现更加微创的颌面部软骨移植修复。
