配体对白蛋白稳定性影响的研究进展
2024-02-03杨列清尹荣超杨磊井金荣房海涛陈加泉刘维鑫
杨列清 尹荣超 杨磊 井金荣 房海涛 陈加泉 刘维鑫
(山东泰邦生物制品有限公司, 山东 泰安 271000)
人血白蛋白是血浆中重要的运载蛋白,具有重要的生理功能,它的3 个结构域的结构相似,每个结构域又分为A和B 两个亚结构域[1]。白蛋白有许多重要的分子或药物的结合位点,包括SudlowⅠ和SudlowⅡ位点、脂肪酸位点(至少7 个,分别为FA1~FA7)、Cys-34 位点、N 端Asp-Ala-His金属离子位点[2,3],见图1。
在白蛋白自身热稳定性方面,它的3 个结构域热稳定性存在差异。根据Kragh-Hansen 等[4]的研究,结构域Ⅰ是热稳定性最差的结构域。根据Watanabe 等[5]的研究,Trp-214是影响结构域Ⅱ热稳定性的重要的残基,它将白蛋白心形分子的两半结合在一起。在白蛋白自身化学稳定性方面,盐酸胍引起的白蛋白变性最少可分为三步,而弱变性剂尿素使得变性过程的中间体更加多样[6]。除自身的抗变性能力外,白蛋白自身的化学稳定性还体现在抗氧化性上,在它的585 个氨基酸残基中,Cys-34 的贡献最大,其次为Met残基,Trp、Arg、Tyr等残基也有助于其自身的抗氧化性[7-8]。
应对白蛋白制备与储存过程中复杂的温度、光照等条件,仅靠白蛋白自身分子结构的稳定性还远远不够。要进一步提升白蛋白的稳定性,可以在生产过程中对白蛋白多聚体含量进行严格地监测[9],可以通过色谱方法降低多聚体的含量[10],可以提升白蛋白储存的条件[11],也可以选择能够提升稳定性的配体。辛酸钠(sodium octanoate,Oct)和N-乙酰色氨酸(N-acetyl-L-tryptophan,N-AcTrp)分别作为脂肪酸类和氨基酸类的配体,从低温乙醇工艺发展之初便得到了广泛应用。Cohn 6法采用N-AcTrp,K/N法采用Oct,郝氏法则选择二者联用。目前,国内外许多白蛋白商业制剂仍采用这两种配体或二者组合来提升白蛋白制备过程中的稳定性。本文将从配体结合角度论述其对白蛋白稳定性的影响。
1 配体对白蛋白热稳定性的影响
1.1 脂肪酸类配体对白蛋白热稳定性的影响
目前,脂肪酸类配体是白蛋白热稳定性研究最多的配体。不同脂肪酸的结合位点和结合能力也存在差异,如FA4对长链脂肪酸(long-chain fatty acid,LCFA)具有高亲和力,而FA1对LCFA的亲和力较低[12]。以变性温度Td来衡量白蛋白的热稳定性,在相同的条件下,脱脂的白蛋白Td要低于未脱脂白蛋白的Td。脂肪酸结合白蛋白后,白蛋白的α结构更加稳定,如图2。白蛋白与高亲和力的LCFA 结合,直至所有位点都被饱和,它的热解折叠是1个双相过程。第1个过程Td与低饱和度LCFA的白蛋白变性相关,Td随着蛋白质浓度的增加而降低,这一点与脱脂白蛋白单体的Td相似;而第2个过程的Td则与饱和LCFA白蛋白的浓度无关,而随着脂肪酸饱和程度的增加,白蛋白的聚合程度也会降低[13]。

图2 人血白蛋白与不饱和脂肪酸复合物的结构Figure 2 Structure of human serum albumin in complex with unsaturated fatty acids
在应用方面,Oct在脂肪酸类配体中的应用最广泛。一方面,链长大于7 个碳原子的脂肪酸对白蛋白热稳定性具有明显的提升效果,所以,Oct的效果优于己酸和庚酸,并且Oct 在水中溶解度高[14]。另一方面,Oct 结合在SudlowⅡ位点,占据了亚结构域ⅢA中最大的内部空腔,可以增强白蛋白构象的稳定性[14]。而类似结构的正辛基配体,可以偶联到琼脂糖微球骨架上,当作色谱纯化白蛋白的介质[11,15-16]。
1.2 氨基酸类配体对白蛋白热稳定性的影响
一般来说,氨基酸类配体对热稳定性的提升效果不如脂肪酸类配体。作为商业白蛋白制剂巴氏灭活工艺(60℃,10h)使用的配体,Oct和N-AcTrp可竞争性地与SudlowⅡ位点结合。研究证明Oct+N-AcTrp的对提升白蛋白热稳定性的效果最好,Oct的效果次之,只加N-AcTrp的效果再次之,而L-色氨酸(L-tryptophan,L-Trp)和N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine,N-AcCys)对白蛋白热稳定性的基本无提升能力[14]。
1.3 其他配体对白蛋白热稳定性的影响
表1总结了近些年研究的一些能提升白蛋白热稳定性的其他类配体,其中有些配体是抗淀粉样纤维化的药物,如反式白藜芦醇、牛磺酸、左旋多巴。纤维化的白蛋白受热更容易发生聚集,破坏白蛋白的热稳定性,这些药物(或配体)通过抑制纤维化来提升白蛋白的热稳定性,但是它们在提升热稳定性的领域还未得到广泛应用。

表1 药物与人血白蛋白作用配位点、作用机制表Table 1 Binding sites and mechanism of drugs on human serum albumin
2 配体对白蛋白化学稳定性的影响
2.1 脂肪酸类配体对白蛋白抗变性能力的影响
与脂肪酸类配体结合后,白蛋白对盐酸胍和尿素的抗变性能力均会增强。盐酸胍和尿素诱导的白蛋白变性存在5 种中间过渡状态(图3),并在过量诱导后,白蛋白达到不可逆的解折叠状态[23-25]。对于盐酸胍和尿素诱导的变性,脱脂白蛋白结构域的展开顺序分别为Ⅲ→Ⅱ→Ⅰ和Ⅰ→Ⅱ→Ⅱ。同种脂肪酸结合白蛋白后,抗盐酸胍和尿素诱导的变性能力均会增强,尤其对弱变性剂尿素的效果更佳,白蛋白在高浓度尿素水平下仍能保持天然状态[23-25],其抗变性机制见图3和4。

图3 盐酸胍和尿素诱导白蛋白变性时产生的中间状态Figure 3 The intermediate produced during the denaturation of albumin induced by guanidine hydrochloride and urea.
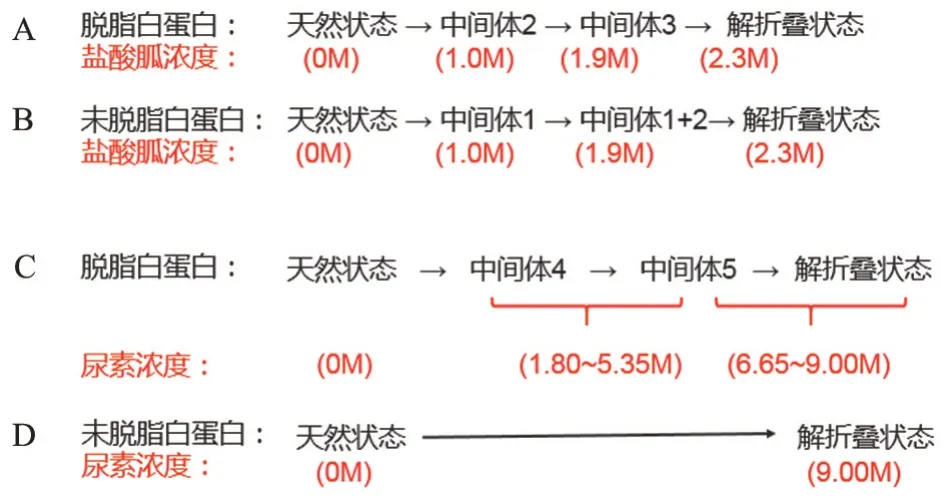
图4 脂肪酸对白蛋白抗变性能力的提升Figure 4 Improvement of anti-denaturation ability of albumin by fatty acids
2.2 其他类配体对白蛋白抗变性能力的影响
氨基酸类配体对白蛋白抗变性能力的研究较少。布洛芬、异丙酚对尿素诱导的变性具有良好的保护效果,二者同时与白蛋白结合会使结构域Ⅱ和Ⅲ更加紧凑,由此产生协同抗变性效果。此外,酮洛芬[26]、地西泮[26]等药物对尿素诱导的变性也具有良好的保护效果。有趣的是,低浓度的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)对尿素诱导的变性也具有保护效果,但高浓度的SDS 则会使白蛋白变性失活[27]。
2.3 氨基酸类配体对白蛋白抗氧化性的影响
对于提升白蛋白抗氧化性,几种氨基酸类配体或组合的效果排序如下:Oct + N-AcTrp>N-AcTrp>L-Trp>Oct。可以看出,Oct 和N-AcTrp 同时存在时白蛋白的抗氧化性最强,但这主要是因为N-AcTrp 提供的抗氧化性。虽然脂肪酸类配体也具有一定的抗氧化效果,但Oct作为饱和脂肪酸盐,其抗氧化效果更差。而利用色氨酸与白蛋白结合的特性,与色氨酸结构类似的色胺和N-AcTrp 均可用作色谱纯化白蛋白的介质[16,28]。
2.3.1 半胱氨酸化人血白蛋白对抗氧化性的影响
半胱酸氨酸化人血白蛋白(Cys-Cys-34-human serum albumin,Cys-Cys-34-HSA)即Cys-34上共价结合另一分子的半胱氨酸,形成了新的二硫键。早期研究证明,保护Cys-34上的自由巯基可以抑制巯基/二硫键反应,防止白蛋白聚合,提升白蛋白的热稳定性[29]。近些年研究证明,Cys-Cys-34-HSA虽然热稳定性得到了提升,但是抗氧化性却是降低的。Cys-34的半胱氨酸化能诱导SudlowⅠ和Ⅱ位点的构象发生变化,这种变化可能导致两个位点的结合能力下降,甚至有可能影响Oct 和N-AcTrp 与SudlowⅡ位点的结合[30]。该研究还表明,商业白蛋白制剂的抗氧化性和配体结合活性与Cys-Cys-34-HSA比例呈负相关关系。
2.3.2 N-乙酰-L-甲硫氨酸和N-AcTrp 的抗氧化性与抗光氧化性
在抗氧化性方面,加入N-AcTrp 或N-乙酰-L-甲硫氨酸(N-acetyl-L-methionine, N-AcMet)后,氯胺T 氧化白蛋白的程度均会削弱,且N-AcMet 的抗氧化性效果优于NAcTrp[31]。在抗光氧化性方面,以氧化后羰基含量为指标,40℃光照4周后,羰基含量从低到高依次为重组人血白蛋白(recombinant human serum albumin,rHSA)+N-AcMet、单独的rHSA、rHSA+N-AcTrp,这说明N-AcTrp 的加入反而会促进白蛋白的光氧化降解,会显著降低白蛋白的抗光氧化性[32]。
2.3.3 N-AcTrp和N-AcMet的对比
N-AcTrp对提升白蛋白抗氧化性效果明显,但是N-Ac-Trp自身也很容易被光照氧化降解,所形成的产物可以氧化白蛋白,且N-AcTrp 的体内代谢产物3-羟基犬尿氨酸也具有神经毒性。N-AcMet 结合在Suldow Ⅰ位点的入口处,且结合能力较弱,这使得N-AcMet的侧链暴露在溶剂中,所以N-AcMet 更容易被活性氧(reactive oxygen species, ROS)氧化[33]。并且,相比于N-AcTrp,N-AcMet 能被更多种类的ROS氧化,加之N-AcMet安全无毒,所以N-AcMet提升稳定性的效果更佳。
3 结论
在人血白蛋白制备过程中,选择合适的配体提高白蛋白的稳定性十分必要。常见的脂肪酸类配体Oct 主要用来提升白蛋白的热稳定性,常见的氨基酸类配体N-AcTrp 主要用来提升白蛋白的抗氧化性,二者联用会进一步提升白蛋白的热稳定性、抗氧化性和抗变性。而相较于传统配体N-AcTrp,最新研究的配体N-AcMet 还具有独特的抗光氧化性。
除了指导商业白蛋白制剂选择合适的配体外,配体对白蛋白稳定性的研究对含有白蛋白的新型制剂选择提升稳定性的配体也具有重要的参考价值(如rHSA[32,34]、Abraxane[13]、Albiguide[13])。其次,它也可以作为蛋白淀粉样纤维化疾病的体外研究模型,对相关药物的筛选起到重要作用[18,21-22]。此外,利用配体与白蛋白结合的稳定性,也可以反向应用于白蛋白的色谱纯化[15-16,28]。
值得注意的是,配体的加入会占据白蛋白的结合位点,这可能会影响白蛋白的运载能力,从而影响其药用效果[17]。对于白蛋白化学稳定性,除了本文提及的抗变性和抗氧化性,还包含抗翻译后修饰性(抗N端截短、抗C端截短、抗糖化等)[35],而面对这些翻译后修饰,还缺乏相关的配体研究。当然,这些问题也可从非配体结合的化合物的角度去考虑,如添加糖类化合物来提升白蛋白的热稳定性和化学稳定性[36]。总之,研究配体对白蛋白稳定性的影响具有十分重要的意义,相信未来还会发现其他更重要的潜在价值。